磷酸酪氨酸互作结构域1(phosphotyrosine interaction domain containing 1,PID1)基因是Wang等[1]于2006年采用抑制性消减杂交技术筛选肥胖与正常人腹膜脂肪组织后而获得的新基因。该基因最先命名为NYGGF4基因,后根据该基因的结构特征被国际统一命名为PID1基因。基于生物信息学分析,发现PID1蛋白序列中存在磷酸酪氨酸作用位点(PTB),该位点与胰岛素受体底物-1(IRS1)的结构相似,参与胰岛素信号途径的调节和生长因子刺激下细胞增殖等下游效应[2]。生物学功能研究表明,PID1与胰岛素抵抗和人类肥胖病的发生密切相关[1, 3]。另有研究表明,PID1基因在鼠脂肪组织中也呈高水平表达[4],在脂肪细胞增殖和分化成熟过程中其表达也逐渐上调[1, 5]。此外,PID1基因在体外过表达能显著促进小鼠3T3-L1脂肪前体细胞的增殖和脂肪细胞数目的增多[1, 2],而脂肪细胞过度增殖是脂肪沉积发生的重要环节[6]。前人对PID1基因的研究主要以人和鼠为对象,对猪PID1基因的研究较少。钱源等[7]首次采用简并引物克隆到猪PID1基因的编码序列(CDS),蛋白结构域分析发现该序列C端也含有一PTB结构域,与IRS1中PTB结构域的结构相似,提示其可能有相似的功能[7]。组织表达规律研究表明,猪PID1基因呈多组织表达特性,并在猪的肝脏中表达量最高,其次为脂肪和肌肉组织[7, 8]。PID1基因在地方品种猪莱芜猪和鲁莱黑猪中的表达均显著高于大白猪[7],而莱芜猪和鲁莱黑猪肌内脂肪含量显著高于大白猪[9]。相关性分析结果表明,肌肉组织中PID1基因表达量与猪肌内脂肪含量呈显著正相关[7],且莱芜猪PID1基因与肌内脂肪含量的相关性高于过氧化物酶体增殖物激活受体γ(PPARγ)[10]。另有研究表明,过表达猪PID1能显著促进3T3-L1前体脂肪细胞的增殖,而对其分化影响差异不显著[11]。上述结果提示,PID1基因能影响脂肪沉积并与猪肌内脂肪含量间存在一定的关联性,可能为影响猪肌内脂肪沉积的候选基因[10, 12]。目前对猪PID1基因的功能和组织表达规律研究仅限于在其mRNA水平上研究。因此,为从蛋白质水平上鉴定猪PID1的功能,猪PID1蛋白的抗体制备就显得非常必要。本研究旨在利用原核表达系统制备重组猪PID1蛋白,并采用镍离子-亚氨基二乙酸(Ni2+-IDA)亲和层析柱对其进行纯化,纯化的蛋白采用十二烷基硫酸钠-变性梯度凝胶电泳(SDS-PAGE)和基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MSMS)进行鉴定,同时制备猪pPID1的多克隆抗体,为深入研究猪pPID1的功能及猪PID1的检测提供试验材料。 1 材料与方法 1.1 试验动物、菌株及质粒
SD雄性大鼠2只,购自成都达硕有限公司。大肠杆菌原核表达载体pET28a(+)为本实验室保存,大肠杆菌DH5α、大肠杆菌BL21购自天根生化科技(北京)有限公司。 1.2 主要试剂
2×Taq PCR Master Mix、DNA分子质量标准购自天根生化科技(北京)有限公司;限制性内切酶EcoRⅠ、Hind Ⅲ、连接溶液(ligation solution,溶液Ⅰ)、蛋白质分子质量标准购自TaKaRa公司;SanPrep柱式DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司;质粒小量提取试剂盒(E.Z.N.ATM Plasmid Mini Kit Ⅰ)购自美国OMEGA公司;Ni2+-IDA层析柱购自美国BBI公司;异丙基硫代-β-D-半乳糖苷(IPTG)购自碧云天生物技术有限公司;二辛可宁酸(BCA)法蛋白质浓度测定试剂盒购自美国Pierce公司;弗氏完全佐剂和弗氏不完全佐剂购自美国MP Biomedicals公司;辣根过氧化酶标记羊抗大鼠IgG购自美国Santa Cruz Biotechnology公司;酵母提取物和蛋白胨为英国Oxoid公司产品。其他试剂均为分析纯。引物由生工生物工程(上海)股份有限公司合成。 1.3 原核表达载体的构建 1.3.1 引物的合成及载体构建
根据猪PID1基因序列(GenBank登录号KC524726)和原核表达载体pET28a(+)的多克隆位点设计引物扩增猪PID1基因编码区序列,引物由上海生工生物工程有限公司合成。上游引物PIDxR-F的核苷酸序列为:5′-CGGAATTCATGTGGCAGCCG-3′,含EcoRⅠ酶切位点;下游引物PIDxh-R的核苷酸序列为:5′-CCCAAGCTTTCAGCCATCATCG-3′,含HindⅢ酶切位点。PCR体系中的模板为本实验室构建的重组质粒pcDNA3.1(+)-PID1[11] 1 μL,上、下游引物(10 μmol/L)各1 μL,2×Taq PCR MasterMix 25 μL,加灭菌水至总体积50 μL。PCR扩增条件为:94 ℃变性5 min;然后94 ℃ 30 s,62 ℃ 30 s,72 ℃ 45 s,共35个循环;最后72 ℃延伸10 min,反应结束后,立即进行电泳。对扩增的PCR产物采用SanPrep柱式DNA胶回收试剂盒进行切胶回收。应用EcoRⅠ和HindⅢ对回收的PCR产物和原核表达载体pET28a(+)进行双酶切,然后对酶切产物进行胶回收和1%琼脂糖凝胶电泳鉴定。根据目的片段与载体物质的量比为(1 : 10)~(1 : 2)的原则,对切胶回收的PCR产物和表达载体进行连接反应。连接反应体系为10 μL,其中双酶切的猪PID1基因PCR产物4.5 μL、双酶切的pET28a(+)表达载体0.5 μL、溶液Ⅰ 5 μL,条件为16 ℃连接4 h。 1.3.2 重组载体的鉴定
将pET28a(+)-pPID1加入到80 μL大肠杆菌DH5α感受态细胞中,混匀,冰中静置30 min,42 ℃水浴热激90 s,在无抗LB液体培养基中37 ℃复苏细菌,将细菌涂于含卡那霉素(Kan)的LB固体培养板中,37 ℃恒温培养16 h出现菌落,挑取菌落进行菌落PCR鉴定,具体方法如下:用灭菌的牙签挑取少量单菌落至含10 μL灭菌水的PCR管中,于PCR仪上95 ℃变性5 min,然后进行PCR分析,体系中加入PIDxR-F 0.5 μL、PIDxh-R 0.5 μL、2×Taq PCR MasterMix 12.5 μL、灭菌水1.5 μL,总体积25 μL。PCR条件为:94 ℃ 30 s,62 ℃ 30 s,72 ℃ 45 s,共35个循环;最后72 ℃延伸10 min,反应结束后,立即进行电泳。对有插入片段的阳性克隆进行测序[由生工生物工程(上海)股份有限公司完成]。 1.4 融合蛋白的诱导表达及纯化
提取构建成功的重组菌的质粒,转化大肠杆菌BL21感受态细胞。挑取单菌落于LB液体培养基中,37 ℃摇床培养过夜,按1%转接到新鲜LB液体培养基中,37 ℃培养至OD600 nm约为0.4~0.6时加入IPTG进行诱导表达。IPTG浓度设定4个梯度(0.1、0.5、1.0、2.0 mmol/L)、温度设2个梯度(30、37 ℃)、诱导时间设5个梯度(1、2、3、4和5 h)。诱导表达后10 000 r/min离心1 min收集菌体,加入70 μL 1×蛋白质上样缓冲液,煮沸10 min,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定融合蛋白的表达。同时将诱导的菌体4 ℃ 10 000 r/min离心1 min,将菌体用磷酸盐缓冲液(PBS,pH 7.4)重悬后于冰上进行超声裂解细菌细胞。4 ℃ 6 000 r/min离心10min,弃去沉淀;上清转移到1个新的离心管中,12 000 r/min离心15 min;分别取离心后得到的上清和沉淀进行SDS-PAGE分析。电泳后,经考马斯亮蓝染色,甲醇-冰乙酸脱色液脱色观察结果。
按照美国BBI公司的Ni2+-IDA亲和层析柱说明书进行蛋白的纯化。将纯化后的包涵体蛋白经SDS-PAGE鉴定。同时将表达的目的蛋白条带切下后送往复旦大学生命科学院进行MALDI-TOF-MSMS鉴定。采用BCA法蛋白质浓度测定试剂盒测定纯化后蛋白的浓度。 1.5 多克隆抗体的制备
用纯化的pPID1融合蛋白常规免疫SD大鼠,每次免疫剂量200 μg,溶于PBS中。首次免疫,将纯化得到的猪PID1蛋白与等体积的弗氏完全佐剂混合乳化,对SD大鼠背部皮下多点注射。2周后以同样的抗原剂量与等体积的弗氏不完全佐剂混合免疫。此后每隔10 d进行加强免疫1次,共加免3次。最后1次免疫后7天摘眼球采血,制备血清。SD大鼠免疫前进行尾根断尾取血清作为阴性对照。 1.6 抗体效价的测定
间接酶联免疫分析(ELISA)方法检测抗体效价,参照文献[13]所述的方法做了适当修改。用包被缓冲液将纯化的pPID1融合蛋白稀释至2.5 μg/mL,按照100 μL/孔的量包被到聚苯乙烯反应(PVC)板上,4 ℃包被过夜;用PBS-T(含0.01%吐温-20和0.1%明胶的PBS)洗涤3次,然后每孔加150 μL封闭液;用PBS-T洗涤3次,每孔加100 μL倍比稀释( 1 : 1 280、1 : 2 560、1 : 5 120、1 : 10 240、1 : 20 480和1 : 40 960)的免疫血清,以免疫前大鼠的血清作为阴性对照,每个样品设2个重复孔,37 ℃温育1 h,用PBS-T洗涤3次,每孔加100 μL PBS-T稀释的二抗[辣根过氧化物酶标记的羊抗大鼠免疫球蛋白G(IgG),1 : 5 000稀释], 37 ℃温育1 h;用PBS-T洗涤3次,加入100 μL底物显色剂邻苯二胺(OPD),37 ℃温育15~30 min,用50 μL 2 mol/L的硫酸终止反应;用酶标仪测定波长490 nm处的吸光度值(OD490 nm),若待测孔OD490 nm大于或等于阴性对照孔的2.1倍,即认为是阳性值,从而得出血清的抗体效价。 1.7 抗体特异性的检测
将纯化的pPID1融合蛋白及空载体pET28a(+)表达蛋白样品进行SDS-PAGE后,进行蛋白质免疫印迹(Western blot)分析,用半干法电转移到硝酸纤维素(NC)膜上,5%脱脂奶粉封闭后,以本试验制备的大鼠抗血清(1 : 2 000)为一抗,辣根过氧化物酶标记的羊抗大鼠IgG(1 : 5 000)为二抗进行反应。显色反应参照美国Pierce公司的化学发光底物说明书进行。 2 结 果 2.1 重组质粒的鉴定
EcoRⅠ和HindⅢ双酶切后的猪PID1基因和表达载体pET28a(+)经连接、转化后获得的重组质粒进行PCR扩增,1.5%琼脂糖凝胶电泳(图1)显示扩增片段大小约650 bp,与目的基因片段大小一致。进一步的测序结果表明,所构建的表达质粒完全正确(测序数据略),将其命名为pET28a(+)-pPID1。
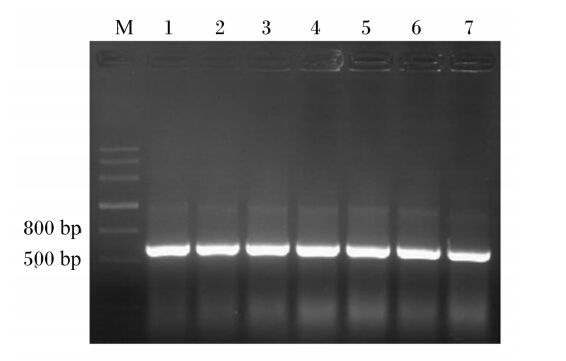 | M:DNA分子质量标准;1~7:重组质粒PCR产物。 M: DNA molecular weight marker; lanes 1 to 7: PCR products of recombinant plasmid.图1 重组质粒pET28a(+)-pPID1的PCR分析 Fig. 1 PCR analysis of recombinant plasmid pET28a(+)-pPID1 |
重组原核表达质粒pET28a(+)-pPID1化学法转化到大肠杆菌BL21感受态细胞中,经IPTG诱导后菌体超声破碎,取上清和沉淀分别进行12%的SDS-PAGE,所表达的融合蛋白主要存在于沉淀中,证明pPID1融合蛋白是以包涵体形式存在。试验中IPTG浓度设置了4个梯度,温度设置了2个梯度,诱导时间设置了6个梯度,IPTG浓度对pPID1融合蛋白表达量影响不大(图略),温度和时间分别以30 ℃和4 h时pPID1融合蛋白表达量最高(图2)。
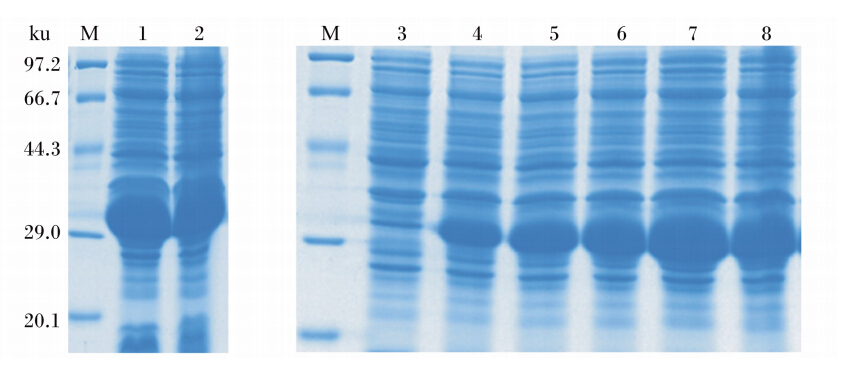 | M:蛋白质分子质量标准;1~2:IPTG在30和37 ℃诱导表达的融合蛋白;3~8:IPTG在30 ℃诱导0、1、2、3、4、5 h表达的融合蛋白。 〓M: protein molecular weight marker; lanes 1 to 2: fusion protein with IPTG induction at 30 and 37 ℃, respectively; lanes 3 to 8: fusion protein with IPTG induction for 0, 1, 2, 3, 4 and 5 h at 30 ℃, respectively.图2 重组pPID1在大肠杆菌中表达的最适诱导条件 Fig. 2 Optimal induction conditions for the expression of recombinant pPID1 in E. coli |
如图3所示,经SDS-PAGE检测,表达产物经Ni2+-IDA亲和层析纯化后仅见单一的蛋白质条带。经测定,纯化后得到的融合蛋白浓度为1.6 mg/mL。对纯化的蛋白质进行MALDI-TOF-MSMS鉴定,结果表明,共有8个肽段与目的蛋白吻合(图4),且鉴定蛋白质的分子质量为28 622 u,与重组蛋白的理论分子质量相符,证明所纯化的蛋白为pPID1。
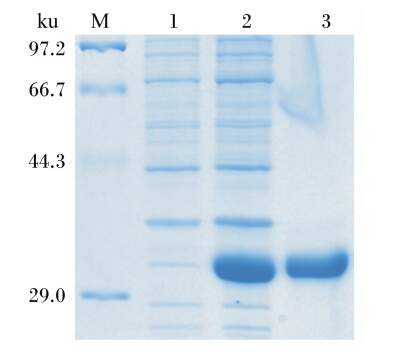 | M:蛋白质分子质量标准;1:重组子未诱导表达结果;2:重组子经IPTG诱导表达结果;3:纯化的pPID1融合蛋白。 M: protein molecular weight marker; lane 1: induced product of recombinant vector without IPTG; lane 2: induced product of recombinant vector after the addition of IPTG; lane 3: purified fusion protein pPID1.图3 纯化的pPID1融合蛋白的SDS-PAGE分析 Fig. 3 Analysis of SDS-PAGE of purified fusion protein pPID1 |
 | 下划线表示与目的蛋白匹配的蛋白肽片段。 The peptide fragments matched target protein are underlined.图4 纯化的pPID1融合蛋白的 MALDI-TOF-MSMS鉴定 Fig. 4 MALDI-TOF-MSMS identification of purified fusion protein pPID1 |
加强免疫后的SD大鼠摘眼球采血,并立即将血液放室温1 h,然后取出放入4 ℃冰箱过夜,制备抗血清,-20 ℃保存备用。采用间接ELISA测定pPID1多克隆抗体效价,以免疫pPID1融合蛋白前的SD大鼠血清为阴性对照,结果表明,经4次免疫后,抗体效价为1 : 20 480(图5)。
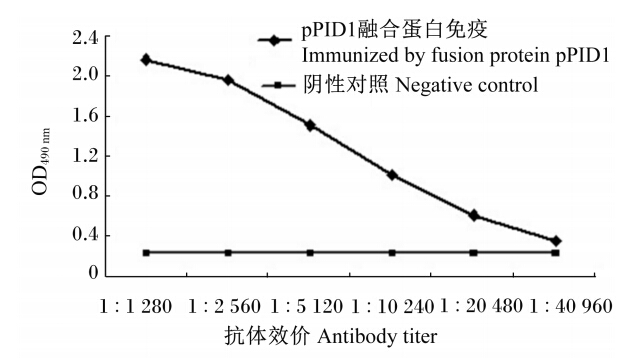 | 图5 间接ELISA法测定猪PID1多克隆抗体效价 Fig. 5 Antibody titer of polyclonal antibody of porcine PID1 determined by indirect ELISA |
对纯化的pPID1融合蛋白及空载体pET28a(+)表达蛋白样品进行SDS-PAGE,将凝胶上的目的蛋白采用半干法电转移到NC膜上,并对NC膜进行封闭、一抗、二抗孵育,然后用化学发光底物进行显色,结果仅见1条反应带,而空载体pET28a(+)表达蛋白样品所作的Western blot分析未见任何条带(图6),这表明本试验制备的多克隆抗体具有很好的免疫反应性和蛋白特异性,同时也证实了在大肠杆菌中成功表达了pPID1融合蛋白。
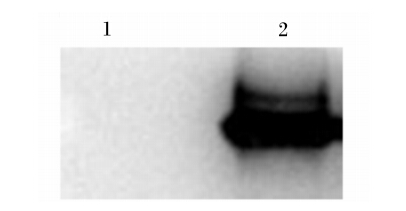 | 1:空载体pET28a(+)与阳性血清反应;2:pPID1融合蛋白与阳性血清反应。 Lane 1: the reaction of empty vector pET28a(+) and positive serum; lane 2: the reaction of fusion protein pPID1 and positive serum.图6 pPID1融合蛋白的Western blot分析 Fig. 6 Western-blot analysis of fusion protein pPID1 |
本试验采用pET28a(+)原核表达载体表达pPID1。pET28a(+)表达载体是原核表达常用的载体,其大小为5 369 bp,含有强有力的T7启动子、卡那霉素抗性基因和便于纯化的N端和C端的组氨酸标签(His-Tag),能被IPTG诱导表达。本试验采用不同的IPTG浓度、不同的诱导温度和诱导时间优化pPID1的表达条件,结果表明,pPID1的最适表达条件为IPTG浓度为0.1 mmol/L,诱导温度为30 ℃,诱导时间为4 h。本试验表达蛋白N端融合了由6个组氨酸串联的His-Tag,这为目的蛋白的纯化提供了方便,使纯化过程简单,因此可利用亲和层析进行分离纯化。表达产物经Ni2+-IDA亲和层析柱纯化后,SDS-PAGE分析可见单一的蛋白条带。
生物质谱,尤其是MALDI-TOF-MS是近年来发展起来的一种新型的软电离生物质谱,能通过离子的质量电荷之比(m/Z)与离子的飞行时间成正比来分析离子,并测得样品分子的分子质量,目前已用于原核表达和真核表达蛋白的鉴定[14, 15]。从SDS-PAGE结果来看,该蛋白质分子质量约为32 ku,而pPID1基因片段实际大小为654 bp,共编码217个氨基酸,与载体pET28a(+)连接后该基因的上游多融合36个氨基酸。因此,加上这一段融合的氨基酸,预测分子质量约为29 ku,而表达的融合蛋白约为32 ku,两者相差约3 ku。本研究采用了MALDI-TOF-MS对原核表达pPID1重组蛋白进行了鉴定,分子质量为28 622 u,与重组蛋白的理论分子质量相符,证实了表达目的蛋白的正确性。
用纯化的pPID1融合蛋白免疫SD大鼠制备抗pPID1多克隆抗体。经间接ELISA检测表明,抗pPID1的抗体效价高达1 : 20 480;利用Western blot方法检测表明,所获得的多克隆抗体能与pPID1融合蛋白特异性结合。因此本试验所获得的pPID1融合蛋白可为今后研究其功能提供了试验材料,且所获得的多克隆抗体也可用于检测pPID1表达等相关试验,同时为从蛋白水平检测pPID1基因调控猪肌内脂肪沉积奠定了良好的工作基础。 4 结 论
本试验成功实现了pPID1基因在大肠杆菌中的表达,同时表达产物经Ni2+-IDA亲和层析柱纯化后得到了纯度较高的pPID1融合蛋白,该蛋白经MALDI-TOF-MS鉴定为pPID1。以纯化的pPID1融合蛋白作为抗原免疫SD大鼠,经间接ELISA和Western blot检测,获得了具有较高抗体效价且特异性良好的pPID1多克隆抗体。
| [1] | WANG B,ZHANG M,NI Y H,et al.Identification and characterization of NYGGF4,a novel gene containing a phosphotyrosine-binding (PTB) domain that stimulates 3T3-L1 preadipocytes proliferation[J]. Gene,2006,379:132-140. ( 4) 4)
|
| [2] | 吴伟玲,王玢,张敏,等.肥胖相关新基因NYGGF4对3T3-L1脂肪前体细胞的增殖调节作用[J]. 实用儿科临床杂志,2008,23(7):498-500. ( 2) 2)
|
| [3] | CHEN X L,HUANG Z Q,CHEN D W,et al.Role of NYGGF4 on insulin resistance[J]. Molecular Biology Reports,2012,39(5):5367-5371. ( 1) 1)
|
| [4] | 夏黎,钱玲梅,孔祥清,等.NYGGF4小鼠同源基因mRNA在遗传性ob/ob肥胖小鼠体内的表达[J]. 实用儿科临床杂志,2008,23(19):1488-1490. ( 1) 1)
|
| [5] | ZHAO Y P,ZHANG C M,ZHU C,et al.NYGGF4 homologous gene expression in 3T3-L1 adipocytes:regulation by FFA and adipokines[J]. Molecular Biology Reports,2010,37(7):3291-3296. ( 1) 1)
|
| [6] | FAJAS L.Adipogenesis:a cross-talk between cell proliferation and cell differentiaton[J]. Annals of Medicine,2003,35(2):79-85. ( 1) 1)
|
| [7] | 钱源,曾勇庆,杜金芳,等.猪PID1基因CDS区的克隆及其mRNA表达与肌内脂肪沉积关系[J]. 遗传,2010,32(11):1153-1158. ( 4) 4)
|
| [8] | 钱源,曾勇庆,崔景香,等.莱芜猪PID1基因的功能分析及表达谱研究[J]. 畜牧兽医学报,2011,42(5):621-628. ( 1) 1)
|
| [9] | 曾勇庆,王根林,魏述东,等.含不同比例莱芜猪血缘杂交猪胴体品质及肉质特性的研究[J]. 遗传,2005,27(1):65-69. ( 1) 1)
|
| [10] | 崔景香.猪肌内脂肪沉积相关基因的mRNA表达及功能分析[D]. 博士学位论文.泰安:山东农业大学,2011:55-71. ( 2) 2)
|
| [11] | CHEN X L,HUANG Z Q,WANG H,et al.Porcine phosphotyrosine interaction domain containing 1 modulates 3T3-L1 preadipocyte proliferation and differentiation[J]. Biologia,2013,68(5):1010-1014. ( 2) 2)
|
| [12] | 陈小玲,黄志清,贾刚,等.磷酸酪氨酸互作结构域1基因对肉质性状的调控[J]. 动物营养学报,2012,24(4):591-594. ( 1) 1)
|
| [13] | YOU J M,LI D F,QIAO S Y,et al.Development of a monoclonal antibody-based competitive ELISA for detection of β-conglycinin,an allergen from soybean[J]. Food Chemistry,2008,106(1):352-360. ( 1) 1)
|
| [14] | CHENG X,LU W,ZHANG S,et al.Expression and purification of antimicrobial peptide CM4 by Npro fusion technology in E.coli[J]. Animo Acids,2010,39(5):1545-1552. ( 1) 1)
|
| [15] | NAKAMURA T,ZÁMOCK Ý M,ZDRÁHAL Z,et al.Expression of glycosylated haloalkane dehalogenase LinB in Pichia pastoris[J]. Protein Expression and Purification,2006,46(1):85-91. ( 1) 1)
|



