2. 宁夏医科大学科技中心, 银川 750004
2. Science and Technology Center of Ningxia Medical University, Yinchuan 750004, China
长期、广泛且不分选择的滥用抗生素加重了病原微生物的耐药,同时导致了动物机体内抗生素药物的大量残留。因此研发“无毒,无残留,无耐药性”的抗微生物制剂代替抗生素成为近期研究的热点[1]。抗菌肽作为具有抗菌作用的阳离子小肽,因分子质量小、构象简单、无免疫原性不易引起耐药等特点极有可能成为新型抗微生物药物[2]。天蚕素A-马盖宁杂合肽(cecA-mag)是根据GenBank中天蚕素A(cecropin A)成熟肽段1~7以及马盖宁(magainin)2~12的氨基酸序列选用酵母偏爱密码子设计合成的杂合肽,对革兰阳性及革兰阴性细菌均具有良好的抑菌活性,且对机体正常微生物菌群无不良影响,具有良好的开发应用前景[3]。天蚕素A-马盖宁杂合肽有望作为一种新的环保型饲料添加剂,达到彻底替代饲用抗生素的目的,对降低机体内抗生素残留以及生产绿色、营养的畜禽产品,发展健康养殖业具有重要意义。本研究团队前期研究发现在治疗大肠杆菌引起的雏鸡疾病模型的试验中,在同等剂量情况下抗菌肽口服的治疗效果比肌肉注射的治疗效果要好[4]。此研究结果提示我们,天蚕素A-马盖宁杂合肽除了具有直接抑菌的作用效果外,还可能通过其他的途径引起其抗菌效果的提高。小肠黏膜对营养物质的吸收是机体得以生长发育的基本保证,而正常的小肠黏膜免疫功能是动物抵抗肠道有害菌群入侵,调节肠道正常微生物菌群水平,促进所饲养动物健康发育的前提。两者相辅相成,共同促进动物抗微生物感染的能力和生产性能的提高。因此我们推测口服途径给予机体此杂合肽可能会影响小肠黏膜的结构、小肠黏膜免疫功能及肠道不同菌群的数量,从而进一步影响动物机体的整体免疫水平。为此设计和实施本试验,以期研究天蚕素A-马盖宁杂合肽对小鼠小肠黏膜结构、小肠黏膜免疫功能和肠道菌群的影响,为天蚕素A-马盖宁杂合肽的应用提供理论基础。
1 材料与方法 1.1 试验材料天蚕素A-马盖宁杂合肽是由本课题组前期研究、设计合成,并利用毕赤酵母表达系统进行表达,具体方法见文献[5]。收集后经微量琼脂糖弥散法检测具有较强的抗菌活性,通过考马斯亮蓝蛋白质浓度测定法检测其蛋白质浓度,表达出的原液蛋白质浓度为0.52 mg/mL。试验小鼠购自宁夏医科大学动物实验中心。兔抗小鼠免疫球蛋白A(IgA)购自北京博奥森生物有限公司,山羊抗兔免疫球蛋白G(IgG)购自北京中杉金桥生物技术有限公司。细胞因子白细胞介素(IL)-2、干扰素-γ(IFN-γ)及IL-4的酶联免疫吸附试验(ELISA)检测试剂盒购自北京诚林生物科技有限公司。
1.2 试验分组设计健康、成熟、体重18~22 g的BALB/c雌性小鼠18只,随机分为:对照组(生理盐水)和天蚕素A-马盖宁杂合肽低、高剂量(0.26、0.52 mg/mL)组,共3组,每组6只,按0.75 mL/d灌胃给予。小鼠饲喂基础饲料,自由采食,充足饮水,均未经任何免疫,连续灌胃6周。
1.3 测定指标及方法 1.3.1 取材灌胃满6周后于次日上午将小鼠颈椎脱臼处死,迅速剪取十二指肠、空肠、回肠各2 cm,用生理盐水冲洗干净后置于福尔马林固定液中固定数日,石蜡包埋,连续切片,片厚5 μm。用细线紧扎回肠和盲肠接口处以防止盲肠内容物被外界污染,然后取下扎口的盲肠,液氮速冻后放置于-80 ℃冰箱中保存,用于测定内容物中大肠杆菌、双歧杆菌和乳酸杆菌的数量。将各小鼠剩余小肠自同一部位取0.2 g放于离心管中,液氮中速冻后置于-80 ℃冷冻保藏用于ELISA检测细胞因子的含量。
1.3.2 小肠黏膜结构的观察石蜡切片常规苏木素-伊红(HE)染色后,采用Olympus显微镜10倍物镜下观察各组小肠黏膜结构,应用Leica图像分析软件测量十二指肠、空肠、回肠的绒毛长度(villous length,从绒毛基底部到绒毛顶端的距离)、隐窝深度(crypt depth,隐窝基底部到绒毛基底部的距离)及绒毛长度/隐窝深度(V/C)。
1.3.3 免疫组化检测小肠黏膜内IgA阳性表达水平石蜡切片脱蜡至水,微波修复抗原20 min,冷却至室温,1%H2O2孵育30 min,0.01 mol/L磷酸盐缓冲液(PBS,pH7.4)洗3次,正常山羊血清封闭20 min;加入一抗即兔抗小鼠IgA室温孵育2 h,PBS洗3次,滴加二抗即生物素标记的山羊抗兔IgG室温孵育20 min,PBS洗3次,链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)复合物室温孵育20 min,PBS洗3次,二氨基联苯胺(DAB)显色、脱水、透明、封片。以PBS代替一抗作为阴性对照。40倍物镜下选取典型视野,使用病理图文分析系统采集照片,应用Image Pro Plus 6.0图像分析软件检测每个视野内IgA阳性表达的光密度值,比较每段肠管不同组间每个视野的平均光密度值。
1.3.4 小肠黏膜内细胞因子含量的测定将小肠组织样品取出平衡至室温,加入无菌pH7.2的PBS缓冲液500 μL,在4 ℃下用组织匀浆器破碎匀浆,立即4 ℃、5 000×g离心10 min,取上清液分装到4个离心管中,每个离心管放100 μL,放回到4 ℃冰箱中保存待测。用ELISA方法按照试剂盒说明书所述步骤对小肠组织匀浆液中IL-2、IFN-γ和IL-4的含量以及IFN-γ/IL-4进行测定。
1.3.5 盲肠内容物菌群的测定将盲肠段置于常温下自然解冻,无菌操作台内称取0.1 g盲肠内容物放入内含0.9 mL灭菌生理盐水的离心管中,用涡旋震荡器充分振荡混匀,将振荡好的标本进行10倍递比稀释至10-7。各菌种均选择适当梯度的稀释液100 μL用无菌玻璃棒均匀涂布于相应的选择性培养基上。稀释度为10-3~10-5的稀释液涂布于麦康凯培养基用于计数大肠杆菌,稀释度为10-4~10-6的稀释液涂布于改良MRS培养基用于计数双歧杆菌,稀释度为10-4~10-6的稀释液涂布于MRS培养基用于计数乳酸杆菌。涂布后大肠杆菌37 ℃恒温培养24 h,双歧杆菌、乳酸杆菌37 ℃恒温厌氧培养48 h,取出后对菌落数在30~300的平板进行计数。结果以菌落形成单位(CFU)的常用对数值lg(CFU/g)表示。
1.3.6 数据统计分析应用SPSS 13.0对取得的数据进行单因素方差分析(one-way ANOVA)并采用LSD法进行多重比较,结果以平均值±标准差表示,P<0.05为差异显著。
2 结 果 2.1 天蚕素A-马盖宁杂合肽对小肠黏膜结构的影响 2.1.1 天蚕素A-马盖宁杂合肽对十二指肠黏膜结构的影响由表1可知,2个杂合肽组十二指肠绒毛长度均显著大于对照组(P<0.05),2个杂合肽组间差异不显著(P>0.05)。隐窝深度值以低剂量杂合肽组最小,其次是高剂量杂合肽组,2组间差异显著(P<0.05),对照组隐窝深度值大于2个杂合肽组,差异均显著(P<0.05)。V/C表现为低剂量杂合肽组最大,但与高剂量杂合肽组差异不显著(P>0.05),均显著大于对照组(P<0.05)。各组的切片展示如图1。
| 表1 天蚕素A-马盖宁杂合肽对小鼠十二指肠黏膜结构的影响 Table 1 Effects of cecA-mag on mucosal structure of duodenum of mice |
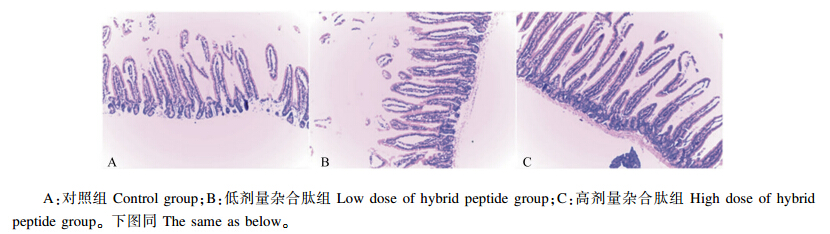 | 图1 天蚕素A-马盖宁杂合肽对小鼠十二指肠黏膜结构的影响
Fig. 1 Effects of cecA-mag on mucosal structure of duodenum of mice (100×) |
2.1.2 天蚕素A-马盖宁杂合肽对空肠黏膜结构的 影响
由表2可知,2个杂合肽组的空肠绒毛长度均大于对照组,但差异不显著(P>0.05)。隐窝深度2个杂合肽组均显著低于对照组(P<0.05),2个杂 合肽组间差异不显著(P>0.05)。V/C表现为2个杂合肽组均显著大于对照组(P<0.05),2个杂合肽组间差异不显著(P>0.05)。各组的切片展示如图2。
| 表2 天蚕素A-马盖宁杂合肽对小鼠空肠黏膜结构的影响 Table 2 Effects of cecA-mag on mucosal structure of jejunum of mice |
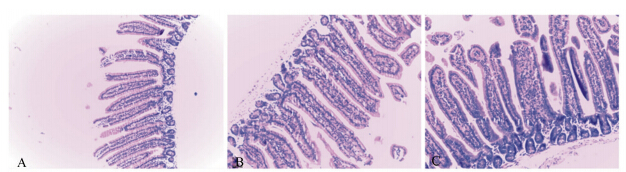 | 图2 天蚕素A-马盖宁杂合肽对小鼠空肠黏膜结构的影响
Fig. 2 Effects of cecA-mag on mucosal structure of jejunum of mice (100×) |
由表3可知,与对照组相比,2个杂合肽组的回肠绒毛长度更长,但是差异不显著(P>0.05)。 隐窝深度2个杂合肽组均显著低于对照组(P< 0.05),2个杂合肽组间差异不显著(P>0.05)。V/C表现为2个杂合肽组均显著大于对照组(P<0.05),2个杂合肽组间差异不显著(P>0.05)。各组的切片展示如图3。
| 表3 天蚕素A-马盖宁杂合肽对小鼠回肠黏膜结构的影响 Table 3 Effects of cecA-mag on mucosal structure of ileum of mice |
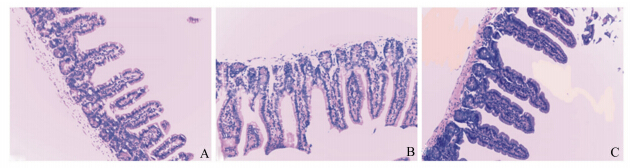 | 图3 天蚕素A-马盖宁杂合肽对小鼠回肠黏膜结构的影响
Fig. 3 Effects of cecA-mag on mucosal structure of ileum of mice (100×) |
由表4可知,与对照组相比,2个杂合肽组十二指肠和空肠内IgA阳性表达水平均显著增加 (P<0.05),而2个杂合肽组间差异不显著(P> 0.05)。同时2个杂合肽组回肠内IgA阳性表达水平均显著高于对照组(P<0.05),且高剂量杂合肽组显著高于低剂量杂合肽组(P<0.05)。各肠段各组的切片展示如图4~图6。
| 表4 小鼠小肠中IgA阳性细胞平均光密度变化 Table 4 The change of mean density of IgA-positive cells in small intestine of mice |
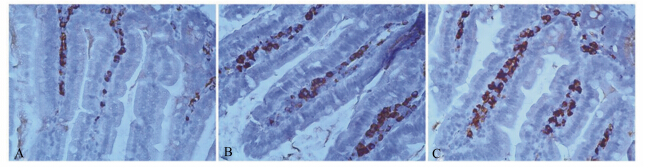 | 图4 小鼠十二指肠中IgA阳性细胞变化
Fig. 4 The change of IgA-positive cells in duodenum of mice (400×) |
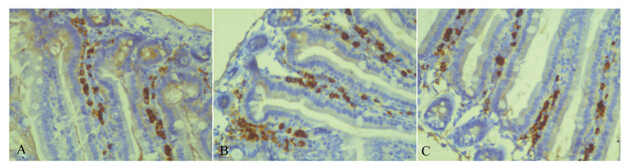 | 图5 小鼠空肠中IgA阳性细胞变化
Fig. 5 The change of IgA-positive cells in jejunum of mice (400×) |
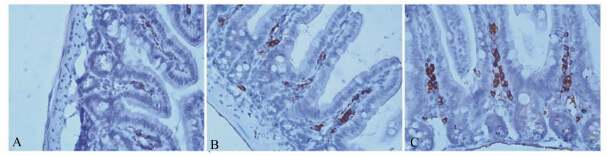 | 图6 小鼠回肠中IgA阳性细胞变化
Fig. 6 The change of IgA-positive cells in ileum of mice (400×) |
由表5可知,2个杂合肽组小肠黏膜IL-2、IFN-γ、IL-4含量均显著高于对照组(P<0.05),而2个杂合肽组间差异不显著(P>0.05)。IFN-γ/IL-4各组之间差异不显著(P>0.05)。
| 表5 天蚕素A-马盖宁杂合肽对小鼠小肠黏膜细胞因子的影响 Table 5 Effects of cecA-mag on cytokines of small intestinal mucosa of mice |
由表6可知,2个杂合肽组小鼠肠道内的大肠杆菌数量均显著低于对照组(P<0.05),且高剂量杂合肽组的大肠杆菌数量亦显著低于低剂量杂合肽组(P<0.05)。2个杂合肽组小鼠肠道内的双歧杆菌和乳酸杆菌数量均显著高于对照组(P<0.05),且2个杂合肽组之间双歧杆菌的数量差异 显著(P<0.05),表现为高剂量杂合肽组显著高于 低剂量杂合肽组。
| 表6 天蚕素A-马盖宁杂合肽对小鼠肠道菌群数量的影响 Table 6 Effects of cecA-mag on the number of intestinal microflora of mice lg(CFU/g) |
小肠是机体主要营养物质消化吸收的重要场所,小肠黏膜发育不良或受损将严重影响机体正常的生长发育和免疫功能。小肠绒毛的长度与小肠上皮细胞的数量呈正相关而且绒毛长度的变化直接影响绒毛的表面积[6]。小肠绒毛变长使小肠上皮细胞的数量及小肠接触营养物质的面积增大,小肠消化和吸收营养物质的能力增强,另外肠绒毛规律的摆动还有利于排除有害菌群的定植[7]。肠隐窝即肠腺,隐窝基部细胞向上迁移到绒毛的过程中成熟为具有吸收功能的绒毛上皮细胞,以补充绒毛上皮的脱落。隐窝深度变浅,表明肠上皮细胞成熟率上升,吸收功能增强[8]。小肠V/C越大表明小肠内膜的面积越大,消化吸收能力越强[9]。刘莉如等[10]研究发现饲粮中添加不同剂量天蚕素抗菌肽可不同程度地提高海兰褐仔公鸡小肠黏膜绒毛长度并降低隐窝深度。包汇慧等[11]的研究结果表明肉鸡的饮水或饲料中添加适量的猪小肠抗菌肽可以增加十二指肠、空肠的绒毛长度,增强肉鸡小肠的吸收功能。本研究结果表明,除空肠、回肠的绒毛长度各组之间无显著性差异外,灌胃给予不同剂量的天蚕素A-马盖宁杂合肽可不同程度地提高小鼠小肠各肠段的绒毛长度,降低各肠段的隐窝深度,增大小肠各段的V/C,从而有效改善了小肠黏膜结构。天蚕素A-马盖宁杂合肽只显著提高试验组十二指肠的绒毛长度,而没有显著提高空肠及回肠的绒毛长度,可能是因为杂合肽经灌胃由十二指肠到回肠的过程中,也不可避免受到了肠内消化液中蛋白酶的消化作用,导致促进小肠吸收功能提高的能力有所下降。
3.2 天蚕素A-马盖宁杂合肽对小肠各段黏膜IgA阳性表达水平的影响肠道黏膜免疫中的分泌型IgA主要由黏膜固有层内的浆细胞(IgA阳性细胞)产生的IgA单体和肠道上皮产生的分泌片(SC片段)通过J链以共价键形式结合而成,能与病原菌形成抗原抗体复合物,刺激肠道黏液的分泌,有助于病原菌和内毒素随粪便排出,对黏膜免疫屏障的形成起着重要作用[12]。姚俊等[13]的研究表明给SPF鸡肌肉注射猪小肠抗菌肽可以显著提高实验动物各肠段分泌型IgA的阳性表达水平。本试验通过观察IgA阳性细胞,衡量IgA的阳性表达水平进一步反映分泌型IgA的多少。免疫组织化学染色结果表明,IgA阳性细胞为棕黄色圆形或椭圆形,主要分布在绒毛固有层和肠腺周围,以绒毛固有层中数量最多,并表现出从绒毛顶端由上到下数量逐渐增多的趋势。灌胃给予不同剂量的天蚕素A-马盖宁杂合肽均可显著提高小鼠小肠各段IgA的阳性表达水平,从而增强小肠黏膜免疫防御功能。
3.3 天蚕素A-马盖宁杂合肽对小肠黏膜内细胞因子含量的影响细胞因子作为免疫调节的关键物质之一,对肠道黏膜免疫具出重要的调节作用。IgA介导的免疫应答依赖于T细胞的辅助,主要是通过肠道淋巴组织中的T细胞调节IgA的合成,并通过T细胞分泌的细胞因子对IgA进行调节和促进。根据产生的细胞因子以及发挥的作用不同,Th细胞(辅助性T细胞)分为Th1、Th2 2种。Th1细胞主要功能是介导细胞免疫,Th2细胞的主要功能在于体液免疫。一般情况下,机体的Th1和Th2细胞处于相对平衡的状态,一旦平衡失调会引发相关免疫学疾病[14]。IL-2是由Th1细胞产生的糖蛋白,又称T细胞生长因子,其主要作用是诱导T淋巴细胞增殖,同时刺激细胞因子的分泌,此外具有抗肿瘤、抗微生物感染的作用。IFN-γ为Th1最特异的细胞因子,具有清除细胞内细菌和病毒、调节细胞免疫功能的作用[15]。IL-4是由Th2细胞产生的特征性细胞因子,又称B细胞生长因子,具有中和细胞外病原体和抑制细胞免疫、促进体液免疫的作用,是有效的抗炎细胞因子。IFN-γ、IL-4还能分别刺激各自细胞产生细胞因子发挥作用,抑制对方细胞活性。因此IFN-γ/IL-4可以反映Th1/Th2的平衡状态[16]。本试验结果表明,灌胃给予2个不同剂量的天蚕素A-马盖宁杂合肽均可显著提高小肠黏膜中的IL-2的含量,说明2个不同剂量的天蚕素A-马盖宁杂合肽灌胃均可促进机体肠道T淋巴细胞的增殖与分化,提高肠道的细胞免疫水平。同时,2个不同剂量杂合肽组的IL-4的含量显著高于对照组,提示2个不同剂量的天蚕素A-马盖宁杂合肽灌胃可以激活并促进Th2细胞分泌IL-4,从而提高肠道黏膜的体液免疫水平。2个不同剂量杂合肽组的IFN-γ的含量比对照组也有显著提高,说明杂合肽组细胞免疫受到促进,同时与升高的IL-4相互拮抗以维持Th1/Th2的平衡。灌胃结束后2个不同剂量杂合肽组的IFN-γ/IL-4与对照组相比差异不显著,说明2个不同剂量水平的天蚕素A-马盖宁杂合肽灌胃在提高机体肠道细胞免疫和体液免疫水平的同时并没有破坏Th1/Th2的平衡状态。
3.4 天蚕素A-马盖宁杂合肽对肠道菌群数量的影响肠道菌群是生物体胃肠道功能的重要组成部分,参与生物体的生理、生化、病理和药理的全过程。乳酸杆菌和双歧杆菌为动物肠道中的有益菌群,具有维护动物健康和调节免疫功能的作用。而大肠杆菌为条件致病菌,是内毒素的重要来源,一旦机体免疫力下降或处于应激等状态下,大肠杆菌引起腹泻等疾病并导致肠黏膜通透性增加,内毒素将会进入血液引起炎性反应[17]。姚远等[18]的研究表明饲粮中适量添加天蚕素能够有效地减少鸡肠道中大肠杆菌、沙门氏菌数量并显著提高乳酸杆菌数量。刘莉如等[19]的研究结果表明在饲粮中添加不同水平抗菌肽均能有效降低大肠杆菌数量,并显著增加双歧杆菌和乳酸杆菌的数量。本试验结果表明,灌胃给予2个不同剂量的天蚕素A-马盖宁杂合肽均能显著降低小鼠盲肠内容物中大肠杆菌的数量,显著提高双歧杆菌和乳酸杆菌的数量,从而改善小鼠肠道微生物菌群,促进肠道微生态平衡。此外,灌胃给予2个不同剂量的天蚕素A-马盖宁杂合肽对于肠道菌群的调节作用表现出剂量依赖性,以高剂量杂合肽组效果更佳。本团队研究前期结果表明天蚕素A-马盖宁杂合肽具有良好的抗菌性能,对金黄色葡萄球菌、大肠杆菌均具有杀灭作用[5]。结合本试验结果提示灌胃给予天蚕素A-马盖宁杂合肽可能通过抑制小鼠肠道有害菌的增殖,减弱有害菌对有益菌生长的竞争抑制作用,同时促进肠道有益菌的增殖,促进有益菌产生乳酸等进而降低肠道pH来阻止有害菌对肠道的入侵,改善机体肠道内环境,增强机体肠道功能。
4 结 论① 灌胃给予小鼠天蚕素A-马盖宁杂合肽,可以不同程度提高小肠各肠段的绒毛长度、绒毛长度/隐窝深度,并显著降低隐窝深度,从而有效地改善小肠黏膜结构。
② 灌胃给予小鼠天蚕素A-马盖宁杂合肽,可以显著提高小肠各肠段黏膜内IgA的阳性表达水平,增强小肠黏膜免疫防御功能。
③ 灌胃给予小鼠天蚕素A-马盖宁杂合肽,可以显著提高小肠黏膜内IL-2、IFN-γ、IL-4的含量,提高机体肠道细胞免疫和体液免疫水平,同时维持Th1/Th2的平衡。
④ 灌胃给予小鼠天蚕素A-马盖宁杂合肽,可以显著降低盲肠内容物中大肠杆菌的数量,显著提高双歧杆菌和乳酸杆菌的数量,促进肠道微生态平衡,以高剂量杂合肽组效果更佳。
| [1] | 黎观红,洪智敏,贾永杰,等.抗菌肽的抗菌作用及其机制[J]. 动物营养学报,2011,23(4):546-555. ( 1) 1)
|
| [2] | 牛明福,李翔,伍家发.抗菌肽的分子设计研究进展[J]. 上海畜牧兽医通讯,2008(4):2-5. ( 1) 1)
|
| [3] | 王秀青,朱明星,张爱君,等.CecA-mag及其突变体在Pichia pastoris中的表达及抗菌活性试验[J]. 动物医学进展,2011,32(2):56-60. ( 1) 1)
|
| [4] | 王秀青,朱明星,张婵,等.抗菌肽cecropin B对人工感染大肠杆菌雏鸡的治疗效果研究[J]. 中国家禽,2011,33(11):15-17,21. ( 1) 1)
|
| [5] | WANG X Q,ZHU M X,ZHANG A J,et al.Synthesis and secretory expression of hybrid antimicrobial peptide cecA-mag and its mutants in Pichia pastoris[J]. Experimental Biology Medicine,2012,237(3):312-317. ( 2) 2)
|
| [6] | CASPARY W F.Physiology and pathophysiology of intestinal absorption[J]. The American Journal of Clinical Nutrition,1992,55(1S):299S-308S. ( 1) 1)
|
| [7] | 刘秋东,张中文,刘凤华,等.复方白头翁胶囊对腹泻犬小肠绒毛长度和隐窝深度的影响[J]. 北京农学院学报,2011,26(3):38-40. ( 1) 1)
|
| [8] | 郭志强,杨奉珠,雷岷,等.抗菌肽对肉兔小肠黏膜形态、盲肠菌群和免疫功能的影响[J]. 动物营养学报,2012,24(9):1778-1784. ( 1) 1)
|
| [9] | BAO H,SHE R,LIU T,et al.Effects of pig antibacterial peptides on growth performance and intestine mucosal immune of broiler chickens[J]. Poultry Science,2009,88(2):291-297. ( 1) 1)
|
| [10] | 刘莉如,杨开伦,滑静,等.抗菌肽对海兰褐仔公鸡小肠黏膜形态结构及免疫活性细胞数量的影响[J]. 动物营养学报,2013,25(1):190-197. ( 1) 1)
|
| [11] | 包汇慧,佘锐萍,张艳梅,等.猪小肠粘膜抗菌肽对肉鸡生长及肠道粘膜免疫的影响[C]//京津冀畜牧兽医科技创新交流会暨新思想、新观点、新方法论坛论文集.保定:中国畜牧兽医学会,2008:108-114. ( 1) 1)
|
| [12] | 杨慧,潘康成,张金辉,等.芽孢杆菌制剂对小肠粘膜抗体分泌细胞的影响[C]//中国畜牧兽医学会动物微生态学分会第四届第九次学术研讨会论文集.新乡:中国畜牧兽医学会动物微生态学分会,2008:322-326.( 1) 1)
|
| [13] | 姚俊,王德成,佘锐萍,等.猪小肠抗菌肽对SPF鸡肠道黏膜免疫功能的影响[J]. 科学技术与工程,2009,9(17):4918-4923. ( 1) 1)
|
| [14] | 姜帆.五味子多糖的提取纯化及其对肠道免疫功能的影响[D]. 硕士学位论文.哈尔滨:东北农业大学,2013:1-64. ( 1) 1)
|
| [15] | 贾玉臣,陈庆森,王友湘,等.瑞士乳杆菌对小鼠肠道黏膜免疫应答及细胞因子的影响[J]. 食品科学,2010,31(23):335-339. ( 1) 1)
|
| [16] | 王强,刘亚欧,李兴平,等.银翘散对呼吸道黏膜Th1/Th2细胞因子的影响[J]. 中成药,2013,35(1):165-167. ( 1) 1)
|
| [17] | 谷娟,许丛丛,蔡旋,等.复合多肽对早期断奶仔猪生长性能、血液理化指标和肠道主要菌群数量的影响[J]. 动物营养学报,2013,25(3):579-586. ( 1) 1)
|
| [18] | 姚远,匡伟,黄忠阳,等.抗菌肽天蚕素对鸡生长性能、肠道黏膜形态、盲肠菌群及免疫功能的影响[J]. 江苏农业学报,2014,30(2):331-338. ( 1) 1)
|
| [19] | 刘莉如,滑静,王晓霞,等.抗菌肽对蛋用仔公鸡血液免疫指标和肠道菌群的影响[J]. 动物营养学报,2012,24(9):1812-1818. ( 1) 1)
|




