2. 华南农业大学动物科学学院, 广州 510642
2. College of Animal Science, South China Agriculture University, Guangzhou 510642, China
通过T型瘘管获得部分动态食糜样品以研究养分在猪体内的消化过程及程度已成为常规的研究手段。在该技术中采样方案直接影响到食糜样品的代表性,从而影响测试结果。目前,在猪回肠末端氨基酸消化率测定的食糜采样中,不同的研究人员采用的采样方案有较大的差异。累计采样时间从16~48 h不等,重复采样天数为1~3 d。如Htoo等[1]在研究不同蛋白质水平饲粮的猪回肠末端氨基酸消化率时,食糜收集期为正试期第67天的08:00~20:00,总共24 h。Diebold等[2]在研究添加木聚糖酶和磷脂酶的小麦型饲粮各养分的回肠消化率时,食糜收集期为正试期第10天的08:00~20:00,第11天的02:00~14:00和20:00~08:00,第12天的14:00~02:00,总共48 h。尽管德国[3]和荷兰[4]分别建立了生长猪回肠氨基酸消化率的推荐测定方法,但仍指出,食糜的采样频率与持续时间以及试验猪的采食时间与频率对食糜样品的代表性有重要的影响。由此可见,现有的肠道食糜采样方案中,仍具有较大的人为随意性,难以追溯其采样的生理依据。为了使通过瘘管采集的食糜样品尽可能多地代表流经肠道全部食糜的生理信息,需要从以下3个方面进行探讨:1)不同采样时间间瘘管内食糜样品的流量有多大差异?2)每日累计采集的样品量占流经回肠末端总食糜样品量的比例?3)每日累计采集的样品中外源指示剂的总回收率及其变异是多少?为此,本试验通过比较3 d不同采样时间间生长猪回肠末端T型瘘管内食糜养分流量的变异,以瘘管收集日内16 h回肠末端食糜总流量、全天流经回肠末端食糜总流量的日间差异及日内16 h通过回肠瘘管收集食糜的三氧化二铬(Cr2O3)回收率,为回肠代表性食糜的采集方案提供参考。
1 材料与方法 1.1 试验设计采用3×16双因素完全随机设计,其中采样日期设3个水平,即试验期第8、9、10天。日内采样时间设16个水平,即08:00~24:00,每小时通过瘘管采集回肠末端食糜样品。待每次样品收集后置于-20 ℃保存。
1.2 试验动物与饲粮选择初始体重为(21.3±1.0) kg左右的大×长二元杂交去势公猪6头,术前1周进入代谢笼。随机选择4头在回肠末端安装T型瘘管。术后恢复14 d,期间每天08:00和16:00等量饲喂饲粮1,自由饮水。从术后第2天开始饲喂自由采食量的10%,其后逐渐增加,到术后第4天,恢复自由采食。 试验期,日采食量按照100 g/kg BW0.75分餐1次[5]分装全部饲粮,08:00和16:00等量饲喂饲粮2。饲粮组成及营养水平见表1。试验期自由饮水,采样期间补充电解质水[5],其组成如下(g/L):KCl 0.372,CaCl2·6H2O 0.548,MgCl2·6H2O 0.304,NaCl 5.260。代谢室卫生管理按动物营养学国家重点实验室常规程序进行。
| 表1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the diets (air-dry basis) |
术前试验猪禁食24 h,期间自由饮水,手术室及手术台以0.01%的新洁尔灭喷雾消毒后,再以紫外灯照射30 min灭菌。手术器械、瘘管、缝合针、线等用0.05%的新洁尔灭浸泡30 min后再用生理盐水清洗。将试验猪右腹侧后半部剃毛并用生理盐水清洁。耳后肌肉注射舒泰0.08 mL/kg及速眠新Ⅱ 0.05 mL/kg作全身麻醉。待猪昏迷后,右腹侧向上保定于手术台上,用碘酊、酒精对术部进行浸染消毒。按照腹壁切开手术常规操作,在腹中线上方约20 cm、最后肋骨后约3~4 cm处,纵向作长约6~8 cm的切口。然后依次切开皮肤层、钝性撕开肌肉层,剪开腹膜层后找到回盲结合处。在距此处往前15 cm处背向肠系膜一侧的肠段上纵向作约3 cm切口,恰好将瘘管凹型端插入。然后绕瘘管作荷包缝合,轻敷青霉素后将瘘管送回腹腔。在第1道皮肤切口距头侧约3~5 cm处,作一长约3 cm的第2道切口,将瘘管管体从此处引出。切忌肠管发生前后扭转。然后套上外垫圈,以防止瘘管掉入腹腔。在第1道切口处依次缝合腹膜、纵肌、斜肌及皮肤。最后用酒精和碘酒在术部消毒,并敷青霉素粉消炎。将荷术猪转移至观察室,待其完全清醒后再转移至代谢笼内。禁饲、禁水24 h,按常规程序护理2周。当试验猪恢复了正常的采食,且体况良好后,开始试验期。
1.4 样品采样与处理根据试验设计规定的采样日和采样时间,依次打开瘘管盖、内塞,将样品收集装置(塑料袋与内螺纹塑料连接件)拧到瘘管上。当袋内的食糜样品超过50 mL时,更换收集装置。将每次收集的样品称重(总重-皮重,精确至0.01 g)后装入每1 h的总收集袋中。-20 ℃冷冻。待试验结束后,解冻食糜样品。无损失地转移到培养皿中65 ℃烘干、称重,并迅速测定干物质含量,同时测定总能、粗蛋白质和Cr2O3的含量。
1.5 测定指标与方法饲粮与食糜样品的干物质含量参照《饲料中水分和其他挥发性物质含量的测定》(GB/T 6435—2006)的方法测定。总能参照《动物饲料、动物性产品和粪或尿总能的测定——氧弹式热量计法》(ISO 9831 ∶ 1998)的方法,使用Parr 6400全自动绝热式氧弹计测定。粗蛋白质含量参照《饲料中粗蛋白测定方法》(GB/T 6432—1994),使用KDY-9820凯氏定氮仪测定。Cr2O3含量参照Fenton等[6]的方法,使用紫外分光光度计测定。
1.6 数据处理与统计分析食糜中养分流量及Cr2O3回收率的计算如下:


式中:ti为第i小时内的采样时间,单位为min;每日回肠末端食糜养分总流量,分别指干物质、总能、粗蛋白质及Cr2O3的总流量,计算中根据猪全消化道消化率指示剂法测定的原理[7]假设全天回肠末端Cr2O3的回收率为100%。
统计分析根据双因素完全随机设计,采用SAS 9.0 GLM模块对瘘管内鲜食糜、食糜干物质、粗蛋白质、总能和Cr2O3的流量进行协方差分析,其中协变量为猪的采食量,主效应为采样日与日内采样时间,随机效应为试验猪个体。对16 h瘘管内食糜养分总流量、全天流经回肠末端食糜养分总流量、Cr2O3的回收率进行协方差分析,其中协变量为猪的采食量,主效应为采样日,随机效应为试验猪个体。组间平均值采用Duncan氏法进行多重比较。数据以最小二乘方平均值表示。
2 结果与分析 2.1 通过T型瘘管收集回肠末端食糜养分及Cr2O3流量的日内与日间变异如图1所示,通过T型瘘管收集回肠末端鲜食糜及干物质的平均流量分别为169.7和13.2 g/h,日内与日间的总变异系数分别为55.01%和56.08%。采样日对回肠末端鲜食糜及干物质的流量均无显著影响(P>0.05)。日内采样时间对回肠末端鲜食糜和干物质的流量均有显著性影响(P<0.05)。采样日与日内采样时间对回肠末端鲜食糜与干物质流量的影响无显著的互作效应(P>0.05)。在食糜流量的日内变异上,回肠末端鲜食糜和干物质的流量在餐后2 h后达到最大值,然后逐渐降低,并在餐后4 h降到最低值。在随后4 h内,回肠末端鲜食糜与干物质的流量一直处于较低的水平波动。
在猪回肠末端T型瘘管中,食糜总能与粗蛋白质的平均流量分别为218.9 kJ/h和2.0 g/h,日内与日间的总变异系数分别为57.09%和56.02%。采样日期对回肠末端食糜总能流量有显著性影响(P<0.05),对回肠末端食糜粗蛋白质的流量没有显著性的影响(P>0.05)。日内采样时间对回肠末端食糜总能和粗蛋白质的流量也均有显著性影响(P<0.05)。采样日与日内采样时间对回肠食糜总能与蛋白质的流量的影响无显著的互作效应(P>0.05)。在食糜流量的日内变异上,回肠食糜总能和粗蛋白质的流量在餐后2 h后达到最大值,然后逐渐降低,并在餐后5 h降到最低值。在随后3 h内,回肠末端食糜总能与粗蛋白质的流量一直处于较低的水平波动。
通过T型瘘管收集的回肠末端食糜中,指示剂Cr2O3的平均流量为0.23 g/h,日内与日间的总变异系数为61.09%。采样日期对指示剂的流量无显著影响(P>0.05)。日内采样时间对回肠末端食糜指示剂的流量有显著性影响(P<0.05)。采样日与日内采样时间对回肠食糜指示剂流量的影响无显著的互作效应(P>0.05)。在日内变异上,餐后2 h指示剂的流量达到最大值,然后逐渐降低,并在餐后5 h降到最低值。在随后3 h内,回肠末端食糜指示剂流量一直处于较低的水平波动。
2.2 通过T型瘘管收集16 h回肠末端食糜流量与 全天流经回肠末端食糜总流量的日间差异由表2可知,采样日对日内通过T型瘘管连续收集16 h的回肠末端食糜干物质总量、总能总量及粗蛋白质总量均有显著性影响(P<0.05),其日间变异系数分别为12.09%,12.99%,13.84%。其中试验期第9和10天的16 h内收集的食糜干物质总量、总能总量及粗蛋白质总量比第8天的相应值分别显著少19.1%和15.8%(P<0.05)、20.1%和16.1%(P<0.05)与19.2%和14.4%(P<0.05)。采样日对通过指示剂估测流经回肠末端的全天食糜干物质总量及总能总量也有显著性影响(P<0.05),变异系数分别为6.97%和7.46%。其中试验期第9、10天每日流经回肠末端的食糜干物质总量及总能总量比第8天的相应值分别显著少14.0%和16.2%(P<0.05),20.4%和22.4%(P<0.05)。采样日对通过指示剂估测流经回肠的全天食糜粗蛋白质总量没有显著性影响(P>0.05)。通过T型瘘管连续收集16 h的回肠末端食糜干物质总量、总能总量及粗蛋白质总量占全天流经回肠末端食糜的相应量的比例分别为76.3%、72.8%和71.5%。而且这一比例在采样日间无显著性差异(P>0.05)。
| 表2 16 h内T型瘘管收集回肠末端食糜与全天流经回肠末端食糜养分的总量 Table 2 The nutrient flow collected for 16 h with T-cannula and passed the intestine in 24 h at terminal ileum of growing pig |
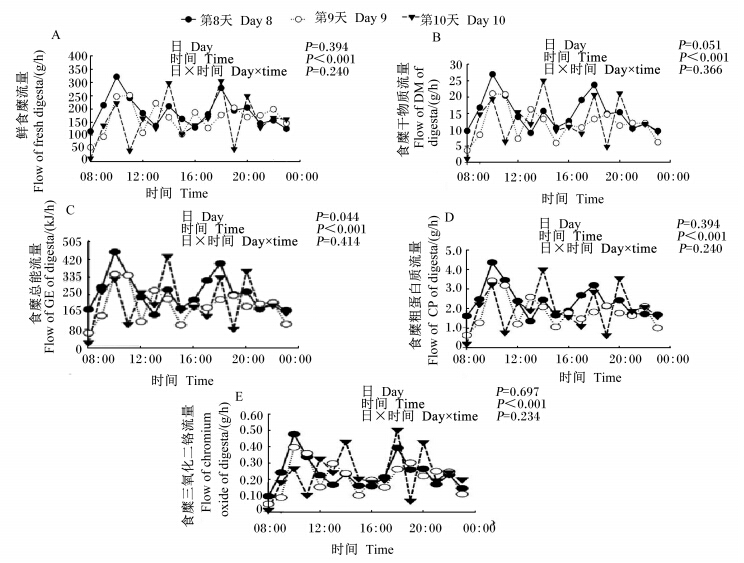 | 图1 生长猪回肠末端T型瘘管中食糜养分及Cr2O3的流量
Fig. 1 Flow of nutrients and chromium oxide in digesta collected with T-cannula at terminal ileum of growing pig |
2.3 通过T型瘘管收集16 h回肠食糜Cr2O3回收率的日间变异
由表3可知,在试验期第8、9、10天,通过瘘管连续16 h收集回肠末端食糜的Cr2O3总量分别为3.7、3.4和3.7 g,日间变异系数为11.18%。采样日间所收集食糜Cr2O3的总量无显著性差异(P>0.05)。3 d采样期中,全天流经回肠末端的Cr2O3总量分别为4.9、4.9和4.9 g,日间变异系数为8.73%。采样日间流经回肠末端食糜Cr2O3的总量无显著性差异(P>0.05)。相应地,3个采样日内通过瘘管16 h连续收集回肠末端食糜Cr2O3总量占全天流经回肠末端Cr2O3总量(回收率)的比例分别为75.4%、69.7%和73.7%,回收率在日间无显著性差异(P>0.05)。
3 讨 论 3.1 生长猪回肠中食糜养分流量变异的控制因素食糜养分的流量是由食糜流量及食糜中养分的含量2个数据相乘得出。在胃肠道鲜食糜流量的控制上,胃内液态食糜的排空主要受胃与十二指肠压力差的控制,而固态食糜的排空受食糜粒度(阈值:直径<2.0 mm)的控制[8, 9]。由此表明,胃排往小肠的食糜在组成上是由固态物质与液态物质按不同的比例混合而成,因此,进入小肠的食糜在化学组成上是波动的。在鲜食糜的流量变化上,餐后1 h内,随着食糜在胃内的充盈,渗透压增加,胃的收缩运动增强,食糜排空速度快。随着食糜的排空,渗透压逐渐降低,排空速度减慢[9]。食糜进入小肠后,依靠小肠的分节运动和蠕动推动食糜向后段肠道。食糜中的固态和液态部分受肠内渗透压及“回肠制动”的控制[10],加之,由胃进 入十二指肠食糜流量及在组成上的波动,最终表 现在不同时间内收集的回肠食糜养分在流量也是波动的。
| 表3 16 h内T型瘘管收集回肠末端Cr2O3的总量与全天流经回肠末端食糜Cr2O3的总量 Table 3 The pooled chromium oxide in digesta collected for 16 h with T-cannula and passed the intestine in 24 h at terminal ileum of growing pig |
本试验中,每日2个餐后2 h后回肠鲜食糜、干物质及养分与指示剂的流量达到最大值,在餐后4~5 h流量降至最低。这一现象与上述猪胃肠道内食糜流量的控制机制相符,也处于食糜在猪胃-小肠内平均停留时间的正常范围内[11, 12, 13]。在日内变化规律上,鲜食糜流量与干物质流量、养分流量及指示剂流量都有类似的规律。这表明不同时间采集食糜的干物质、养分及指示剂含量的变异远低于鲜食糜流量的变异,从而使得干物质及养分与指示剂流量的日内变异系与鲜食糜流量的变异系数都比较接近。在日间差异上,尽管鲜食糜的流量无日间显著性差异,但干物质的流量有日间显著性差异,其差异来自于采样期第1天的流量显著地高于第2、3天的流量。由此导致食糜总能与粗蛋白质的流量也呈现类似差异。这表明猪回肠食糜流量在日间平均流量也具有不稳定性。特别是采样首日是否因猪对采样的不适应性导致养分的平均流量与后2 d有显著差异,尚需要进一步研究。
3.2 采样方案对食糜代表性的影响测定饲粮养分在回肠末端的消化率,样品的代表性非常关键[3, 4]。现有研究表明,不同采样时间回肠末端食糜中样品养分及指示剂含量是波动的[14, 15],其中指示剂含量的变异系数达到13%[15]。因此,采集某几个时间点的食糜样品作为测定消化率的依据可能会产生较大的误差。目前,国际上在猪回肠末端消化率的测定上,采样方案有较大的差异(表4)。从本试验结果来看,通过T型瘘管连续收集16 h回肠食糜,其干物质总量占全天流经回肠末端食糜总量的73%以上,总能与粗蛋白质的总量占全天流经回肠末端的68%以上,且这一比例的日间差异不显著,表明16 h所收集的样品具有较好的代表性。特别是16 h从回肠末端收集的Cr2O3总量在日间相对稳定,回收率在69%以上。这表明日内2个餐后连续采集8 h回肠食糜的样品代表性是可以接受的。但综合前面讨论的结果,在3 d的收集中,后面2 d回肠食糜的平均流量相对稳定。因此,在3 d的采样中建议取后面2 d的样品作为分析用样品。
| 表4 文献报道的猪回肠食糜采样方案
Table 4 The published collection schemes for ileal digesta in pigs
|
① 生长猪回肠末端食糜养分及指示剂的流量在日内采样时间上有显著差异,在3 d的收集中,后面2 d食糜养分的平均流量相对稳定。
② 2个餐后8 h的连续收集食糜有较好的代表性,建议3 d采样中,第1天作为采样预试期,后面2 d作为采样正试期。
| [1] | HTOO J K,ARAIZA B A,SAUER W C,et al.Effect of dietary protein content on ileal amino acid digestibility,growth performance,and formation of microbial metabolites in ileal and cecal digesta of early-weaned pigs[J]. Journal of Animal Science,2007,85(12):3303-3312. ( 2) 2)
|
| [2] | DIEBOLD G,MOSENTHIN R,PIEPHO H P,et al.Effect of supplementation of xylanase and phospholipase to a wheat-based diet for weanling pigs on nutrient digestibility and concentrations of microbial metabolites in ileal digesta and feces[J]. Journal of Animal Science,2004,82(9):2647-2656. ( 2) 2)
|
| [3] | GFE.Standardised praecaecal digestibility of amino acids in feedstuffs for pigs-methods and concepts[J]. Proceedings of Society Nutrition Physiology,2005,14:185-205. ( 2) 2)
|
| [4] | CVB.Protocol for determining ileal digestibility in cannulated growing pigs[S].Protocol CVB,Lelystad,The Netherlands,1996. ( 2) 2)
|
| [5] | MOSENTHIN R,JANSMAN A J M,EKLUND M.Standardization of methods for the determination of ileal amino acid digestibilities in growing pigs[J]. Livestock Science,2007,109(1/2/3):276-281. ( 2) 2)
|
| [6] | FENTON T W,FENTON M.An improved procedure for the determination of chromic oxide in feed and feces[J]. Canadian Journal of Animal Science,1979,59(3):631-634. ( 1) 1)
|
| [7] | LEWIS A J,SOUTHERN L L.Swine nutrition[M]. 2nd ed.Washington,D.C.:CRC Press,2001:903-916. ( 3) 3)
|
| [8] | LOW A G.Nutritional regulation of gastric secretion,digestion and emptying[J]. Nutrition Research Reviews,1990,3(1):229-252. ( 1) 1)
|
| [9] | YEN J T.Digestive system[M]//POND W G,MERSMANN H J.Biology of the domestic pig.New York:Cornell University Press,2001.( 2) 2)
|
| [10] | 蒋朱明,吴蔚然.肠内营养[M].2版.北京:人民卫生出版社,2002:8-9. ( 1) 1)
|
| [11] | PARTANEN K,JALAVA T,VALAJA J.Effects of a dietary organic acid mixture and of dietary fibre levels on ileal and faecal nutrient apparent digestibility,bacterial nitrogen flow,microbial metabolite concentrations and rate of passage in the digestive tract of pigs[J]. Animal,2007,1(3):389-401. ( 1) 1)
|
| [12] | POTKINS Z V,LAWRENCE T L J,THOMLINSON J R.Effects of structural and non-structural polysaccharides in the diet of the growing pig on gastric emptying rate and rate of passage of digesta to the terminal ileum and through the total gastrointestinal tract[J]. The British Journal of Nutrition,1991,65(3):391-413. ( 1) 1)
|
| [13] | WILFART A,MONTAGNE L,SIMMINS H,et al.Effect of fibre content in the diet on the mean retention time in different segments of the digestive tract in growing pigs[J]. Livestock Science,2007,109(1/2/3):27-29. ( 1) 1)
|
| [14] | LIVINGSTONE R M,BAIRD B A,ATKINSON T,et al.Circadian variation in the apparent digetibility of diets measured at the terminal ileum in pigs[J]. The Journal of Agricultural Science,1980,94(2):399-405. ( 1) 1)
|
| [15] | GRAHAM H,MAN P.Circadian variation in composition of duodenal and ileal digesta from pigs fitted with T-cannulas[J]. Animal Production,1986,43(1):133-140. ( 1) 1)
|
| [16] | DE LANGE C F,SAUER W C,SOUFFRANT W.The effect of protein status of the pig on the recovery and amino acid composition of endogenous protein in digesta collected from the distal ileum[J]. Journal of Animal Science,1989,67(3):755-762. ( 1) 1)
|
| [17] | SOL-ORIOL D,TORRALLARDONA D,GASA J.Role of dietary fibre source and meal size on the ileal transit of digesta in growing pigs[J]. Livestock Science,2010,133(1/2/3):67-69. ( 1) 1)
|
| [18] | FAN M Z,SAUER W C,MCBURNEY M I.Estimation by regression analysis of endogenous amino acid levels in digesta collected from the distal ileum of pigs[J]. Journal of Animal Science,1995,73(8):2319-2328. ( 1) 1)
|
| [19] | JANSMAN A J,VERSTEGEN M W,HUISMAN J,et al.Effects of hulls of faba beans (Vicia faba L.) with a low or high content of condensed tannins on the apparent ileal and fecal digestibility of nutrients and the excretion of endogenous protein in ileal digesta and feces of pigs[J]. Journal of Animal Science,1995,73(1):118-127. ( 1) 1)
|
| [20] | OWUSU-ASIEDU A,PATIENCE J F,LAARVELD B,et al.Effects of guar gum and cellulose on digesta passage rate,ileal microbial populations,energy and protein digestibility,and performance of grower pigs[J]. Journal of Animal Science,2006,84(4):843-852. ( 1) 1)
|
| [21] | DONKOH A,MOUGHAN P J,SMITH W C.Comparison of the slaughter method and simple T-piece cannulation of the terminal ileum for determining ileal amino acid digestibility in meat and bone meal for the growing pig[J]. Animal Feed Science and Technology,1994,49(1/2):43-56. ( 1) 1)
|
| [22] | IMBEAH M,SAUER W C,CAINE W R.Comparison of the single dose and withdrawal method for measuring the rate of passage of two digestibility markers in digesta collected from the distal ileum and feces in growing pigs[J]. Animal Feed Science and Technology,1995,52(1/2):41-50. ( 1) 1)
|
| [23] | CAINE W R,TAMMINGA S,SAUER W C,et al.Bacterial contributions to total and endogenous recoveries of nitrogen and amino acids in ileal digesta of newly weaned piglets fed protease-treated soybean meal[J]. Livestock Production Science,1999,57(2):147-157. ( 1) 1)
|
| [24] | URBAITYTE R,MOSENTHIN R,EKLUND M,et al.Determination of standardized ileal crude protein and amino acid digestibilities in protein supplements for piglets[J]. Animal,2009,3(12):1696-1705. ( 1) 1)
|




