2. 北京市营养源研究所 系统营养工程技术研究中心, 北京 100069
2. Open Laboratory for Aquatic Animal Nutrition, Beijing Research Institute for Nutritional Resources, Beijing 100069, China
酵母培养物(yeast culture,YC)是在特定工艺条件控制下由酵母在特制的培养基上经过充分厌氧发酵所形成的微生态制品,其主要由酵母细胞代谢产物、经过发酵后变异的培养基以及少量的已无活性的酵母细胞所构成[1, 2]。酵母培养物添加到水产饲料中有助于提高鱼体的增重率,降低饲料系数,修复肝胰脏损伤[2, 3]。肠道作为营养吸收的主要器官[4],极易受到饲料中有害物质的损伤[5, 6]。在肠道保护方面,酵母培养物一方面通过提供营养物质直接促进肠道有益菌的增生繁殖,改善肠道黏膜状态,提高肠绒毛高度及肠壁厚度[1, 7];另一方面通过提高肠道pH稳定性途径促进肠道有效益生菌的繁殖,从而保护肠道[8]。酵母培养物中营养物质对鱼体肠道细胞直接的保护作用未曾见报道。此外,使用养殖试验方法研究酵母培养物对鱼体肠道保护作用存在试验周期长、影响因素复杂等缺点,而使用细胞培养方法则有试验周期短、影响因素可控的优点,有助于研究酵母培养物对有害物质损伤肠道的修复作用机理及作用浓度。因酵母培养物有效物质成分为其代谢产物,同时细胞培养中有防止细菌引入的要求,需要获得无菌酵母培养物代谢产物。因此,本试验在草鱼(Ctenopharyngodon idella)肠道黏膜细胞分离与原代培养技术方法[9]的基础上,以水溶解酵母培养物,通过过滤除菌手段获得酵母培养物的有效成分,得到含不同浓度酵母培养物水溶物的细胞培养液,添加在离体肠道黏膜细胞的培养液中,以观察酵母培养物水溶物对离体草鱼肠道黏膜细胞生长及细胞膜完整性的影响,为研究酵母培养物中营养物质对鱼体肠道细胞保护作用机理及对有害物质损伤肠道的修复作用浓度筛选提供参考。
1 材料与方法 1.1 试验草鱼与肠道黏膜细胞分离、培养 1.1.1 试验草鱼及饲养管理获取肠道黏膜细胞的试验草鱼平均体重为(22.0±5.0) g,取自苏州相城新时代养殖场,饲养于苏州大学鱼类循环养殖系统中。
试验草鱼随机分养于24个养殖桶中,每桶放养30~40尾,养殖桶水体体积0.2 m3,在养殖桶的进、出水口安置过滤棉以防循环水带进饲料等物质。使用自制的强化饲料[10]强化饲养2周后用于肠道黏膜细胞的采集。养殖期间投喂的配合饲料含蛋白质28%、油脂4%。每天投喂饲料2次,投喂时间为08:00、17:00。养殖期间水温为(24±4) ℃、溶解氧浓度>6 mg/L。
1.1.2 肠道黏膜细胞的获取与培养方法草鱼肠道黏膜细胞(细胞团)获取及其培养方法参照本实验室建立的方法[9]。主要操作步骤为:试验草鱼用超纯水冲洗体表2次,捣碎脑部处死,迅速置75%乙醇中浸泡5~10 s。超净工作台上解剖鱼体,取出肠道中段,去除肠系膜脂肪,用注射器(10 mL)吸取D-Hanks液冲洗肠段内腔3~4次;采用机械刮取获得肠道黏膜组织,加入胶原酶Ⅰ、Ⅳ联合消化液(含有胶原酶Ⅰ、Ⅳ各0.1 mg/mL的D-Hanks液,0.22 μm过滤,-20 ℃贮存),28 ℃振荡消化30 min后,立即加入终止液(按消化液 ∶ 胎牛血清=19 ∶ 1的比例配制而成)终止消化,玻璃吸管反复吹打5 min后静止1 min,吸取上层细胞悬液为原代黏膜细胞(细胞团)液。原代黏膜细胞(细胞团)液经过400 r/min离心7 min后,加入细胞培养液(使用前添加15%胎牛血清的M199培养液)悬浮沉淀,再离心(400 r/min、7 min)2次,取细胞(细胞团)悬浮液接种于96孔细胞培养板(鼠尾胶原Ⅰ型包被)。细胞(细胞团)接种数量保持在2×103个/孔,使用添加15%胎牛血清的M199培养液作为细胞培养液,在27 ℃,6% CO2条件下培养36 h后进行试验。
1.2 酵母培养物水溶物制备制备酵母培养物水溶物原料为达农威水产益康(DV AQUA,美国达农威生物发酵工程技术有限公司,有效成分为酵母细胞外代谢产物)。酵母培养物水溶物制备方法:室温下使用细胞培养液将酵母培养物溶解10 min,超净工作台中0.22 μm过滤,制得无菌含酵母培养物的细胞培养液。分别制备含酵母培养物水溶物10、25、50、100、200 mg/L的细胞培养液,并调整pH至7.3。试验开始后直接使用含不同浓度酵母培养物水溶物的细胞培养液进行细胞培养。
1.3 试验设计采用单因子试验设计,设1个对照组及5个酵母培养物水溶物组(YC-1~5组),各组均设96个重复,每个重复为1个培养孔。当细胞生长36 h后,按表1所示更换各组对应的细胞培养液,开始试验。
| 表1 试验设计 Table 1 Experimental design |
在试验开始后3 h时每组随机选取8个培养孔,经过吉姆萨(Giemsa)染色[11],观察细胞集落的生长状态,使用IX70荧光倒置显微镜(奥林巴斯公司)拍照记录。
1.4.2 细胞活性测定分别在试验开始后3、6、9、12 h时每组随机选取8个培养孔,采用噻唑蓝(MTT)法[12]测定培养液中细胞活性。所用试剂MTT(Sigma-Aldrich公司产品)浓度为5 mg/mL,0.22 μm过滤,-20 ℃贮存。
1.4.3 主要酶活力测定分别在试验开始后3、6、9、12 h时每组随机选取8个培养孔,吸取培养孔中培养液保存于EP管中,-80 ℃冷冻保存,用于测定培养液中乳酸脱氢酶(lactate dehydrogenase,LDH)、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)的活力。上述指标测定试剂盒均为南京建成生物工程研究所生产,按照试剂盒说明书进行测定。
1.5 数据处理数据以平均值±标准差(mean±SD)表示,结果用SPSS 17.0软件进行统计分析,用Duncan氏法进行多重比较,差异显著水平为P<0.05。
2 结果与分析 2.1 细胞生长情况 2.1.1 细胞生长状态变化前期试验结果[9]表明,进行Giemsa染色后对细胞生长状态的观察更为直观。从培养3 h后细胞生长状态(图1)可以看出,对照组与5个酵母培养物水溶物组的贴壁细胞均正常铺展,细胞均能汇集形成细胞集落,且5个酵母培养物水溶物组的细胞形态与对照组无明显差别。
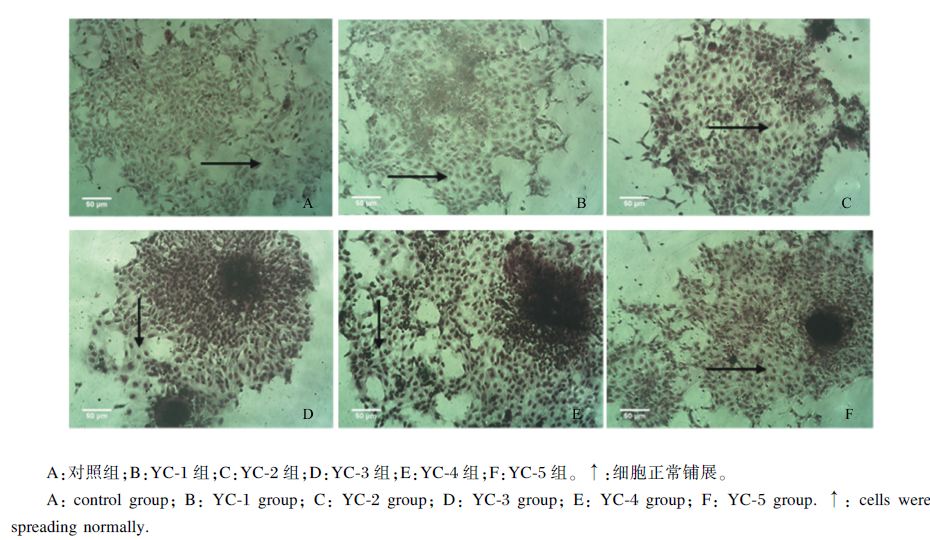 | 图1 培养3 h后各组细胞的生长状态(吉姆萨染色,200×) Fig. 1 Growth state of cells at 3 h after culture in different groups (Giemsa staining,200×) |
使用MTT法测定细胞活性,结果见表2。与对照组相比,5个酵母培养物水溶物组的细胞活性均有所升高,其中3 h时YC-4、YC-5组较对照组显著升高(P<0.05),6 h时YC-3组较对照组显著升高(P<0.05)。此外,9 h时细胞活性以YC-3组为最高,12 h时则以YC-4组为最高。
上述结果表明,细胞培养液中添加10~200 mg/L酵母培养物水溶物后细胞形态没有出现明显的损伤现象;100~200 mg/L酵母培养物水溶物在添加后3 h时增强细胞活性,50 mg/L酵母培养物水溶物则在添加后6 h时增强细胞活性。
| 表2 各组不同培养时间时细胞活性变化(结果以噻唑蓝的吸光度值表示) Table 2 Change of cell activity at different culture time in different groups (results were expressed by OD value of MTT) |
由培养液中LDH活力结果(表3)可以看出,3 h时各酵母培养物水溶物组的LDH活力与对照组相比均没有显著变化(P>0.05);6~12 h时各酵母培养物水溶物组的LDH活力较对照组有不同程度的下降,其中6 h时YC-4、YC-5组较对照组显著降低(P<0.05),9 h时YC-3、YC-4、YC-5组较对照组显著降低(P<0.05),12 h时YC-2、YC-3、YC-4、YC-5组较对照组显著降低(P<0.05)。
| 表3 各组不同培养时间时培养液中LDH活力变化 Table 3 Change of LDH activity in culture solution at different culture time in different groups |
由培养液中GPT、GOT活力结果(表4、表5)可以看出,各时间点各酵母培养物水溶物组的GPT、GOT活力与对照组相比均没有显著变化(P>0.05),但在6~12 h时各酵母培养物水溶物组的GPT活力均低于对照组。
| 表4 各组不同培养时间时培养液中GPT活力变化 Table 4 Change of GPT activity in culture solution at different culture time in different groups |
| 表5 各组不同培养时间时培养液中GOT活力变化 Table 5 Change of GOT activity in culture solution at different culture time in different groups |
上述结果表明,培养液中添加10~200 mg/L酵母培养物水溶物对培养液中LDH活力的影响较GPT、GOT明显,100~200 mg/L酵母培养物水溶物在添加6~9 h后降低了培养液中LDH活力。
3 讨 论 3.1 酵母培养物水溶物对离体草鱼肠道黏膜细胞生长的影响线粒体内琥珀酸脱氢酶能将MTT裂解为蓝色甲瓒,目前MTT法已广泛用于测定细胞增殖指标[12, 13],当96孔细胞培养板中细胞数量介于1.2×103~5.0×104个/孔之间时,细胞数量与甲瓒形成量呈良好相关性[14]。本试验结果中添加10~200 mg/L酵母培养物水溶物12 h内细胞活性有增强趋势,表明了此浓度与作用时间下酵母培养物水溶物对细胞增殖及生长有良好的促进作用。在细胞培养中,由细胞培养液为细胞生长提供基本营养物质,不同类型的细胞应选用适宜类型的培养液[15],因此本试验选用营养物质全面的M199培养液为离体草鱼肠道黏膜细胞的生长提供营养物质[9]。研究表明,将一种成分复杂的培养液与一种氨基酸和维生素含量较高的培养液混合使用,对原代培养细胞的生长有多方面的促进作用[15]。酵母培养物中含有多种营养物质,包括多种维生素、微量元素(硒、锌、铜、铁、锰等)、谷胱甘肽(GSH)、氨基酸、有机酸、核苷酸、多肽、寡糖、酶[如超氧化物歧化酶(SOD)]等和其他未知因子[16],能为动物机体生长发育提供丰富的营养物质[1]。因此,酵母培养物水溶物对细胞生长的促进作用可能是由于其中的氨基酸、维生素对细胞生长起到了促进作用,并导致细胞活性增强。本试验中,细胞活性在培养液中添加100~200 mg/L酵母培养物水溶物3 h后即较对照组显著增强,而添加50 mg/L酵母培养物水溶物则在6 h后显著增强,随着作用时间的延长,细胞活性增强并不显著,可能与培养液中营养物质浓度发生变化密切相关。从细胞Giemsa染色结果可以看到各酵母培养物水溶物组的细胞形态与对照组一致,一方面表明酵母培养物水溶物对细胞没有产生损伤,另一方面与细胞活性相结合显示酵母培养物水溶物对离体肠道黏膜细胞生长的起到了促进作用。
3.2 酵母培养物水溶物对离体草鱼肠道黏膜细胞细胞膜完整性的影响细胞通透性变化是细胞损伤的标志之一,胞浆酶(LDH、GPT、GOT)释放量可以反映出细胞膜的完整性和胞内酶的渗漏性[17, 18, 19],同时漏出酶活力大小也反映添加物质对细胞保护作用的强弱[20, 21]。本试验中,培养液中添加50~200 mg/L酵母培养物水溶物9~12 h后培养液中LDH活力较对照组显著降低,显示了酵母培养物水溶物在此浓度与作用时间下对细胞膜的完整性有保护作用。研究表明,维生素C、维生素E均能提高机体的抗氧化能力[21, 22];谷胱甘肽过氧化物酶(GSH-Px)以GSH为底物[23],在清除细胞内的过氧化氢及脂质过氧化物上发挥重要作用[24];SOD为细胞内重要的抗氧化系统酶,能特异性消除超氧化物,从而维护细胞的正常抗氧化功能。因此,酵母培养物水溶物对细胞膜完整性的保护或与其含有的抗氧化物质如维生素、GSH、SOD等物质[16]对细胞抗氧化能力的增强有关。
4 结 论在本试验条件下,培养液中添加10~200 mg/L酵母培养物水溶物能促进草鱼离体肠道黏膜细胞的生长,保护细胞膜的完整性,其发挥保护作用的适宜浓度为50~200 mg/L。
| [1] | 肖曼,高振华,李兴华,等.酵母培养物对肉仔鸡生长性能、肠黏膜结构及肠道菌群的影响[J]. 动物营养学报,2013,25(7):1624-1631. ( 3) 3)
|
| [2] | 许凡,叶元土,蔡春芳,等.注射硫代乙酰胺并饲喂酵母培养物,姜黄素和水飞蓟素对草鱼脂代谢相关基因表达丰度的影响[J]. 水产学报,2012,36(5):740-747. ( 2) 2)
|
| [3] | 徐磊,刘波,谢骏,等.酵母培养物对异育银鲫生长、血液生化及免疫的影响[J]. 江苏农业科学,2010,6(5):371-374. ( 1) 1)
|
| [4] | FERRARIS R P,AHEARN G A.Sugar and amino acid transport in fish intestine[J]. Comparative Biochemistry and Physiololgy,1984,77(3):397-413. ( 1) 1)
|
| [5] | KIMURA T,LIDA K,TAKEI Y.Mechanisms of adverse effect of air-oxidized soybean oil-feeding in rats[J]. Journal of Nutritional Science and Vitaminology,1984,30(2):125-133. ( 1) 1)
|
| [6] | REQUENA J R,FU M X,AHMED M U,et al.Quantification of malondialdehyde and 4-hydroxynonenal adducts to lysine residues in native and oxidized human low-density lipoprotein[J]. Biochemical Journal,1997,322(1):317-325. ( 1) 1)
|
| [7] | SANTIN E,MAIORKA A A,MACARI M,et al.Performance and intestinal mucosa development of broiler chickens fed diets containing Saccharomyces cerevisiae cell wall[J]. The Journal of Applied Poultry Research,2001,10(3):236-244. ( 1) 1)
|
| [8] | 张连忠.酵母培养物对雏鸡肠道菌群及免疫机能的影响[J]. 西南农业学报,2011,24(2):754-757. ( 1) 1)
|
| [9] | 姚仕彬,叶元土,蔡春芳等.草鱼肠道黏膜上皮细胞的分离与原代培养[J]. 上海海洋大学学报,2013,22(1):33-41. ( 4) 4)
|
| [10] | 叶元土,蔡春芳,张宝彤,等.一种强化鱼类肠道黏膜和肝胰脏细胞生理功能的配合饲料:中国,201010585756[P]. 2011-05-25. ( 1) 1)
|
| [11] | QUARONI A,WANDS J,TRELSTAD R L,et al.Epithelioid cell cultures from rat small intestine.Characterization by morphologic and immunologic criteria[J]. The Journal of Cell Biology,1979,80(2):248-265. ( 1) 1)
|
| [12] | SHAPPELL N W.Ergovaline toxicity on Caco-2 cells as assessed by MTT,alamarBlue,and DNA assays[J]. In Vitro Cellular & Developmental Biology:Animal,2003,39(7):329-335. ( 2) 2)
|
| [13] | DENIZOT F,LANG R.Rapid colorimetric assay for cell growth and survival:modifications to the tetrazolium dye procedure giving improved sensitivity and reliability[J]. Journal of Immunological Methods,1986,89(2):271-277. ( 1) 1)
|
| [14] | 谭凤霞,王敏,王卫民.利用草鱼CIK细胞和MTT法测定镉和铬毒性试验的优化[J]. 水生生物学报,2006,30(3):371-374. ( 1) 1)
|
| [15] | 弗雷谢尼.动物细胞培养基本技术指南[M]. 5版.北京:科学出版社,2008:146-290. ( 2) 2)
|
| [16] | 张爱忠,卢德勋,姜宁,等.酵母培养物对绒山羊机体抗氧化能力的影响[J]. 动物营养学报,2010,22(3):781-786. ( 2) 2)
|
| [17] | ZIEGLER F,SEDDIKI L,MARION-LETELLIER R,et al.Effects of L-glutamine supplementation alone or with antioxidants on hydrogen peroxide-induced injury in human intestinal epithelial cells[J]. Journal of Clinical Nutrition and Metabolism,2011,6(4):e211-e216. ( 1) 1)
|
| [18] | DIESING A K,NOSSOL C,PANTHER P,et al.Mycotoxin deoxynivalenol (DON) mediates biphasic cellular response in intestinal porcine epithelial cell lines IPEC-1 and IPEC-J2[J]. Toxicology Letters,2011,200(1):8-18. ( 1) 1)
|
| [19] | DE WALLE J V,SERGENT T,PIRONT N,et al.Deoxynivalenol affects in vitro intestinal epithelial cell barrier integrity through inhibition of protein synthesis[J]. Toxicology and Applied Pharmacology,2010,245(3):291-298. ( 1) 1)
|
| [20] | 邹晓防,胡森,吕艺,等.卡巴胆碱对肠上皮细胞氧化损伤的保护作用[J]. 世界华人消化杂志,2007,15(11):1273-1275. ( 1) 1)
|
| [21] | 刘扬,池磊,冯琳,等.维生素C对建鲤肠上皮细胞增殖分化的影响[J]. 动物医学进展,2012,33(8):41-46. ( 2) 2)
|
| [22] | 许友卿,李伟峰,丁兆坤.谷氨酰胺和维生素E协同对机体的影响及机理[J]. 动物营养学报,2013,25(8):1671-1676. ( 1) 1)
|
| [23] | 程元恺.谷胱甘肽的解毒作用与毒性代谢物[J]. 生物化学与生物物理进展,1994,21(5):395-399. ( 1) 1)
|
| [24] | 高姝娟,刘锡锰,高贵,等.谷胱甘肽的抗线粒体脂质过氧化作用[J]. 生物化学杂志,1997,13(3):287-290. ( 1) 1)
|




