2. 泰山医学院基础医学院, 泰安 271000;
3. 山东省淡水水产研究所, 济南 252000
2. School of Basic Medical Sciences, Taishan Medical University, Taian 271000, China;
3. Freshwater Fishery Research Institute of Shandong Province, Jinan 252000, China
葡萄糖是一种极性分子,除小肠和肾小管外的其他组织细胞都必须经细胞膜上的一类易化葡萄糖转运载体(glucose transporter,GLUT)的转运来输送葡萄糖[1]。在哺乳动物体内已经鉴定有4种GLUT(分别为GLUT1、GLUT2、GLUT3、GLUT4),它们分布于不同的组织,发挥着不同的生理作用[2]。葡萄糖的代谢在鱼类上已经进行了广泛的研究,作为低等脊椎动物,鱼类与哺乳动物最大的不同在于其外周组织对葡萄糖的利用能力,饲料中添加过多的糖会导致鱼体脂肪含量增加,并引起生理代谢的紊乱[3],就目前研究而言,国内外对各种鱼类,如鲤鱼(Cyprinus carpio)[4]、鲫鱼(Carassius)[5]、虹鳟(Scophthalmus maximus)[6]和鲇(Silurus asotus Linnaeus)[7, 8]等的糖代谢机制研究较多,因鱼的种类繁多,不同的种类其代谢机制不尽相同。本试验选择罗非鱼(Oreochromis niloticus)为研究对象,测定其在注射葡萄糖后血浆葡萄糖和胰岛素含量的变化,并从分子水平探讨GLUT4、GLUT2在罗非鱼不同组织中的表达及其对注射葡萄糖的响应,为研究罗非鱼葡萄糖代谢机理提供一定的理论依据。
1 材料与方法 1.1 材料及试剂罗非鱼由山东省淡水水产研究所提供,在山东农业大学水产养殖基地暂养2周后,挑选健康、规格整齐、平均体重为80 g左右的鱼作为试验用鱼。
试验用葡萄糖购于上海索莱宝生物科技有限公司,将葡萄糖溶于无菌蒸馏水中配制成30 mg/mL的针剂,置于4 ℃冰箱保存备用。
1.2 试验设计将150尾罗非鱼随机分配到6个水族箱(水族箱水容量为0.3 m3)中,每个水族箱投放罗非鱼25尾。对照组、试验组各设3个重复,每个水族箱为1个重复。试验鱼饲喂常规的罗非鱼饲料,饲料组成及营养水平见表1,试验开始时先将2组试验鱼分别禁食24 h,然后试验组依照每100 g体重30 mg的剂量腹腔注射葡萄糖[9],对照组以相同剂量腹腔注射0.7%的无菌生理盐水。
在注射前(0 h)和注射后的1、3、6和12 h分别进行采样。每个水族箱每次取样5尾,用MS-222(每1 m3水20 g)麻醉鱼体后,尾静脉采血,血样用肝素抗凝,在4 ℃下3 000 r/min离心10 min制备血浆,将血浆移入冻存管存于液氮中备用。每次采完血的罗非鱼,取其肝胰脏和背部肌肉,并冻存于液氮中备用。
1.3 指标测定 1.3.1 血浆葡萄糖和胰岛素含量测定血浆中葡萄糖含量在美国贝克曼Cx-4型自动生化分析仪上测定。胰岛素含量使用R&D Systems 公司提供的鱼胰岛素测定试剂盒,采用固相夹心法酶联免疫吸附试验(ELISA)测定吸光度(OD)值,由试剂盒中标准物的胰岛素含量与OD值计算出标准曲线的回归方程式,将样品中胰岛素的OD值代入方程式,计算出样品中胰岛素的含量,若是稀释后的样品,再乘以稀释倍数即为样品中胰岛素的实际含量。
| 表1 饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the diet (air-dry basis |
预混料为每千克饲料提供The premix provided the following per kg of the diet:VA 12 000 IU,VD3 3 000 IU,VE 80 mg,VK 7 mg,VB1 20 mg,VB2 40 mg,VB6 20 mg,泛酸钙 calcium pantothenate 60 mg,生物素 biotin 3.0 mg,叶酸 folic acid 10 mg,VB12 0.8 mg,VC 1 000 mg,Fe 20 mg,Cu 5 mg,Mn 20 mg,I 0.4 mg,Mg 0.9 g。
1.3.2 GLUT4的cDNA克隆和序列分析取50~100 mg罗非鱼肌肉组织,加液氮研磨至粉末状,参照Trizol Reagent(Invitrogen公司)说明书的步骤提取总RNA,然后再用该公司提供的DNase Ⅰ进行纯化,纯化后的RNA在TaKaRa公司提供的反转录酶(M-MLV Reverse Transcriptase)的作用下进行转录,参照美国国立生物技术信息中心(NCBI)网站公布的褐鳟(brown trout,GenBank登录号:AF247395.1)、 大西洋鳕鱼(Atlantic cod,GenBank登录号:DQ109810.1)和银鲑鱼(coho salmon,GenBank登录号:AF502957.1)的GLUT4 基因序列设计引物1和2(表2),使用天根公司提供的PCR(2×Taq PCR)试剂盒,克隆获得罗非鱼GLUT4的序列片段,反应条件为:94 ℃ 5 min,(4 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min)×30个循环,72 ℃ 5 min,而后使用MBI公司生产的pTZ-57R/T载体连接试剂盒,将所得片段连入pTZ-57R/T载体,连接产物转化感受态大肠杆菌(E. coli)DH 5,培养菌液,将鉴定好的菌液寄往北京天根生物工程公司测序。使用DNAMAN软件对获得的序列进行比对和分析,进化树由MEGA-5软件设计而成。
| 表2 cDNA克隆和PCR引物序Table 2 Sequences of primers used in cDNA cloning and PCR |
采取饲喂常规饲料的罗非鱼的肌肉、肝脏和心脏,同样参照Trizol Reagent(Invitrogen公司)说明书的步骤,分别从这3种组织中提取总RNA后进行反转录,而后使用天根公司提供的2×Taq PCR反应液进行实时荧光半定量PCR检测,根据本试验克隆获得的GLUT4(GenBank登录号:JN900493)序列设计引物3和4(表2)用于GLUT4表达的检测,参照NCBI网站公布的罗非鱼GLUT2(GenBank登录号:XM_005477306.1)基因序列设计引物7和8(表1)用于GLUT2表达的检测,二者的反应条件均为:94 ℃ 5 min,(94 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min)×34个循环,72 ℃ 5 min。同样,参照NCBI网站公布的罗非鱼β-肌动蛋白(β-actin)(GenBank登录号:EF026001.1)序列设计引物11和12(表2)用于β-actin表达的检测,反应条件为:94 ℃ 5 min,(94 ℃ 30 s,59 ℃ 30 s,72 ℃1 min)×32个循环,72 ℃ 5 min。最后,通过0.8%琼脂糖凝胶电泳,使用Bio-Rad全自动凝胶成像系统进行照相,测定各组织中各基因的相对表达量。
1.3.4 实时荧光定量PCR检测组织中GLUT4和GLUT2的表达取1 μg总RNA,参照TaKaRa公司反转录酶(M-MLV Reverse Transcriptase)的说明书合成cDNA第1链,然后置于-20 ℃保存。采用SYBR Green Ⅰ荧光染料在7500 Real-Time PCR System (Bio-Rad)进行PCR扩增,分别检测注射葡萄糖后1、3、6和12 h时GLUT4在肌肉和心脏、GLUT2在肝脏中的mRNA相对表达量。
在8联管(Axygen)中分装以下反应体系:10 μL 2×SYBR Premix Ex TaqTM,0.4 μL 50×ROX Reference Dye Ⅱ(TakaRa),6.8 μL dH2O,正、反向引物(10 μmol/mL)各0.4 μL,模板cDNA 2 μL,阴性对照则以等量RNase-free水代替,补充RNase-free水至20 μL。根据本试验克隆获得的GLUT4(GenBank登录号:JN900493)序列设计引物5和6(表2)用于GLUT4 mRNA相对表达量的检测,参照NCBI网站公布的罗非鱼GLUT2(GenBank登录号:XM_005477306.1)序列设计引物9和10(表2)用于GLUT2 mRNA相对表达量的检测,PCR反应条件:94 ℃ 30 s,(94 ℃ 5s,60 ℃ 34 s)×40个循环,最后在55~95 ℃制作熔解曲线。反应完成后,用ABI 7500 System分析软件分析结果。
1.4 数据统计与分析试验数据用平均值±标准差表示。mRNA的相对表达量以罗非鱼β-actin为内参,以对照组的基因mRNA表达量为基准,应用2-△△Ct方法计算肌肉和心脏中GLUT4及肝脏中GLUT2 mRNA的相对表达量。采用SPSS 13.0软件进行数据处理和分析,先对数据进行单因素方差分析(one-way ANOVA),若组间差异显著再用Duncan氏法进行多重比较,以P<0.05为差异显著。
2 结果与分析 2.1 注射葡萄糖后罗非鱼血浆葡萄糖和胰岛素含量的变化从图1可以看出,与注射前(0 h)相比,试验组罗非鱼在注射葡萄糖1 h后血浆葡萄糖含量达到最高,并显著高于对照组(P<0.05),而后开始下降,6 h后恢复到正常水平。试验组血浆胰岛素含量在注射葡萄糖3 h后达到最高,并显著高于对照组(P<0.05),而后开始下降,在12 h后降低至接近正常水平。
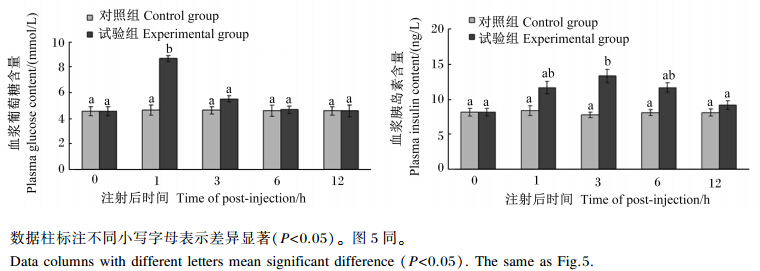 |
图1 注射葡萄糖对罗非鱼血浆葡萄糖和胰岛素含量的影响 Fig. 1 Changes of plasma glucose and insulin contents of tilapia after glucose injection |
通过实时荧光定量PCR克隆获得了罗非鱼GLUT4的部分cDNA序列(GenBank登录号:JN900493),经琼脂糖凝胶电泳检测这一序列片段大小为603 bp,由200个氨基酸组成(图2),与所预测的片段大小基本一致。将鉴定好的菌液寄往北京天根生物工程公司测序,用DNAMAN软件将所得片段序列与来源于其他动物的同源序列进行序列比较,发现该片段为所要克隆的目的基因的中间片段。
 |
图2 罗非鱼与其他鱼类GLUT4氨基酸序列的比对结果 Fig. 2 Alignment result of GLUT4 amino acid sequences between tilapia and other fish species |
通过与其他鱼类比对可以看出,罗非鱼的GLUT4的氨基酸序列具有很高的保守性,并具有GLUT第1类型的特征性序列(图2)。在系统发育学上,与其他鱼类的GLUT(包括GLUT1、GLUT2、GLUT3、GLUT4)相比较,可以看出罗非鱼的GLUT4和其他鱼类的GLUT4在同一簇上,这些脊椎动物包括银鲑鱼、褐鳟和大西洋鳕鱼。而与其他鱼类的其他GLUT相比较则不在同一簇上,这包括来自于大西洋鳕鱼、虹鳟和普通鲤鱼的GLUT1,来自于大西洋鳕鱼和草鱼的GLUT3,以及来自于罗非鱼、大西洋鳕鱼和虹鳟的GLUT2(图3)。
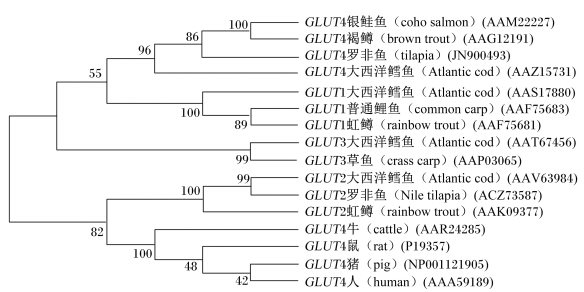 |
图3 不同来源GLUT4的聚类分析 Fig. 3 Cluster analysis of GLUT4 from different sources |
同时,从图3中可以看出,哺乳动物的GLUT4与鱼类有明显的区分,它们的GLUT4均在同一簇上,这些动物包括牛、鼠、猪和人。
在氨基酸水平上,罗非鱼的GLUT4与褐鳟和银鲑鱼的同源性非常高,均达到92.5%,与大西洋鳕鱼的同源性为86.5%,与哺乳动物的同源性介于66.0%~74.5%之间(表3)。通过比较鉴定可以得出,罗非鱼的GLUT4具有GLUT第1类型的保守序列,同时具有和其他GLUT一样的跨膜结合位点。
| 表3 在核苷酸和氨基酸水平上罗非鱼GLUT4与其他鱼类的同源性比较 Table 3 Homologous comparison of GLUT4 between tilapia and other fish species on nucleotide and Amino acid levels |
通过实时荧光半定量PCR检测的方法,对罗非鱼肌肉、心脏和肝脏中GLUT4、GLUT2的表达量进行比较发现,GLUT4在肌肉和心脏中获得了较高的表达量,而在肝脏中GLUT4的表达量相对较低;GLUT2在肝脏中的表达量最高,而在肌肉和心脏中则表现出极低的表达量(图4)。
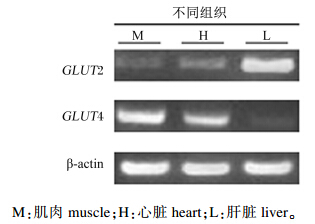 |
图4 罗非鱼GLUT4和GLUT2在不同组织中的表达 Fig. 4 Expression of GLUT4 and GLUT2 from different tissues of tilapia |
通过实时荧光定量PCR检测罗非鱼注射葡萄糖后12 h内GLUT4和GLUT2 mRNA的相对表达量的变化。结果(图5)显示,肌肉中GLUT4 mRNA的相对表达量在注射葡萄糖后3 h时开始升高,在12 h时达到最高水平,此时显著高于对照组(P<0.05);心脏中GLUT4 mRNA的相对表达量在注射葡萄糖后1 h时即较对照组显著升高(P<0.05),而后随着时间的推移逐渐降低,在6 h时恢复到了正常水平;肝脏中GLUT2 mRNA的相对表达量与心脏中GLUT4 mRNA的相对表达量十分相似,在注射葡萄糖后1 h达到最高水平,而后随着时间的推移逐渐降低,但是在注射后的各个时间点内与对照组均没有显著差异(P>0.05)。
3 讨 论 3.1 罗非鱼GLUT4的基因序列分析从序列、系统发生学和组织分布来分析,本试验所克隆获得的基因片段属于GLUT家族第1类型中的GLUT4。从罗非鱼肌肉中克隆获得的GLUT4,其在序列和结构上与其他鱼类的GLUT4十分相似,其与哺乳动物GLUT4的 氨基酸同源性介于66.0%~74.5%之间,与其他鱼类GLUT4的氨基酸同源性介于86.5%~92.5%之间。获得的GLUT4的氨基酸序列除了具有第1类型GLUT的特征序列外,同时还具有其他类别的氨基酸区域和跨膜螺旋体[10]。从序列的分析结果来看,除了一少部分的氨基酸替代外,本试验从罗非鱼肌肉中克隆获得的序列具备了GLUT4的普遍特征。
3.2 罗非鱼GLUT4和GLUT2的组织表达分布特征虽然各GLUT在结构上有很大的相似,但是其表达位点、转运葡萄糖的功能以及受激素和代谢调节的方式都有所不同[11]。一些研究表明,鱼类GLUT4和GLUT2的组织表达分布与哺乳动物是十分相似的[12, 13]。在鳕鱼中,GLUT4主要在心脏和骨骼肌这些胰岛素反应性的组织中表达,并且在餐后调节葡萄糖的摄取上发挥着重要的作用[14]。而本研究结果表明,GLUT4在罗非鱼肌肉中的表达量最高,其次是心脏,在肝脏中的表达量最低。相反,GLUT2在肝脏中的表达量最高,在肌肉和心脏中的表达量较低。罗非鱼GLUT4和GLUT2的组织特异性表达与关于虹鳟的报道[15]是一致的,然而GLUT4在心脏中的表达与虹鳟有 所不同,虹鳟GLUT4在心脏中的表达量是有限的[16]。GLUT4在不同鱼类心脏中表现出的这种表达差异有待于进一步研究。
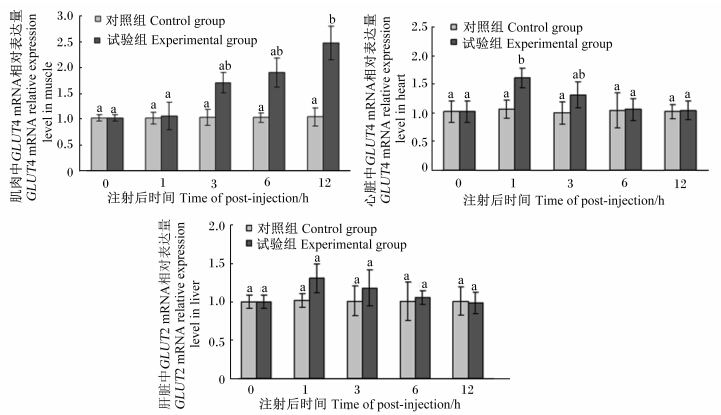 |
图5 注射葡萄糖后罗非鱼不同组织中GLUT4和GLUT2 mRNA的相对表达量 Fig. 5 Changes of GLUT4 and GLUT2 mRNA relative expression levels in different tissues of tilapia after glucose injection |
GLUT4属于胰岛素依赖性的GLUT,肌肉和脂肪都是对胰岛素比较敏感的组织,在哺乳动物体内,葡萄糖的动态平衡是通过胰岛素来维持的,在肌肉和脂肪组织中,胰岛素主要通过促进GLUT4从细胞内转移到细胞膜上来促进葡萄糖的吸收[17]。GLUT数量的变化对动物机体葡萄糖的吸收具有十分重要的作用,当胰岛素与细胞膜的受体结合后,GLUT4便从细胞内移动到细胞膜上,来促使葡萄糖进入细胞内。对于鱼类,GLUT4同样能够在胰岛素的调节下促进葡萄糖向细胞内运动,促进葡萄糖在体内的代谢[18]。在基础水平下,GLUT4主要存在于胰岛素反应性的细胞贮存室(IRC)内,但是在胰岛素的刺激下,GLUT4将移动至细胞膜,并且其数量逐渐升高,从而应对葡萄糖摄取后的高糖水平[19, 20]。在多种鱼类包括罗非鱼中,血浆葡萄糖含量的升高能引起血浆胰岛素含量[21]和组织中胰岛素受体数量的升高[9]。鳕鱼心脏中GLUT4的表达在禁食后下降并在恢复采食后回升,表明心脏中GLUT4 mRNA的表达与血浆葡萄糖含量存在着一定的相关性[14]。在虹鳟的骨骼肌中,GLUT4 mRNA的表达受到了胰岛素的调节[22]。
本研究发现,葡萄糖处理引起的胰岛素表达上调与GLUT4表达的变化存在着一定的关系,罗非鱼在注射葡萄糖后1 h时血浆葡萄糖含量达到最高水平,而血浆胰岛素含量则在葡萄糖注射后3 h时达到最高水平,所以高水平的血浆葡萄糖并没有被充分的吸收利用,从而造成鱼体对葡萄糖的代谢负担。在高糖引起的代谢负担的压力下,心脏中GLUT4 mRNA的相对表达量与血浆葡萄糖含量的变化趋势相一致,在注射葡萄糖后1 h时就达到了最高水平,而后逐渐降低,其变化并没有受到血浆胰岛素含量的影响,这其中的机理有待于进一步研究。James等[3]报道,罗非鱼的心肌对葡萄糖的利用是白肌的10倍,而GLUT4对葡萄糖反应的快速应答可能就是其原因所在。而同样在高糖引起的代谢负担的压力下,肌肉中的GLUT4 mRNA的相对表达量逐渐升高,在葡萄糖注射后12 h时才达到最高水平,而此时的血浆葡萄糖含量已恢复到正常水平。由此可以得出,外周组织骨骼肌中GLUT4 mRNA的表达相对于血浆葡萄糖含量升高反应滞后,影响了血液中葡萄糖向外周组织的转运,加重了鱼类对葡萄糖的代谢负担。
对于哺乳动物,GLUT2主要在肾脏和肠道上皮细胞进行表达,这些部位主要参与葡萄糖的分泌和吸收[23]。另外,GLUT2同样在肝脏、胰脏和大脑中进行表达,在肝细胞内GLUT2将通过糖异生作用生成的葡萄糖释放到血液中为机体提供能量。近几年,GLUT2已经在虹鳟[24]、鳕鱼[14]中获得克隆。另外,GLUT2与胰岛素的分泌有一定的关系,对于GLUT2缺失的小鼠,当受葡萄糖刺激时出现了胰岛素分泌受阻的现象,并且与葡萄糖的亲和力相对较低[25]。虹鳟肝脏中GLUT2的表达与血浆葡萄糖含量有一定的关联,大西洋鲑肝脏中的GLUT2的表达量和血浆葡萄糖含量表现出一样的变化趋势,饲喂状态下的表达量明显高于饥饿状态下[14]。本研究结果与之非常相似,肝脏中GLUT2的表达量在注射葡萄糖后1 h时达到最高水平,而后随着时间的推移逐渐降低,但是并没有表现出显著的差异。由结果可以得出,罗非鱼在高浓度葡萄糖的刺激下,肝脏中GLUT2 mRNA的相对表达量并没有表现出显著性的变化,所以这可能也是鱼类对糖不耐受的一个原因所在。
4 结 论① 克隆获得的罗非鱼GLUT4基因序列具有很高的保守性,除了具有第1类型GLUT的特征序列外,同时还具有其他类别的氨基酸区域和跨膜螺旋体。
② 罗非鱼GLUT4在肌肉中的表达量最高,其次是心脏,在肝脏中的表达量最低;GLUT2在肝脏中的表达量最高,在肌肉和心脏中的表达量较低。
③ 注射葡萄糖后瞬时升高了罗非鱼的血浆葡萄糖含量,相对于血浆葡萄糖含量,血浆胰岛素含量的升高相对延迟,而肌肉中GLUT4 mRNA相对表达量的升高又延迟于胰岛素含量的升高,从而加重了罗非鱼对葡萄糖的代谢负担。
| [1] | GOULD G W,HOLMAN G D.The glucose transporter family:structure,function and tissue-specific expression[J].Biochemical Journal,1993,295(Pt 2):329-341. ( 1) 1)
|
| [2] | JOOST H G,THORENS B.The extended GLUT-family of sugar/polyol transport facilitators:nomenclature,sequence characteristics,and potential function of its novel members(review)[J]. Molecular Membrane Biology,2001,18(4):247-256. ( 1) 1)
|
| [3] | JAMES R,WRIGHT J R,BONEN A,et al.Glucose homeostasis in the teleost fish tilapia:insights from Brockmann body xenotransplantation studies[J]. American Zoologist,2000,40(2):234-245. ( 2) 2)
|
| [4] | SHIMENO S,KHEYY D,SHIKATA T.Metabolic response to dietary carbohydrate to protein ratios in carp[J]. Fisheries Science,1995,61:277-281.( 1) 1)
|
| [5] | 蔡春芳,王道尊.异育银鲫对糖利用性的研究——外源胰岛素敏感性试验[J]. 中国水产科学,1999,6(1):62-65. ( 1) 1)
|
| [6] | PANSERAT S,PLAGNES J E,BREQUE J.Hepatic phosphoenolpyruvate carboxykinase gene expression is not repressed by dietary carbohydrates in rainbow trout (Oncorhynchus mykiss)[J]. The Journal of Experimental Biology,2001,204(2):359-365. ( 1) 1)
|
| [7] | 林小植,罗毅平,谢小军.饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响[J]. 水生生物学报,2006,30(3):304-311. ( 1) 1)
|
| [8] | 罗毅平.肉食性鱼类南方鲇对饲料碳水化合物营养胁迫的生理生态学反应[D]. 博士学位论文.重庆:西南大学,2007. ( 1) 1)
|
| [9] | CARNEIRO N M,NAVARRO I,GUTI RREZ J,et al.Hepatic extraction of circulating insulin and glucagon in brown trout (Salmo trutta fario) after glucose and arginine injection[J]. Journal of Experimental Zoology,1993,267(4):416-422. ( 2) 2)
|
| [10] | HRUZ P W,MUECKLER M M.Structural analysis of the GLUT1 facilitative glucose transporter[J]. Molecular Membrane Biology,2001,18(3):183-193. ( 1) 1)
|
| [11] | CAPILLA E,DIAZ M,GUTIERREZ J,et al.Physiological regulation of the expression of a GLUT4 homolog in fish skeletal muscle[J]. American Journal of Physiology Endocrinology and Metabolism,2002,283:E44-E49. ( 1) 1)
|
| [12] | WOOD I S,TRAYHURN P.Glucose transporters (GLUT and SGLT):expanded families of sugar transport proteins[J]. British Journal of Nutrition,2003,89(1):3-9. ( 1) 1)
|
| [13] | MOON T W.Glucose intolerance in teleost fish:fact or fiction?[J]. Comparative Physiology and Biochemistry,2001,129(2/3):243-249. ( 1) 1)
|
| [14] | HALL J R,SHORT C E,DRIEDZIC W R.Sequence of Atlantic cod (Gadus morhua) GLUT4,GLUT2 and GPDH:developmental stage expression,tissue expression and relationship to starvation-induced changes in blood glucose[J]. The Journal of Experimental Biology,2006,209(22):4490-4502. ( 4) 4)
|
| [15] | TEERIJOKI H,KRASNOV A,PITKANEN T I,et al.Cloning and characterization of glucose transporter in teleost fish rainbow trout (Oncorhynchus mykiss)[J]. Biochimica et Biophysica Acta,2000,1494(3):290-294. ( 1) 1)
|
| [16] | PLANAS J V,CAPILLA E,GUTI RREZ J.Molecular identification of a glucose transporter from fish muscle[J]. FEBS Letters,2000,481(3):266-270. ( 1) 1)
|
| [17] | PAUL F P,JONGSOON L.Insulin receptor family[J]. Encyclopedia of Biological Chemistry,2004,2:436-440. ( 1) 1)
|
| [18] | DÍAZ M,CAPILLA E,PLANAS J V.Physiological regulation of glucose transporter (GLUT4) protein content in brown trout (Salmo trutta) skeletal muscle[J]. The Journal of Experimental Biology,2007,210(13):2346-2351. ( 1) 1)
|
| [19] | BRYANT N J,GOVERS R,JAMES D E.Regulated transport of the glucose transporter GLUT4[J]. Nature Reviews Molecular Cell Biology,2002,3(4):267-277. ( 1) 1)
|
| [20] | PESSIN J E,THURMOND D C,ELMENDORF J S,et al.Molecular basis of insulin-stimulated GLUT4 vesicle trafficking[J]. Journal of Biological Chemistry,1999,274(5):2593-2596. ( 1) 1)
|
| [21] | MOMMSEN T P,PLISETSKAYA E M.Insulin in fishes and agnathans:history,structure and metabolic regulation[J]. Reviews in Aquatic Sciences,1991,4:225-259.( 1) 1)
|
| [22] | CAPILLA E,DÍAZ M,ALBALAT A,et al.Functional characterization of an insulin-responsive glucose transporter (GLUT4) from fish adipose tissue[J]. American Journal of Physiology:Endocrinology and Metabolism,2004,287(2):E348-E357.( 1) 1)
|
| [23] | WRIGHT E M,TURK E M.The sodium glucose cotransporter family SLC5[J]. Pflugers Arch,2003,447:813-815. ( 1) 1)
|
| [24] | KRASNOV A,TEERIJOKI H,MOLSA H.Rainbow trout (Onchorhynchus mykiss) hepatic glucose transporter[J]. Biochimica et Biophysica Acta:Gene Structure and Expression,2001,1520(2):174-178. ( 1) 1)
|
| [25] | ZHAO F Q,KEATING A F.Functional properties and genomics of glucose transporters[J]. Current Genomics,2007,8(2):113-128. ( 1) 1)
|




