2. 暨南大学水生生物研究所, 广州 510632
2. Institute of Hydrobiology, Jinan University, Guangzhou 510632, China
酵母菌是一类单细胞真核微生物的总称,并非是自然的系统分类单元,其泛指能够发酵糖类的各种单细胞真菌,是一个复杂的类群。酵母菌的分类一直充满着挑战和争议,在分子生物学技术应用于物种分类之前,经典分类学方法主要从形态、繁殖和生理特征来进行酵母的分类,然而这些指标具有极大的局限性,酵母菌的特征可能随着培养基成分和生长阶段的改变而发生变化[1]。截止到1998年,已描述的酵母菌达到95属,723种,目前荷兰微生物菌种保藏中心保藏有900种[2]。常见的重要酵母菌各属有酿酒酵母属(Saccharomyces)、裂殖酵母属(Schizosaccharomyces)、汉逊酵母属(Hansenula)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、球拟酵母属(Torulopsis)和红酵母属(Rhodotorula)等[3],其中酿酒酵母属是目前研究最透彻、对人类社会贡献最大的酵母属,是酿酒工业的主要菌种,还用于制造面包、糕点及医药工业等。 1 酿酒酵母属简介
有关酿酒酵母属的研究可以追溯到1838年,当时Meyen首次提出了Saccharomyces这一属名,并采用双名法将啤酒酵母命名为Saccharomyces cerevisiae,Reess于1870年首次描述这一种属为具有酒精发酵能力的真菌,并将酿酒酵母命名为巴氏酵母(Saccharomyces pastorianus)[4, 5]。1975年,Yarrow和Nakase建立了酿酒酵母属的7种系统,之后经过多年的分子生物学鉴定和修正,直到1998年酿酒酵母属的种数被鉴定为16个,其中的酿酒酵母(S. cerevisiae)是酒精生产和果汁发酵酿酒的主要菌种[5]。
啤酒酵母属于酿酒酵母的不同品种或株系,是啤酒生产上常用的发酵酵母,其细胞一般呈球形或卵形,平均直径为5~6 μm,长宽比值一般为1.1[6]。啤酒酵母细胞结构包括细胞壁(cell wall)、细胞膜(cell membrane)、细胞核(nucleus)、1个或多个液泡(vacuoles)、线粒体(mitochondrias)、核糖体(ribosomes)、内质网(endoplasmic reticulum)、微体(microsomes)、微丝(microfilament)和其他内含物等,此外还有出芽痕(bud scars)和诞生痕(birth scars)(图1)[7]。
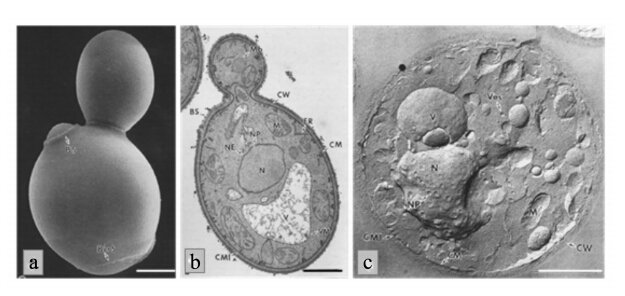 | BS:出芽痕 bud scars;BirS:诞生痕birth scars;CW:细胞壁 cell wall;ER:内质网 endoplasmic reticulum;CM:细胞膜 cell membrane;M:线粒体 mitochondrias;N:细胞核 nucleus;NP:核孔 nuclear pore;NE:核膜 nuclear membrane;V:液泡 vacuoles;VM:液泡膜 vacuole membrane;CMI:细胞膜内陷 cell membrane invagination。图1 酿酒酵母扫描电镜(a)和透射电镜(b、c)照片(a、b标尺为1 μm,c标尺为100 nm) Fig. 1 Scanning electron microscope (a) and transmission electron microscope (b and c) images of S. cerevisiae [bar=1 μm (a and b), 100 nm (c)][7] |
啤酒酵母细胞含有丰富的营养物质,其中蛋白质含量可达酵母干物质含量的45%~55%,且富含人体所必需的8种氨基酸,脂肪含量为1%~8%[8, 9],功能性多糖含量高达细胞壁干重的95%[10]。啤酒酵母中的维生素和矿物质含量也十分丰富,主要富含硫胺素、核黄素等近10种B族维生素,以及磷、铁、钙等10多种微量元素,在调节动物体生理机能方面发挥重要作用。此外,啤酒酵母作为优良的发酵菌种,其细胞内还具有发达的酶系统和丰富的生理活性物质,能够分泌产生蔗糖酶、蛋白酶、脂肪酶等10多种生物酶,以及多种辅酶、细胞色素C、凝血质、谷胱甘肽等生理活性物质[9],目前利用废啤酒酵母提取具有生物活性的功能物质也已逐渐成为研究的热点。 2 酿酒酵母细胞壁结构
酿酒酵母细胞外面包被着一层坚韧的细胞壁,其厚度根据培养条件和遗传特性而有所差异,发酵初期细胞壁厚度在60 nm左右,随着发酵进入稳定期细胞壁厚度也逐渐增加到80 nm[6],也有报道称酿酒酵母细胞壁厚度可达200 nm[11],这可能与生长后期细胞老化有关。酿酒酵母细胞壁占细胞干重的20%~30%,其结构明显分为粗糙的外层和相对均匀的内层,外层主要由稀疏的甘露糖蛋白纤维构成,而内层则由更加致密的β-葡聚糖纤维构成,也包含有少量的几丁质和脂质[7, 12]。酿酒酵母细胞壁中的β-葡聚糖是由D-葡萄糖通过β-1,3糖苷键相连而成的线性主链和通过β-1,6糖苷键与主链相连的支链构成,由于支链结构的存在,β-1,3-葡聚糖分子之间只能通过氢键进行连接,从而形成一个连续的三维网状结构(图2)[7, 10]。
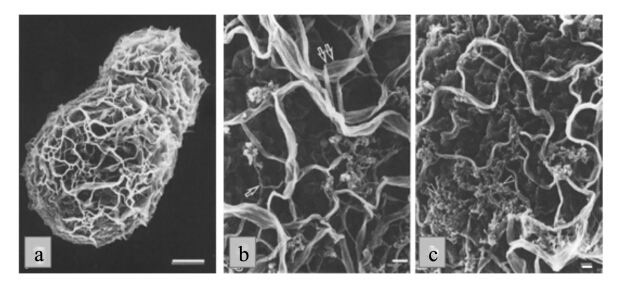 | a:由β-葡聚糖构成的酵母细胞壁微纤维网状结构;b:形成酵母细胞壁网状结构的2种微纤维,缠绕型纤维(单箭头)和平行的束状型纤维(双箭头);c:填充于微纤维之间的直径20 nm左右的颗粒状物质(α-半乳甘露聚糖)。
a: microfibrils network by β-glucan in yeast cell wall;b: two types of microfibrils in network, the twisted microfibrils (single arrow) and flat bundles (double arrows);c: the granular substances (α-galactomannan, about 20 nm in diameter) which filled in the intrafibrillar space.图2 酿酒酵母细胞壁扫描电子显微结构(a标尺为1 μm,b、c标尺为100 nm) Fig. 2 The structure of yeast cell wall by scanning electron microscope [bar=1 μm (a),100 nm (b and c)][7] |
酿酒酵母细胞壁内层的β-1,3-葡聚糖占细胞壁干重的30%~45%,β-1,6-葡聚糖占5%~10%,几丁质占1.5%~6.0%,主要起到维持细胞壁机械强度的作用,而外层则主要由甘露糖蛋白组成,占细胞壁干重的30%~50%,其决定着细胞表面蛋白识别信息[10]。甘露糖蛋白以共价键方式与内层的葡聚糖相连,因此葡聚糖内层也同时提供了细胞壁外层结构蛋白的附着位点,此外酵母细胞壁中还存在一些分布于细胞膜和内层骨架层之间的胞外酶,这些酶可能与细胞壁的形成有关(图3)[7, 10]。
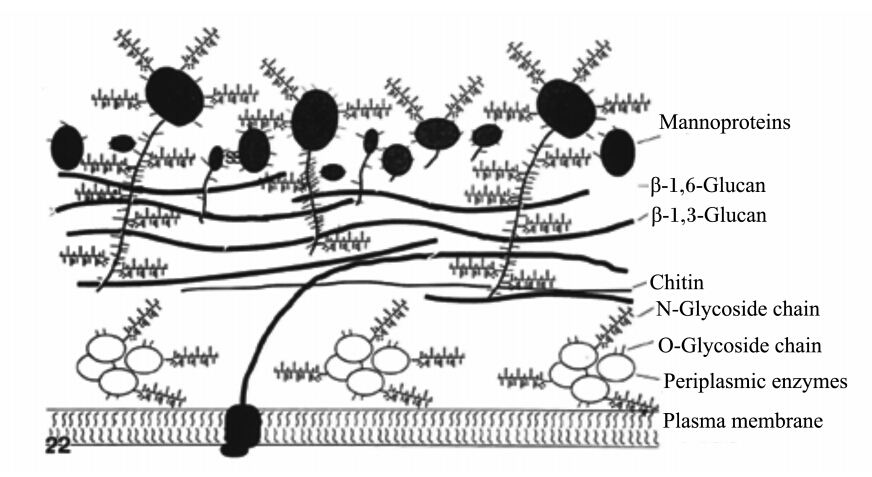 | Mannoproteins:甘露糖蛋白;β-1,6-Glucan:β-1,6-葡聚糖;β-1,3-Glucan:β-1,3-葡聚糖;Chitin:几丁质;N-Glycoside chain:N-糖苷链;O-Glycoside chain:O-糖苷链;Periplasmic enzymes:细胞周质酶;Plasma membrane:质膜。图3 酿酒酵母细胞壁结构和组成示意图 Fig. 3 The diagram of structure and composition of cell wall in S. cerevisiae[7] |
总之,酿酒酵母细胞壁是一种韧性结构,能够保持细胞内部渗透压稳定性,限制外部水分子的进入,从而避免细胞因吸水过度膨胀而破裂。酿酒酵母细胞壁也具有较大的机械强度和韧性,能够转移和分散外界压力,保护细胞抵抗外力的压迫,有效保护细胞免受机械损伤,从而维持细胞正常形状。另外,酿酒酵母细胞壁也是蛋白质固定的支架,细胞壁中网状的结构性多糖结构能够为外层糖蛋白的固定提供支架,而这些糖蛋白能够维持酵母细胞对高分子蛋白的渗透性,保护酵母细胞壁结构性多糖免受外来蛋白的攻击[10]。 3 β-1,3-葡聚糖在水产饲料中的应用
当今水产养殖业在快速发展的过程中仍然面临着许多问题,其中由病毒、细菌和寄生虫引发的疾病是困扰水产养殖健康发展的最严重问题之一。随着人类社会对食品健康重视程度的不断增强,绝大多数抗生素类药物都已被明令禁止使用于水产养殖,促使人们不断寻求更加安全环保的抗生素替代物。近10年来,酿酒酵母细胞壁中的多糖[主要为β-1,3-葡聚糖和甘露寡糖(mannan oligosaccharides,MOS)]由于在促进生长、提高饲料利用效率、维护肠道健康和增强免疫力方面所具有的显著效果而逐渐被人们重视,同时酵母多糖类产品作为饲料添加剂在水产养殖中的开发和应用也越来越广泛。 3.1 β-1,3-葡聚糖调节免疫基因表达水平
细胞活素是由免疫细胞产生的蛋白质调节物,包括白细胞介素(ILs)、肿瘤坏死因子(TNFs)、转化生长因子(TGF)、趋化因子和干扰素(IFNs)等,主要参与机体非特异性免疫调节过程,具有促炎症反应、抗炎症反应和杀灭病原菌的作用。研究表明,酵母抽提物(主要成分为β-1,3-葡聚糖和酵母核苷酸)可以显著提高鲤(Cyprinus carpio L.)促炎症细胞活素(IL-1β、IL-10、IL-12p35、IL-12p40、TNF-α、CXC-趋化因子、IFN-α和IFN-γ)基因的表达活性[13]。在真鲷(Sparus aurat)饲料中添加β-葡聚糖可以促使IL-1β和IFN-γ的基因表达上调,表明β-1,3-葡聚糖同样能够调节真鲷免疫相关基因的表达,增强鱼体免疫能力[14]。因此,酵母β-1,3-葡聚糖能够通过增强细胞活素类基因的表达来增强鱼体头肾中免疫细胞内细胞活素因子的分泌量,这些细胞因子在机体应对微生物侵蚀和组织损伤的过程中发挥着重要作用,并能通过活化淋巴细胞来刺激免疫功能,或者通过诱导其他细胞因子的释放来进一步激活巨噬细胞、自然杀伤细胞和其他淋巴细胞[15]。 3.2 β-1,3-葡聚糖增强非特异性免疫能力
作为抵抗疾病非常重要的一道防线,血清中的溶菌酶、抗体、补体因子以及其他各种细胞因子在抵抗病菌侵蚀方面发挥着非常重要的作用,β-葡聚糖是目前被广泛使用的益生元,对鱼类具有良好的免疫增强作用,在增强溶菌酶活性、补体活性和杀菌活性方面均具有显著的作用[16, 17, 18]。酵母β-葡聚糖能够显著提高鲤肾脏噬菌细胞的吞噬活性,攻毒试验表明饲喂β-葡聚糖后鱼体对嗜水气单胞菌(Aeromonas hydrophila)的抵抗作用明显增强[13]。血清中C反应蛋白(C-reactive protein,CRP)和补体旁路途径(alternative complement pathway,ACP)溶血活性也受到饲料中β-葡聚糖含量的影响,投喂含β-葡聚糖的饲料仅仅14 d就能使鲤血液中CRP和ACP水平显著提高,并且鱼体抵抗杀鲑气单胞菌(Aeromonas salmonicida)的能力也显著增强[19]。在露斯塔野鲮(Labeo rohita)中的试验证明血清白细胞数量、噬菌率、溶菌酶活性、ACP溶血活性和血清杀菌率等均会受到饲料中β-葡聚糖含量的影响,当饲料中β-葡聚糖添加量达到250 mg/kg时,就能显著增强上述免疫指标的功能,攻毒试验表明饲料中添加100~500 mg/kg的β-葡聚糖均能显著降低鱼体在嗜水气单胞菌和迟钝爱德华菌(Edwardsiella tarda)感染后的死亡率[17]。从众多的研究结果来看,β-1,3-葡聚糖对许多养殖鱼类均具有明显的免疫增强作用,但是其作用效果仍会因鱼种,β-葡聚糖来源、剂量以及使用时间长短而呈现出一定的差异。 3.3 β-1,3-葡聚糖活化巨噬细胞
巨噬细胞是鱼体非特异性免疫系统的重要组成部分,在抵抗外源微生物、杀灭病菌的过程中发挥着非常重要的作用。鱼体巨噬细胞表面具有β-葡聚糖识别和结合位点,当β-葡聚糖与细胞表面受体结合之后巨噬细胞就会被活化,激活后的巨噬细胞能够分泌ILs、白三烯等一系列细胞活素因子,而ILs等细胞活素因子分泌量的增加会进一步激活T细胞、B细胞和自然杀伤细胞,从而增强鱼体的免疫能力[15, 20, 21]。在斑马鱼(Danio rerio)饲料中添加β-葡聚糖可以提高肾脏粒单核细胞(myelomonocytic)数量及IFN-γ和趋化因子的表达量,显著提高嗜水气单胞菌感染后的存活率,在虹鳟(Oncorhynchus mykiss)中的试验也得到了类似的结果[22, 23]。在大黄鱼(Pseudosciaena crocea)饲料中添加0.09%(纯物质含量)的酵母β-1,3-葡聚糖就能显著提高血清溶菌酶活性、噬菌率和呼吸爆发活性,但是ACP溶血活性却未受到β-葡聚糖含量的影响,同时当添加量增加到0.18%时,各项免疫指标的活性/含量反而下降到与对照组相似的水平,说明高剂量的β-葡聚糖可能会对某些鱼类的免疫产生一定的反馈抑制作用[24]。以上试验结果说明β-葡聚糖增强免疫系统的功能具有普遍性,能够广泛应用于不同的水产动物,是一种安全、高效、绿色的抗生素替代物,具有非常广阔的应用前景,但是不同种类鱼类的最适添加量有所差异。 4 MOS在水产饲料中的应用
水产养殖中的MOS产品主要由酿酒酵母细胞壁中的甘露聚糖酶解而来,一般认为MOS具有阻止肠道病原菌定植和刺激免疫系统的功能,此外其作为饲料添加剂同时也具有促进生长和提高饲料转化效率的作用,但是根据MOS的来源、剂量、添加时间,以及养殖条件、养殖鱼种类和年龄大小等的不同,其添加效果有所差异[25]。 4.1 MOS阻止肠道病原菌的吸附和定植
细菌主要依靠其表面特定的糖基与特定的凝集素之间的相互作用吸附到肠道细胞表面,这是细菌在肠道定植并产生病理反应的必经途径。MOS能够阻止这一过程的发生,因为MOS能够竞争病原菌表面的吸附位点,清除病原菌的吸附表面,破坏细胞识别,从而有效减少病原菌与肠壁细胞之间吸附作用的发生,阻止病原菌在肠道的定植,使病原菌随粪便加速排出体外,大大降低了疾病发生的可能性和严重性[26]。在饲料中添加0.4%的酵母多糖产品饲喂欧洲鲈(Dicentrarchus labrax)幼鱼8周,能有效减少肠道内溶藻弧菌(Vibrio alginolyticus)和鳗弧菌(Vibrio anguillarum)的繁殖和感染[27, 28]。而在异育银鲫(Carassius auratus gibeto)饲料中添加0.024%~0.048%的MOS并连续饲喂10周,其对嗜水气单胞菌的抵抗力明显增强,存活率也大大提高[29]。同样的结果也存在于虹鳟和尼罗罗非鱼(Oreochromis niloticus)中,其中给虹鳟投喂含0.4% MOS的饲料12周后使用鳗弧菌进行攻毒,其存活率显著提高,而尼罗罗非鱼在投喂含0.4%~0.6%MOS的饲料3周后,其对无乳链球菌(Streptococcus agalactiae)的抵抗力也得到明显的增强[25]。因此,在饲料中添加一定量的MOS并持续投喂一段时间,能够帮助鱼体提高对病原菌的抵抗能力,减少病原菌在肠道中的吸附和定植,从而提高养殖鱼类的存活率和对不利环境的抵抗能力。 4.2 MOS刺激胃肠道黏液的分泌
胃肠道黏膜表层是一个复杂的微生态系统,由上皮细胞、免疫细胞和微生物菌群组成。鱼类肠道黏液中含有细胞活素类、肽类、溶菌酶、脂蛋白、补体、凝集素、蛋白酶、抗体和黏液素等多种成分。黏膜层具有抵御病原菌、分泌消化液、润滑肠道和吸收营养物质的作用。研究发现,饲料中添加MOS能够增加欧洲鲈肠道细胞中杯状细胞的密度[27, 28],并促进虹鳟皮肤黏液的分泌[30]。因此,MOS能够促进鱼体黏液的分泌,减少潜在致病菌在肠道上皮细胞的附着率,从而提高其对疾病的抵抗能力,减少感染的发生。在欧洲鲈饲料中添加4 g/kg的酵母细胞壁MOS,饲喂8周之后其前肠黏膜褶皱的高度、宽度和表面积均显著上升,组织形态学分析显示单位面积内酸性黏液分泌细胞的数量增多,同时黏液中嗜酸性粒细胞数量和溶菌酶活性也显著上升[28]。因此,宿主黏膜表面 黏液分泌量的增加是阻止病原菌定植并杀灭病原 菌的有效手段,当宿主肠道黏膜表面黏液分泌量增大时,大量的黏液就能够阻断病原菌与肠道上皮细胞的接触,溶解病原菌并促使其加速排出体外,而MOS通过刺激肠道黏液的分泌量可以达到抵抗和杀灭病原菌的目的。 4.3 MOS促进肠道完整性
当肠道上皮细胞受到损伤,或者细胞之间连接的紧密度下降之后,鱼体就很容易受到细菌的侵蚀,在饲料中添加MOS可以促进鱼体肠道健康,增强肠道上皮细胞膜之间连接的紧密性,从而减少感染疾病的几率[31, 32, 33]。研究发现,在欧洲鲈饲料中添加0.4%的MOS,其肠道黏膜褶皱高度、密度和宽度与对照组相比均明显上升,电镜照片显示对照组鱼体肠道肠绒毛排列稀疏、整齐度差,而试验组肠道绒毛则非常紧密和整齐(图4)[28]。此外,对照组肠道上皮细胞之间连接较松散,相邻细胞之间间隙明显,而试验组肠道上皮细胞之间的连接则非常紧密(图4),这些结果说明MOS能够有效维护鱼体肠道健康,减少病原菌对肠壁细胞的侵蚀作用,从而防止疾病的发生[28, 31]。
 | 图4 欧洲鲈肠道组织切片(左图)和透射电镜照片(右图) Fig. 4 The histological section (pictures on left) and transmission electron micrographs (pictures on right) of European sea bass[28] |
在饲料中添加0.3%的MOS饲喂虹鳟90 d后其肠黏膜褶皱明显增大[34],在石首鱼饲料中添加1%的MOS饲喂4周后其肠道褶皱和微绒毛的长度均有所增长[35]。因此,酵母细胞壁多糖中的MOS能够在众多水产养殖鱼类中发挥作用,通过增加鱼体肠绒毛密度、长度和宽度,以及促进肠道上皮细胞之间连接的紧密性来维持鱼体肠道健康,并有效阻止病原菌的侵蚀。 4.4 MOS激活非特异性免疫系统
MOS不仅能够通过刺激肠道黏液分泌和促进肠道完整性的方式来提高鱼体对潜在致病菌的抵抗力,而且能够通过活化模式识别受体(pattern recognition receptors,PRR)和模式识别蛋白(pattern recognition protein,PRP)来激活动物体对非自身物质的非特异性免疫反应。MOS能增强血浆和黏液中溶菌酶活性,提高头肾中的白细胞吞噬指数,并刺激肠道淋巴组织和前列腺素类激素的分泌,从而增强机体的非特异性免疫功能[27, 28, 36]。在石首鱼饲料中添加1%的MOS饲喂4周后其血清溶菌酶活性即显著升高[37],而真鲷则只需投喂含0.4%的MOS的饲料14 d就会导致其血液中白细胞数量上升,但是其血清ACP溶血活性和溶菌酶活性则未受到显著影响[38]。在虹鳟中的试验显示饲料中添加0.4%的MOS饲喂12周之后,血浆中噬菌率、血细胞容积、溶菌酶活性、ACP溶血活性、传统补体途径(classical complement pathway)溶血活性和血清杀菌活性均有明显增强[30, 39]。这说明MOS具有激活鱼体非特异性免疫功能的作用,通过提高鱼体黏液中溶菌酶等免疫指标活性和血浆中免疫因子的含量,从而对病原菌产生有效的杀灭作用,维持鱼体的健康。
然而,MOS能否通过维护肠道健康、刺激黏液分泌和提高非特异性免疫因子的含量来增强鱼体的健康状况,还受到诸多其他因素的影响。MOS对不同鱼类的作用效果也不尽相同,MOS可以显著提高斑点叉尾 的血清溶菌酶活性,但是对血清总杀菌活性以及血液白细胞、血红蛋白水平等均未产生显著影响[40]。而在真鲷的试验中证明MOS可以提高其血液中总白细胞数量,但是对血清溶菌酶活性和ACP溶血活性却未产生显著影响[38]。这些试验研究均说明MOS不仅对不同鱼类的作用效果不同,即使在同种鱼类中对不同免疫指标的影响也不一样。同时,肠道细胞内可利用Ca2+浓度的高低、可改变肠道菌群组成的短链脂肪酸的含量、血管活性肠肽(vasoactive intestinal peptide,VIP)的分泌水平、蛋白激酶活化产生的肠道瘦蛋白水平,甚至饲料中可利用的色氨酸含量等均会对MOS调节肠道健康和免疫功能产生一定的影响[25]。 5 β-1,3-葡聚糖和MOS的促生长作用
研究发现β-1,3-葡聚糖和MOS不仅是良好的天然免疫增强剂,而且对水产动物的生长也具有明显的促进作用。在饲料中添加0.09%的β-1,3-葡聚糖就能够显著促进大黄鱼的生长[24],而在露斯塔野鲮中,β-1,3-葡聚糖的添加量在250~500 mg/kg时,其特定生长率也出现显著上升,同时饲料系数出现一定程度的下降[17]。Torrecillas等[25]综述了MOS对水产动物生长和饲料消化吸收效率的影响,表明在尼罗罗非鱼、达氏鳇、牙鲆、欧洲鲈、大西洋鲑(Salmo salar)、虹鳟和真鲷等养殖鱼类中添加一定量(根据不同鱼类添加量从0.15%~30.00%不等)的MOS均能显著促进其生长,并同时具有提高达氏鳇、牙鲆、欧洲鲈和虹鳟对饲料吸收转化效率的作用。
然而,β-1,3-葡聚糖和MOS促进水产动物生长的作用机制目前并没有明确的文献报道,一般认为这2类免疫多糖在动物肠道中并不会作为营养物质而被直接吸收利用,因此它们可能主要通过维护肠道健康、刺激胃肠道黏液分泌并降低pH,来提高胃肠道中消化酶的活性并调节肠道微生物菌群的平衡,从而提高动物对营养物质的消化吸收效率,有效促进水产动物的生长并降低饲料系数。 6 酿酒酵母核苷酸营养
核苷酸是体内合成核酸的前体物质,由嘌呤或嘧啶碱基、核糖或脱氧核糖以及磷酸组成,在细胞结构、代谢、遗传信息编码和细胞信号传递、能量和功能调节方面都具有重要作用。核苷酸合成的途径有从头合成和补救途径2种方式,机体许多生长代谢旺盛的组织(小肠、大肠、淋巴)和细胞(红细胞、白细胞等)从头合成核苷酸的能力有限,尤其当动物处于免疫应激、肝损伤、饥饿及快速生长的情况下,内源合成的核苷酸不能满足机体的需求,在饲料中添加外源核苷酸可以促进由补救途径合成核苷酸的量,从而满足机体对核苷酸的需求。酿酒酵母细胞中的核酸95%以上为RNA,占细胞干重的7%~10%[41],是养殖动物获取外源核苷酸非常好的途径。许丹丹等[42]综述了外源核苷酸对水产动物的营养生理作用,认为核苷酸具有促进摄食、调节生长、保护肝脏、促进肠道生长和发育、调节肠道微生物菌群以及提高免疫和抗应激能力的功能。
酵母核苷酸是强烈的水产动物诱食剂,其对水产动物的味觉、嗅觉神经以及化学感受器有特定作用,能够改善饲料的适口性,刺激动物对饲料的摄食,从而促进水产动物生长,提高免疫能力。无论投喂商业饲料还是半纯化饲料,饲料中添加一定量的核苷酸均能促进斑节对虾(penaeus monodon)的生长,提高其日均增长率[43]。而在日本囊对虾(Marsupenaeus japonicus)中的试验则表明酵母核苷酸能够显著上调其淋巴器官中抗菌肽和溶菌酶基因的表达,并显著提高其在弧菌(Vibrio nigripulchritudo)感染之后的存活率[44]。在虹鳟饲料中添加0.1%~0.2%的核苷酸即能显著提高其增重率和特定生长率并降低饲料系数[45]。虹鳟血浆中半数溶血值时血清总补体活性(ACH50)、溶菌酶活性和免疫球蛋白M的含量均随着核苷酸添加量的上升而显著升高,利用海豚链球菌(Streptococcus iniae)对虹鳟进行攻毒,结果表明0.2%核苷酸组死亡率仅为38%左右,而对照组死亡率则接近85%,说明饲料中添加外源核苷酸显著提高了虹鳟的免疫能力和对病原菌的抵抗能力[45]。在异育银鲫饲料中添加344和430 mg/kg的酵母核苷酸均显著促进了异育银鲫的生长并降低了饲料系数,而添加172 mg/kg的酵母核苷酸即能显著提高血清中溶菌酶和碱性磷酸酶活性[46],在鲤鱼[47]中的试验也得到类似的结果。在团头鲂(Megalobrama amblycephala)的试验中则表明饲料中添加200 mg/kg的酵母核苷酸能显著提高其特定生长率和蛋白质效率,显著降低饲料系数,同时嗜水气单胞菌攻毒后96~168 h的累积死亡率也显著降低[48]。在南美白对虾(Litopenaeus vannamei)饲料中添加核苷酸能显著提高增重率并降低饲料系数,同时溶菌酶、超氧化物歧化酶和过氧化物酶活性以及对低温和低氧的耐受能力均显著提高[49]。以上众多的试验结果表明酵母核苷酸能够广泛作用于鱼类和虾类,对它们的生长和免疫产生明显的促进作用,目前酵母核苷酸在水产饲料中的使用效果也得到了市场的广泛认同。 7 酿酒酵母氨基酸/小肽营养
此外,酵母类产品中还含有大量的氨基酸和小肽,包括为蛋白质合成提供碳-氮骨架的营养性小肽,以及参与调节动物生理活动的功能性小肽(如谷胱甘肽)。酿酒酵母中必需氨基酸含量接近20%,其中赖氨酸含量为3.43%,蛋氨酸为0.72%,赖氨酸 : 蛋氨酸 : 色氨酸 : 苏氨酸=100 : 21 : 19 : 64[8]。氨基酸和小肽可直接被动物吸收利用,完整地通过肠黏膜细胞进入机体循环,具有速度快、耗能低、载体不易饱和等特点,从而减少氨基酸间的相互竞争,加速蛋白质的合成,协助矿物元素吸收(形成微量元素螯合物)。硬骨鱼类免疫系统发育相对比较完整,能够有效抵抗养殖过程中的不利环境因素,承受一定的应激并抵抗病原菌的侵蚀。当动物体处于不利环境中时,其体内会发生各种相应的生理变化来应对应激,促使机体尽快从病原体感染或物理应激导致的内环境失衡中恢复。这些保护机制包括细胞活素类因子的分泌、抗氧化反应以及其他的各种细胞反应等,而细胞内营养物质的顺利供应是促使免疫系统保护机体组织免受损伤的最基本保障,核苷酸和氨基酸/小肽作为细胞内各种生化过程(如基因表达、生化酶合成等)正常进行所必不可少的营养物质,在保护动物体抵抗病原菌侵蚀和修复受损机体组织和细胞方面发挥着非常重要的免疫营养作用[50]。因此,酿酒酵母中富含的核苷酸和氨基酸/小肽既能作为营养补充剂来满足水产动物的生长需求,在动物体受到病菌侵蚀和其他应激时又能活化免疫系统,帮助其抵抗感染并有效修复受损组织和细胞。 8 酿酒酵母其他营养
酿酒酵母细胞不仅含有丰富的能够给水产养殖动物的生长和免疫带来明显的促进作用的功能性多糖、核苷酸和氨基酸,而且细胞质内还含有众多其他的营养物质。利用啤酒废酵母为原料抽提制取的海藻糖有助于维护动物生物膜、脂质体、蛋白质和核酸等细胞和生物大分子的正常结构和功能,从而避免或降低动物在营养缺乏或恶劣环境中的受损伤程度[51]。酵母细胞中含有较丰富的超氧化物歧化酶,其比活力达到3 000 U/mg,远远高于红酵母、香菇、毛霉等其他真菌,能够帮助动物清除体内的超氧阴离子,对机体氧化损伤具有很好的保护作用[52]。邱雁临等[53]利用废酵母泥为原料成功制得纯度较高的谷胱甘肽,其具有清除自由基、维持生物体内适宜的氧化还原环境、维持红细胞膜完整性以及促进DNA合成、细胞正常生长和提高细胞免疫等多种生理功能。此外,酿酒酵母细胞中B族维生素含量非常丰富,含维生素B1(硫胺素)80~120 mg/kg、维生素B2(核黄素)32~35 mg/kg、泛酸100~150 mg/kg、胆碱2 700~3 000 mg/kg、烟酸350~400 mg/kg、肌醇3 500~4 000 mg/kg以及吡哆醇、生物素和叶酸等[9]。同时,酿酒酵母细胞中也富含磷、铁、钙、钠、钾、镁、铜、锌、锰等矿物元素和钴、硒、铬等微量元素,以及发达的生物酶系统和辅酶等生理活性物质[9]。啤酒酵母因其生长繁殖快、发酵周期短、对微量元素吸收率高等特点,成为无机微量元素的理想载体,已有利用酵母生产富硒酵母、富铬酵母的研究报道[54]。也有学者认为酵母细胞中还含有许多未知生长因子,其营养价值不能仅根据已知营养素(蛋白质、氨基酸、核苷酸、多糖)的组成来衡量[55]。随着对酵母研究的不断深入,酵母的营养和功能成分已经得到了相当广泛和透彻的分析,饲料酵母类产品的应用也得到市场越来越广泛的认可。 9 小 结
我国是世界水产养殖大国,水产养殖产量和水产饲料生产量均位列全球首位,调查显示2013年我国水产饲料生产量达到1 900万t,国内养殖水产量接近4 400万t。鱼粉是应用于水产饲料的最优质的动物蛋白质源,全球产量近10年来维持在500万~600万t,而随着水产饲料产量的快速增长,鱼粉已经成为越来越紧缺的优质资源,其在饲料中的用量也逐步下降。而要解决鱼粉替代难题,就必须考虑到饲料中使用鱼粉所具有的适口性好、营养均衡及维护肠道健康、增强免疫能力等特点。众多的研究表明,酿酒酵母细胞壁免疫多糖和酿酒酵母核苷酸类产品作为天然、优质的单细胞蛋白质源,在促进水产动物生长、改善饲料品质、增强动物免疫能力方面均发挥着非常重要的作用,酿酒酵母深加工产品在水产饲料中的应用也日趋成熟和普遍,其应用效果也获得了广大养殖户的认可。此外,酿酒酵母作为一种单细胞真核生物,其培养和发酵等工业化生产过程均不会受到季节、气候、地域等因素的影响,而我国作为啤酒生产大国,2013年啤酒产量已超过5 000万kL,也为饲料酵母的生产提供了大量的原料来源。因此,酿酒酵母产品的开发利用将会越来越广泛,而如何对酿酒酵母进行更深程度的开发利用,也将是饲用酵母行业发展所必须关注的重点问题之一。
| [1] | HITTINGER C T.Saccharomyces diversity and evolution:a budding model genus[J]. Trends in Genetics,2013,29(5):309-317. ( 1) 1)
|
| [2] | 王庆国,刘天明.酵母菌分类学方法研究进展[J]. 微生物学杂志,2007,27(3):96-101. ( 1) 1)
|
| [3] | 孙万儒.酵母菌[J]. 生物学通报,2007,42(11):5-10. ( 1) 1)
|
| [4] | RAINIERI S,ZAMBONELLI C,KANEKO Y.Saccharomyces sensu stricto:systematics,genetic diversity and evolution[J]. Journal of Bioscience and Bioengineering,2003,96(1):1-9. ( 1) 1)
|
| [5] | 白逢彦.酿酒酵母属的分类学研究进展[J]. 微生物学通报,2000,27(2):139-142. ( 2) 2)
|
| [6] | SRINORAKUTARA T.Determination of yeast cell wall thickness and cell diameter using new methods[J]. Journal of Fermentation and Bioengineering,1998,86(3):253-260. ( 2) 2)
|
| [7] | OSUMI M.The ultrastructure of yeast:cell wall structure and formation[J]. Micron,1998,29(2/3):207-233. ( 6) 6)
|
| [8] | 贺淼,周安国,王之盛,等.复合酵母的营养价值评定[J]. 动物营养学报,2013,25(8):1904-1910. ( 2) 2)
|
| [9] | 王定昌,赖荣婷.酵母的用途[J]. 粮油食品科技,2002,10(1):12-16. ( 4) 4)
|
| [10] | KLIS F M,BOORSMA A,DE GROOT P W J.Cell wall construction in Saccharomyces cerevisiae[J]. Yeast,2006,23(3):185-202. ( 5) 5)
|
| [11] | KLIS F M,MOL P,HELLINGWERF K,et al.Dynamics of cell wall structure in Saccharomyces cerevisiae[J]. FEMS Microbiology Reviews,2002,26(3):239-256. ( 1) 1)
|
| [12] | KIM K S,YUN H S.Production of soluble β-glucan from the cell wall of Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology,2006,39(3):496-500. ( 1) 1)
|
| [13] | BISWAS G,KORENAGA H,TAKAYAMA H,et al.Cytokine responses in the common carp,Cyprinus carpio L.treated with baker's yeast extract[J]. Aquaculture,2012,356/357:169-175. ( 2) 2)
|
| [14] | GUZMÁN-VILLANUEVA L T,TOVAR-RAMÍREZ D,GISBERT E,et al.Dietary administration of β-1,3/1,6-glucan and probiotic strain Shewanella putrefaciens,single or combined,on gilthead seabream growth,immune responses and gene expression[J]. Fish & Shellfish Immunology,2014,39(1):34-41. ( 1) 1)
|
| [15] | LOW C,WADSWORTH S,BURRELLS C,et al.Expression of immune genes in turbot (Scophthalmus maximus) fed a nucleotide-supplemented diet [J]. Aquaculture,2003,221(1/2/3/4):23-40. ( 2) 2)
|
| [16] | SAHOO P K,MUKHERJEE S C.Effect of dietary β-1,3-glucan on immune responses and disease resistance of healthy and aflatoxin B1 induced immunocompromised rohu (Labeo rohita Hamilton)[J]. Fish & Shellfish Immunology,2001,11(8):683-695. ( 1) 1)
|
| [17] | MISRA C K,DAS B K,MUKHERJEE S C,et al.Effect of long term administration of dietary β-glucan on immunity,growth and survival of Labeo rohita fingerlings[J]. Aquaculture,2006,255(1/2/3/4):82-94. ( 3) 3)
|
| [18] | PIONNIER N,FALCO A,MIEST J J,et al.Feeding common carp Cyprinus carpio with β-glucan supplemented diet stimulates C-reactive protein and complement immune acute phase responses following PAMPs injection[J]. Fish & Shellfish Immunology,2014,39(2):285-295. ( 1) 1)
|
| [19] | PIONNIER N,FALCO A,MIEST J,et al.Dietary β-glucan stimulate complement and C-reactive protein acute phase responses in common carp (Cyprinus carpio) during an Aeromonas salmonicida infection[J]. Fish & Shellfish Immunology,2013,34(3):819-831. ( 1) 1)
|
| [20] | ENGSTAD R E,ROBERTSEN B.Recognition of yeast cell wall glucan by Altantic salmon (Salmo salar L.) macrophages[J]. Developmental and Comparative Immunology,1993,17(4):319-330. ( 1) 1)
|
| [21] | AINSWORTH A J.A β-glucan inhibitable zymosan receptor on channel catfish neutrophils[J]. Veterinary Immunology and Immunopathology,1994,41(1/2):141-152. ( 1) 1)
|
| [22] | SKOV J,KANIA P W,HOLTEN-ANDERSEN L,et al.Immunomodulatory effects of dietary β-1,3-glucan from Euglena gracilis in rainbow trout (Oncorhynchus mykiss) immersion vaccinated against Yersinia ruckeri[J]. Fish & Shellfish Immunology,2012,33(1):111-120. ( 1) 1)
|
| [23] | RODRÍGUEZ I,CHAMORRO R,NOVOA B,et al.β-Glucan administration enhances disease resistance and some innate immune responses in zebrafish (Danio rerio)[J]. Fish & Shellfish Immunology,2009,27(2):369-373. ( 1) 1)
|
| [24] | AI Q H,MAI K S,ZHANG L,et al.Effects of dietary β-1,3-glucan on innate immune response of large yellow croaker,Pseudosciaena crocea[J]. Fish & Shellfish Immunology,2007,22(4):394-402. ( 2) 2)
|
| [25] | TORRECILLAS S,MONTERO D,IZQUIERDO M.Improved health and growth of fish fed mannan oligosaccharides:potential mode of action[J]. Fish & Shellfish Immunology,2014,36(2):525-544. ( 4) 4)
|
| [26] | BAVINGTON C,PAGE C.Stopping bacterial adhesion:a novel approach to treating infections[J]. Respiration,2005,72(4):335-344. ( 1) 1)
|
| [27] | TORRECILLAS S,MAKOL A,CABALLERO M J,et al.Improved feed utilization,intestinal mucus production and immune parameters in sea bass (Dicentrarchus labrax) fed mannan oligosaccharides (MOS)[J]. Aquaculture Nutrition,2011,17(2):223-233. ( 3) 3)
|
| [28] | TORRECILLAS S,MAKOL A,BENITEZ-SANTANA T,et al.Reduced gut bacterial translocation in European sea bass (Dicentrarchus labrax) fed mannan oligosaccharides (MOS)[J]. Fish & Shellfish Immunology,2011,30(2):674-681. ( 6) 6)
|
| [29] | LIU B,XU L,GE X P,et al.Effects of mannan oligosaccharide on the physiological responses,HSP70 gene expression and disease resistance of Allogynogenetic crucian carp (Carassius auratus gibelio) under Aeromonas hydrophila infection[J]. Fish & Shellfish Immunology,2013,34(6):1395-1403. ( 1) 1)
|
| [30] | RODRIGUES-ESTRADA U,SATOH S,HAGA Y,et al.Studies of the effects of mannan-oligosaccharides,Enterococcus faecalis,and poly hydrobutyric acid as immune stimulant and growth promoting ingredients in rainbow trout diets[C]//5th World Fisheries Congress.Yokohama,Japan,2008:158.( 2) 2)
|
| [31] | TORRECILLAS S,MAKOL A,BETANCOR M B,et al.Enhanced intestinal epithelial barrier health status on European sea bass (Dicentrarchus labrax) fed mannan oligosaccharides[J]. Fish & Shellfish Immunology,2013,34(6):1485-1495. ( 2) 2)
|
| [32] | WELKER T L,LIM C,YILDIRIM-AKSOY M,et al.Immune response and resistance to stress and Edwardsiella ictaluri challenge in channel catfish,Ictalurus punctatus,fed diets containing commercial whole-cell yeast or yeast subcomponents[J]. Journal of the World Aquaculture Society,2007,38(1):24-35. ( 1) 1)
|
| [33] | SALZE G,MCLEAN E,SCHWARZ M H,et al.Dietary mannan oligosaccharide enhances salinity tolerance and gut development of larval cobia[J]. Aquaculture,2008,274(1):148-152. ( 1) 1)
|
| [34] | YILMAZ E,GENC M A,GENC E.Effects of dietary mannan oligosaccharides on growth,body composition,and intestine and liver histology of rainbow trout,Oncorhynchus mykiss[J]. The Israeli Journal of Aquaculture-Bamidgeh,2007,59(3):182-188. ( 1) 1)
|
| [35] | ANGUIANO M,POHLENZ C,BUENTELLO A,et al.The effects of prebiotics on the digestive enzymes and gut histomorphology of red drum (Sciaenops ocellatus) and hybrid striped bass (Morone chrysops×M.saxatilis)[J]. British Journal of Nutrition,2013,109(4):623-629. ( 1) 1)
|
| [36] | TORRECILLAS S,MAKOL A,CABALLERO M J,et al.Immune stimulation and improved infection resistance in European sea bass (Dicentrarchus labrax) fed mannan oligosaccharides[J]. Fish & Shellfish Immunology,2007,23(5):969-981. ( 1) 1)
|
| [37] | BUENTELLO J A,NEILL W H,GATLIN D M.Effects of dietary prebiotics on the growth,feed efficiency and non-specific immunity of juvenile red drum Sciaenops ocellatus fed soybean-based diets[J]. Aquaculture Research,2010,41(3):411-418. ( 1) 1)
|
| [38] | DIMITROGLOU A,MERRIFIELD D L,CARNEVALI O,et al.Microbial manipulations to improve fish health and production:a mediterranean perspective[J]. Fish & Shellfish Immunology,2011,30(1):1-16. ( 2) 2)
|
| [39] | STAYKOV Y,SPRING P,DENEV S,et al.Effect of a mannan oligosaccharide on the growth performance and immune status of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture International,2007,15(2):153-161. ( 1) 1)
|
| [40] | WELKER T L,LIM C,YILDIRIM-AKSOY M,et al.Effect of short-term feeding duration of diets containing commercial whole-cell yeast or yeast subcomponents on immune function and disease resistance in channel catfish,Ictalurus punctatus[J]. Journal of Animal Phyisology and Animal Nutrition,2011,96(2):159-171. ( 1) 1)
|
| [41] | TODD B,ZHAO J,FLEET G.HPLC measurement of guanine for the determination of nucleic acids (RNA) in yeasts[J]. Journal of Microbiological Methods,1995,22(1):1-10. ( 1) 1)
|
| [42] | 许丹丹,曹俊明,黄燕华,等.外源核苷酸对水产动物营养生理作用的研究进展[J]. 水产科学,2011,30(11):716-720. ( 1) 1)
|
| [43] | HUU H D,TABRETT S,HOFFMANN K,et al.Dietary nucleotides are semi-essential nutrients for optimal growth of black tiger shrimp (Penaeus monodon)[J]. Aquaculture,2012,366/367:115-121. ( 1) 1)
|
| [44] | BISWAS G,KORENAGA H,NAGAMINE R,et al.Immune stimulant effects of a nucleotide-rich baker's yeast extract in the kuruma shrimp,Marsupenaeus japonicus[J]. Aquaculture,2012,366/367:40-45. ( 1) 1)
|
| [45] | TAHMASEBI-KOHYANI A,KEYVANSHOKOOH S,NEMATOLLAHI A,et al.Dietary administration of nucleotides to enhance growth,humoral immune responses,and disease resistance of the rainbow trout (Oncorhynchus mykiss) fingerlings[J]. Fish & Shellfish Immunology,2011,30(1):189-193. ( 2) 2)
|
| [46] | 魏文志,罗方妮,杨成,等.酵母核苷酸对异育银鲫生长和免疫酶活性的影响[J]. 淡水渔业,2007,37(4):57-60. ( 1) 1)
|
| [47] | 向枭,周兴华,陈建,等.酵母核苷酸对鲤生长性能、体组成及血清免疫指标的影响[J]. 动物营养学报,2011,23(1):171-178. ( 1) 1)
|
| [48] | 张一平,刘波,华洵璐,等.酵母核苷酸对团头鲂生长性能、抗氧化功能和抗病力的影响[J]. 动物营养学报,2012,24(3):583-590. ( 1) 1)
|
| [49] | 王广军,朱旺明,谭永刚,等.酵母核苷酸对凡纳滨对虾生长、免疫以及抗应激影响的研究[J]. 饲料工业,2006,27(8):29-32. ( 1) 1)
|
| [50] | KIRON V.Fish immune system and its nutritional modulation for preventive health care[J]. Animal Feed Science and Technology,2012,173(1/2):111-133. ( 1) 1)
|
| [51] | 谭海刚,李书巧,关凤梅,等.从啤酒废酵母中提取海藻糖工艺的研究[J]. 酿酒科技,2005(4):78-80. ( 1) 1)
|
| [52] | 李宏,单振秀.利用几种生物原料提取SOD的比较研究[J]. 贵州农业科学,2009,37(3):93-94. ( 1) 1)
|
| [53] | 邱雁临,殷伟,潘飞,等.吸附层析法从啤酒废酵母中提取谷胱甘肽[J]. 生物技术,2005,15(1):49-51. ( 1) 1)
|
| [54] | 孙伟峰,周素梅,王强.废啤酒酵母综合利用研究进展[J]. 化工进展,2008,27(7):990-1000. ( 1) 1)
|
| [55] | 白晓婷.酵母类产品在饲料中的研究与应用[J]. 中国饲料,2005(2):8-10. ( 1) 1)
|



