2. 重庆市畜牧科学院, 荣昌 402460
2. Chongqing Academy of Animal Sciences, Rongchang 402460, China
microRNAs(miRNAs)是在真核生物体内发现的一类长度约22个核苷酸的内源性非编码单链RNA,能与靶mRNA 3’端非翻译区(3’-UTR)的碱基序列结合。如果它们之间的碱基序列完全配对,则会引起靶mRNA的剪切;如果是不完全配对,则会抑制靶mRNA的翻译,从而在转录后水平调控靶基因的表达[1, 2, 3, 4, 5]。研究还发现,miRNAs除了与靶mRNA的3’-UTR结合外,还可结合氨基酸编码区(amino acid coding regions,CDS)来调控mRNA的表达[6, 7]。预测认为,人体内超过60%的基因受到miRNAs的调控,每个miRNA能够调控多个靶mRNA,广泛参与调节机体的生理学和病理学过程,如细胞凋亡、增殖、分化、代谢、病原体感染及复杂的信号传导等[5, 8, 9, 10]。也有研究表明,癌症、心血管和代谢性等一些人类疾病的发生和形成与体内miRNAs的异常表达密切关联[1, 11]。
miR-21是在哺乳动物上最早被发现和确认的miRNAs分子中的一种,目前已在31个物种体内的多种组织及细胞中发现有miR-21存在,但还没在植物上发现。大量试验表明,miR-21对多种肿瘤和心血管疾病的形成和发展都具有重要影响[12, 13, 14]。细胞凋亡是细胞为了适应环境变化,由多基因调控的细胞自发性的程序性死亡,细胞凋亡的异常变化会导致一些疾病的发生,例如肿瘤的形成。动物试验结果表明细胞凋亡对于维持动物的正常生理状态、健康的生长和高效的生产有重要的影响。本文将重点介绍miR-21的生成、表达调控及其对细胞凋亡的影响。 1 miR-21的生成
同其他miRNAs的生成一样,miR-21由miR-21基因编码,在细胞核内通过RNA聚合酶Ⅱ转录产生初始转录物pri-miR-21,再通过有序的2步修饰,形成成熟的miR-21。初始转录物pri-miR-21首先由RNA聚合酶Ⅲ家族的Drosha酶在DiGeorge综合征关键区域基因8(DGCR8)辅酶配合下,剪切成约70个核苷酸的具有茎环结构的前体miR-21(pre-miR-21);该前体通过转运蛋白Exportin-5的转运作用,从细胞核转至细胞质;然后经RNA聚合酶Ⅲ家族的Dicer酶修饰后得到双链的miRNA:miRNA*。根据热力学稳定性,miRNA*稳定性高,不易解螺旋,通常被降解,而miRNA由于稳定性低,更容易解螺旋后与RNA诱导沉默复合物(RISC)结合形成功能性的miRISC复合物,进而与靶mRNA的3’-UTR结合,以调控mRNA的表达[13, 15](图1)。
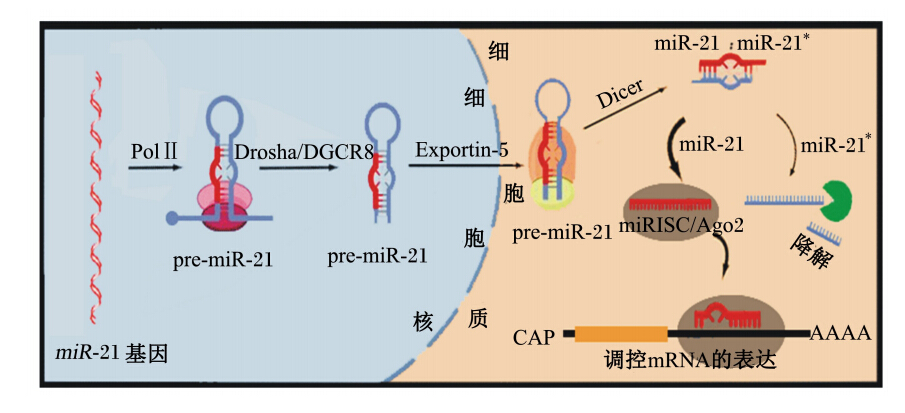 | 图1 miR-21的生成 Fig. 1 Biogenesis of miR-21[1] |
miR-21的基因定位具有种属特异性。小鼠的miR-21基因定位在11号染色体上,猪的定位在12号染色体上,而人的定位在17号染色体q23.2区域,与跨膜蛋白49(TMEM49)编码基因重叠,存在于TMEM49基因的第10个内含子内。尽管miR-21与TMEM49基因有重叠部分,但与其他miRNAs不同,它拥有独立的启动子区域[16]。研究发现,miR-21可能拥有3个启动子区域。Cai等[17]发现了位于miR-21上游-3 403位到-2 395位的启动子,通过序列分析,转录控制元件是CCAAT盒,而不是典型的距转录起始位点约25个碱基的ATAT盒。Lffler等[18]发现了另一个与Cai等[17]非常相似的启动子,从上游-3 565位延伸到-2 415位,由白细胞介素-6/信号传导及转录活化因子3(IL-6/STAT3)所诱导。Fujita等[19]运用信息学算法确定了位于上游-3 770位到-3 337位区间、含有独立且高度保守序列的启动子。该启动子含有多个保守的增强子元件结合位点,能与激活蛋白1(activation protein 1,AP-1)、Ets/PU.1、CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein,C/EBPα)、核因子Ⅰ(nuclear factor Ⅰ,NFⅠ)、血清应答因子(serum response factor,SRF)、p53及STAT3等转录因子结合。
不同的转录因子对miR-21表达的调控信号通路存在差异。Fujita等[19]发现,在293FT细胞中激活的AP-1在PU.1的协助下可激活miR-21的转录,而核转录因子I/B(NFIB)和C/EBPα相互作用则能抑制miR-21的表达,且miR-21与NFIB之间存在负反馈调节机制。Lffler等[18]和Krichevsky等[20]在研究多发性骨髓瘤时发现,转录因子STAT3促进miR-21上游增强子激活,IL-6可诱导miR-21的转录;当敲除STAT3的骨髓瘤细胞在IL-6诱导下培养48 h时,pri-miR-21的表达水平降低,表明STAT3介导了IL-6-miR-21的自分泌反馈调节。Wickramasinghe等[21]在乳腺癌MCF-7细胞中发现,雌激素受体(estrogen receptor,ER)可抑制miR-21的表达,同时miR-21的靶基因程序性细胞死亡4(programmed cell death 4,PDCD4)、磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)和B细胞淋巴瘤/白血病-2(B-cell lymphoma 2,Bcl2)表达上调,其机制可能是雌激素同源受体ERα和ERβ通过与miR-21启动子中具有雌激素效应元件的配体结合来实现。另外在雄激素受体(androgen receptor,AR)活跃的前列腺癌细胞系C4-2和CWR22Rv1中,AR可直接与miR-21启动子相互作用,上调miR-21的表达[22]。
除上述提到的转录水平调控外,miR-21的表达还受到转录后水平调控。Ribas等[23]发现转化生长因子-β(transforming growth factor-β,TGF-β)和骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)通过促进Drosha酶对pri-miR-21转录物的加工来上调miR-21的表达。另有研究发现miR-21在转录后水平的表达调控存在组织差异性。Chiosea等[24]和Ambs等[25]发现在前列腺癌组织中Dicer、Drosha以及DGCR8酶的表达水平上调,并通过对pri-miR-21高效修饰,促进miR-21的表达,而在其他组织未发现这种情况。目前运用生物信息学软件分析发现,还有Yin Yang-1(YY1)、转录因子NF-E2相关因子2(NFE2L2)、重组人活化转录因子-2(ATF2)、特化蛋白1(Sp1)、缺氧诱导因子1(HIF1)等转录因子可能也参与miR-21表达的转录或转录后调控过程[14],但尚需进一步试验加以证实。 3 miR-21对于细胞凋亡的影响
细胞凋亡是指细胞为维持内环境稳态,由多基因调控的细胞自主有序的死亡。涉及的基因包括半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)家族、Bcl2、PDCD4及PTEN等。自miRNA被发现后,已确认不少于30种miRNA小分子与细胞凋亡关系紧密。有些miRNA能促进细胞凋亡,如Let-7家族、miR-29和miR-34等;而有些miRNA则抑制细胞凋亡,如miR-21、miR-20a等[26]。
肿瘤的发生往往伴随着明显的细胞凋亡,在现有对肿瘤的研究中,miR-21被认为是一个原癌基因,并且表现出强烈的抑制细胞凋亡的作用。在人的胶质瘤组织和细胞系中发现miR-21显著高表达,利用化学修饰试剂2’甲氧基(2’OMe)-miR-21和锁核酸(LNA)-miR-21能抑制miR-21基因表达,将它们转染进胶质瘤细胞系48 h后,细胞数量急剧下降,Caspase 3和7的活性提高3倍,而Caspase 3和7是已知细胞凋亡的执行者,能显著推进细胞凋亡进程,促进细胞的凋亡。研究表明,miR-21在胶质瘤中抑制细胞凋亡是通过抑制Caspase 3和7的表达来发挥作用[27]。类似结果在Corsten等[28]研究胶质瘤细胞对细胞毒性肿瘤治疗时得到验证。除依赖Caspase调控细胞凋亡外,Chen等[29]研究发现miR-21还能通过靶向调控抑癌基因PDCD4来影响神经胶质瘤细胞的凋亡,他首先通过荧光素酶活性分析试验确定了PDCD4在miR-21的调控位点,再使用2’OMe-miR-21处理T98G细胞,发现miR-21的下调伴随着PDCD4蛋白质水平的上调,提示高表达miR-21在翻译水平上抑制了PDCD4的表达,从而抑制细胞的凋亡。建立过表达的PDCD4能显著促进神经胶质瘤细胞的凋亡,而在T98G细胞中过表达miR-21能补救由PDCD4过表达引起的细胞凋亡。研究表明,miR-21不仅通过直接抑制PDCD4的翻译,而且还通过其他靶基因和通路来抑制细胞凋亡[29]。Papagiannakopoulos等[30]研究发现miR-21还可靶向负调控p53、TGF-β及线粒体凋亡通路基因电压依赖性阴离子通道1(VDAC1),这些基因对细胞凋亡的发生和发展都具有重要影响。另外,miR-21还可直接调控凋亡基因Bcl2来抑制细胞凋亡。Si等[31]对157例乳腺癌病人体内miRNAs表达进行分析,发现miR-21异常高表达,为了解miR-21在乳腺癌形成过程中的作用,他们通过体外转染anti-miR-21到乳腺癌MCF-7细胞中,发现miR-21能抑制乳腺癌细胞的生长,已经移植到小鼠身上的肿瘤,其生长也受到了抑制,并且对肿瘤生长的抑制明显与细胞凋亡的增加有关。进一步研究发现,miR-21下调了Bcl2的表达,而Bcl2是一个细胞凋亡的抑制因子,通过抑制细胞色素C从线粒体释放到细胞质来调控细胞凋亡。此外,miR-21在肝癌、胆管癌、肾癌等实体癌上都具有抑制细胞凋亡的作用。
除影响癌细胞的凋亡外,miR-21对心肌细胞和血管平滑肌细胞等非癌细胞的凋亡也有抑制作用。抑制细胞凋亡可以防止或减轻心肌缺血再灌注损伤,Yin等[32]研究发现热休克的小鼠会诱导心肌中miR-21的表达,且将从热休克小鼠体内分离的miRNAs用于处理正常小鼠,缺血再灌注导致的心肌梗死面积减少;采用化学合成的miR-21注射给小鼠出现类似的结果,而用2’OMe-miR-21配合处理后,对缺血再灌注导致的心肌梗死的保护作用消失。同时发现miR-21会引起促凋亡因子Caspase 1、Caspase 2、Caspase 8、Bid、Bcl-10、大鼠凋亡相关因子配体(FASL)、Trp53的蛋白质水平下降,而抑凋亡因子Bag3、Prdx2的蛋白质水平增加,表明miR-21的抑凋亡作用是通过调控凋亡因子的表达发挥作用的。Cheng等[33]也发现miR-21有抑制心肌细胞凋亡的作用,利用LNA-miR-21抑制miR-21表达促进了过氧化氢(H2O2)诱导的心肌细胞凋亡,而用Pre-miR-21建立的miR-21过表达则减少了心肌细胞凋亡,而且miR-21可能通过PDCD4及其下游信号分子AP-1的作用来保护H2O2诱导的心肌细胞损伤。
PTEN作为迄今发现的第1个具有双特异磷酸酶活性的抑癌基因,同样受到miR-21的调控,且对细胞的凋亡具有重要的影响。Ji等[34]研究发现,在增生的血管平滑肌细胞中miR-21的表达水平明显升高,但用不同剂量2’OMe-miR-21处理体外培养的鼠主动脉血管平滑肌细胞48 h后,细胞增殖减缓,而凋亡细胞的数量以剂量依赖的方式增加,揭示miR-21对血管平滑肌细胞有促进增殖和抑制凋亡的作用。进一步研究其作用机制发现,抑制miR-21基因表达会上调原癌基因PTEN的表达,而过表达的miR-21则会下调PTEN的表达。凋亡抑制因子Bcl2则出现与PTEN完全相反的变化。研究表明miR-21在抑制血管平滑肌细胞凋亡是通过PTEN和Bcl2发挥作用的。
细胞凋亡除了与人类健康和疾病形成具有密切的联系外,对于动物的健康生长、发育、代谢和生产也有重要影响。动物机体能够通过细胞凋亡的方式去除损伤细胞、维持代谢稳定和保持机体内环境的稳态。关于细胞凋亡的研究能够促进动物生长和生产,改善动物福利,保障动物的健康,具有重要的科学意义和经济价值。当前已经有许多研究关注动物体内的细胞凋亡及其引起的表型和生理变化。例如绒山羊的产毛性能与皮肤毛囊细胞密切相关,其细胞凋亡的变化揭示了生绒机制[35]。兔乳腺上皮细胞的凋亡与泌乳量呈负相关的关系,可为维持泌乳的高产提供调控依据[36]。有研究表明,miRNAs可以抑制奶牛乳腺上皮细胞的生长,促进细胞的凋亡,调控奶牛的泌乳产量[37]。骨骼肌的生长发育对动物的产肉性状影响较大,猪骨骼肌细胞的凋亡能够有效调控猪体内的肌肉含量与分布[38]。此外动物的繁殖性能与卵泡中的颗粒细胞密切联系,颗粒细胞凋亡的变化可指导多胎动物的繁殖性能[39]。综上所述,细胞凋亡与动物体内各个组织器官的各种机能都存在直接或者间接的联系。作为细胞凋亡的一个重要调控因子,miR-21在不同动物体内的多种细胞中均有表达,它可能通过调控不同细胞的凋亡影响到动物的胚胎发育,器官形成,代谢进程和诸如产毛、泌乳、产肉等各种生产性能。但是当前相关研究还较为缺乏,有待进一步的通过试验加以确认。 4 小 结
虽然已有大量试验阐述了miR-21的表达和作用,尤其是它在肿瘤形成和心血管疾病发生中的重要地位,但迄今为止仍有许多疑问亟待解决。例如,miR-21在不同类型的肿瘤细胞中的表达模式和靶分子是否相同?miR-21对凋亡的影响是直接靶向凋亡基因还是经由信号转录因子发挥间接作用?miR-21除在大多数细胞中表现出抑制凋亡作用外,在特殊情况下某些细胞中似乎也有一定的促凋亡作用,这只是个例还是一种新的作用机制?miR-21在不同动物体内的表达模式及其对不同细胞凋亡的调控机制并引起怎样的表型和生理变化?虽然当前还有许多疑问,但是通过大量的基础研究,我们有可能在不久的将来通过靶向调控类似于miR-21这样的重要转录调控因子来实现对于人和动物疾病诊疗和代谢控制的目标。
| [1] | HENNESSY E,O'DRISCOLL L.Molecular medicine of microRNAs: structure,function and implications for diabetes[J]. Expert Reviews in Molecular Medicine,2008,10:e24. ( 3) 3)
|
| [2] | LAU N C,LIM L P,WEINSTEIN E G,et al.An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans[J]. Science,2001,294(5543):858-862. ( 1) 1)
|
| [3] | FABIAN M R,SONENBERG N,FILIPOWICZ W.Regulation of mRNA translation and stability by microRNAs[J]. Annual Review of Biochemistry,2010,79(1):351-379. ( 1) 1)
|
| [4] | CARTHEW R W,SONTHEIMER E J.Origins and mechanisms of miRNAs and siRNAs[J]. Cell,2009,136(4):642-655. ( 1) 1)
|
| [5] | BARTEL D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J]. Cell,2004,116(2):281-297. ( 2) 2)
|
| [6] | RIGOUTSOS I.New tricks for animal microRNAS:targeting of amino acid coding regions at conserved and nonconserved sites[J]. Cancer Research,2009,69(8):3245-3248. ( 1) 1)
|
| [7] | SIOMI H,SIOMI M C.Posttranscriptional regulation of microRNA biogenesis in animals[J]. Molecular Cell,2010,38(3):323-332. ( 1) 1)
|
| [8] | STAREGA-ROSLAN J,KOSCIANSKA E,KOZLOWSKI P,et al.The role of the precursor structure in the biogenesis of microRNA[J]. Cellular and Molecular Life Sciences,2011,68(17):2859-2871. ( 1) 1)
|
| [9] | OKADA C,YAMASHITA E,LEE S J,et al.A high-resolution structure of the pre-microRNA nuclear export machinery[J]. Science,2009,326(5957):1275-1279. ( 1) 1)
|
| [10] | KIM V N.MicroRNA biogenesis:coordinated cropping and dicing[J]. Nature Reviews:Molecular Cell Biology,2005,6(5):376-385. ( 1) 1)
|
| [11] | FARAZI T A,HOELL J I,MOROZOV P,et al.MicroRNAs in human cancer[J]. The Journal of Pathology,2011,223(2):102-115. ( 1) 1)
|
| [12] | CHENG Y H,ZHANG C X.MicroRNA-21 in cardiovascular disease[J]. Journal of Cardiovascular Translational Research,2010,3(3):251-255. ( 1) 1)
|
| [13] | HUANG Y,YANG Y B,ZHANG X H,et al.MicroRNA-21 gene and cancer[J]. Medical Oncology,2013,30(1):376. ( 2) 2)
|
| [14] | JAZBUTYTE V,THUM T.MicroRNA-21:from cancer to cardiovascular disease[J]. Current Drug Targets,2010,11(8):926-935. ( 2) 2)
|
| [15] | Stem-loop sequence hsa-miR-21[DB/OL].Mirbase[2014-5-20].http://www.mirbase.org/cgi-bin/mirna_entry.pl?acc=MI0000077. ( 1) 1)
|
| [16] | KUMARSWAMY R,VOLKMANN I,THUM T.Regulation and function of miRNA-21 in health and disease[J]. RNA Biology,2011,8(5):706-713. ( 1) 1)
|
| [17] | CAI X Z,HAGEDORN C H,CULLEN B R.Human microRNAs are processed from capped,polyadenylated transcripts that can also function as mRNAs[J]. RNA,2004,10(12):1957-1966. ( 2) 2)
|
| [18] | LÖFFLER D,BROCKE-HEIDRICH K,PFEIFER G,et al.Interleukin-6 dependent survival of multiple myeloma cells involves the Stat3-mediated induction of microRNA-21 through a highly conserved enhancer[J]. Blood,2007,110(4):1330-1333. ( 2) 2)
|
| [19] | FUJITA S,ITO T,MIZUTANI T,et al.miR-21 gene expression triggered by AP-1 is sustained through a double-negative feedback mechanism[J]. Journal of Molecular Biology,2008,378(3):492-504. ( 2) 2)
|
| [20] | KRICHEVSKY A M,GABRIELY G.miR-21:a small multi-faceted RNA[J]. Journal of Cellular and Molecular Medicine,2009,13(1):39-53. ( 1) 1)
|
| [21] | WICKRAMASINGHE N S,MANAVALAN T T,DOUGHERTY S M,et al.Estradiol downregulates miR-21 expression and increases miR-21 target gene expression in MCF-7 breast cancer cells[J]. Nucleic Acids Research,2009,37(8):2584-2595. ( 1) 1)
|
| [22] | RIBAS J,NI X H,HAFFNER M,et al.miR-21:An androgen receptor-regulated microRNA that promotes hormone-dependent and hormone-independent prostate cancer growth[J]. Cancer Research,2009,69(18):7165-7169. ( 1) 1)
|
| [23] | RIBAS J,LUPOLD S E.The transcriptional regulation of miR-21,its multiple transcripts and their implication in prostate cancer[J]. Cell Cycle,2010,9(5):923-929. ( 1) 1)
|
| [24] | CHIOSEA S,JELEZCOVA E,CHANDRAN U,et al.Up-regulation of dicer,a component of the MicroRNA machinery,in prostate adenocarcinoma[J]. The American Journal of Pathology,2006,169(5):1812-1820. ( 1) 1)
|
| [25] | AMBS S,PRUEITT R L,YI M,et al.Genomic profiling of microRNA and messenger RNA reveals deregulated microRNA expression in prostate cancer[J]. Cancer Research,2008,68(15):6162-6170. ( 1) 1)
|
| [26] | WANG Z G.MicroRNA:a matter of life or death[J]. World Journal of Biological Chemistry,2010,1(4):41-54. ( 1) 1)
|
| [27] | CHAN J A,KRICHEVSKY A M,KOSIK K S.MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells[J]. Cancer Research,2005,65(14):6029-6033. ( 1) 1)
|
| [28] | CORSTEN M F,MIRANDA R,KASMIEH R,et al.MicroRNA-21 knockdown disrupts glioma growth in vivo and displays synergistic cytotoxicity with neural precursor cell-delivered S-TRAIL in human gliomas[J]. Cancer Research,2007,67(19):8994-9000. ( 1) 1)
|
| [29] | CHEN Y,LIU W,CHAO T F,et al.MicroRNA-21 down-regulates the expression of tumor suppressor PDCD4 in human glioblastoma cell T98G[J]. Cancer Letters,2008,272(2):197-205. ( 2) 2)
|
| [30] | PAPAGIANNAKOPOULOS T,SHAPIRO A,KOSIK K S.MicroRNA-21 targets a network of key tumor-suppressive pathways in glioblastoma cells[J]. Cancer Research,2008,68(19):8164-8172. ( 1) 1)
|
| [31] | SI M L,ZHU S,WU H,et al.miR-21-mediated tumor growth[J]. Oncogene,2007,26(19):2799-2803. ( 1) 1)
|
| [32] | YIN C,WANG X Y,KUKREJA R C.Endogenous microRNAs induced by heat-shock reduce myocardial infarction following ischemia-reperfusion in mice[J]. FEBS Letters,2008,582(30):4137-4142. ( 1) 1)
|
| [33] | CHENG Y H,LIU X J,ZHANG S,et al.MicroRNA-21 protects against the H2O2-induced injury on cardiac myocytes via its target gene PDCD4[J]. Journal of Molecular and Cellular Cardiology,2009,47(1):5-14. ( 1) 1)
|
| [34] | JI R,CHENG Y,YUE J,et al.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation[J]. Circulation Research,2007,100(11):1579-1588. ( 1) 1)
|
| [35] | 赵艳丽,姜怀志,张世伟,等.辽宁绒山羊皮肤毛囊细胞凋亡特点的研究[J]. 中国畜牧兽医,2011,38(8):35-38. ( 1) 1)
|
| [36] | 黄小丹,孙斌,李广兴.兔乳腺上皮细胞凋亡与泌乳量的相关性研究[J]. 繁殖生理,2012,48(11):28-30. ( 1) 1)
|
| [37] | 李惠侠,王振云,张震,等.高温条件下miRNA-24对奶牛乳腺上皮细胞增殖与凋亡的影响[J]. 中国农业科学,2010,43(22):4732-4738. ( 1) 1)
|
| [38] | 于太永,庞卫军,吴江维,等.TNF-α通过ERK和MAPK信号途径抑制猪骨骼肌成肌细胞分化[J]. 动物学报,2007,53(5):877-883. ( 1) 1)
|
| [39] | 刘忠华,刘海兰,岳奎忠,等.性未成熟小母猪注射PMSG对卵泡闭锁及颗粒细胞凋亡的影响[J]. 中国兽医学报,2002,7,22(4):384-386. ( 1) 1)
|




