随着人们生活水平的提高和健康意识的加强,对牛奶质量的要求也越来越高,而乳蛋白的含量是衡量牛奶品质的重要指标。乳成分前体物(MCP)的含量和组成直接影响乳腺内乳蛋白等乳成分的合成,进而影响乳品质。因此,深入研究乳成分前体物对改善牛奶品质具有重要意义。以往的研究多数集中在乳脂前体物(MFP)对乳脂肪合成的影响方面,对乳蛋白影响的系统研究报道极少。然而,许多研究发现MFP不仅对乳脂肪的合成有影响,也会对乳蛋白和乳糖的合成产生影响[1, 2]。一些体外研究资料也报道,单一MFP如乙酸、油酸、硬脂酸和棕榈酸等不仅对奶牛乳腺内乳脂合成有显著影响,而且也影响乳蛋白合成相关基因的表达,但研究结果不尽一致[3, 4, 5, 6, 7],影响机理也尚不清楚。β-羟丁酸(BHBA)是奶牛乳腺内脂肪酸从头合成的前体物,主要由瘤胃上皮细胞吸收的丁酸转化而来,但目前关于BHBA影响乳成分的研究报道很少。孔庆洋等[8]的研究结果表明,不同浓度的丁酸钠(0~1.25 mmol/L)可显著增加奶牛乳腺上皮细胞(BMEC)胞外甘油三酯(TAG)的合成,同时上调脂肪酸合成酶(FASN)和乙酰辅酶A羧化酶α(ACACA)的基因表达;但对乳蛋白合成方面的影响研究尚未见资料报道,值得进一步探讨。哺乳动物雷帕霉素靶点(mTOR)是一种丝氨酸/苏氨酸蛋白激酶,由2种不同的多蛋白复合体mTORC1和mTORC2组成[9],在调节乳蛋白合成方面起重要作用[10]。信号转导和转录激活因子5(STAT5)属于信号转导和转录激活因子家族,是乳腺中负责催乳素信号转导的主要转录因子,其信号转导通路可以被许多细胞因子、生长因子和激素激活[11],并在潜在的调节乳蛋白合成方面起重要作用。瘦素(leptin)是一种由白脂肪组织分泌的一种蛋白质激素,在调节奶牛能量代谢和乳腺中乳的合成方面起重要作用,在催乳素存在的条件下,leptin可促进奶牛乳腺中乳脂肪酸的合成,以及上调α-酪蛋白和β-乳球蛋白的基因表达量[12]。鉴于此,本试验以BMEC为模型,研究不同浓度的BHBA对乳蛋白合成相关基因表达量的影响,探讨其对乳蛋白合成影响的机理;为深入研究MFP对乳蛋白合成的调节作用奠定基础,也为MFP理想模式的建立提供依据。
1 材料与方法1.1 试验材料
DMEM/F12培养液、胎牛血清(FBS)、胰岛素转铁蛋白溶液、胶原酶Ⅱ、胰蛋白酶/乙二胺四乙酸(EDTA)和双抗均购自美国Gibco公司。氢化可的松、表皮生长因子、催乳素和β-羟丁酸钠均购自美国Sigma公司。噻唑蓝(MTT)和两性霉素均购自美国Amresco公司。其他主要试剂:磷酸盐缓冲液(PBS,美国HyClone公司)、无脂肪酸牛血清白蛋白(BSA,美国Equitech-Bio公司)、RNAprep pure Cell/Bacteria Kit[天根生化科技(北京)有限公司],PrimeScript RT Master Mix(日本TaKaRa公司)和SYBR Premix Ex TaqTM Ⅱ(日本TaKaRa公司)。
BMEC采用胶原酶消化法获得。取健康荷斯坦奶牛乳腺组织,分离去除组织外层于深处取约1 cm3的组织块若干,放入预冷的PBS中。在超净台中用PBS将组织块洗净后,再剪去组织块表层并将组织块剪成糊状。加入0.5%胶原酶Ⅱ溶液于37 ℃和5% CO2条件下消化1 h,每隔20 min轻轻摇晃离心管。消化液用孔径80目的细胞滤网过滤,收集细胞滤液,1 500 r/min离心5 min,弃上清。加入培养液,吹打均匀,转入25 cm2培养瓶中,于37 ℃和5% CO2培养箱中培养。每日观察细胞的生长情况。待细胞生长至80%~90%融合度时,根据BMEC与成纤维细胞对胰蛋白酶消化敏感性不同,纯化BMEC并进行传代。本试验采用第3代传代细胞进行研究,细胞经荧光免疫细胞染色法鉴定,为BMEC[13]。将传至第3代的BMEC,用含10% FBS的DMEM/F12培养液制成细胞悬液,按照测试指标的要求调整细胞密度接种于细胞培养板上,置于37 ℃、5% CO2培养箱培养48 h。
1.2 试验设计采用单因子完全随机试验设计,将培养48 h的BMEC随机分为6组,每组采用含不同浓度BHBA的DMEM/F12培养液,培养液中的FBS用1 g/L无脂肪酸BSA代替,并使反应体系中BHBA(以β-羟丁酸钠的形式进行添加)的最终浓度分别为0、0.58、1.16、2.32、4.64和9.28 mmol/L,其中0 mmol/L为对照组,其余为试验组,每组6个重复,每个重复1个孔,将细胞培养板置于37 ℃、5% CO2培养箱中继续培养48 h。
1.3 测试指标与方法乳蛋白合成的相关基因αs1-酪蛋白(CSN1S1)、STAT5、mTOR和leptin基因的表达量采用SYBR Green实时荧光定量PCR法进行检测。
收集第3代的BMEC,用含10% FBS的DMEM/F12培养液悬浮细胞,将细胞悬浮液以2×105个/孔接种于6孔培养板,培养48 h后,将培养液换为含不同浓度BHBA的DMEM/F12诱导培养液,继续培养48 h;培养结束后,弃掉上清液,用PBS漂洗2次,加入0.25%胰蛋白酶500 μL消化10 min,然后加入终止培养液终止消化,离心,弃上清,提取总RNA。细胞总RNA的提取完全按照试剂盒说明进行。总RNA的纯度用2.0%琼脂糖凝胶电泳进行检测,完整性用全自动酶标仪测定。
反转录采用PrimeScript RT Master Mix试剂盒,反应体系为10 μL(400 ng总RNA),具体操作完全按照说明书进行。总RNA反转录后cDNA作为模板用SYBR Premix Ex TaqTM Ⅱ试剂盒进行实时荧光定量PCR,反应体系为20 μL。
选用管家基因磷酸甘油醛脱氢酶(GAPDH)作为内参基因。引物序列及参数见表1。实时荧光定量PCR的反应程序为:95.0 ℃预变性30 s;95.0 ℃变性30 s,退火温度下退火30 s,72.0 ℃延伸20 s,40个循环;72 ℃延伸7 min。熔解曲线程序为:70~95 ℃,每6 s温度升高0.5 ℃,共51个循环。PCR产物用2.0%琼脂糖凝胶电泳进行检测,采用2-△△Ct法进行相对定量数据分析。
| 表1 引物序列及参数 Table 1 Sequences and parameters of primer |
试验数据采用SAS 9.0软件的回归统计程序进行一次线性和二次曲线回归分析,P<0.05表示回归关系显著,0.05<P<0.10表示回归关系趋于显著。
2 结 果 2.1 细胞总RNA的检测提取的总RNA在全自动酶标仪上测定260 nm的吸光度值(A260)和280 nm的吸光度值(A280),并计算A260/A280。结果显示,总RNA A260/A280都分布在1.8~2.0范围内,符合总RNA提取的纯度要求。总RNA经2.0%琼脂糖凝胶电泳进行完整性检测,结果显示总RNA分子保持完整,可分辨出28S、18S和5S条带(图1)。
2.2 PCR产物电泳检测PCR产物用2.0%琼脂糖凝胶电泳进行检测,结果显示,PCR产物片段与设计扩增片段大小一致(图2),可用于相对定量数据分析。
2.3 BMEC内乳蛋白合成相关基因的表达量由表2可知,所有试验组的CSN1S1基因表达量均高于对照组,其中以2.32~9.28 mmol/L组较高,尤以4.64 mmol/L BHBA组最高。回归统计结果表明,随着BHBA浓度的增加,CSN1S1基因表达量呈显著的一元二次曲线增加(R2=0.931 6,P=0.018);leptin基因表达量呈一定的一次线性降低趋势(R2=0.482 5,P=0.126),从数值上看,以0.58 mmol/L BHBA组最高。STAT5和mTOR基因表达量随BHBA浓度增加的变化趋势经检验回归关系不显著(P=0.459,P=0.398)。
 | 图1 总RNA电泳检测
Fig. 1 Electrophoresis detection of total RNA |
3 讨 论
牛乳蛋白中,约80%为酪蛋白,其中CSN1S1和β-酪蛋白是主要的组成成分,含量约占酪蛋白总量的70%(其中CSN1S1约为36%,β-酪蛋白约为34%)[16],因此,CSN1S1是乳蛋白中比例最高的蛋白质,其基因表达量和蛋白质的合成水平与乳蛋白的品质密切相关。本试验发现,外源补加0~9.28 mmol/L BHBA,BMEC内CSN1S1基因表达量随着BHBA浓度的增加呈显著的一元二次增加,尤以2.32~9.28 mmol/L BHBA组CSN1S1基因表达量较高,分别比对照组高45.58、67.40和52.08倍。这些结果提示,BHBA的添加对乳蛋白中的主要酪蛋白CSN1S1的合成可能有促进作用。然而,本试验只对CSN1S1的基因表达水平进行了初步研究,对其蛋白质合成及其他酪蛋白基因表达和蛋白质合成均没有进行深入研究,值得进一步探讨。
mTOR是一种丝氨酸/苏氨酸蛋白激酶,由2种不同的多蛋白复合体mTORC1和mTORC2组成[9];STAT5属于信号转导和转录激活因子家族,是乳腺中负责催乳素信号的主要转录因子,其信号转导通路可以被许多细胞因子、生长因子和激素激活[11];二者在调节乳蛋白合成方面起重要作 用。但本试验研究表明,BHBA的添加对STAT5 和mTOR的基因表达均没有显著的影响,提示BHBA的添加对乳蛋白合成的调节作用可能与其他因素有关。
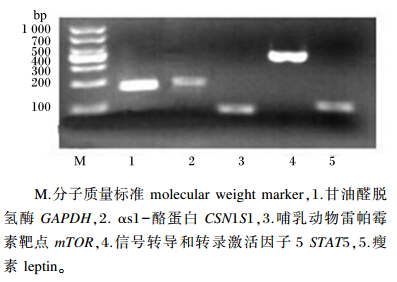 | 图2 BMEC内乳蛋白合成相关基因PCR产物电泳结果 Fig. 2 Electrophoresis results of PCR products of genes involved in protein synthesis in BMECs |
| 表2 BHBA对BMEC内乳蛋白相关基因表达量的影响 Table 2 Effects of BHBA on expressions of genes involved in milk protein synthesis in BMECs |
leptin是一种由白脂肪组织分泌的一种蛋白激素,在调节奶牛能量代谢和乳腺中乳的合成方面起重要作用,在催乳素存在的条件下,leptin可促进奶牛乳腺中乳脂肪酸的合成,以及上调α-酪蛋白和β-乳球蛋白的基因表达量[12]。leptin基因的表达和蛋白质分泌受激素和脂肪酸等多种因素的影响[17]。leptin基因在反刍动物的胎盘和胎儿组织、乳腺、胃和骨骼肌中表达[18]。Yonezawa等[19]在BMEC培养液中添加10 mmol/L乙酸或丁酸,显著下调了leptin基因表达量。Soliman等[20]利用牛脂肪细胞为材料进行的体外研究结果表明,添加0.1或0.5 mmol/L的乙酸、丙酸和丁酸均上调了leptin基因表达量。然而,用人的脂肪细胞的研究结果发现,添加生理浓度范围(0.5或1 mmol/L)的丁酸促进了leptin基因表达,高浓度(5 mmol/L)则抑制了leptin基因的表达。本试验发现,BMEC培养液中BHBA浓度与leptin的基因表达间的回归关系尽管没有达到显著水平,但也表现出一定的浓度依赖关系,即低浓度促进leptin的基因表达,高浓度则抑制。关于BHBA对leptin转录水平的调节机理尚不清楚。Soliman等[20]研究指出,丁酸对leptin转录水平的调节可能通过2个方面来完成,一是通过短链脂肪酸(SCFA)特有的G蛋白偶联受体,二是通过丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇-3-激酶(PI3K)信号途径。Xiong等[21]利用体内外试验相结合的方式,以鼠脂肪细胞和鼠作为试验模型,研究结果提示SCFA可作为一种信号分子通过G蛋白偶联受体41(G protein-coupled receptor 41,GPR41)调节脂肪细胞中leptin的量。GPR41和G蛋白偶联受体43(G protein-coupled receptor 43,GPR43)是G蛋白偶联受体超家族的成员,而GPR41主要在脂肪组织中表达[22]。在BMEC中,BHBA对leptin基因转录水平的调节作用是否通过GPR41,还有待于进一步的研究。本试验结果也提示,丁酸对乳蛋白合成相关基因表达的影响可能与其对leptin基因转录水平的调节作用有关。
从乳蛋白合成基因的表达量角度考虑,BHBA的添加上调了CSN1S1基因的表达,对乳蛋白的合成可能有促进作用,以2.32~9.28 mmol/L的促进效果较好,但其影响机制需要进一步探讨。此外,从系统营养学观点考虑,当强调某一种营养素的功能和作用时,一定要求与其他营养素协调配合,也就是各营养素相互平衡问题。本试验只研究了单一MFP BHBA对BMEC内乳蛋白合成相关基因表达的影响。有研究结果表明,MFP的组成与配比可能存在理想平衡模式[23, 24, 25]。如Kadegowda等[23]的研究表明,MFP含有与乳汁中相同的脂肪酸成分,可以为乳脂的合成提供理想的前体物,即乳脂的合成在MFP的组成与配比方面可能存在理想平衡模式。但目前尚未见到系统资料报道,需要进一步试验研究。
4 结 论BHBA的浓度为2.32~9.28 mmol/L可上调CSN1S1基因的表达,尤以BHBA浓度为4.64 mmol/L时对BMEC内乳蛋白合成的促进效果最好。
| [1] | JENKINS T C,MCGUIRE M A.Major advances in nutrition:impact on milk composition[J]. Journal of Dairy Science,2006,89(4):1302-1310. ( 1) 1)
|
| [2] | CANT J P,DEPETERS E J,BALDWIN R L.Effect of dietary fat and postruminal casein administration on milk composition of lactating dairy cows[J]. Journal of Dairy Science,1991,74(1):211-219. ( 1) 1)
|
| [3] | YONEZAWA T,YONEKURA S,KOBAYASHI Y,et al.Effects of long-chain fatty acids on cytosolic triacylglycerol accumulation and lipid droplet formation in primary cultured bovine mammary epithelial cells[J]. Journal of Dairy Science,2004,87(8):2527-2534. ( 1) 1)
|
| [4] | WEISBJERG M R,WIKING L,KRISTENSEN N B,et al.Effects of supplemental dietary fatty acids on milk yield and fatty acid composition in high and medium yielding cows[J]. The Journal of Dairy Research,2008,75(2):142-152. ( 1) 1)
|
| [5] | MAXIN G,GLASSER F,HURTAUD C,et al.Combined effects of trans-10,cis-12 conjugated linoleic acid,propionate,and acetate on milk fat yield and composition in dairy cows[J]. Journal of Dairy Science,2011,94(4):2051-2059. ( 1) 1)
|
| [6] | 齐利枝,生冉,闫素梅,等.乙酸浓度对奶牛乳腺上皮细胞甘油三酯含量及瘦素和过氧化物酶增殖物激活受体γ基因表达量的影响[J]. 动物营养学报,2013,25(7):1519-1525. ( 1) 1)
|
| [7] | QI L Z,YAN S M,SHENG R,et al.Effects of saturated long-chain fatty acid on Mrna expression of genes associated with milk fat and protein biosynthesis in bovine mammary epithelial cells[J]. Asian-Australasian Journal of Animal Sciences, 2014,27(3):414-421. ( 1) 1)
|
| [8] | 孔庆洋,林叶,李庆章.乙酸钠和丁酸钠对奶牛乳腺脂肪酸合成相关基因的影响[J]. 中国乳品工业,2012,40(3):15-17. ( 1) 1)
|
| [9] | LAPLANTE M,SABATINI D M.mTOR signaling at a glance[J]. Journal of Cell Science,2009,122(20):3589-3594. ( 2) 2)
|
| [10] | BURGOS S A,DAI M,CANT J P.Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J]. Journal of Dairy Science,2010,93(1):153-161. ( 1) 1)
|
| [11] | HENNIGHAUSEN L.Molecular mechanisms of hormone controlled gene expression in the breast[J]. Molecular Biology Reports,1997,24(3):169-174. ( 2) 2)
|
| [12] | 胡菡.中国荷斯坦奶牛乳腺上皮细胞体外培养体系的建立与应用[D]. 博士学位论文.兰州:甘肃农业大学,2010. ( 2) 2)
|
| [13] | HU H,WANG J Q,BU D P,et al.In vitro culture and characterization of a mammary epithelial cell line from Chinese Holstein dairy cow[J]. PLoS ONE,2009,4(11):e7636. ( 1) 1)
|
| [14] | ZHOU Y,AKERS R M,JIANG H.Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells[J]. Journal of Dairy Science,2008,91(1):100-108. ( 1) 1)
|
| [15] | FEUERMANN Y,MABJEESH S J,SHAMAY A.Leptin affects prolactin action on milk protein and fat synthesis in the bovine mammary gland[J]. Journal of Dairy Science,2004,87(9):2941-2946. ( 1) 1)
|
| [16] | 顾瑞霞.乳与乳制品的生理功能特性[M].北京:中国轻工业出版社,2001:1-5. ( 1) 1)
|
| [17] | SOLIMAN M M,AHMED M M,SALAH-ELDIN A,et al.Butyrate regulates leptin expression through different signaling pathways in adipocytes[J]. Journal of Veterinary Science,2011,12(4):319-323. ( 1) 1)
|
| [18] | CHILLIARD Y,DELAVAUD C,BONNET M.Leptin expression in ruminants:nutritional and physiological regulations in relation with energy metabolism[J]. Domestic Animal Endocrinology,2005,29(1):3-22. ( 1) 1)
|
| [19] | YONEZAWA T,YONEKURA S,SANOSAKA M,et al.Octanoate stimulates cytosolic triacylglycerol accumulation and CD36 mRNA expression but inhibits acetyl coenzyme A carboxylase activity in primary cultured bovine mammary epithelial cells[J]. The Journal of Dairy Research,2004,71(4):398-404. ( 1) 1)
|
| [20] | SOLIMAN M,KIMURA K,AHMED M,et al.Inverse regulation of leptin mRNA expression by short- and long-chain fatty acids in cultured bovine adipocytes[J]. Domestic Animal Endocrinology,2007,33(4):400-409. ( 2) 2)
|
| [21] | XIONG Y M,MIYAMOTO N,SHIBATA K,et al.Short-chain fatty acids stimulate leptin production in adipocytes through the G protein-coupled receptor GPR41[J]. Proceedings of National Academy of Sciences of United States of America,2004,101(4):1045-1050. ( 1) 1)
|
| [22] | BROWN A J,GOLDSWORTHY S M,BARNES A A,et al.The orphan g protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids[J]. The Journal of Biological Chemistry,2003,278(13):11312-11319. ( 1) 1)
|
| [23] | KADEGOWDA A K G,PIPEROVA L S,DELMONTE P,et al.Abomasal infusion of butterfat increases milk fat in lactating dairy cows[J]. Journal of Dairy Science,2008,91(6):2370-2379. ( 1) 1)
|
| [24] | 齐利枝,闫素梅,生冉,等.奶牛乳腺中乳成分前体物对乳成分合成影响的研究进展[J]. 动物营养学报,2011,23(12):2077-2083. ( 1) 1)
|
| [25] | 孙满吉,卢德勋,王丽芳,等.基础日粮下关中奶山羊乳腺对营养物质摄取和利用的研究[J]. 动物营养学报,2009,21(6):859-864. ( 1) 1)
|




