2. 中国科学院亚热带农业生态研究所, 湖南省畜禽健康养殖工程技术中心, 农业部中南动物营养与饲料科学观测实验站, 长沙 410125
2. Key Laboratory for Agro-Ecological Processes in Subtropical Region, Hunan Engineering and Research Center of Animal/Poultry Science, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
多胺是一类含有2个或更多氨基的低分子质量脂肪族化合物,包括腐胺、亚精胺和精胺等。这类晶体物质最初是由Leeuwenhoek于1678年在人的非新鲜精液中发现的,后被命名为多胺。起初,研究人员从霍乱弧菌中分离得到腐胺;1924年,Rosenheim等才鉴定出了精胺的化学结构,并在实验室中成功合成。作为有机阳离子,多胺在调控基因表达、DNA和蛋白质合成、细胞信号转导、离子通道开合、细胞增殖分化、血管生成、胎盘生长和胚胎发育等方面起着重要作用。同时,多胺能够清除机体内的活性氧,从而保护DNA、蛋白质和脂质等免受氧化损伤。近年来的研究表明,多胺在调控器官发育、繁殖、衰老、免疫、癌症等生理和病理过程中均具有重要作用[1]。本文从早期胚胎发育、胚胎着床、胎盘形成及着床后胚胎发育等方面,对多胺在哺乳动物孕体发育过程中的调控作用进行综述,为研究多胺的作用机制以及提高哺乳动物繁殖性能提供参考。 1 多胺的来源
多胺广泛存在于真核生物和原核生物体内(甲烷杆菌目和嗜盐菌目2种古生菌除外)。哺乳动物体内的多胺不仅可以从母乳和饲粮中获取[2],也可以由体内的精氨酸、蛋氨酸、脯氨酸和谷氨酸等氨基酸通过代谢途径合成[3]。除此之外,动物的肠细胞以及肠道微生物也能通过对氨基酸前体物的代谢作用产生多胺。多胺之间在机体内也可以相互转化。 2 多胺的合成与分解
动物体内不断发生着多胺的合成代谢与分解代谢(图1),并维持着其在体内的动态平衡[3]。多胺的生物合成起始于腐胺的产生,其前体物鸟氨酸在鸟氨酸脱羧酶(ornithine decarboxylase,ODC)作用下生成腐胺。腐胺是脂肪族二元胺,同时也是合成亚精胺和精胺的前体。腐胺在亚精胺合成酶的催化下与丙胺基作用合成亚精胺,亚精胺则在亚精胺合成酶的催化下与丙胺基作用合成精胺。在这一系列反应中,S-腺苷蛋氨酸在其脱羧酶(S-adenosylmethionine decarboxylase,SAMDC)作用下获得合成亚精胺和精胺所需的丙胺基。因此,ODC和SAMDC是多胺合成代谢中的关键代谢酶。除了合成代谢外,细胞内的多胺含量还与其分解代谢有关。精胺和亚精胺在其乙酰转移酶(spermidine/spermine acetyltransferase,SSAT)和多胺氧化酶(polyamine oxidases,PAO)作用下,可以逐步分解为腐胺,从而维持细胞内正常的多胺含量。近期的研究表明,敲除羊胚胎滋 养层细胞中的鸟氨酸脱羧酶1(Odc1)基因,虽然 可以抑制腐胺的合成,细胞却通过另一条合成多胺的信号通路,即精氨酸脱羧酶(arginine decarboxylase,ADC)/胍丁胺酶(agmatinase,AGMAT)信号通路(精氨酸、胍丁胺、腐胺途径),来维持体内多胺的平衡,由此说明ADC/AGMAT信号通路对维持哺乳动物孕体正常发育同样是重要的[4]。
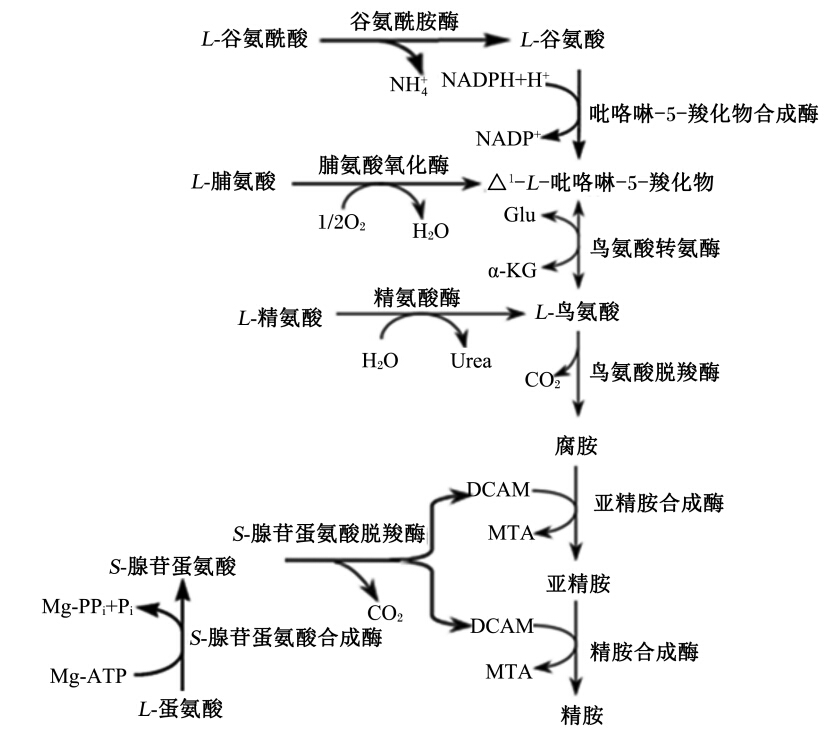 | NH4+:铵根;NADPH:还原性辅酶Ⅱ;H+:氢离子;NADP+:辅酶Ⅱ;O2:氧气;H2O:水;Glu:谷氨酸 glutamic acid;α-KG:α-酮戊二酸 α-ketoglutarate;Urea:尿素;CO2:二氧化碳;Mg-PPi:镁的焦磷酸盐;Pi:单磷酸根;Mg-ATP:镁-三磷酸腺苷;DCAM:脱羧5-腺苷蛋氨酸 decarboxylated 5-adenosylmethionine;MTA:甲硫腺苷 methylthioadenosine图1 多胺代谢途径
Fig. 1 The metabolic pathways of polyamines[3] |
3 多胺对孕体发育的影响 3.1 早期胚胎发育
体外研究表明,在猪的二细胞期孤雌激活胚胎的培养基中添加外源性多胺,能够增加其囊胚率以及囊胚期的细胞数,且囊胚期的细胞凋亡减少;定量PCR检测发现,细胞内Odc以及亚精胺合成酶mRNA表达量也升高。用抑制剂抑制这2种酶的活性,孤雌激活胚胎发育则出现了相反的现象,即囊胚率降低、细胞凋亡增加,说明多胺对于早期胚胎的发育十分重要[5]。研究表明,用多胺抑制剂甲基乙二醛-双(脒腙)[methylglyoxal-bis(guanylhydrazone),MGBG]处理八细胞期到桑椹胚期小鼠受精卵,抑制其中亚精胺和精胺的生物合成,可抑制体外胚胎生长以及DNA的合成。此外,用二氟甲基鸟氨酸(2-difluromethyl ornithine,DFMO)抑制腐胺生成,也会抑制细胞DNA的合成,从而影响胚胎的发育。8-羟基-2,7,10-三氨基癸酸(hypusine)是真核翻译起始因子5A(eukaryotic translation initiation factor 5A,eIF-5A)的特定赖氨酸残基经亚精胺依赖性的翻译后修饰形成的,经hypusine修饰后的eIF-5A是细胞存活与增殖的必需物质。在小鼠中,eIF-5A亚基的缺失会导致母鼠不孕,说明亚精胺和精胺在早期胚胎形成中发挥着重要作用[6]。 3.2 胚胎滞育
哺乳动物子宫内膜和孕体中多胺的生物合成受到转录、翻译和翻译后水平的调控,可促进孕体发育和着床[7]。胚胎滞育是指某些动物的受精卵发育成囊胚后,游离在子宫中抑制其进一步发育的一个时期。在此期间,胚胎只维持基本的代谢,细胞有丝分裂和蛋白质合成极少或不发生[8]。水貂是专性滞育动物,在对其再激活胚胎的研究中发现,多胺相关基因Odc1、精胺/亚精胺N1乙酰转移酶(spermidine/spermine N1-acetyltransferase,Sat1)的表达上调,子宫内多胺的含量也显著上升;经DFMO处理后,其胚胎活性被再次抑制,滋养层细胞增殖受阻,说明多胺是水貂囊胚从滞育期转化为激活期的重要调控物质[9]。 3.3 胚胎着床
对于真兽类哺乳动物而言,胚胎着床后形成胎盘,胎儿在子宫中发育,并依靠胎盘从母体获得营养物质,建立起母体与胎儿之间的联系,为胎儿的正常发育提供可靠保障。排卵后,在孕激素的调控下,子宫内膜进行蜕膜化,主要表现为子宫内膜间质细胞(endometrial stromal cells,ESCs)的增殖分化,逐渐转化为蜕膜基质细胞(decidual stromal cells,DSCs)。随着胚胎着床与滋养层细胞的侵入,蜕膜化现象扩展至整个子宫内膜。蜕膜化程度对胚胎着床、胎盘形成以及维持正常妊娠发挥着重要的调控作用[10]。根据有无蜕膜现象,可将胎盘分为蜕膜型胎盘和非蜕膜型胎盘。研究表明,多胺功能在多种胎盘类型孕体中均有体现,并在从着床到胎盘形成的过程中起到积极作用[11]。
就蜕膜型胚胎而言,子宫内膜的增殖伴随着基质细胞的分化,最终形成蜕膜组织。对多种动物的研究均表明,在胚胎着床期,孕体子宫内ODC1和SAMDC的活性均增强,其着床位点处的ODC1和多胺活性均显著增强[11]。此外,多胺合成相关基因在小鼠子宫内膜基质细胞中表达均上调,在着床位点的上调现象更为显著。早期的研究表明,在大鼠子宫内膜分化过程中,其细胞内ODC1活性显著升高;用高剂量的DFMO处理着床期母鼠,会影响其正常蜕膜化,最终导致母鼠不孕。在小鼠饮水中加入DFMO,抑制ODC1活性,妊娠后第5~8天胚胎发育受到阻碍,妊娠后第18天发生流产。上述研究结果,均可以说明多胺对胚胎着床的重要性[12]。
有报道指出,母猪子宫液中多胺含量在妊娠第12天时达到最高。在此期间,Sat1基因在妊娠母猪子宫内膜中的表达上调。给体外培养的猪子宫腺上皮和基质细胞添加外源性腐胺和亚精胺,能够促进细胞DNA的合成。当胎盘发育到最大时,猪尿囊液中多胺产物以及鸟氨酸大量聚集,从而说明胎盘、胎儿发育过程中需要大量的多胺[13]。除此之外,在母羊滋养层细胞附着之前,Odc1基因表达及蛋白含量升高,为滋养层细胞附着做准备[14]。 3.4 胎盘形成
Lopez-Garcia等[15]的研究表明,ODC活性及其蛋白在胎盘中的表达量高于其在胎儿和卵黄囊中的表达量,特别是在胎盘迷路层中其表达量最高。尽管胎儿中多胺生物合成活性低于胎盘,但是胎儿中的多胺含量明显高于其在胎盘中的含量,说明小鼠胎盘中的多胺生物合成活性增强为妊娠后期胎儿对多胺的需要提供了有利保障。
作为哺乳动物发育过程中分化的第1类细胞,滋养层细胞可调控胚胎着床和胎盘形成。研究表明,多胺能够促进滋养外胚层细胞的增殖和迁移,是羊和猪孕体生长发育的重要调控物质[16]。同时,多胺也是大鼠胎盘发育和血管生成的重要物质[17]。ODC1活性以及多胺前体物鸟氨酸的含量在妊娠第20~40天之间也显著上升。在此期间,滋养外胚层细胞附着到子宫腔上皮,这也恰好是胎盘形成的时期。精氨酸通过合成多胺与一氧化氮(NO)激活细胞内哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/FK506结合蛋白12-雷帕霉素相关蛋白1(FK506 binding protein 12-rapamycin associated protein 1,FRAP1)-核糖体蛋白S6激酶(ribosomal protein S6 kinase,RPS6K)-核糖体蛋白S6(ribosomal protein S6,RPS6)信号通路,增加磷酸化的mTOR、RPS6K和真核翻译起始因子4E-结合蛋白1(eukaryotic translation initiation factor 4E-binding protein 1,eIF4E-BP1)含量,促进蛋白质合成,减少蛋白质降解,从而促进羊滋养层细胞的增殖和迁移。有研究表明,腐胺能促进羊滋养层细胞增殖升高6.7倍[18]。子宫胎盘血流量的多少依赖于胎盘血管的生成[19],而多胺具有促进血管生成的功能,这足以说明多胺在胎盘发育中的重要性。大鼠上的研究发现,在其妊娠第8天抑制ODC生成,将导致卵黄囊结构改变和滋养层细胞分化异常,从而影响血管生成和类固醇激素产生[20]。 3.5 着床后胚胎发育
研究发现,Odc或SAMDC基因缺失抑制亚精胺合成,是小鼠胚胎在发育早期的致死因子[21]。多胺对胎儿发育的影响主要表现为胎儿宫内发育迟缓。研究表明,在怀孕小鼠妊娠第18天降低其体内ODC1活性,可导致胎儿体重减轻[22]。同时,胎盘大小也会受到多胺含量的影响,从而影响胎儿的正常发育。抑制多胺合成会减小胎盘重量,损害胎儿生长[23]。昔多芬能够增加羊水、尿囊液中氨基酸和多胺含量,增加胎儿体重及血流量,将营养物质从母体运送至胎儿,从而促进胎儿的生长发育[24]。在母羊中,胎儿自身多胺合成以及母体胎盘将多胺转运至胎儿,是维持胎儿体内多胺平衡的重要因素[25]。营养缺乏母羊妊娠中后期,母体、胎儿血浆和胎液中的多胺含量均降低,说明多胺与胎儿正常发育有关[26]。羊胎盘和子宫内膜组织中,精氨酸大量转化为多胺,是母羊孕体内鸟氨酸的主要来源。在母羊妊娠第30~60天阶段,胎盘的生长发育最快,多胺对胎盘血管生成和生长均起着重要作用。妊娠第40天的母羊子宫内膜和胎盘节中多胺合成及其含量达到最高,此时胎儿生长和形态学变化也最大。另外,高含量的多胺还出现在胎盘和子宫内膜,在妊娠的后半期,胎盘血管床发育,子宫内血流量增加,从而支持胎儿的生长[27]。
早期的研究表明,多胺能够保护神经细胞免受神经外伤造成的细胞死亡[28]。此外,多胺在神经管的发育过程中也起到重要作用[29]。在近期的研究中,研究人员用酒精处理小鼠胚胎,使其体内多胺含量降低,从而改变机体DNA、RNA和蛋白质的合成,导致发育紊乱以及神经嵴细胞的迁移。此外,大脑微血管网络的缺乏可能是造成宫内发育迟缓的部分原因。尽管通过母体循环可以适当补充胎儿缺失的多胺,但外源性的多胺却无法到达胎儿的末梢组织,特别是胎儿的头部,从而导致其脑部多胺缺乏。间隙连接畸变以及微血管网络的急剧减少,也会进一步损伤胎儿组织的营养供给,造成胎儿的发育异常[30]。
Wu等[31]的研究发现,宫内生长迟缓(intrauterine growth retardation,IUGR)胎儿肌肉中多胺含量低于正常胎儿。谷氨酰胺也能促进鸟氨酸转化为多胺,将精氨酸与谷氨酰胺同时加到妊娠30~114 d母猪的饲粮中,发现其产活仔率、窝总重和初生活仔猪重均增加,且仔猪个体间的差异降低。 4 小 结
综上所述,多胺通过调控基因表达、DNA与蛋白质合成、细胞信号转导、细胞增殖分化、血管生成等途径影响孕体发育,并在哺乳动物早期胚胎发育、胚胎着床、胎盘形成及着床后胚胎发育等一系列过程中起着重要作用,但多胺调控孕体发育的具体分子机制尚未明确,还需要进一步深入研究。另外,尚存在许多问题有待解决,比如多胺与其他调控因子之间的相互作用是拮抗还是协同?多胺不同前体氨基酸之间在特定靶组织中的转化关系及其对不同物种的影响是否一致?通过阐明多胺调控孕体发育的机制,将为提高哺乳动物繁殖性能、促进畜牧业生产提供有利保障。
| [1] | 易星,莫远亮,姜冬梅,等.多胺的生物学功能及其调控机制[J]. 动物营养学报,2014,26(2):348-352. ( 1) 1)
|
| [2] | LARQUÉ E,SABATER-MOLINA M,ZAMORA S.Biological significance of dietary polyamines[J]. Nutrition,2007,23(1):87-95. ( 1) 1)
|
| [3] | WU G,FLYNN N E,KNABE D A.Enhanced intestinal synthesis of polyamines from proline in cortisol-treated piglets[J]. American Journal of Physiology:Endocrinology and Metabolism,2000,279(2):E395-E402. ( 3) 3)
|
| [4] | WANG X Q,YING W,DUNLAP K A,et al.Arginine decarboxylase and agmatinase:an alternative pathway for de novo biosynthesis of polyamines for development of mammalian conceptuses[J]. Biology of Reproduction,2014,90(4):84. ( 1) 1)
|
| [5] | CUI X S,KIM N H.Polyamines inhibit apoptosis in porcine parthenotes developing in vitro[J]. Molecular Reproduction and Development,2005,70(4):471-477. ( 1) 1)
|
| [6] | PARK M H,NISHIMURA K,ZANELLI C F,et al.Functional significance of eIF5A and its hypusine modification in eukaryotes[J]. Amino Acids,2010,38(2):491-500. ( 1) 1)
|
| [7] | BAZER F W,WU G Y,SPENCER T E,et al.Novel pathways for implantation and establishment and maintenance of pregnancy in mammals[J]. Molecular Human Reproduction,2010,16(3):135-152. ( 1) 1)
|
| [8] | DESMARAIS J A,BORDIGNON V,LOPES F L,et al.The escape of the mink embryo from obligate diapause[J]. Biology of Reproduction,2004,70(3):662-670. ( 1) 1)
|
| [9] | LEFÈVRE P L C,PALIN M F,CHEN G,et al.Polyamines are implicated in the emergence of the embryo from obligate diapause[J]. Endocrinology,2011,152(4):1627-1639. ( 1) 1)
|
| [10] | RAMATHAL C Y,BAGCHI I C,TAYLOR R N,et al.Endometrial decidualization:of mice and men[J]. Seminars in Reproductive Medicine,2010,28(1):17-26. ( 1) 1)
|
| [11] | LEFÈVRE P L C,PALIN M F,MURPHY B D.Polyamines on the reproductive landscape[J]. Endocrine Reviews,2011,32(5):694-712. ( 2) 2)
|
| [12] | ZHAO Y C,CHI Y J,YU Y S,et al.Polyamines are essential in embryo implantation:expression and function of polyamine-related genes in mouse uterus during peri-implantation period[J]. Endocrinology,2008,149(5):2325-2332. ( 1) 1)
|
| [13] | RODRIGUEZ-SALLABERRY C,SIMMEN F A,SIMMEN R C.Polyamine- and insulin- like growth factor-Ⅰ-mediated proliferation of porcine uterine endometrial cells:a potential role for spermidine/spermine N1-acetyltransferase during peri-implantation[J]. Biology of Reproduction,2001,65(2):587-594. ( 1) 1)
|
| [14] | GAO H J,WU G,SPENCER T E,et al.Select nutrients in the ovine uterine lumen.Ⅴ.Nitric oxide synthase,GTP cyclohydrolase,and ornithine decarboxylase in ovine uteri and peri-implantation conceptuses[J]. Biology of Reproduction,2009,81(1):67-76. ( 1) 1)
|
| [15] | LOPEZ-GARCIA C,LOPEZ-CONTRERAS A J,CREMADES A,et al.Transcriptomic analysis of polyamine-related genes and polyamine levels in placenta,yolk sac and fetus during the second half of mouse pregnancy[J]. Placenta,2009,30(3):241-249. ( 1) 1)
|
| [16] | BAZER F W,KIM J,KA H,et al.Select nutrients in the uterine lumen of sheep and pigs affect conceptus development[J]. Journal of Reproduction and Development,2012,58(2):180-188. ( 1) 1)
|
| [17] | WU G Y,BAZER F W,DAVIS T A,et al.Arginine metabolism and nutrition in growth,health and disease[J]. Amino Acids,2009,37(1):153-168. ( 1) 1)
|
| [18] | KIM J Y,BURGHARDT R C,WU G,et al.Select nutrients in the ovine uterine lumen.Ⅷ.arginine stimulates proliferation of ovine trophectoderm cells through MTOR-RPS6K-RPS6 signaling cascade and synthesis of nitric oxide and polyamines[J]. Biology of Reproduction,2011,84(1):70-78. ( 1) 1)
|
| [19] | REYNOLDS L P,CATON J S,REDMER D A,et al.Evidence for altered placental blood flow and vascularity in compromised pregnancies[J]. The Journal of Physiology,2006,572(Pt 1):51-58. ( 1) 1)
|
| [20] | LÔPEZ-GARCÍA C,LÔPEZ-CONTRERAS A J,CREMADES A,et al.Molecular and morphological changes in placenta and embryo development associated with the inhibition of polyamine synthesis during midpregnancy in mice[J]. Endocrinology,2008,149(10):5012-5023. ( 1) 1)
|
| [21] | WANG X J,IKEGUCHI Y,MCCLOSKEY D E,et al.Spermine synthesis is required for normal viability,growth,and fertility in the mouse[J]. The Journal of Biological Chemistry,2004,279(49):51370-51375. ( 1) 1)
|
| [22] | MANEN C A,HOOD R D,FARINA J.Ornithine decarboxylase inhibitors and fetal growth retardation in mice[J]. Teratology,1983,28(2):237-242. ( 1) 1)
|
| [23] | ISHIDA M,HIRAMATSU Y,MASUYAMA H,et al.Inhibition of placental ornithine decarboxylase by DL-α-difluoro-methyl ornithine causes fetal growth restriction in rat[J]. Life Sciences,2002,70(12):1395-1405. ( 1) 1)
|
| [24] | SATTERFIELD M C,BAZER F W,SPENCER T E,et al.Sildenafil citrate treatment enhances amino acid availability in the conceptus and fetal growth in an ovine model of intrauterine growth restriction[J]. The Journal of Nutrition,2010,140(2):251-258. ( 1) 1)
|
| [25] | JOBGEN W S,FORD S P,JOBGEN S C,et al.Baggs ewes adapt to maternal undernutrition and maintain conceptus growth by maintaining fetal plasma concentrations of amino acids[J]. Journal of Animal Science,2008,86(4):820-826. ( 1) 1)
|
| [26] | KWON H,FORD S P,BAZER F W,et al.Maternal nutrient restriction reduces concentrations of amino acids and polyamines in ovine maternal and fetal plasma and fetal fluids[J]. Biology of Reproduction,2004,71(3):901-908. ( 1) 1)
|
| [27] | KWON H,WU G Y,BAZER F W,et al.Developmental changes in polyamine levels and synthesis in the ovine conceptus[J]. Biology of Reproduction,2003,69(5):1626-1634. ( 1) 1)
|
| [28] | GILAD G M,GILAD V H.Novel polyamine derivatives as neuroprotective agents[J]. The Journal of Pharmacology and Experimental Therapeutics,1999,291(1):39-43. ( 1) 1)
|
| [29] | MARTÍN I,GIBERT M J,PINTOS C,et al.Oxidative stress in mothers who have conceived fetus with neural tube defects:the role of aminothiols and selenium[J]. Clinical Nutrition,2004,23(4):507-514. ( 1) 1)
|
| [30] | HAGHIGHI P S,ALHONEN L,SALONURMI T,et al.Ethanol-induced impairment of polyamine homeostasis-A potential cause of neural tube defect and intrauterine growth restriction in fetal alcohol syndrome[J]. Biochemical and Biophysical Research Communications,2014,446(1):173-178. ( 1) 1)
|
| [31] | WU G,BAZER F W,BURGHARDT R C,et al.Impacts of amino acid nutrition on pregnancy outcome in pigs:mechanisms and implications for swine production[J]. Journal of Animal Science,2010,88(13 electronic suppl):E195-E204. ( 1) 1)
|




