植物多糖是广泛存在于植物体内,经过提取分离得到的一类天然大分子活性物质。它是由单糖之间脱水形成糖苷键,并以糖苷键线性或分枝连接而成的多于20个糖基的链状聚合物[1]。多糖的糖苷键分为α型和β型2种,常见的糖苷键有α-1,4、β-1,3、β-1,6和α-1,6。多数具有突出生物活性的多糖都具有β(1→3)-D-葡聚糖的主链结构[2]。在较早研究中药活性物质时,常将其中的多糖成分作为无活性物质除去[1];直到20世纪50年代,真菌多糖的免疫调节作用被发现,自此人们开始了对多糖结构与功能的探究;20世纪80年代以后,随着研究的深入,人们逐步认识到植物源性多糖来源的广泛性、生物学功能的多样性,作为新兴饲料添加剂具有无毒、无害、无残留、功能性强等特点,随后,植物多糖的生物活性功能及其作用机理逐渐成为了新的研究热点。目前报道的天然植物多糖已有上百种,如刺五加(Acanthopanax senticosus)多糖[3]、黄芪(Astragalus membranaceus)多糖、牛膝(Achyranthes bidentata)多糖[4]等。研究表明,众多的植物多糖具有免疫调节作用,是天然免疫调节剂,可以激活T/B淋巴细胞[5]、巨噬细胞[6]、自然杀伤(NK)细胞[7]等免疫细胞;促进多种细胞因子的释放[6];促进抗体的生成[8];激活补体系统[9]等。而植物多糖对免疫细胞的调控与其对细胞信号转导功能的调节密切相关,通过介导细胞信号通路进而调节细胞内基因表达,实现对表观性状的调控。本文将近年来植物多糖对动物机体的免疫调节作用及其分子机制的相关研究进行了概括总结,为植物多糖免疫调节作用及其机理的更深入研究提供参考,也为新型植物多糖的开发提供新的思路。 1 植物多糖对动物机体的免疫调节作用
植物多糖的免疫调节作用是其最重要的生物活性功能,一直是人们研究的热点。当前研究认为植物多糖的免疫调节作用主要通过以下几个途径实现。 1.1 对巨噬细胞的影响
巨噬细胞起源于单核细胞,是一种多功能效应细胞,可作为抗原递呈细胞在机体免疫的前期阶段起作用,或通过吞噬靶细胞直接起到机体免疫作用,也可通过分泌多种免疫活性物质而发挥免疫调节作用。在继皮肤屏障后,它与中性粒细胞构成了宿主防御的第1道防线[10]。植物多糖对巨噬细胞的调节作用主要体现在对其形态、吞噬活性、细胞因子分泌等方面的影响。 1.1.1 对巨噬细胞形态的影响
细胞形态在一定程度上能够反映出细胞的功能,植物多糖可以通过增大巨噬细胞体积来提高机体免疫力。
研究表明,甘草(Glycyrrhiza uralensis Fisch)多糖能使巨噬细胞体积明显增大,呈圆形、椭圆、菱形、梭形或者不规则形,还可见较长的伪足,而未添加甘草多糖的对照组很少有伪足[11]。尹美珍等[12]也在显微镜下观察到艾叶(Artemisia argyi)多糖组的巨噬细胞体积显著增大,但各组细胞形态均呈圆形、椭圆形、三角形或者不规则形,有伪足和突起。 1.1.2 对巨噬细胞吞噬活性的影响
吞噬作用是巨噬细胞最重要的功能,巨噬细胞通过吞噬作用将损伤细胞和病原体等清除以维持机体内环境的稳态。植物多糖对巨噬细胞吞噬活性的影响与其浓度有一定关系,在适当的浓度范围内能促进巨噬细胞的吞噬作用。
尹美珍等[12]分别以10、100、500 μg/mL的艾叶多糖培养液培养巨噬细胞,发现100、500 μg/mL的艾叶多糖能显著提高巨噬细胞吞噬墨汁和金黄色葡萄球菌的能力,而10 μg/mL的艾叶多糖组与对照组相比差异不显著。Yu等[13]研究发现,纯化的黑灵芝(Ganoderma atrum)多糖可以增强小鼠腹腔巨噬细胞系RAW246.7细胞的吞噬活性。 1.1.3 对巨噬细胞细胞因子分泌的影响
细胞因子主要是由免疫细胞分泌的一些小分子蛋白质,在机体免疫和炎症反应中发挥重要作用。巨噬细胞可以通过分泌多种细胞因子[如白介素(IL)-1、一氧化氮(NO)、肿瘤坏死因子(TNF)-α等]来发挥其功能。植物多糖可以通过调节巨噬细胞细胞因子的分泌量来调节巨噬细胞功能。
不同来源的植物多糖调控巨噬细胞分泌细胞因子的种类各异。Kim等[6]研究了蝉拟青霉(Paecilomyces cicadae)多糖对RAW 264.7细胞的影响,发现RAW 264.7细胞中IL-1β、IL-6和TNF-α基因的表达量均增加。王德成等[14]报道,以不同浓度的牛膝多糖来刺激体外培养的小鼠腹腔巨噬细胞时,200 μg/mL的牛膝多糖显著促进巨噬细胞TNF-α及IL-12的分泌。
NO是由巨噬细胞分泌的另一种具有生物活性的细胞信使因子。它是由NO合成酶(NOS)催化L-精氨酸转变而成的一种短期的生物活性自由基,在杀灭病原微生物与肿瘤细胞等方面发挥重要作用[15]。诱导型NO合成酶(iNOS)表达不依赖细胞内钙离子浓度的变化,一经表达即具有催化活性,因而体内高于生理浓度的NO通常是iNOS被活化的结果[16]。研究表明,茯苓(Poria cocos)多糖通过促进iNOS mRNA的表达及其蛋白质的产生来诱导巨噬细胞分泌NO[17]。 1.1.4 对巨噬细胞内酶活性的影响
巨噬细胞内具有多种酶,这些酶的活性在一定程度上可以反映巨噬细胞的功能状态。当巨噬细胞受到刺激后分化成熟,变为活化巨噬细胞,可以使细胞内多种酶的活性显著增强,更加有效地执行吞噬、对抗原的处理及活性物质的分泌等功能[18]。酸性磷酸酶(ACP)和酸性α-醋酸萘酯酶(ANAE)存在于巨噬细胞溶酶体中,参与巨噬细胞的多种溶酶体消化功能,前者更是巨噬细胞活化的标志[19]。酸性ATP酶(ATPase)和琥珀酸脱氢酶(SDH)均存在于线粒体中,在能量代谢、物质的吸收及运输等过程中起着重要作用。植物多糖可以通过调节巨噬细胞内酶的活性进而影响巨噬细胞的功能。
程安玮等[11]分别将浓度为10、100、500 μg/mL的甘草多糖添加到体外培养的巨噬细胞中,研究其对巨噬细胞内酶活性的影响,结果表明,与空白对照组相比,3种浓度的甘草多糖均使巨噬细胞内ACP、ANAE、ATPase、SDH的活性显著增强。尹美珍等[20]分别用10、100、500 μg/mL的艾叶多糖刺激小鼠腹腔巨噬细胞,发现500 μg/mL的艾叶多糖可以显著增强ACP、非特异性酯酶(NSE)和SDH的活性,而浓度为100 μg/mL时只能显著增强ACP和NSE的活性,说明一定浓度的艾叶多糖能增强体外培养巨噬细胞内酶的活性。 1.2 对淋巴细胞的影响
淋巴细胞是机体最主要的免疫细胞,主要包括T、B淋巴细胞。在机体免疫应答的过程中,T淋巴细胞主要参与细胞免疫应答,B淋巴细胞主要参与体液免疫应答。植物多糖对淋巴细胞的调节作用主要体现在对其增殖能力、亚群结构、细胞因子分泌等的影响。 1.2.1 对淋巴细胞数量与亚群的影响
淋巴细胞的增殖和分化是免疫应答中的一个重要环节,淋巴细胞的数量与亚群的变化对机体免疫状态有一定的提示作用[21]。CD4+ T淋巴细胞和CD8+ T淋巴细胞是T淋巴细胞2重要的个亚群,二者的比例可以反映机体内的免疫功能。一定浓度的植物多糖可以促进淋巴细胞增殖,改善淋巴细胞亚群结构,从而调节机体免疫功能。
章世元等[5]研究表明,苜蓿(Medicago sativa)多糖和黄芪多糖在一定浓度下均能显著促进肉仔鸡血液和脾脏中淋巴细胞的增殖,其中苜蓿多糖以20 μg/mL的浓度效果最好,而黄芪多糖以100 μg/mL的浓度效果最好。罗强等[22]分用25、50、100 mg/kg 3个剂量的刺五加多糖给小鼠灌胃,结果显示各剂量组均可极显著提高小鼠淋巴细胞转化率和脾脏指数,100 mg/kg多糖组小鼠T淋巴细胞亚群CD3++CD4+/CD3++CD8+极显著提高,从而增强机体正向免疫。邹云等[4]研究牛膝多糖、白术(Atractylodes macrocephalaon)多糖以及黄芪多糖单独或联合使用对断奶仔猪淋巴细胞增殖作用的影响时发现,单独或联合添加多糖组的断奶仔猪外周血淋巴细胞转化率较对照组均显著提高,且3种多糖合用时淋巴细胞转化率显著高于单独添加1种多糖时。 1.2.2 对淋巴细胞细胞因子分泌的影响
淋巴细胞释放的细胞因子是免疫系统中重要的信息分子,在免疫调节方面发挥着十分重要的作用,如干扰素(IFN)-γ、IL-2等。细胞因子分泌水平的高低能够在一定程度上体现机体的免疫状态。植物多糖可以通过促进细胞因子分泌来增强机体的免疫功能。
Huang等[23]研究表明,12.5、25.0、50.0、100.0、200.0 μg/mL的地黄(Rehmannia glutinosa)多糖均能显著促进小鼠脾淋巴细胞对IFN-γ、IL-2的释放。邹云等[4]研究牛膝多糖、白术多糖以及黄芪多糖单独或联合使用对断奶仔猪淋巴细胞细胞因子分泌的影响时发现,单独添加1种多糖组断奶仔猪血清中IL-2、IL-1β、TNF、IFN-γ的含量与对照组相比均显著提高,3种多糖两两合用或三者合用较对照组显著提高了血清中IL-2、IL-1β、TNF、IL-6、IFN-γ的含量。 1.2.3 对淋巴细胞抗体分泌的影响
抗体是B淋巴细胞受到抗原刺激后增殖分化为浆细胞后所产生的免疫球蛋白(Ig),可以与相应的抗原发生特异性结合,是介导机体免疫反应的重要分子,主要存在于血清等体液中。植物多糖可以提高动物机体血清中抗体水平,增强机体免疫功能。
刘亚娟等[24]研究表明,饲粮中添加枸杞(Lycium barbarum)多糖能够提高幼兔血清中IgG、IgM含量,其中1%多糖组幼兔血清中IgM含量显著提高,说明饲粮中添加枸杞多糖能够提高幼兔机体的免疫力。徐贤柱等[8]分别以50、100、200 mg/kg的杜仲(Eucommia ulmoides)叶多糖对小鼠进行灌胃,发现200 mg/kg多糖组可以显著提高小鼠血清中IgG和IgM含量,而50 mg/kg多糖组小鼠血清中IgG、IgM含量与对照组无显著差异。 1.3 对自然杀伤细胞的影响
自然杀伤细胞来源于骨髓淋巴样干细胞,是一种大颗粒淋巴细胞,无需抗原预先致敏即可识别和杀灭肿瘤细胞、病毒感染细胞和较大的病原体,活化的自然杀伤细胞能分泌IFN-γ等可溶性细胞因子,增强机体的免疫应答[25]。植物多糖可以激活自然杀伤细胞,增强其杀伤活性。李敬双等[7]研究了苜蓿多糖对小鼠免疫功能的影响,发现苜蓿多糖可以显著地增强小鼠自然杀伤细胞对K562靶细胞的杀伤活性。 1.4 对补体系统的影响
补体系统是由一系列约40种蛋白质所组成的、有着精密调控机制的蛋白质反应系统,它广泛存在于血清、组织液及细胞膜表面,参与破坏或清除病原微生物,在机体免疫中发挥着重要作用[26]。研究表明,当归(Angelica sinensis)多糖、茯苓多糖、圆锥绣球(Hydrangea paniculata Sieb)多糖、酸枣(Ziziphus jujuba Mill)仁多糖等均可激活补体系统[27]。 2 植物多糖对动物机体免疫调节的机制
自从发现多糖具有调节机体免疫功能以来,研究人员就开始了对多糖生物学效能机制的探索。研究发现,植物多糖通过多条信号转导途径调节免疫细胞的功能和代谢,这是植物多糖发挥免疫调节作用的重要机制,包括多糖激活巨噬细胞(图1)、T/B淋巴细胞的信号通路(图2)。 2.1 对巨噬细胞调控的信号通路
巨噬细胞表面表达多种模式识别受体,这些模式识别受体可以识别并结合植物多糖,经各种信号传导通路将信号传入细胞内,引起细胞内一系列的信号级联反应,从而调控相关基因表达。
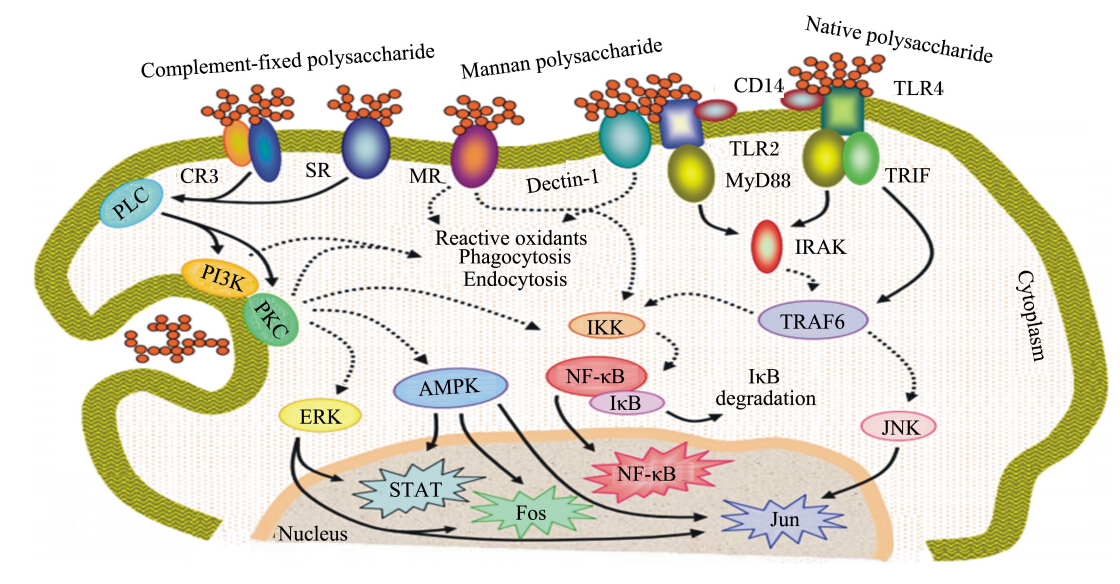 | Complement-fixed polysaccharide:补体相关多糖;Mannan polysaccharide:甘露聚糖;Native polysaccharide:天然多糖;CR3:补体3型受体 complement receptor 3;SR:清道夫受体 scavenger receptors;MR:甘露糖受体 mannose receptors;Dectin-1:树突状细胞相关性C型植物血凝素-1 dendritic cell-associated C-type lectin-1;CD14:白细胞分化抗原14 cluster of differentiation antigen 14;TLR2:Toll样受体2 Toll-like receptor 2;TLR4:Toll样受体4 Toll-like receptor 4;PLC:磷脂酶C phospholipases C;MyD88:髓样分化蛋白 myeloid differentiation factor 88;TRIF:由β干扰素TIR结构域衔接蛋白 Toll/IL-1 domain containing adaptor inducing interferon β;PI3K:磷脂酰肌醇3激酶 phosphatidylinositol 3 kinase;PKC:蛋白激酶 protein kinase C;Reactive oxidants:活性氧族;Phagocytosis:吞噬作用;Endocytosis:内吞作用;IRAK:白介素-1受体相关激酶 interleukin-1 receptor associated kinase;IKK:核因子κB抑制激酶 inhibitor of nuclear factor kappa-B kinase;TRAF6:肿瘤坏死因子受体相关因子6 tumor necrosis factor receptor-associated factor 6;Cytoplasm:细胞质;Nucleus:细胞核;NF-κB:核因子κB nuclear factor kappa-B;IκB:核因子κB抑制蛋白 inhibitor of nuclear factor kappa-B;MAPK:丝裂原激活的蛋白激酶 mitogen-activated protein kinase;ERK:细胞外信号调节激酶 extracellular signal-regulated kinase;STAT:信号传导及转录激活因子 signal transducers and activators of transcription;JNK:c-Jun氨基末端激酶 c-Jun N-terminal kinase图1 多糖激活巨噬细胞的信号通路 Fig. 1 Signaling pathways involved in macrophage activation by polysaccharides[10] |
Toll样受体(Toll-like receptors,TLRs)是一类跨膜蛋白样模式识别受体,广泛表达于树突状细胞、巨噬细胞、中性粒细胞和淋巴细胞的表面[28]。目前发现的Toll样受体家族成员中,只有TLR4与TLR2可以结合糖基配体,二者在天然免疫和获得性免疫系统中均发挥重要作用。TLR2/4与植物多糖配体结合后,通过髓样分化蛋白88(MyD88)介导的信号通路或者Toll样受体相关的干扰素活化因子(TRIF)介导的信号通路,激活肿瘤坏死因子受体相关分子-6(TRAF6),活化的TRAF6分别使下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor-κB,NF-κB)的活化,激活2条不同途径的信号转导[29]。研究表明,蝉拟青霉能够诱导C3H/HeN小鼠(含正常TLR4)巨噬细胞产生NO,而对C3H/HeJ小鼠(TLR4突变型)巨噬细胞没有诱导作用,而SB203580(p38抑制剂)和PDTC(NF-κB p65抑制剂)均能抑制NO的产生和IL-1β mRNA的表达,说明蝉拟青霉通过与巨噬细胞表面的TLR4受体结合,进而激活p38和NF-κB介导的信号通路[6]。 2.1.1.1 MAPK信号转导途径
MAPK是一类高度保守的丝/苏氨酸蛋白激酶,可以被胞外刺激所激活。哺乳动物细胞中的MAPK家族成员主要有胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)和p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)。MAPK信号转导途径是由3级激酶构成的信号级联系统。在未受刺激的细胞内,MAPK处于静止状态。当细胞受到刺激后,丝裂原活化蛋白激酶激酶激酶(MAPKKK)被磷酸化激活,转而继续使丝裂原活化蛋白激酶激酶(MAPKK)激活,然后通过双位点磷酸化激活MAPK(包括ERK、p38、JNK),激活的MAPK产生的磷酸化转录因子进入细胞核,来调控相关基因的转录[30]。
研究表明,茯苓多糖能够显著促进小鼠RAW264.7细胞对iNOS基因的表达和NO的分泌,当分别加入TLR4抗体与p38抑制剂后,iNOS基因的表达和NO的分泌受到明显抑制,说明TLR4介导的p38信号通路是茯苓多糖激活巨噬细胞的1条信号通路[31]。 2.1.1.2 NF-κB信号转导途径
NF-κB转录因子是一类结构相关的真核生物中的转录因子,调节超过150个细胞进程的基因的表达[32]。在未受刺激细胞的细胞质中,NF-κB与NF-κB抑制蛋白(inhibitor of NF-κB,IκB)结合而成为无活性的复合体形式。当细胞受到刺激时,IκB激酶(IKK)复合体被激活,IκB在IKK催化下发生磷酸化并与NF-κB发生解离,从而使NF-κB转化为活化形式,活化的NF-κB转运到细胞核内,并且与相关DNA位点结合来促进靶基因的转录,从而影响多种炎性介质和细胞因子的转录[33]。
Li等[34]研究表明,猪苓(Polyporus umbellatus)多糖能够显著促进C3H/HeN小鼠腹腔巨噬细胞TNF-α和IL-1β的产生和NF-κB的激活,但当分别加入TLR4、TLR2、补体3型受体(complement receptor 3, CR3)单克隆抗体后,只有TLR4抗体明显抑制猪苓多糖诱导的TNF-α和IL-1β的产生量,说明猪苓多糖可以通过TLR4受体介导的NF-κB信号通路激活小鼠巨噬细胞。 2.1.2 CD14、CR3介导的信号通路
白细胞分化抗原14(cluster of differentiation antigen 14,CD14)是存在于单核细胞表面或血浆中的一种糖蛋白,是脂多糖(LPS)高度亲和受体[35]。CR3是由CD11b和CD18 2个亚基以非共价键结合而构成的异二聚体糖蛋白,属于白细胞β2整合素家族成员,能识别β-葡聚糖[36]。CD14和CR3可以形成跨膜复合体共同介导信号传递[37]。CD14和CR3通过激活磷脂酶(PLC),继而激活蛋白激酶(PKC)和磷脂酰肌醇-3-激酶(PI3-K),通过MAPK或NF-κB信号通路调控相关基因的表达[10]。
Mork等[38]研究发现,酵母多糖激活巨噬细胞会引起Ca2+的内流,当用PKC抑制剂或者蛋白质酪氨酸激酶(PTK)抑制剂后,酵母多糖引起的Ca2+内流显著下降,说明酵母多糖影响巨噬细胞Ca2+浓度是通过PKC与PTK来激活巨噬细胞。桔梗(Platycodon grandiflorum)根多糖能激活巨噬细胞中iNOS的转录和NO的产生,但当加入CD14和CD11b抗体后,NO的产生量显著降低,表明桔梗根多糖通过CD14、CR3来激活巨噬细胞[39]。 2.1.3 甘露糖受体(mannose receptors,MR)介导的信号通路
MR是C型凝集素样受体家族的成员,主要由巨噬细胞表达,能够识别甘露糖、L-岩藻糖及L-乙酰葡萄糖氨[40, 41]。郭振军等[42]研究发现,含有N-乙酰葡糖胺残基的大黄(Rheum palmatum)多糖能显著促进大鼠腹腔巨噬细胞TNF-α的分泌,而MR的拮抗剂甘露糖可以完全阻断大黄多糖刺激巨噬细胞分泌TNF-α的作用,说明大黄多糖通过MR受体来刺激巨噬细胞。 2.1.4 清道夫受体(scavenger receptors,SR)介导的信号通路
SR是存在于巨噬细胞、树突细胞等表面且结构多样的跨膜糖蛋白,可以识别结合革兰氏阴性菌脂多糖等[43, 44]。研究表明,SR受体激活巨噬细胞的通路可能与CR3受体一致[45]。墨角藻(Fucoidan)聚糖可以显著促进野生型小鼠(含SR基因)RAW264.7细胞中NO的释放量,对SR基因缺陷型小鼠的巨噬细胞无激活作用,说明墨角藻聚糖通过SR受体激活巨噬细胞释放NO,当分别加入各种抑制剂后,结果表明墨角藻聚糖与SR受体结合后再通过p38 MAPK和NF-κB 2条途径来诱导iNOS基因的表达[46]。 2.1.5 Dectin-1介导的信号通路
Dectin-1是由4个亚基组成的Ⅱ型跨膜受体,胞外为类C型凝集素区域,胞质内是酪氨酸活性区域,存在于单核/巨噬细胞中,可以识别β-葡聚糖[47]。Dectin-1与配体结合后,胞质内的酪氨酸激活基序(ITMA)在酪氨酸(Src)家族激酶的作用下发生酪氨酸磷酸化,接着激活酪氨酸激酶(Syk),进而激活胞内信号通路,如MAPK信号通路或者NF-κB信号通路,引起细胞应答[48]。
灵芝(Ganoderma lucidum)孢子多糖可以显著促进Dectin-1稳定表达的RAW264.7细胞释放TNF-α,但对Dectin-1通路缺陷的细胞的TNF-α释放量没有影响,说明灵芝孢子多糖可以通过Dectin-1激活巨噬细胞[49]。 2.2 对T/B淋巴细胞调控的分子通道
植物多糖激活T淋巴细胞的分子通道主要是通过T细胞受体(T-cell receptor,TCR)/CD3复合受体介导的信号通路,下游涉及MAPK信号通路;而植物多糖激活B淋巴细胞的调节通路主要是与细胞表面的IgM/CD79复合受体或TLR2/4结合,通路下游主要是经过MAPK和NF-κB 2条信号转导途径进行调节。
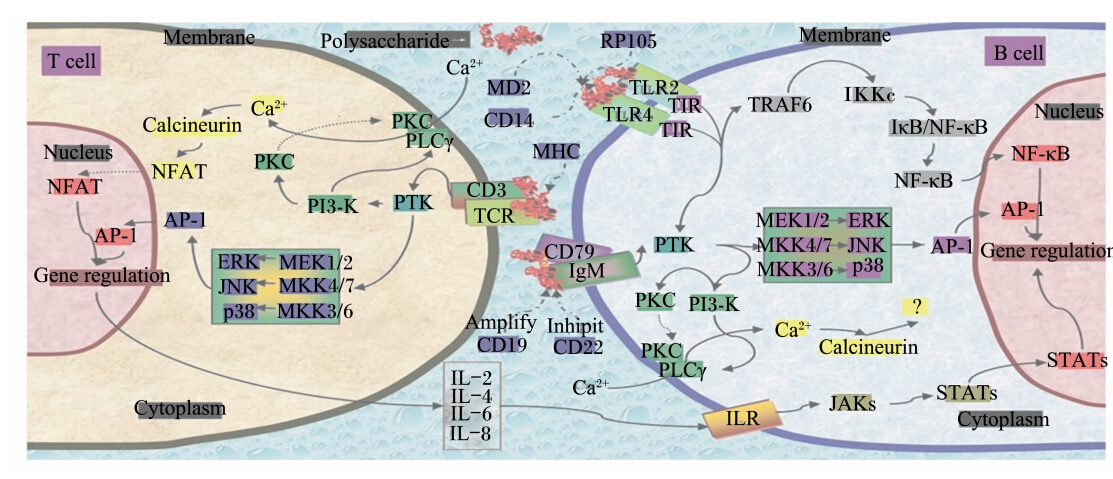 | CD3:白细胞分化抗原3 cluster of differentiation antigen 3;CD79:白细胞分化抗原79 cluster of differentiation antigen 79;TCR:T细胞受体 T cell receptor;IgM:免疫球蛋白 M immunoglobulin M;ILR:白细胞介素受体 interleukin receptor;MHC:主要组织相容性复合体 major histocompatibility complex;IL-2:白细胞介素-2 interleukin-2;IL-4:白细胞介素-4 interleukin-4;IL-6:白细胞介素-6 interleukin-6;IL-8:白细胞介素-8 interleukin-8;Membrane:细胞膜;PLCγ:磷酸脂酶C-γ phospholipase C γ;PTK:蛋白酪氨酸激酶 protein tyrosine kinase;AP-1:激活蛋白1 activator protein-1;NFAT:活化T细胞核因子 nuclear factor of activated T cells;Calcineurin:钙调神经蛋白。图2 多糖激活T/B淋巴细胞的信号通路 Fig. 2 Signaling pathways involved in T/B lymphocytes activation by polysaccharides[50] |
mIg受体是B淋巴细胞表面最主要的受体,是B淋巴细胞的特征性表面标志,它可以与CD79b形成mIg复合受体,共同识别抗原、调节B淋巴细胞活化等。当IgM/CD79与多糖结合后,激活蛋白酪氨酸激酶(PTK),在PTK的催化作用下进一步激活MAPK,产生转录激活蛋白1(Activator protein-1,AP-1),调控B淋巴细胞相关基因的表达[50]。
桔梗根多糖能够显著增强小鼠B淋巴细胞的增殖和IgM的产生,随着CD19抗体和CD79b抗体的加入,B淋巴细胞的增殖受到明显抑制,表明桔梗根多糖激活B淋巴细胞的途径与CD19、CD79受体有关[39]。黄芪多糖能刺激BALB/c小鼠B淋巴细胞增殖,当加入兔抗小鼠Ig抗体后,ASP对小鼠B细胞增殖的促进作用被抑制,说明ASP可以通过与mIg受体结合来调节B淋巴细胞的活性[51]。Matsumoto等[52]从银柴胡(Bupleurum falcatum)根中提取出1种果胶多糖(bupleuran 2Ⅱc)并研究了其促进B淋巴细胞周期蛋白D2(Cyclin D2)表达的机制,发现PTK、Syk、PI3-K、PLCγ、PKC、钙调神经蛋白(calcineurin)的抑制剂都能显著降低bupleuran 2Ⅱc/PG-1(bupleuran 2Ⅱc的分支结构)诱导的Cyclin D2的表达,而Cyclin D2的表达在丝裂原激活蛋白激酶1(MEK1)和细胞外信号调节激酶1/2(ERK 1/2)抑制剂的作用下略有下降,但不受p38 MAPK抑制剂的影响,说明bupleuran 2Ⅱc对B淋巴细胞Cyclin D2表达的调节涉及PI3-K与PLCγ介导的信号通路,而ERK1/2信号通路并不是主要的作用途径。 2.2.2 TLR2/4受体介导的信号通路
TLR2/4受体也存在于B淋巴细胞表面,植物多糖可以B淋巴细胞表面的TLR4受体结合,通过MAPK信号通路或者NF-κB信号通路调控相关基因的转录。研究表明,刺五加多糖能够显著刺激C3H/HeN小鼠B淋巴细胞的增殖,但当分别加入TLR4抗体或者TLR2抗体培养后,B淋巴细胞的增殖均受到明显抑制,说明刺五加多糖可以与B淋巴细胞表面的TLR2/4受体结合来促进B淋巴细胞的增殖[3]。 2.2.3 TCR介导的信号通路
TCR是T淋巴细胞表面存在的特异性识别和结合主要组织相容性复合体分子的结构,是T淋巴细胞产生免疫应答的关键结构。由于它对抗原的亲和力相对较弱,一般与CD3形成复合体。多糖与TCR/CD3复合体结合后,激活PTK,然后通过PI3-K或者MAPK途径激活T淋巴细胞的免疫应答[50]。
山豆根(Sophora subprosrate)多糖可以显著增强T淋巴细胞膜上PKC的活性和细胞内游离Ca2+的浓度,促进T淋巴细胞释放NO和IL-2;当加入Ca2+阻断剂后,可以抑制山豆根激活T淋巴细胞,表明Ca2+是山豆根多糖激活T淋巴细胞的关键因素[53]。枸杞多糖可以显著促进T淋巴细胞的增殖及IL-2、IFN-γ因子的释放,还能激活活化T细胞核因子(nuclear factor of activated T cells,NFAT)和AP-1,并且能促进CD25的表达,这表明枸杞多糖激活T淋巴细胞的信号通路可能是通过激活NFAT、AP-1及CD25来实现的[54]。 2.3 调节自然杀伤细胞的信号通路
自然杀伤细胞可以通过多种途径被活化,包括膜表面的CD3分子和多种细胞因子。自然杀伤细胞表面具有IL-2亲和性受体,因而IL-2可以增强自然杀伤细胞的活性。可溶性β-葡聚糖能显著增强自然杀伤细胞对K562细胞的杀伤作用,而这种增强作用被CR3抗体抑制,表明β-葡聚糖与自然杀伤细胞的结合识别位点可能是CR3[37]。 2.4 对补体系统激活的调节机制
补体系统可以由3条途径激活:经典途径、替代(旁路)途径以及凝集素途径。经典途径是第1个被发现的依赖抗体介导的激活途径,其过程是与抗原结合的IgG、IgM分子作为激活物与补体(C)1q结合,顺序活化C1r、C1s、C2、C4、C3,形成C3转化酶与C5转化酶的级联酶促反应;而替代途径不依赖于抗体,由微生物或外源异物直接激活C3[44]。研究表明,不同的多糖可以通过经典途径或者替代途径来激活补体系统。
Glovsky等[9]报道,啤酒酵母多糖在体外能激活豚鼠血清的经典途径和替代途径,静脉注射还能激活豚鼠的替代途径。Hamuro等[55]研究8种β-1,3葡聚糖对补体系统的影响时发现,除了羟基茯苓多糖外,其他多糖均可以通过替代途径激活小鼠补体系统。C3a des Arg和C4a des Arg分别是替代途径和经典途径的产物,心叶青牛胆(Tinospora cordifolia)多糖能够使C3a des Arg含量逐步上升,而对C4a des Arg没有显著影响,说明心叶青牛多糖是通过替代途径激活补体系统,而不是经典途径[56]。 3 小 结
近年来,对植物多糖的研究已取得一定的进展,目前已对百余种植物多糖进行了活性相关的研究报道。随着生活水平的提高,人们对绿色无害畜产品的追求愈来愈强烈,植物多糖作为一种天然活性成分,具有无毒、无害、无残留、无抗药性的特点,在畜牧业中具有广阔的应用前景。但是,由于当前多糖提取工艺技术的限制,在生产中应用的植物多糖多为粗提制品,纯度不高,这导致许多研究者所报道的各类植物多糖在生产中的推荐用量不尽相同,同时也给深入研究植物多糖调节动物体免疫的分子机制带来很大困难。同时,我国植物资源丰富,植物多糖种类多样,不同来源多糖的结构也存在相当大的差异,其功能和作用机制也有待进一步研究探索。因此,今后的研究工作在植物多糖提取工艺的优化,不同动物品种和年龄阶段的最适添加量,以及不同来源植物多糖的免疫增强的分子机制等方面应该给予更多的关注和探索。这将有利于植物多糖在畜牧业上的更广泛应用,对于提高养殖业生产效率,保障畜产品安全,实现畜牧业健康快速的可持续发展具有重要意义,同时,也对今后新型无公害饲料添加剂的开发应用提供新的思路和方法。
| [1] | 何朝勇,王立为.多糖的免疫调节作用综述[J]. 安徽中医学院学报,2002,21(4):62-64. ( 2) 2)
|
| [2] | ROUT D,MONDAL S,CHAKRABORTY I,et al.Chemical analysis of a new (1→3)-,(1→6)-branched glucan from an edible mushroom,Pleurotus florida[J]. Carbohydrate Research,2005,340(16):2533-2539. ( 1) 1)
|
| [3] | HAN S B,YOON Y D,AHN H J,et al.Toll-like receptor-mediated activation of B cells and macrophages by polysaccharide isolated from cell culture of Acanthopanax senticosus[J]. International Immunopharmacology,2003,3(9):1301-1312. ( 2) 2)
|
| [4] | 邹云,谢红兵,禹琪芳,等.植物多糖对断奶仔猪淋巴细胞增殖和细胞因子分泌的影响[J]. 动物营养学报,2014,26(1):210-218. ( 3) 3)
|
| [5] | 章世元,徐春燕,董晓芳,等.苜蓿多糖和黄芪多糖对肉仔鸡淋巴细胞增殖的影响[J]. 动物营养学报,2010,22(3):670-674. ( 2) 2)
|
| [6] | KIM H S,KIM Y J,LEE H K,et al.Activation of macrophages by polysaccharide isolated from Paecilomyces cicadae through toll-like receptor 4[J]. Food and Chemical Toxicology,2012,50(9):3190-3197. ( 3) 3)
|
| [7] | 李敬双,刘英姿,唐雨顺,等.苜蓿多糖对小鼠淋巴细胞增殖和NK细胞活性影响的研究[J]. 中国农学通报,2012,28(32):89-93. ( 2) 2)
|
| [8] | 徐贤柱,饶华,蔡险峰,等.杜仲叶多糖提取及对小鼠免疫功能影响研究[J]. 时珍国医国药,2013(3):541-542. ( 2) 2)
|
| [9] | GLOVSKY M M,CORTES-HAENDCHEN L,GHEKIERE L,et al.Effects of particulate beta-1,3 glucan on human, rat, and guinea pig complement activity[J]. Journal of the Reticuloendothelial Society,1983,33(5):401-413. ( 2) 2)
|
| [10] | SCHEPETKIN I A,QUINN M T.Botanical polysaccharides:macrophage immunomodulation and therapeutic potential[J]. International Immunopharmacology,2006,6(3):317-333. ( 3) 3)
|
| [11] | 程安玮,金征宇,万发春,等.甘草多糖对小鼠腹腔巨噬细胞化学成分及胞内酶的影响[J]. 食品与生物技术学报,2008,27(1):76-79. ( 2) 2)
|
| [12] | 尹美珍,阮启刚,余桂朋,等.艾叶多糖对体外培养巨噬细胞吞噬功能的影响[J]. 时珍国医国药,2012,23(1):162-163. ( 2) 2)
|
| [13] | YU Q,NIE S P,LI W J,et al.Macrophage immunomodulatory activity of a purified polysaccharide isolated from Ganoderma atrum[J]. Phytotherapy Research,2013,27(2):186-191. ( 1) 1)
|
| [14] | 王德成,单风平.牛膝多糖对小鼠腹腔巨噬细胞的活化作用[J]. 微生物学杂志,2013,33(4):59-61. ( 1) 1)
|
| [15] | HUANG M,MEI X,ZHANG S.Mechanism of nitric oxide production in macrophages treated with medicinal mushroom extracts (review)[J]. International Journal of Medicinal Mushrooms,2011,13(1): 1-6. ( 1) 1)
|
| [16] | 荣岳光.苜草素对小鼠巨噬细胞NO,IL-6,TNF-α分泌的影响及其机理研究[D]. 硕士学位论文.北京:中国农业科学院,2007. ( 1) 1)
|
| [17] | LEE K Y,JEON Y J.Polysaccharide isolated from Poria cocos sclerotium induces NF-κB/Rel activation and iNOS expression in murine macrophages[J]. International Immunopharmacology,2003,3(10):1353-1362. ( 1) 1)
|
| [18] | 黄海华.药学细胞生物学[M]. 北京:中国医药科技出版社,2006:208. ( 1) 1)
|
| [19] | 郭仁强.临床免疫学基础[M]. 南京:江苏科学出版社,1982:72-86. ( 1) 1)
|
| [20] | 尹美珍,胡岗,李仲娟,等.艾叶多糖对小鼠腹腔巨噬细胞内酶活性的影响[J]. 时珍国医国药,2013,24(9):2118-2120. ( 1) 1)
|
| [21] | 王青,胡明华,董燕,等.茯苓多糖对免疫抑制小鼠粘膜淋巴组织及脾脏中CD3+和 CD19+细胞变化的影响[J]. 中国免疫学杂志,2011,27(3):228-231. ( 1) 1)
|
| [22] | 罗强,任鸿,孙黎,等.刺五加多糖对小鼠淋巴细胞转化率及外周血淋巴细胞亚群的影响[J]. 河南农业科学,2013,42(8):137-140. ( 1) 1)
|
| [23] | HUANG Y,JIANG C,HU Y,et al.Immunoenhancement effect of rehmannia glutinosa polysaccharide on lymphocyte proliferation and dendritic cell[J]. Carbohydrate Polymers,2013,96(2):516-521. ( 1) 1)
|
| [24] | 刘亚娟,陈赛娟,李海丽,等.枸杞多糖对生长獭兔生产性能及血清生化指标的影响[J]. 中国饲料,2013(20):22-25. ( 1) 1)
|
| [25] | RAULET D H.Missing self recognition and self tolerance of natural killer (NK) cells[J]. Seminars in Immunology,2006,18(3):145-150. ( 1) 1)
|
| [26] | 余英才,张纯,夏循礼,等.补体系统的进化[J]. 生命科学,2012,24(004):362-367. ( 1) 1)
|
| [27] | 马红樱,张德禄,胡春香,等.植物活性多糖的研究进展[J]. 西北师范大学学报:自然科学版,2004,40(3):112-117. ( 1) 1)
|
| [28] | ROEDER A,KIRSCHNING C J,RUPEC R A,et al.Toll-like receptors as key mediators in innate antifungal immunity[J]. Medical Mycology,2004,42(6):485-498. ( 1) 1)
|
| [29] | 吴燕燕,王易.Toll样受体信号通路中MyD88的研究进展[J]. 免疫学杂志,2012,28(3):262-265. ( 1) 1)
|
| [30] | WIDMANN C,GIBSON S,JARPE M B,et al.Mitogen-activated protein kinase:conservation of a three-kinase module from yeast to human[J]. Physiological Reviews,1999,79(1):143-180. ( 1) 1)
|
| [31] | LEE K Y,YOU H J,JEONG H G,et al.Polysaccharide isolated from Poria cocos sclerotium induces NF-κB/Rel activation and iNOS expression through the activation of p38 kinase in murine macrophages[J]. International Immunopharmacology,2004,4(8):1029-1038. ( 1) 1)
|
| [32] | GHOSH S,MAY M J,KOPP E B.NF-κB and Rel proteins:evolutionarily conserved mediators of immune responses[J]. Annual Review of Immunology,1998,16(1):225-260. ( 1) 1)
|
| [33] | LI Q,VERMA I M.NF-κB regulation in the immune system[J]. Nature Reviews Immunology,2002,2(10):725-734. ( 1) 1)
|
| [34] | LI X,XU W.TLR4-mediated activation of macrophages by the polysaccharide fraction from Polyporus umbellatus (pers.) fries[J]. Journal of Ethnopharmacology,2011,135(1):1-6. ( 1) 1)
|
| [35] | WRIGHT S D,RAMOS R A,TOBIAS P S,et al.CD14,a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein[J]. Science,1990,249(4975):1431-1433. ( 1) 1)
|
| [36] | ROSS G D,VETVIVKA V.CR3 (CD11b,CD18):a phagocyte and NK cell membrane receptor with multiple ligand specificities and functions[J]. Clinical and Experimental Immunology,1993,92(2):181-184. ( 1) 1)
|
| [37] | ZAREWYCH D M,KINDZELSKII A L,TODD R F,et al.LPS induces CD14 association with complement receptor type 3,which is reversed by neutrophil adhesion[J]. The Journal of Immunology,1996,156(2):430-433. ( 2) 2)
|
| [38] | MORK A C,SUN X,LIU X B,et al.Regulation of (1-3)-β-glucan-stimulated Ca2+ influx by protein kinase C in NR8383 alveolar macrophages[J]. Journal of Cellular Biochemistry,2000,78(1):131-140. ( 1) 1)
|
| [39] | HAN S B,PARK S H,LEE K H,et al.Polysaccharide isolated from the radix of Platycodon grandiflorum selectively activates B cells and macrophages but not T cells[J]. International Immunopharmacology,2001,1(11):1969-1978. ( 2) 2)
|
| [40] | GAZI U,MARTINEZ-POMARES L.Influence of the mannose receptor in host immune responses[J]. Immunobiology,2009,214(7):554-561. ( 1) 1)
|
| [41] | STEINMAN R M,MELLMAN I S,MULLER W A,et al.Endocytosis and the recycling of plasma membrane[J]. The Journal of Cell Biology,1983,96(1):1-27. ( 1) 1)
|
| [42] | 郭振军,刘莉,张维璐,等.大黄、当归多糖对巨噬细胞甘露糖受体作用的研究[J]. 细胞与分子免疫学杂志,2008,24(5):514-516. ( 1) 1)
|
| [43] | MURPHY J E,TEDBURY P R,HOMER-VANNIASINKAM S,et al.Biochemistry and cell biology of mammalian scavenger receptors[J]. Atherosclerosis,2005,182(1):1-15. ( 1) 1)
|
| [44] | 金伯泉.医学免疫学[M]. 5版.北京:人民卫生出版社,2008:137. ( 2) 2)
|
| [45] | ILCHMANN A,BURGDORF S,SCHEURER S,et al.Glycation of a food allergen by the Maillard reaction enhances its T-cell immunogenicity:role of macrophage scavenger receptor class A type Ⅰ and Ⅱ[J]. Journal of Allergy and Clinical Immunology,2010,125(1):175-183. ( 1) 1)
|
| [46] | NAKAMURA T,SUZUKI H,WADA Y,et al.Fucoidan induces nitric oxide production via p38 mitogen-activated protein kinase and NF-κB-dependent signaling pathways through macrophage scavenger receptors[J]. Biochemical and Biophysical Research Communications,2006,343(1):286-294. ( 1) 1)
|
| [47] | BROWN G D,GORDON S.Immune recognition:a new receptor for β-glucans[J]. Nature,2001,413(6851):36-37. ( 1) 1)
|
| [48] | HERRE J,MARSHALL A S,CARON E,et al.Dectin-1 uses novel mechanisms for yeast phagocytosis in macrophages[J]. Blood,2004,104(13):4038-4045. ( 1) 1)
|
| [49] | GUO L,XIE J,RUAN Y,et al.Characterization and immunostimulatory activity of a polysaccharide from the spores of Ganoderma lucidum[J]. International Immunopharmacology,2009,9(10):1175-1182. ( 1) 1)
|
| [50] | 易阳,曹银,张名位.多糖调控T/B淋巴细胞免疫应答机制的研究进展[J]. 中国细胞生物学学报,2012,34(1):67-74. ( 3) 3)
|
| [51] | SHAO B,XU W,DAI H,et al.A study on the immune receptors for polysaccharides from the roots of Astragalus membranaceus, a Chinese medicinal herb[J]. Biochemical and Biophysical Research Communications,2004,320(4):1103-1111. ( 1) 1)
|
| [52] | MATSUMOTO T,HOSONO-NISHIYAMA K,GUO Y,et al.A possible signal transduction pathway for cyclin D2 expression by a pectic polysaccharide from the roots of Bupleurum falcatum L. in murine B cell[J]. International Immunopharmacology,2005,5(9):1373-1386. ( 1) 1)
|
| [53] | TINGJUN H,RONGLIANG Z.Promotion of Sophora subprosrate polysaccharide on nitric oxide and interleukin-2 production in murine T lymphocytes:implicated Ca2+ and protein kinase C[J]. International Immunopharmacology,2004,4(1):109-118. ( 1) 1)
|
| [54] | CHEN Z,KWONG HUAT TAN B,CHAN S H.Activation of T lymphocytes by polysaccharide-protein complex from Lycium barbarum L.[J]. International Immunopharmacology,2008,8(12):1663-1671. ( 1) 1)
|
| [55] | HAMURO J,HADDING U,BITTER-SUERMANN D.Solid phase activation of alternative pathway of complement by beta-1,3-glucans and its possible role for tumour regressing activity[J]. Immunology,1978,34(4):695-705. ( 1) 1)
|
| [56] | RAVEENDRAN NAIR P K,RODRIGUEZ S,RAMACHANDRAN R,et al.Immune stimulating properties of a novel polysaccharide from the medicinal plant Tinospora cordifolia[J]. International Immunopharmacology,2004,4(13):1645-1659. ( 1) 1)
|




