2. 湖南农业大学生命科学与技术学院, 长沙 410128;
3. 中国科学院亚热带 农业生态研究所, 中国科学院农业生态过程重点实验室, 长沙 410125
2. College of Life Science and Technology, Hunan Agriculture University, Changsha 410128, China;
3. Key Laboratory of Agro-Ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
农作物秸秆及牧草等饲料在草食畜牧业生产中占有很重要的地位。农作物秸秆因纤维含量高而致使消化利用率低,优质牧草消化利用率高,但其种植量不能满足草食畜牧业的需求。而农作物秸秆及牧草的化学成分与组成不同,导致微生物对其分解利用的过程也不相同,将两者进行组合有可能改变降解过程,从而有助于提高粗饲料的利用率。有研究发现,农作物秸秆间或秸秆与牧草间进行组成后可产生正组合效应,其干物质消失率(DMD)等要高于单一秸秆或牧草[1, 2, 3]。因此,深入认识秸秆及牧草降解过程的机理是充分利用高纤维含量饲料的基础。反刍动物对粗饲料高效利用的前提是瘤胃微生物对纤维素的降解。微生物表面或界面的一些特性如表面电荷、细胞表面疏水性(CSH)及其细胞膜通透性(CMP)也可能对微生物的吸附过程及胞内酶的释放产生影响[4, 5, 6]。同时,任何影响瘤胃微生物活性的因素都可能影响微生物对纤维的降解与利用,如碳水化合物在微生物的作用下分解生成的短链脂肪酸会改变瘤胃微生物的界面特性,瘤胃微生物界面特性的改变进而会影响微生物的活性。因此,本文通过开展不同粗饲料的体外发酵特性和瘤胃微生物界面物理化学特性的研究工作,比较不同粗饲料的降解过程差异及微生物界面特性差异,以期为深入理解纤维降解机理提供理论根据,为提高粗饲料利用效率提供科学依据。 1 材料与方法 1.1 试验动物与饲养管理
选取3头年龄(2年)和体重相近[(20.00±2.20) kg]、体况良好的成年去势浏阳黑山羊作为瘤胃液供体动物。试验动物饲粮非纤维性碳水化合物/中性洗涤纤维比(NFC/NDF)为40 ∶ 60,精料 组成为玉米47.00%,豆粕24.00%,麸皮22.00%,食盐0.77%,石粉2.23%,预混料4.00%。粗饲料为水稻秆,自由饮水。整个试验每头瘘管羊每天饲喂精料200 g,粗饲料300 g。 1.2 发酵底物的制备
所选的饲料底物与邹瑶等[7]试验中的材料一致,包括小麦秸、玉米秸、水稻秆、苜蓿和桂牧一号杂交象草(简称桂牧一号),并经粉碎机粉碎并过1 mm筛,不同粗饲料的主要化学成分如表1所示。
| 表1 不同粗饲料的主要化学成分(风干基础) Table 1 Main chemical components of different roughages (air-dry basis) % |
本试验采用单因素试验设计,比较不同粗饲料(小麦秸、玉米秸、水稻秆、苜蓿和桂牧一号)的体外发酵特性以及发酵液中微生物细胞膜的界面化学特性。每个处理设3个重复,每个重复2个平行。 1.4 体外发酵程序
参照卢德勋等[8]的方法配制人工唾液,邹瑶等[7]的方法进行体外发酵并稍作改进,发酵瓶中添加(400±5) mg底物粗饲料和40 mL瘤胃液滤液与人工唾液(1 ∶ 4)的混合液。发酵瓶放入39 ℃恒温震荡水浴锅中,通过带针头的塑料管将发酵瓶与压力传感器相连。记录0~48 h的产气量,记录时间间隔为1 h,数据自动保存在压力传感器中。发酵完毕,取一定量的发酵液于离心管中保存,备用。同时过滤发酵残渣,用于测定DMD。 1.5 化学分析 1.5.1 发酵液中氨态氮(NH3-N)含量与DMD的测定
发酵结束之后,取1 mL上清液于2 mL离心管中,经3 500~4 000 r/min离心10 min,另取上清液0.1 mL于1.9 mL、0.2 mol/L的盐酸溶液中,摇匀(稀释20倍),用比色法[9]测定NH3-N含量。DMD计算方法如下:
DMD(%)=(1-M1/M2)×100。
式中:M2和M1分别表示发酵前和发酵后底物干物质质量。 1.5.2 瘤胃微生物界面物理化学指标的测定
参照Pelletier等[10]的方法测定微生物表面电荷,取2 mL上清液,12 000 r/min离心10 min,得细胞沉淀。用1 mmol/L KNO3溶液洗涤2次(漩涡震荡2 min,12 000 r/min再次离心),将细胞沉淀悬浮在5 mL、1 mmol/L KNO3溶液中,放于冰盒中静置30 min。用Zeta Potential Analyzer(Brookhaven Instruments Company)测定细胞表面zeta电位(zeta potential,ZP)和电子迁移率(electrophoretic mobility,EM)。
参照Bellon-Fontaine等[11]和Hori等[12]陈述的微生物黏附溶剂法(MATS)来测定微生物细胞CSH,取一定量的上清液,4 ℃、12 000 r/min再次离心10 min,得细胞沉淀溶液。用0.1 mol/L磷酸盐(PBS)缓冲溶液(pH 6.6)洗涤2次(同上),制成细胞悬浮液。取少量细胞悬浮液,用紫外分光光度计(日本岛津,UV2450)测定其吸光度(OD)400 nm(A0);再向每个样品管中加入十六烷,室温孵育10 min,再旋涡震荡2 min,待混合物完全两相分离,移出水相并测定其OD400 nm(A1),则CSH(%)=[(A0-A1)/A0]×100。
CMP参照王福远等[13]的方法测定。在分液加入厌氧瓶之前,取混合液,10 000 r/min离心10 min,取上清液。加入100 mg/L荧光剂FITC-Dextran溶液配成荧光剂浓度分别为0、10、20、30、40、50 mg/L的溶液,其中0 mg/L为空白对照,制备标准曲线。
发酵结束后,取上清液,加入的FITC-Detran溶液使其初始浓度为25 mg/L。37 ℃、避光、厌氧培养1 h后取发酵液,经4 ℃、10 000 r/min、10 min,取上清液用于荧光分光光度计检测(激发波长488 nm,发射波长520 nm)。另取瘤胃液经4 ℃、10 000 r/min离心10 min,取上清液加双蒸水使其浓度为25 mg/L,摇匀,测定其荧光分光光度值,以去除瘤胃原液的影响。 1.6 数据计算与统计分析
将压强换算成为室温标准气压下的气体体积,换算公式为: y=(x-0.037 4)/0.926 1。
式中:0.037 4和0.926 1分别为实测发酵瓶内的压强与体积之间的换算系数,x为压强(kPa),y为气体量 (mL)。
将各时间点测得的总产气量运用LE体外发酵产气模型[14]进行拟合,计算动态发酵产气参数。模型公式如下:
y=Vf(1-exp(d-kt)/1+exp(b-kt)。
式中:y表示t时间点底物的产气量(mL);Vf表示最大产气量(mL);k表示产气分率。b和d表示产气曲线常数,b>0表示曲线为S形,b<0表示曲线为非S形。
采用以下计算公式计算产气动力学参数:
FRD0=k/[1+exp(b)];
T0.5={ln[2+exp(b)]}/k;
FRDt0.5=k[1+0.5 exp(b)]/[1+exp(b)]。
式中:FRD0表示初始(<12 h)发酵产气分率;T0.5表示达到最大产气量1/2时所用时间,FRDt0.5表示达到最大产气量1/2时的发酵产气分率。
试验数据采用SAS 8.2的MIXED过程统计,不同粗饲料间的差异采用Tukey选项进行多重比较,统计结果以平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著。 2 结果与分析 2.1 不同粗饲料对体外发酵产气参数和48 h总产气量的影响
由图1-A可知,随着时间的增加,5种粗饲料产气量逐渐增加。在发酵30 h时,产气量以苜蓿最高,超过32 h之后,产气量则以桂牧一号最高。从产气量曲线来看,在发酵早期,苜蓿与桂牧一号产气量迅速增加,而小麦秸在发酵早期产气量上升很慢。由图1-B可知,48 h总产气量以桂牧一号最高,极显著高于水稻秆和小麦秸(P<0.01),但与玉米秸和苜蓿之间差异不显著(P>0.05);玉米秸和苜蓿48 h总产气量分别比水稻秆高16.0%和16.5%(P<0.05),分别比小麦秸高63.8%和64.6%(P<0.01),水稻秆产气量显著高于小麦秸(P<0.05)。
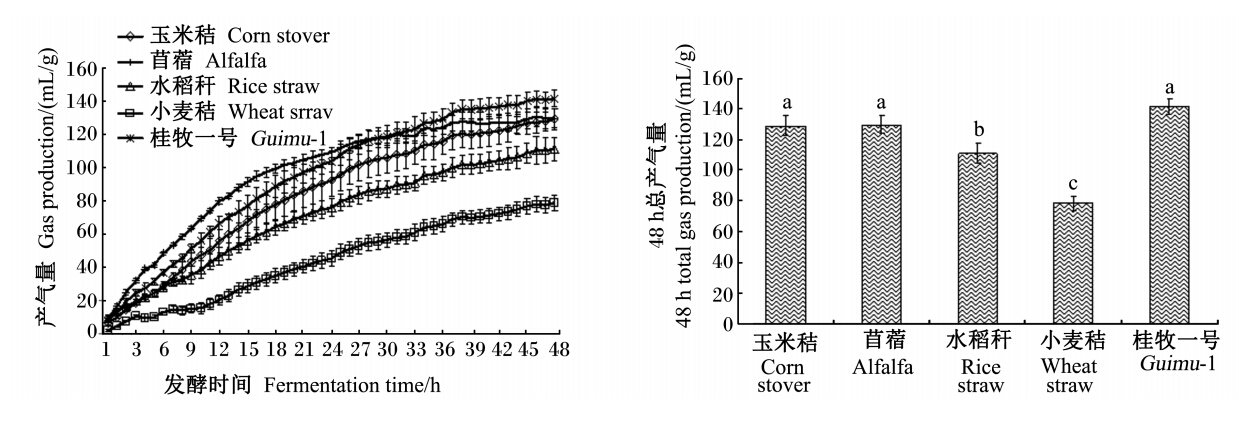 | 数据柱标相同小写字母表示差异不显著(P>0.05),相邻小写字母表示差异显著(P<0.05),相间小写字母表示差异极显著(P<0.01)。
Value columns with the same small letter mean no significant difference (P>0.05), while with adjacent small letter mean significant difference (P<0.05), and with alternate small letter mean significant difference (P<0.01).图1 不同粗饲料体外发酵产气曲线(A)及48 h总产气量(B) Fig. 1 Gas production curve (A) and 48 h gas production (B) of different forages of in vitro fermentation |
由表2可知,Vf以桂牧一号最高,显著高于水稻秆(P<0.05),极显著高于小麦秸(P<0.01),但与玉米秸及苜蓿间差异不显著(P>0.05)。玉米秸与苜蓿Vf分别比小麦秸高58%和51%(P<0.05)。对于b、k、T0.5,均是小麦秸最大,最小值分别是苜蓿、稻秆和桂牧一号。麦秸的b值极显著高于其余4种粗饲料(P<0.01),而桂牧一号及玉米秸间b值差异不显著(P>0.05),但均极显著高于苜蓿(P<0.01)。k值以水稻秆最低,极显著低于桂牧一号、小麦秸和苜蓿(P<0.01)。FRD0以苜蓿最高,显著高于桂牧一号、水稻秆及玉米秸(P<0.05),后三者又极显著高于小麦秸(P<0.01)。FRDt0.5则也是以苜蓿最高,显著高于桂牧一号、小麦秸及玉米秸(P<0.05),极显著高于水稻秆(P<0.01),桂牧一号与玉米秸的FRDt0.5显著高于水稻秆(P<0.05)。T0.5则按小麦秸>水稻秆>玉米秸和桂牧一号>苜蓿的顺序显著降低(P<0.05),但桂牧一号与玉米秸之间没有显著差异(P>0.05)。
| 表2 不同粗饲料体外发酵产气参数及48 h总产气量Table 2 In vitro gas production parameters and 48 h total gas production of different forages |
由表3可知,DMD以苜蓿(63.7%)最高,苜蓿与桂牧一号(60.94%)和玉米秸(59.26%)间无显著差异(P>0.05),但显著高于水稻秆(52.32%)(P<0.05),极显著高于小麦秸(46.86%)(P<0.01)。桂牧一号与玉米秸DMD相对水稻秆分别高16.4%和13.4%,相对小麦秸则分别高30.0%和26.4%。不同粗饲料发酵液NH3-N含量存在显著差异(P<0.05)。苜蓿NH3-N含量(23.15 mg/dL)显著高于桂牧一号(15.17 mg/dL)和水稻秆(13.08 mg/dL)(P<0.05),但与玉米秸(19.25 mg/dL)及小麦秸(17.98 mg/dL)间无显著差异(P>0.05)。玉米秸和小麦秸NH3-N含量与桂牧一号及水稻秆之间差异不显著(P>0.05)。
| 表3 不同底物对干物质消失率、氨态氮含量及瘤胃微生物界面物理化学指标的影响 Table 3 Effects of different substrates on dry matter disappearance,ammonia nitrogen content and interface physical and chemical characteristics of ruminal microbe |
由表3可知,不同粗饲料发酵后微生物的EM、ZP差异不显著(P>0.05),EM和ZP具有相同的变化规律,其绝对值均是小麦秸最大,然后依次为苜蓿、水稻秆、玉米秸和桂牧一号。5种粗饲料发酵后发酵液微生物CSH在17.43%~21.70%之间,CSH以苜蓿最高,然后依次是小麦秸、玉米秸、水稻秆、桂牧一号,但5种粗饲料间没有显著差异(P>0.05)。5种粗饲料体外发酵48 h后CMP以玉米秸最高(51.83%),比小麦秸高11.27%(P<0.05),而小麦秸比水稻秆高5.7%(P<0.05),水稻秆分别比桂牧一号和苜蓿高9.8%和10.9%(P<0.05),桂牧一号和苜蓿间没有显著差异(P>0.05)。 3 讨 论 3.1 粗饲料体外发酵与DMD
在体外发酵试验中,研究者往往根据其试验目的选择合适的发酵时间。在粗饲料发酵特性评价中,很多研究者一般将发酵时间设定在72 h甚至72 h以上,但也有研究者将发酵时间设定在48 h以内。有研究认为,粗饲料在反刍动物瘤胃中的正常消化时间在30 h左右,将培养时间由48 h缩短至30 h或更能比较客观地反映高产奶牛消化纤维的能力[16]。因此,在本研究中,将粗饲料的发酵时间选定为48 h。
瘤胃样品中碳水化合物在微生物的作用下分解产生气体,气体产量的多少与碳水化合物降解量直接相关,因此,发酵产气量一定程度上可以反映出发酵底物为瘤胃微生物所利用的程度[17],通过测定5种不同粗饲料体外发酵产气量,可以粗略地估计其干物质的降解程度。从结果来看,除苜蓿外,其他粗饲料的产气量越高,其DMD也越高。但由于饲料中粗蛋白质在微生物作用下分解时,所产气体很少,饲料中粗蛋白质含量越高,其产气量也会越低。如Cone等[18]对酪蛋白和淀粉的体外发酵研究发现,发酵72 h后蛋白质发酵的产气量仅为碳水化合物的30%。姜海林等[19]研究发现,不同牧草产气量与其粗蛋白质含量呈显著负相关关系。这可能就是苜蓿的产气量比桂牧一号低,但DMD要高于桂牧一号的主要原因。另外,中性洗涤可溶物(NDS)的含量在粗饲料体外发酵中对产气量的贡献也占很高的比例。高巍等[20]对玉米秸秆及苜蓿干草的体外发酵研究表明,青贮玉米秸秆及苜蓿干草NDS的产气量占饲草累积产气量的绝大部分;粗饲料DMD的高低不仅与粗饲料的纤维降解有关,而且与其中NDS含量也密切相关。如在本研究中,NDS含量高的粗饲料(苜蓿与桂牧一号),其DMD也比较高。这可能是因为可溶性非结构性碳水化合物是为瘤胃内微生物提供营养的主要来源,NDS含量越高,干物质(DM)被分解的越多,为微生物提供的营养也越多,从而促进了微生物的增殖,进而更进一步促进了碳水化合物及其他营养物质的分解,故DMD也越高。
b值大于0时表示产气曲线为S形,小于0则为非S形,非S形曲线表示底物接种瘤胃细菌后很快就开始产气,而S形曲线则表示底物在接种瘤胃细菌后的初始发酵阶段有一个延滞期。苜蓿b值为负,而小麦秸和玉米秸都为正,说明苜蓿在接种细菌后可快速开始降解,而低质粗饲料(如小麦秸)的发酵启动时间相对来说要更长。这从FRD0以及T0.5也可得到相同的结果,FRD0越高或T0.5越低,说明底物初始发酵产气速度越快或达到最大产气量1/2时所用时间最短。如苜蓿的FRD0最高而T0.5最低,而小麦秸的FRD0最低而T0.5最高。这说明优质牧草与低质粗饲料的发酵模式存在差异,优质牧草的消化主要在发酵前期,而低质粗饲料主要在发酵后期(>12 h)才进入降解的主要阶段。由结果可以推测,将低质粗饲料与优质牧草进行组合,有可能通过利用优质牧草与低质牧草发酵特性的差异,弥补低质粗饲料在发酵初始阶段微生物增殖慢,从而对纤维降解缓慢的不足。Tang等[21]研究发现,苜蓿与农作物秸秆(玉米秸、小麦秸及水稻秆)按75 ∶ 25的比例组合时,产气量的正组合效应最为显著。
瘤胃NH3-N含量在一定程度上反映了特定饲粮组成下蛋白质降解与微生物对氨氮利用之间所达到的平衡状况[22],NH3-N是瘤胃微生物合成微生物蛋白的主要原料,瘤胃NH3-N适宜含量为6.3~27.5mg/dL[23, 24]。从5种粗饲料的发酵结果来看,其NH3-N含量适宜于微生物的生长。发酵液的NH3-N含量不仅与粗饲料的蛋白质含量有关,可能也与粗饲料的可利用性有关。粗饲料DMD越高,意味着粗饲料分解后给微生物提供的营养物质也越多,从而促进微生物的增殖,进而使NH3-N维持在一定的水平。当粗饲料降解后的营养物质不能满足微生物的进一步增殖时,可能会导致微生物自身的分解,从而也会导致NH3-N含量的升高。这可能就是苜蓿为发酵底物时,发酵液中NH3-N含量是5种底物中最高的,以及小麦秸为底物时发酵液中NH3-N含量要高于水稻秆和桂牧一号的原因。 3.2 瘤胃微生物界面物理化学特性
微生物表面含有磷酰基、羧基和氨基等官能团,正是由于这些基团的电离才使生物表面带静的负电荷,且随着环境pH的改变,基团发生不同程度的电离[25]。细胞表面ZP在维持细胞膜的稳定性上扮演极其重要的角色,能影响细胞结构或功能以及胞内物质的转运[26],在细菌对底物的吸附过程中起到一定的作用[27]。5种粗饲料发酵48 h后发酵液中微生物的EM和ZP间没有显著差异,表明粗饲料的差异在发酵时不影响的微生物表面电荷量,也意味着微生物对不同粗饲料的黏附特性可能没有差异。
细菌由于其表面结构组成特异性而具有疏水性的物理特性,细菌细胞CSH是影响细菌非特异性黏附到各种生物和非生物表面及界面的重要物理因素,也是影响细菌吸附和降解聚合物的主要因素之一[5,28-29]。本研究中不同粗饲料培养时处于相同的培养液条件,瘤胃微生物的数量和种类及其所处的环境基本一致,这可能导致不同粗饲料间发酵液微生物CSH没有差异。
瘤胃微生物降解纤维类物质的活动过程涉及到很多生理过程,在实现这些重要的生理功能过程中,CMP占有很重要的地位[6]。CMP受很多因素的影响,如非离子表面活性剂本身所具有的疏水结构可作用于细菌细胞膜,增加细胞膜的流动性及渗透性,从而使胞内酶更容易流向胞外[30]。在生物催化技术中,常常在不破坏细胞有机整体结构的情况下,通过改善CMP,使得小分子物质和一些较大分子物质能够自由进出细胞,从而提高细胞催化效率[31]。如生产常用非离子表面活性剂Trition X-100改善细胞被膜通透性[32, 33]。在粗饲料发酵过程中,纤维物质被微生物分解所产生的短链脂肪酸也是一种表面活性物质,而表面活性物质有可能通过改变降解微生物细胞表面性质,调节细胞在发酵底物表面的吸附状况,促进它们之间的相互作用[34]。
此外,瘤胃微生物增殖过程中自身也会产生一些生物表面活性物质,这些生物表面活性物质具有降低发酵液表面张力的作用。本研究中,不同粗饲料发酵后,微生物CMP存在显著差异,其主要原因可能是不同粗饲料发酵后产生的短链脂肪酸量不同所致。农作物秸秆的主要成分为中性洗涤纤维,其降解产物主要为短链脂肪酸,干物质降解率越高,其短链脂肪酸产量也越高。从邹瑶[35]的研究结果来看,玉米秸、小麦秸及水稻秆的短链脂肪酸产量分别为19.39、12.49和12.30 mmol/L。粗饲料短链脂肪酸产量越高,其降低表面张力的效果越明显,从而引起CMP增大的效果也越明显。在图2中,粗饲料干物质降解率与微生物CMP的增高呈二次曲线变化。这可能与这2种牧草其化学成分不同于农作物秸秆,其发酵产物也相应发生变化,进而导致CMP变化不一致有关。但这有待更多的研究予以证实。
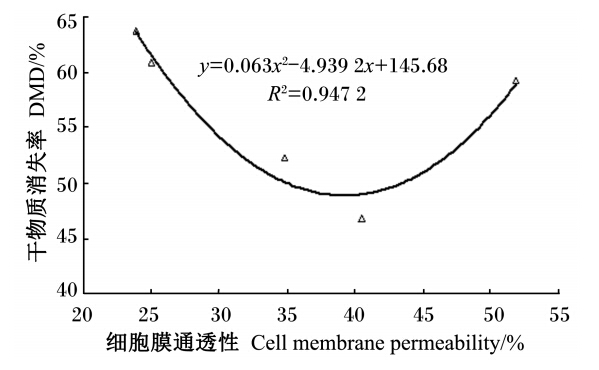 | 图2 粗饲料DMD与CMP关系 Fig. 2 Correlation between dry matter disappearance and cell membrane permeability |
粗饲料体外产气及发酵特性受粗饲料品种的影响,较低纤维含量的牧草具有比农作物秸秆具有更快的FRD0及FRDt0.5,其T0.5也更短。瘤胃微生物表面ZP及CSH不受粗饲料品种的影响,但微生物CMP则受粗饲料品种的影响。利用不同粗饲料发酵动力学不同步的特性进行组合利用可能有利于提高粗饲料的利用率。
| [1] | 周传社,汤少勋,姜海林,等.农作物秸秆体外发酵营养特性及其组合利用研究[J]. 应用生态学报,2005,16(10):1862-1867. ( 1) 1)
|
| [2] | 汤少勋,姜海林,周传社,等.豆科和蓼科牧草的组合发酵特性研究[J]. 草业学报,2005,14(5):59-65. ( 1) 1)
|
| [3] | 汤少勋,姜海林,周传社,等.不同品种牧草间组合时体外产气发酵特性研究[J]. 草业学报,2006,15(1):68-75. ( 1) 1)
|
| [4] | CIEŚLA J,BIEGANOWSKI A,JANCZAREK M,et al.Determination of the electrokinetic potential of Rhizobium leguminosarum bv. trifolii Rt24.2 using laser doppler velocimetry-A methodological study[J]. Journal of Microbiological Methods,2011,85(3):199-205. ( 1) 1)
|
| [5] | GUMARGALIEVA K Z,KALININA I G,MIRONOVA S N,et al.Biodegradation of polymers and adhesion properties of microorganism cells[J]. Polymer Degradation and Stability,1995,47(3):363-368. ( 1) 1)
|
| [6] | ROJAS M,DONAHUE J P,TAN Z J,et al.Genetic engineering of proteins with cell membrane permeability[J]. Nature Biotechnology,1998,16(4):370-375. ( 2) 2)
|
| [7] | 邹瑶,汤少勋,谭支良,等.纤维素酶来源对粗饲料体外发酵特性及甲烷产量的影响[J]. 农业现代化研究,2013,34(2):239-243. ( 2) 2)
|
| [8] | 卢德勋,谢崇文.现代反刍动物营养研究方法和技术[M]. 北京:农业出版社,1991. ( 1) 1)
|
| [9] | 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学,2010,31(6/7):37. ( 1) 1)
|
| [10] | PELLETIER C,BOULEY C,CAYUELA C,et al.Cell surface characteristics of Lactobacillus casei subsp.casei,Lactobacillus paracasei subsp.paracasei,and Lactobacillus rhamnosus strains[J]. Applied and Environmental Microbiology,1997,63(5):1725-1731. ( 1) 1)
|
| [11] | BELLON-FONTAINE M N,RAULT J,VAN OSS C J.Microbial adhesion to solvents:a novel method to determine the electron-donor/electron-acceptor or Lewis acid-base properties of microbial cells[J]. Colloids and Surfaces B:Biointerfaces,1996,7(1/2):47-53. ( 1) 1)
|
| [12] | HORI K,MATSUMOTO S.Bacterial adhesion:from mechanism to control[J]. Biochemical Engineering Journal,2010,48(3):424-434. ( 1) 1)
|
| [13] | 王福远,苗长春,韩慧龙,等.电场对黄孢原毛平革菌生长、细胞通透性及其胞外酶反应的影响[J]. 过程工程学报,2007,7(2):385-389. ( 1) 1)
|
| [14] | WANG M,SUN X Z,TANG S X,et al.Deriving fractional rate of degradation of logistic-Exponential (LE) model to evaluate early in vitro fermentation[J]. Animal,2013,7(6):920-929. ( 1) 1)
|
| [15] | WANG M,TANG S X,TAN Z L.Modeling in vitro gas production kinetics:derivation of Logistic-Exponential (LE) equations and comparison of models[J]. Animal Feed Science and Technology,2011,165(3/4):137-150. ( 0) 0)
|
| [16] | 张吉鹍,邹庆华,卢德勋.反刍动物粗饲料纤维品质的整体评定研究[J]. 饲料工业,2011,32(1):31-34. ( 1) 1)
|
| [17] | HALL M B,PELL A N,CHASE L E.Characteristics of neutral detergent-soluble fiber fermentation by mixed ruminal microbes[J]. Animal Feed Science and Technology,1998,70(1/2):23-39. ( 1) 1)
|
| [18] | CONE J W,VAN GELDER A H.Influence of protein fermentation on gas production profiles[J]. Animal Feed Science and Technology,1999,76(3/4):251-264. ( 1) 1)
|
| [19] | 姜海林,汤少勋,周传社,等.不同禾本科牧草与组合秸秆混合饲料的营养特性及利用效率研究[J]. 中国生态农业学报,2006,14(4):190-194. ( 1) 1)
|
| [20] | 高巍,王新峰,潘晓亮,等.玉米秸青贮与黄贮及苜蓿干草的体外动态消化研究[J]. 石河子大学学报:自然科学版,2002,6(3):222-225. ( 1) 1)
|
| [21] | TANG S X,TAYO G O,TAN Z L,et al.Use of in vitro gas production technique to investigate interactions between rice straw,wheat straw,maize stover and alfalfa or clover[J]. Asian-Australasian Journal of Animal Science,2008,21(9):1278-1285. ( 1) 1)
|
| [22] | MCDONALD I.A revised model for the estimation of protein degradability in the rumen[J]. The Journal of Agricultural Science,1981,96(1):251-252. ( 1) 1)
|
| [23] | ORTEGA M E,STERN M D,SATTER L D,et al.The effect of rumen ammonia concentrate on dry matter disappearance in situ[J]. Journal of Dairy Science,1979,62(Suppl.1):76. ( 1) 1)
|
| [24] | MURPHY J J,KENNELLY J J.Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science,1987,70(9):1841-1849. ( 1) 1)
|
| [25] | WILSON W W,WADE M M,HOLMAN S C,et al.Status of methods for assessing bacterial cell surface charge properties based on zeta potential measurements[J]. Journal of Microbiological Methods,2001,43(3):153-164. ( 1) 1)
|
| [26] | KANG S H,KIM J Y,SUNG Y E.Role of surface state on the electron flow in modified TiO2 film incorporating carbon powder for a dye-sensitized solar cell[J]. Electrochimica Acta,2007,52(16):5242-5250. ( 1) 1)
|
| [27] | HONG S H,JEONG J,SHIM S,et al.Effect of electric currents on bacterial detachment and inactivation[J]. Biotechnology and Bioengineering,2008,100(2):379-386. ( 1) 1)
|
| [28] | KUSTOS T,KUSTOS I,GONDA E,et al.Capillary electrophoresis study of outer membrane proteins of Pseudomonas strains upon antibiotic treatment[J]. Journal of Chromatography A,2002,979(1/2):277-284. ( 0) 0)
|
| [29] | ELLEPOLA A N B,JOSEPH B K,KHAN Z U.Cell surface hydrophobicity of oral Candida dubliniensis isolates following limited exposure to sub-therapeutic concentrations of chlorhexidine gluconate[J]. Mycoses,2013,56(1):82-88. ( 0) 0)
|
| [30] | LEE S S,KIM H S,MOON Y H,et al.The effects of a non-ionic surfactant on the fermentation characteristics,microbial growth,enzyme activity and digestibility in the rumen of cows[J]. Animal Feed Science and Technology,2004,115(1/2):37-50. ( 1) 1)
|
| [31] | 赵伟睿,胡升,黄俊,等.微生物细胞通透性改善方法与策略[J]. 中国生物工程杂志,2014,34(3):125-131. ( 1) 1)
|
| [32] | KAEHNE F,BUCHHAUPT M,SCHRADER J.A recombinant α-dioxygenase from rice to produce fatty aldehydes using E.coli.[J]. Applied Microbiology and Biotechnology,2011,90 (3):989-995. ( 1) 1)
|
| [33] | GALABOVA D,TULEVA B,SPASOVA D.Permeabilization of Yarrowia lipolytica cells by triton X-100[J]. Enzyme and Microbial Technology,1996,18(1):18-22. ( 1) 1)
|
| [34] | VOLKERING F,BREURE A M,RULKENS W H.Microbiological aspects of surfactant use for biological soil remediation[J]. Biodegradation,1998,8:401-417. ( 1) 1)
|
| [35] | 邹瑶.瘤胃真菌纤维素酶对粗饲料体外发酵特性影响的研究[D]. 硕士学位论文.长沙:中国科学院亚热带农业生态研究所,2012:55-56. ( 1) 1)
|




