2. 东北农业大学动物营养研究所, 哈尔滨 150030
2. Institute of Animal Nutrition, Northeast Agricultural University, Harbin 150030, China
2013年11月鸡蛋期货上市以来,作为鸡蛋新鲜度的主要指标,鸡蛋哈夫单位(Haugh unit,HU)受到了各方的重视,后者主要受鸡蛋卵黏蛋白(ovomucin)影响。鸡蛋清蛋白主要包含卵清蛋白(ovalbumin,54%)、卵转铁蛋白(ovotransferrin,12%)和溶菌酶(lysozyme,3.5%)[1]。Eichholz于1898年首次从鸡蛋中分离出卵黏蛋白,是硫酸化的糖蛋白,对新鲜鸡蛋的蛋清凝胶性起主要作用[2]。之前关于蛋清中主要蛋白质[3, 4, 5]的综述较多,也有资料关注了卵黏蛋白的理化性质、分离纯化,生物活性(抗黏附、抗癌、抗菌、降胆固醇及免疫活性)及潜在应用等[6, 7, 8],但关于卵黏蛋白对鸡蛋蛋白品质的影响,尚未见较详细、系统的资料。作为一种可为人类提供优质蛋白质的食品,鸡蛋在储存过程中不可避免的会发生浓蛋白液化,并伴随蛋清pH升高,而影响其食用品质。浓蛋白液化就是浓蛋白分解成透明液体的变质过程,但该定义并未阐明引起浓蛋白变稀的生化过程[9]。本文综述了卵黏蛋白的结构组成、理化特性、在浓蛋白液化过程中的作用和可能机制以及对鸡蛋中卵黏蛋白含量的营养调控,为更好地理解卵黏蛋白对蛋白品质的作用及影响因素,通过营养调控鸡蛋蛋白品质提供研究思路。
1 结构组成卵黏蛋白约占蛋清蛋白的3.5%,分子质量高,是具亚基结构的线性分子,末端有较多盘绕区域,形成随机的螺旋结构,是由鸡5号染色体上的2个基因经转录翻译得到的黏蛋白类的糖蛋白[10]。从流变[11]、结构[12]和遗传[13]等方面的研究表明,卵黏蛋白与其他具凝胶性能的黏蛋白类似。故可认为卵黏蛋白是与哺乳动物黏蛋白类似、由二硫键参与聚合而成的大分子[14]。鸡蛋浓蛋白中卵黏蛋白含量是稀蛋白的2~4倍[6],至少含α-卵黏蛋白(含11%~15%碳水化合物)和β-卵黏蛋白(含50%~57%碳水化合物)2种亚基[15, 16, 17],通过凝胶层析法纯化卵黏蛋白(图1)[6],洗脱液出现了3个峰:β-卵黏蛋白、α2-卵黏蛋白和α1-卵黏蛋白[6, 18]。
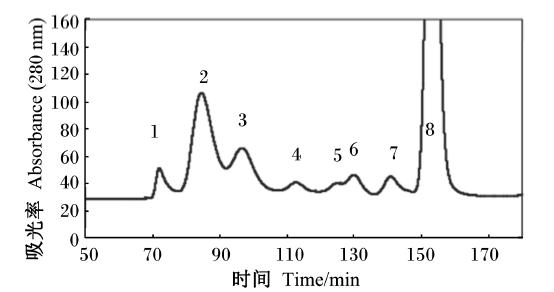 | 1:β-卵黏蛋白 β-ovomucin;2:α2-卵黏蛋白 α2-ovomucin;3:α1-卵黏蛋白 α1-ovomucin;4:卵转铁蛋白 ovotransferrin;5:未知(球蛋白?) unknown(globulins?);6:卵清蛋白 ovalbumin;7:卵类黏蛋白 ovomucoid;8:溶菌酶 lysozyme。 图1 6 HR凝胶过滤色谱分离洗脱液中粗卵黏蛋白组成 Fig. 1 Elution profile of crude ovomucin obtained by Superose 6 HR gel-filtration chromatography |
用溶菌酶-琼脂糖4B色谱柱分析2个卵黏蛋白亚基的氨基酸组成,结果显示:第1个卵黏蛋白中丝氨酸和苏氨酸比例较高,第2个含天冬氨酸较多[19];后续研究显示:苏氨酸和丝氨酸等羟基氨基酸是β-卵黏蛋白的主要成分;α-卵黏蛋白的分子质量为230.9 ku,由2 087个氨基酸残基组成,谷氨酸和天冬氨酸等酸性氨基酸是其主要成分[12, 20]。采用2-步沉淀法[21]制备的卵黏蛋白的氨基酸组成与前人研究[22, 23]结果一致。干燥卵黏蛋白复合物含水分9.24%(w/w)、氮12.6%(w/w)、粗蛋白质60.6%~69.7%(w/w)、粗灰分2.1%(w/w)[20, 21, 22]。
鸡蛋卵黏蛋白中碳水化合物的结构和成分研究,始于20世纪80年代[24, 25, 26]。其碳水化合物含量高达33%[27],包括甘露糖、半乳糖、N-乙酰基-D-半乳糖胺、N-乙酰基-D-葡萄糖胺、N-乙酰基-甘露糖胺丙酮酸、唾液酸和果糖[22]及硫酸化的糖类[20, 24]。其糖侧链至少有3条:一条链由半乳糖、半乳糖胺、唾液酸和硫酸盐以1 ∶ 1 ∶ 1 ∶ 1的摩尔浓度组成,另一条链由半乳糖和葡萄糖胺以1 ∶ 1的摩尔浓度组成,第3条链由甘露糖和葡萄糖胺以1 ∶ 1的摩尔浓度组成[28]。
2 理化性质可将鸡蛋清中卵黏蛋白根据溶解度的不同分为(据含亚基比例)不溶性和可溶性2类。浓蛋白和稀蛋白中均含可溶性卵黏蛋白,而不溶性卵黏蛋白仅存在于浓蛋白中[6]。采用超速离心法可将浓蛋白分为不溶性(沉淀)和可溶性卵黏蛋白(上清液)[29],不溶性部分含67%的α-卵黏蛋白和33%的β-卵黏蛋白,而可溶性部分含87%的α-卵黏蛋白和13%的β-卵黏蛋白[23]。在6.5 mol/L盐酸胍中,用光散射法测定的不溶性卵黏蛋白分子质量为23 000 ku[30],可溶性卵黏蛋白的分子质量为5 600~8 300 ku[6]。
α-和β-卵黏蛋白亚基的等电点(pI)分别为4.5和5.0[20, 31],根据该性质可制备卵黏蛋白纯品。α1-卵黏蛋白和α2-卵黏蛋白亚基的分子量分别为150和220 ku,β-卵黏蛋白亚基的分子质量为400 ku[17],经液相色谱质谱/质谱联用(LC-MS/MS)分析、用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定得出α-卵黏蛋白的分子质量为100~250 ku[32]。因卵黏蛋白分子的疏水性、弹性及与球蛋白和溶菌酶等蛋白质的相互作用,使其具有较好的发泡性、泡沫稳定性和乳化性[33, 34, 35, 36]。据此推测蛋白质表面的疏水性对乳化性有调节作用[37],经超声得到的卵黏蛋白,分子表面的疏水性随溶解度和离解度的增加而增加。
在中性pH或无变性剂的条件下,卵黏蛋白高度不可溶,但机械混匀可令其溶解;在偏碱性或化学变性剂[尿素、盐酸胍、十二烷基硫酸钠(SDS)]及还原剂(巯基乙醇、二硫苏糖醇)存在的情况下,超声降解亦可令其溶解[17, 20]。但这些方法常致二硫键断裂,从而释放出糖基侧链。研究报道,分子质量为8 300 ku的分子,在偏碱性条件下用超声波处理可使其减小到1 100 ku,若用还原剂、超声波分别处理可将分子质量降为230 ku[31]。
3 在浓蛋白液化过程中的作用和可能机制鸡蛋储存过程中,最重要的变化就是浓蛋白转变成低黏度状态,通常称浓蛋白液化,并伴随着蛋清pH升高到9.5。卵黏蛋白作为对蛋清凝胶性能起关键作用的糖蛋白,其变化对鸡蛋蛋白品质的恶化起主要作用。目前,虽然浓蛋白液化过程中的化学变化机制尚未得到完全解释,但仍有一些结论可供参考。
3.1 β-亚基的降解鸡蛋浓蛋白的凝胶性主要缘于卵黏蛋白,浓蛋白液化过程中,其中的β-卵黏蛋白逐渐溶解,而α-卵黏蛋白保持不变,致使鸡蛋蛋白中β-卵黏蛋白含量降低[38];且β-卵黏蛋白亚基中的O-型糖苷碳水化合物对于卵黏蛋白的凝胶性能具有重要作用[39];在浓蛋白液化过程中,O-型糖苷碳水化合物逐渐从卵黏蛋白的丝氨酸和苏氨酸残基中释放出来,可能影响卵黏蛋白的凝胶结构,进而导致β-卵黏蛋白亚基的降解[40]。研究证实,浓蛋白液化与卵黏蛋白的α-和β-亚基的解聚作用有联系,鸡蛋储存过程中浓蛋白凝胶中的β-卵黏蛋白亚基(高糖)减少,致含高糖的不溶性卵黏蛋白比例减少[10]。因此,目前最易接受的导致浓蛋白液化的原因是卵黏蛋白复合物的降解。
3.2 与溶菌酶之间的相互作用在pH=7.4溶液中,1.97 g溶菌酶可与2 g卵黏蛋白相互作用[10];与α-卵黏蛋白相比,β-卵黏蛋白与溶菌酶的互作更强,主要是β-卵黏蛋白末端的唾液酸残基的负电荷和溶菌酶的赖氨酸ε-氨基的正电荷之间的静电作用[41, 42]。所以,卵黏蛋白常与溶菌酶[43]以络合物的形式存在于蛋清中,它们共同参与维持浓蛋白的凝胶性,浓蛋白液化系因溶菌酶-卵黏蛋白络合物以一定方式改变了卵黏蛋白的物理状态,进而破坏了凝胶结构[44]。pH=7.0时卵黏蛋白与溶菌酶之间的互作最大,而鸡蛋储存过程中随着蛋清pH升高,降低了这种互作,进而致浓蛋白液化[43]。后来运用沉降平衡试验研究了降解卵黏蛋白及天然卵黏蛋白与溶菌酶之间互作的不同,发现pH改变并未引起卵黏蛋白与溶菌酶之间互作的变化,认为卵黏蛋白与溶菌酶之间的互作不太可能是导致浓蛋白液化的原因[45]。因此,卵黏蛋白与溶菌酶之间网络链的变化是否可引起浓蛋白液化还有待进一步的研究。
3.3 二硫键断裂鸡蛋蛋清的蛋白质中含有大量巯基(—SH)[46],在浓蛋白液化过程中也可能有一定作用。有研究认为,降低冷库气体中二氧化硫的比例,可致卵黏蛋白中二硫键断裂,造成浓蛋白液化[47];也有研究认为浓蛋白液化是由卵黏蛋白二硫键的碱性水解作用造成[48];30 ℃储存60 d时,α-卵黏蛋白仍通过二硫键保持不溶性,在浓蛋白液化过程中未发生二硫键裂解,说明储存过程中卵黏蛋白非共价键裂解可能是浓蛋白液化的原因[49];因此,卵黏蛋白中的二硫键的还原或碱性水解是否可致浓蛋白液化还有待商榷[40]。卵清蛋白的巯基也可能参与浓蛋白液化[50];虽然在加热或储存过程中,卵清蛋白会转变成为一种更为稳定的形式[51],但卵清蛋白的巯基在浓蛋白液化过程中的作用尚待研究。
4 营养调控途径卵黏蛋白是对蛋清凝胶性起主要作用的糖蛋白[3],而浓蛋白高度、哈夫单位是衡量鸡蛋蛋白品质、鸡蛋新鲜度的重要指标之一,浓蛋白高度越高,蛋白越黏稠,蛋白品质越好。对于不同鸡种而言,哈夫单位较低鸡蛋的蛋清和浓蛋白中不溶性卵黏蛋白的含量显著低于哈夫单位较高的鸡蛋[16]。蛋鸡营养、健康状况是影响新鲜鸡蛋蛋白品质的几个因素。
4.1 饲粮粗蛋白质关于饲粮粗蛋白质水平或来源对鸡蛋浓蛋白高度的影响,研究结果并不一致。有研究认为,在总含硫氨基酸和赖氨酸比例恒定的情况下,20周龄的海兰W-36蛋鸡,试验期1年,饲粮粗蛋白质水平降低1.5%不影响鸡蛋浓蛋白高度[52];而在相同氨基酸回肠标准消化率(SID AA)模式下,20周龄的海兰灰蛋鸡的饲粮中粗蛋白质水平由18.0%降到16.0%,浓蛋白高度由7.01 mm显著下降到6.60 mm[53],蛋清重量显著降低[54]。蛋鸡蛋氨酸摄入量增加可显著增加蛋清重量及蛋清中蛋白质含量,而蛋清成分是对营养变化导致蛋鸡体内某种蛋白质合成机制改变所作出的反应[55],但对于饲粮粗蛋白质在调节机体蛋白质合成中的细胞生物学机制尚需进一步研究。对于44~63周龄的海兰W-98蛋鸡,当饲粮粗蛋白质水平由16.0%降到13.0%,因蛋鸡体内蛋白质合成受到抑制或限制,致鲜和干蛋清比例、蛋清蛋白质和固形物含量显著降低[56]。但未见饲粮粗蛋白质水平对鸡蛋卵黏蛋白含量影响的研究,饲粮粗蛋白质水平或来源是否影响鸡蛋产生过程中的卵黏蛋白的合成及分泌,还有待研究。
4.2 蛋鸡健康及年龄因素作为一个为人类提供优质蛋白质的生物转换器,商品蛋鸡的健康状况和年龄是影响鸡蛋蛋白品质的主要因素[57]。研究证明,蛋鸡采食高脂低蛋白质饲粮或添加3%葵花油的饲粮,可显著降低浓蛋白高度,严重影响鸡蛋蛋白品质[58, 59],高脂低蛋白质饲粮可诱导蛋鸡发生脂肪肝,抑制或减慢机体内蛋白质的合成代谢;而多不饱和脂肪酸易引发组织的脂质过氧化及DNA损伤,进而影响蛋白质的表达,表现在显著降低鸡蛋的浓蛋白高度,而此时向饲粮中添加吡咯喹啉醌或L-肉碱可恢复浓蛋白高度至正常水平。研究发现,当蛋鸡处于高温(35~37 ℃)条件下,处理组饮水中添加L-肉碱50 mg/kg,与未添加L-肉碱组相比,鸡蛋浓蛋白高度可由5.43 cm显著提高到7.00 cm[60],推测这些营养素的添加,除增加机体的抗氧化能力、保持较好的健康状况外,还调控了机体内β-卵黏蛋白的合成和分泌,但后者还需要进一步研究证实。
除疾病因素外,蛋鸡年龄也显著影响新鲜鸡蛋蛋白品质,经过较长时间旺盛的脂质代谢高峰产蛋期后,蛋鸡机体生殖系统和抗氧化状态显著降低,体内的蛋白质合成转运降低,表现在鸡蛋的蛋白含量、黏稠度降低,哈夫单位下降。此时,通过营养手段可以调控代谢,进而改善老龄蛋鸡所产鸡蛋的蛋白品质。研究表明,饲粮中添加25~50 mg/kg的L-肉碱可显著提高产蛋后期鸡蛋的浓蛋白高度,蛋白品质主要依赖于β-卵黏蛋白(由输卵管膨大部分泌)含量;推测L-肉碱能提高输卵管膨大部的代谢速率或壳腺的活性,促进β-卵黏蛋白的合成和分泌[61, 62],从而提高浓蛋白高度和哈夫单位,关于这一论点还需要试验研究证实。
5 小 结哈夫单位是评价鸡蛋蛋白质量和新鲜度的主要指标之一,蛋白越黏稠,哈夫单位越高,鸡蛋越新鲜,蛋白品质越好,因此也成为了鸡蛋期货的主要指标之一。作为对蛋清凝胶性能起关键作用的巨大糖蛋白分子,卵黏蛋白的结构尚未得到完全研究,可能限制了揭示其在浓蛋白液化过程中的作用机制。除储存致浓蛋白液化、蛋白品质下降外,饲粮因素、蛋鸡健康状况是否通过影响卵黏蛋白含量及成分、鸡蛋蛋白品质和抗氧化特性,进而影响鸡蛋品质,以及如何通过营养调控鸡蛋蛋白品质也需要更为详尽地研究。
| [1] | ABEYRATHNE E D N S,LEE H Y,AHN D U.Sequential separation of lysozyme,ovomucin,ovotransferrin,and ovalbumin from egg white[J]. Poultry Science,2014,93(4):1001-1009. ( 1) 1)
|
| [2] | BROOKS J,HALE H P.The mechanical properties of the thick white of the hen's egg[J]. Biochimica et Biophysica Acta,1959,32:237-250. ( 1) 1)
|
| [3] | CEGIELSKA-RADZIEJEWSKA R,LESNIEROWSKI G,KIJOWSKI J.Properties and application of egg white lysozyme and its modified preparations-a review[J]. Polish Journal of Food and Nutrition Sciences,2008,58(1):5-10. ( 2) 2)
|
| [4] | MINE Y,KOVACS-NOLAN J.New insights in biologically active proteins and peptides derived from hen egg[J]. World's Poultry Science Journal,2006,62(1):87-96. ( 1) 1)
|
| [5] | NGUYEN T H L,SMITH M B.S-ovalbumin in eggs:a review[J]. CSIRO Food Research Quarterly,1984,44(2):44-48. ( 1) 1)
|
| [6] | HIIDENHOVI J.Ovomucin[M]//HUOPALAHTI R,LÓPEZ-FANDIÑO R,ANTON M,et al.Bioactive egg compounds.Berlin Heidelberg:Springer,2007:61-68. ( 5) 5)
|
| [7] | MINE Y,D'SILVA I.Bioactive components in egg white[M]//MINE Y.Egg bioscience and biotechnology.Hoboken,NJ:Wiley-Interscience,2007:141-184. ( 1) 1)
|
| [8] | OMANA D A,WANG J P,WU J P.Ovomucin-a glycoprotein with promising potential[J]. Trends in Food Science & Technology,2010,21(9):455-463. ( 1) 1)
|
| [9] | ALMQUIST H J,LORENZ F W.Liquefaction of egg white[J]. US Egg and Poultry Magazine,1932,38:20-23. ( 1) 1)
|
| [10] | OFFENGENDEN M.N-glycosylation and gelling properties of ovomucin from egg white[D]. Master Thesis.Canada:University of Alberta,2011. ( 3) 3)
|
| [11] | RABOUILLE C,AON MA,THOMAS D.Interactions involved in ovomucin gel-forming properties:a rheological-biochemical approach[J]. Archives of Biochemistry and Biophysics,1989,270(2):495-503. ( 1) 1)
|
| [12] | WATANABE K,SHIMOYAMADA M,ONIZUKA T,et al.Amino acid sequence of α-subunit in hen egg white ovomucin deduced from cloned cDNA[J]. DNA Sequence,2004,15(4):251-261. ( 2) 2)
|
| [13] | LANG T G,HANSSON G C,SAMUELSSON T.An inventory of mucin genes in the chicken genome shows that the mucin domain of Muc13 is encoded by multiple exons and that ovomucin is part of a locus of related gel-forming mucins[J]. BMC Genomics,2006,7:197. ( 1) 1)
|
| [14] | GALLAGHER J T,CORFIELD A P.Mucin-type glycoproteins-new perspectives on their structure and synthesis[J]. Trends in Biochemical Sciences,1978,3(1):38-41. ( 1) 1)
|
| [15] | ITOH T,MIYAZAKI J,SUGAWARA H,et al.Studies on the characterization of ovomucin and chalaza of the hen's egg[J]. Journal of Food Science,1987,52(6):1518-1521. ( 1) 1)
|
| [16] | TOUSSANT M J,LATSHAW J D.Ovomucin content and composition in chicken eggs with different interior quality[J]. Journal of the Science of Food and Agriculture,1999,79(12):1666-1670. ( 2) 2)
|
| [17] | OFFENGENDEN M,FENTABIL M A,WU J.N-glycosylation of ovomucin from hen egg white[J]. Glycoconjugate Journal,2011,28(3/4):113-123. ( 3) 3)
|
| [18] | HIIDENHOVI J,MÄKINEN J,HUOPALAHTI R,et al.Comparison of different egg albumen fractions as sources of ovomucin[J]. Journal of Agricultural and Food Chemistry,2002,50(10):2840-2845. ( 1) 1)
|
| [19] | KATO A,OGINO K,MATSUDOMI N,et al.Separation of ovomucin into carbohydrate rich and poor components by chromatography on lysozyme-sepharose 4B[J]. Agricultural and Biological Chemistry,1977,41(10):1925-1929. ( 1) 1)
|
| [20] | ROBINSON D S,MONSEY J B.Studies on the composition of egg-white ovomucin[J]. The Biochemical Journal,1971,121(3):537-547. ( 5) 5)
|
| [21] | OMANA D A,WU J P.A new method of separating ovomucin from egg white[J]. Journal of Agricultural and Food Chemistry,2009,57(9):3596-3603. ( 1) 1)
|
| [22] | DONOVAN J W,DAVIS J G,WHITE L M.Chemical and physical characterization of ovomucin,a sulfated glycoprotein complex from chicken eggs[J]. Biochimica et Biophysica Acta (BBA):Protein Structure,1970,207(1):190-201. ( 2) 2)
|
| [23] | HAYAKAWA S,SATO Y.Physicochemical identity of α-ovomucins or β-ovomucins obtained from the sonicated insoluble and soluble ovomucins[J]. Agricultural and Biological Chemistry,1977,41(7):1185-1191. ( 2) 2)
|
| [24] | STRECKER G,WIERUSZESKI J M,MARTEL C,et al.Determination of the structure of sulfated tetra- and pentasaccharides obtained by alkaline borohydride degradation of hen ovomucin.A fast atom bombardment-mass spectrometric and 1H-NMR spectroscopic study[J]. Glycoconjugate Journal,1987,4(4):329-337. ( 2) 2)
|
| [25] | STRECKER G,WIERUSZESKI J M,MARTEL C,et al.Complete 1H- and 13C-N.M.R.assignments for two sulphated oligosaccharide alditols of hen ovomucin[J]. Carbohydrate Research,1989,185(1):1-13. ( 1) 1)
|
| [26] | STRECKER G,WIERUSZESKI J M,CUVILLIER O,et al.1H and 13C-NMR assignments for sialylated oligosaccharide-alditols related to mucins.Study of thirteen components from hen ovomucin and swallow nest mucin[J]. Biochimie,1992,74(1):39-51. ( 1) 1)
|
| [27] | MINE Y.Recent advances in the understanding of egg white protein functionality[J]. Trends in Food Science & Technology,1995,6(7):225-232. ( 1) 1)
|
| [28] | KATO A,FUJINAGA K,YAGISHITA K.Nature of the carbohydrate side chains and their linkage to the protein in chicken egg white ovomucin[J]. Agricultural and Biological Chemistry,1973,37(11):2479-2485. ( 1) 1)
|
| [29] | KATO A,NAKAMURA R,SATO Y.Studies on changes in stored shell eggs.Part Ⅵ.Changes in the chemical composition of ovomucin during storage[J]. Agricultural and Biological Chemistry,1970,34(7):1009-1013. ( 1) 1)
|
| [30] | TOMINATSU Y,DONOVAN J W.Light scattering study of ovomucin[J]. Journal of Agricultural and Food Chemistry,1972,20(5):1067-1073. ( 1) 1)
|
| [31] | KATO A,SATO Y.The separation and characterization of carbohydrate rich component from ovomucin in chicken eggs[J]. Agricultural and Biological Chemistry,1971,35(3):439-440. ( 2) 2)
|
| [32] | MANN K.The chicken egg white proteome[J]. Proteomics,2007,7(19):3558-3568. ( 1) 1)
|
| [33] | KATO A,ODA S,YAMANAKA Y,et al.Functional and structural properties of ovomucin[J]. Agricultural and Biological Chemistry,1985,49(12):3501-3504. ( 1) 1)
|
| [34] | JOHNSON T M,ZABIK M E.Egg albumen proteins interactions in an angel food cake system[J]. Journal of Food Science,1981,46(4):1231-1236. ( 1) 1)
|
| [35] | HAMMERSHØJ M,NEBEL C,CARSTENS J H.Enzymatic hydrolysis of ovomucin and effect on foaming properties[J]. Food Research International,2008,41(5):522-531. ( 1) 1)
|
| [36] | BANIEL A,FAINS A,POPINEAU Y.Foaming properties of egg albumen with a bubbling apparatus compared with whipping[J]. Journal of Food Science,1997,62(2):377-381. ( 1) 1)
|
| [37] | KATO A,OSAKO Y,MATSUDOMI N,et al.Changes in the emulsifying and foaming properties of proteins during heat denaturation[J]. Agricultural and Biological Chemistry,1983,47(1):33-37. ( 1) 1)
|
| [38] | ROBINSON D S,MONSEY J B.Changes in the composition of ovomucin during liquefaction of thick egg white[J]. Journal of the Science of Food and Agriculture,1972,23(1):29-38. ( 1) 1)
|
| [39] | KATO A,SATO Y.The release of carbohydrate rich component from ovomucin gel during storage[J]. Agricultural and Biological Chemistry,1972,36(5):831-836. ( 1) 1)
|
| [40] | KATO A,OGINO K,KURAMOTO Y,et al.Degradation of the O-glycosidically linked carbohydrate units of ovomucin during egg white thinning[J]. Journal of Food Science,1979,44(5):1341-1344. ( 2) 2)
|
| [41] | KATO A,IMOTO T,YAGISHITA K.The binding groups in ovomucin-lysozyme interaction[J]. Agricultural and Biological Chemistry,1975,39(2):541-544. ( 1) 1)
|
| [42] | KATO A,YOSHIDA K,MATSUDOMI N,et al.The interaction between ovomucin and egg white proteins[J]. Agricultural and Biological Chemistry,1976,40(12):2361-2366. ( 1) 1)
|
| [43] | COTTERILL O J,WINTER A R.Egg white lysozyme:3.The effect of pH on the lysozyme-ovomucin interaction[J]. Poultry Science,1955,34(3):679-686. ( 2) 2)
|
| [44] | HAWTHORNE J R.The action of egg white lysozyme on ovomucoid and ovomucin[J]. Biochimica et Biophysica Acta,1950,6(1):28-35. ( 1) 1)
|
| [45] | MILLER S M,KATO A,NAKAI S.Sedimentation equilibrium study of the interaction between egg white lysozyme and ovomucin[J]. Journal of Agricultural and Food Chemistry,1982,30(6):1127-1132. ( 1) 1)
|
| [46] | GREENSTEIN J P.Sulfhydry groups in proteins Ⅱ.Edestin,excelsin and globin in solutions of guanidine hydrochloride,urea and their derivatives[J]. Journal of Biological Chemistry,1939,128(1):233-240. ( 1) 1)
|
| [47] | MACDONNELL L R,LINEWEAVER H,FEENEY R E.Chemistry of shell egg deterioration:Effect of reducing agents[J]. Poultry Science,1951,30(6):856-863. ( 1) 1)
|
| [48] | DONOVAN J W,DAVIS J G,WIELE M B.Viscosimetric studies of alkaline degradation of ovomucin[J]. Journal of Agricultural and Food Chemistry,1972,20(2):223-228. ( 1) 1)
|
| [49] | KATO A,OGATA S,MATSUDOMI N,et al.Comparative study of aggregated and disaggregated ovomucin during egg white thinning[J]. Journal of Agricultural and Food Chemistry,1981,29(4):821-823. ( 1) 1)
|
| [50] | SMITH M B,BACK J F.Modification of ovalbumin in stored eggs detected by heat denaturation[J]. Nature,1962,193:878-879. ( 1) 1)
|
| [51] | SMITH M B,BACK J F.Studies on ovalbumin:2.The formation and properties of S-ovalbumin,a more stable form[J]. Australian Journal of Biological Sciences,1965,18:365-377. ( 1) 1)
|
| [52] | KHAJALI F,KHOSHOUIE E A,DEHKORDI S K,et al.Production performance and egg quality of Hy-Line W36 laying hens fed reduced-protein diets at a constant total sulfur amino acid:lysine ratio[J]. Journal of Applied Poultry Research,2008,17(3):390-397. ( 1) 1)
|
| [53] | 付胜勇,武书庚,张海军,等.标准回肠可消化氨基酸模式下降低饲粮粗蛋白质水平对蛋鸡生产性能、蛋品质及氮平衡的影响[J]. 动物营养学报,2012,24(9):1683-1693. ( 1) 1)
|
| [54] | GUNAWARDANA P,ROLAND SR D A,BRYANT M M.Effect of energy and protein on performance,egg components,egg solids,egg quality,and profits in molted Hy-Line W-36 hens[J]. The Journal of Applied Poultry Research,2008,17(4):432-439. ( 1) 1)
|
| [55] | SHAFER D J,CAREY J B,PROCHASKA J F,et al.Dietary methionine intake effects on egg component yield,composition,functionality,and texture profile analysis[J]. Poultry Science,1998,77(7):1056-1062. ( 1) 1)
|
| [56] | NOVAK C,YAKOUT H M,SCHEIDELER S E.The effect of dietary protein level and total sulfur amino acid:lysine ratio on egg production parameters and egg yield in Hy-Line W-98 hens[J]. Poultry Science,2006,85(12):2195-2206. ( 1) 1)
|
| [57] | WILLIAMS K C.Some factors affecting albumen quality with particular reference to Haugh unit score[J]. World's Poultry Science Journal,1992,48(1):5-16. ( 1) 1)
|
| [58] | 赵芹,张海军,武书庚,等.吡咯喹啉醌对高能低蛋白质饲粮蛋鸡生产性能、蛋品质、血浆脂质代谢及抗氧化能力的影响[J]. 动物营养学报,2014,26(4):885-892. ( 1) 1)
|
| [59] | 徐少辉,张亚男,武书庚,等.L-肉碱对饲粮中添加葵花油的产蛋鸡抗氧化功能及鸡蛋品质的影响[J]. 动物营养学报,2011,23(7):1201-1208. ( 1) 1)
|
| [60] | CELIK L B,TEKELI A,ÖZTÜRKCAN O.Effects of supplemental L-carnitine in drinking water on performance and egg quality of laying hens exposed to a high ambient temperature[J]. Journal of Animal Physiology and Animal Nutrition,2004,88(5/6):229-233. ( 1) 1)
|
| [61] | 徐少辉,武书庚,张海军,等.饲粮中添加L-肉碱对产蛋鸡生产性能、蛋品质及脂质代谢的影响[J]. 动物营养学报,2011,23(4):640-646. ( 1) 1)
|
| [62] | RABIE M H,SZILÁGYI M,GIPPERT T.Effects of dietary L-carnitine on the performance and egg quality of laying hens from 65-73 weeks of age[J]. British Journal of Nutrition,1997,78(4):615-623. ( 1) 1)
|




