2. 青岛市畜牧兽医研究所, 青岛 266109;
3. 山东省饲料质量检验所, 济南 250022
2. Institute of Husbandry and Veterinary of Qingdao, Qingdao 266109, China;
3. Shandong Feed Quality Inspection, Jinan 250022, China
崂山奶山羊原产于山东省胶东半岛,主要分布于崂山及周边市区,是当地群众利用莎能奶山羊、吐根堡羊对当地山羊进行杂交改良,并经多年培育形成的奶用高产地方良种。该羊具有耐粗饲、生长发育快、体格健硕、抗病力强、乳品质佳和遗传性能稳定等诸多优点。近几年来,崂山奶山羊的养殖方式已逐渐由放养转为舍饲,舍饲模式下,羊只所需要的营养完全来自饲粮,而饲粮粗蛋白质(CP)水平是保证羔羊正常生长发育的关键。戈新等[1]研究了2个营养水平(净能5.39 MJ/kg、CP 14.50%;净能5.11 MJ/kg、CP 13.50%)对不同性别崂山奶山羊羔羊生长性能的影响,结果发现,饲粮净能为5.39 MJ/kg、CP为14.50%时,羔羊可以得到较高生长速度;同时发现,2个营养水平下,崂山奶山羊公羔的生长速度均优于母羔。目前,关于育成期崂山奶山羊母羔蛋白质需要量的报道甚少,严重影响了奶用山羊生产性能的发挥及养殖的经济效益。本试验旨在研究饲粮CP水平对育成期崂山奶山羊母羔生长发育及血清生化指标的影响,从而为崂山奶山羊的饲养标准制定与科学饲养提供基础参数和理论依据。 1 材料与方法 1.1 试验动物及试验设计
选用健康无病147日龄体重(14.57±0.32) kg的崂山奶山羊断奶母羊30只,采用单因素随机分组设计,按体重均衡原则随机分成3组,每组10个重复,每个重复1只羊。试验在青岛奥特种羊场进行,时间为2014年5月至2014年10月。 1.2 试验饲粮及营养水平
参考NRC(2007)[2]建议的奶用山羊饲养标准配制试验饲粮,A、B、C组饲粮CP水平分别为10.74%、13.22%和15.74%,其他营养水平基本一致。试验饲粮组成及营养水平见表1。采用全混合日粮饲喂。
| 表1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
预试期14 d,正试期162 d。因实际试验月份,将161~170日龄共9 d的数据作为5月龄数据(5月份进行),171~200日龄共30 d数据作为6月龄数据(6月份进行),201~231日龄共31 d数据作为7月龄数据(7月份进行),232~262日龄共31 d数据作为8月龄数据(8月份进行),263~292日龄共30 d数据作为9月龄数据(9月份进行),293~323日龄共31 d数据作为10月龄数据(10月份进行)。 1.4 饲养管理
供试验羊单栏饲养,每天于06:30、12:00、18:00定量饲喂,固定时间段赶入运动场活动,供给充足洁净饮水,定期给羊舍消毒。及时清理粪便,保持试验场地清洁,试验羊的驱虫免疫严格按照羊场程序进行。各组间饲养管理条件完全一致。 1.5 消化代谢试验
分别在饲养试验的正试期第11(前期)、160天(后期)开展前、后2期消化代谢试验,每期试验前均有7 d的预试期,正试期3 d。每组选取较接近平均体重的供试验羊3只饲养于专用消化代谢笼内,采用全收粪、尿法进行2期3 d的消化代谢试验(预试期7 d),饲粮组成及饲喂方法与饲养试验相同,记录投料量及剩料量,并收集剩料,65 ℃烘干制成风干样后保存。每期连续3 d全收粪、尿。粪样取1 d粪量的10%,加入1/4粪重的10%酒石酸溶液,混匀后65 ℃烘箱内烘干至恒重,制成风干样保存,做好标记并记录数据;每天试验羊全部尿液经8层纱布过滤后加入10%硫酸,最后将3 d尿样混匀取5%保存,做好标记,保存在-20 ℃冰箱中备用。 1.6 测定指标及方法 1.6.1 干物质采食量(DMI)
每天饲喂前后准确记录投喂量和剩余量,收集剩料后2 h内测定干物质含量,计算DMI。 1.6.2 体重及平均日增重(ADG)
每隔14 d在晨饲前连续2 d空腹称重,依体重平均值计算试验羊在试验期不同阶段的ADG。 1.6.3 氮代谢
剩料、粪样、尿样中氮含量的测定均使用定氮仪(KDN-102C),采用张丽英[3]介绍的方法进行测定,计算食入氮量和粪氮、尿氮排出量。采用以下公式计算沉积氮和氮沉积率。
沉积氮(g/d)=食入氮(g/d)-粪氮(g/d)-尿氮(g/d); 氮沉积率(%)=(沉积氮/食入氮)×100。
1.6.4 体尺分别在试验羊147、156、186、217、247、278、308日龄用软尺和量杆测定体高、体长、胸深、胸宽、胸围、荐宽、荐高、管围,相应作为预试期和5、6、7、8、9、10月龄的数据。 1.6.5 血清生化指标
161、242和323日龄(分别作为5、8和10月龄的数据)时,晨饲前空腹颈静脉采血5 mL,静置2 h后3 500 r/min离心10 min,转移上清液液于2 mL离心管中,置于-80 ℃冰箱中保存待用,试验结束后用南京建成生物工程研究所提供的试剂盒及方法测定血清总蛋白(TP)、白蛋白(ALB)、葡萄糖(GLU)、尿素氮(UN)、总胆固醇(T-CHO)含量及谷草转氨酶(GOT)活性及谷丙转氨酶(GPT)活性。 1.7 数学模型表达式
目前,试验研究中最常用的3种非线性生长模型为Logistic、Gompertz和Von Bertalanffy。而在大量的地方山羊生长曲线拟合分析的研究结果中,Gompertz的拟合度最高[4, 5, 6]。同时,Gompertz模型满足Wellock等[7]对动物生长模型提出的标准,故本试验选用Gompertz模型对试验羊生长过程进行拟合。
y=Ae-Bexp(-kt)。
式中:y为动物在t时的体重或体尺;模型参数A为体重或体尺极限值;k为瞬时相对生长率;B为常数;拐点(绝对生长出现最大值[8])时间为k-1lnB;拐点y值为A/e。 1.8 数据统计与分析
试验数据采用Excel软件整理,用SPSS 20.0软件进行方差分析及非线性回归,用LSD与Duncan氏法进行组间差异显著性检验,用拟合度(R2)大小评价Gompertz模型。试验数据以“平均值±标准误”表示。 2 结果与分析 2.1 DMI
由表2结果可知,总体上,各月龄DMI随饲粮CP水平的升高而增加,其中,6、7月龄A组DMI极显著低于B、C组(P<0.01),但B、C组之间无显著差异(P>0.05);8月龄C组试验羊DMI极显著高于A组(P<0.01),B组高于A组低于C组,但差异不显著(P>0.05)。
| 表2 饲粮CP水平对崂山奶山羊DMI的影响 Table 2 Effects of dietary CP level on DMI of Laoshan dairy goats |
由表3结果可知,6~10月龄体重随饲粮CP水平的提高而增加,组间差异极显著(P<0.01)。不同月龄间比较,5月龄时,各组试验羊体重均有所增长,但与预试期差异不显著(P>0.05);A组试验羊6月龄时增重较少,与5月龄体重差异不显著(P>0.05),6~10月龄体重增幅较大,月龄间差异 显著(P<0.05);B和C组体重在5~10月龄增幅 较大,月龄间差异显著(P<0.05)。10月龄时A、B、C 3组试验羊分别较预试期增加了102.87%、128.87%、133.42%。根据Gompertz模型,饲粮CP水平与试验羊体重拐点有负相关的关系,A、B、C 3组试验羊体重拐点分别在6.57、6.05、5.90月龄,拐点体重分别为19.23、18.96、18.61 kg,即A组>B组>C组。
| 表3 饲粮CP水平对崂山奶山羊体重的影响 Table 3 Effects of dietary CP level on BW of Laoshan dairy goats |
由表4结果可知,在5、6、7月龄,试验羊ADG随饲粮CP水平的增加而增加,组间差异极显著(P<0.01);8~10月龄,饲粮CP水平对试验羊ADG无显著影响(P>0.05),数值上,8、9月龄B组试验羊ADG高于A、C 2组,C组高于A组,10月龄时,A组试验羊ADG最高,B组低于A组,高于C组。不同月龄间比较,A、B、C 3组试验羊ADG均为先升高后降低的趋势,分别在10、8、7月龄内出现最高ADG,之后开始下降。
| 表4 饲粮CP水平对崂山奶山羊ADG的影响 Table 4 Effects of dietary CP level on ADG of Laoshan dairy goats |
由表4结果可知,在5、6、7月龄,试验羊ADG随饲粮CP水平的增加而增加,组间差异极显著(P<0.01);8~10月龄,饲粮CP水平对试验羊ADG无显著影响(P>0.05),数值上,8、9月龄B组试验羊ADG高于A、C 2组,C组高于A组,10月龄时,A组试验羊ADG最高,B组低于A组,高于C组。不同月龄间比较,A、B、C 3组试验羊ADG均为先升高后降低的趋势,分别在10、8、7月龄内出现最高ADG,之后开始下降。 2.4 氮代谢
由表5结果可知,后期试验羊食入氮量、氮排出量均高于前期。A组后期氮沉积率高于前期,而B、C 2组后期氮沉积率均低于前期。前期A组试验羊食入氮量显著低于B、C2组(P<0.05),B组低于C组(P>0.05);A组尿氮排出量、沉积氮极显著低于B、C 2组(P<0.01),B组低于C组(P>0.05);试验羊粪氮排出量随食入氮量的增高而增加,但组间差异不显著(P>0.05)。后期C组试验羊食入氮量、尿氮排出量极显著高于A组(P<0.01),B组高于A组低于C组(P>0.05);C组试验羊粪氮排出量高于A、B组,但差异不显著(P>0.05)。随着食入氮量的增加,前期氮沉积率呈增加趋势,而后期呈现降低趋势。
| 表5 饲粮CP水平对崂山奶山羊氮代谢的影响 Table 5 Effects of dietary CP level on nitrogen metabolism of Laoshan dairy goats |
根据试验中试验羊食入氮量(x)及ADG(y)做出回归曲线为一元二次方程,试验羊在食入氮量为29.72 g/d时有最高ADG,为126.08 g/d(图1)。
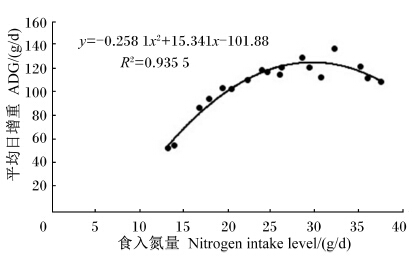 | 图1 崂山奶山羊食入氮量与ADG的关系 Fig. 1 The relationship between nitrogen intake and ADG of Laoshan dairy goats |
由表6结果可知,预试期和5月龄,饲粮CP水平对试验羊各体尺指标均无显著影响(P>0.05),6~10月龄各体尺的增长与饲粮CP水平呈极显著正相关关系(P<0.01)。随着试验的进行,各组均逐渐增加,A组在预试期至5月龄各体尺增长变化不显著(P>0.05),6~10月龄各月龄间差异显著(P<0.01);B、C组试验羊全期各月龄间差异显著(P<0.05)。从各体尺Gompertz模型中可以看出,试验羊各体尺的拐点时间随饲粮CP水平的升高而提前,但对拐点体尺的影响并不规律,各拐点体尺差异不显著(P>0.05)。各体尺拐点时间出现的先后顺序是管围、体长、体高、荐高、胸深、胸围、胸宽、荐宽。
| 表6 饲粮CP水平对崂山奶山羊体尺的影响 Table 6 Effects of dietary CP level on body size of Laoshan dairy goats |
由表7所示,随着饲粮CP水平的增加,各日龄血清总蛋白和葡萄糖的含量均升高,即A组 反刍动物DMI受到多种因素的影响,从饲粮营养因素来看,饲粮CP水平是影响反刍动物DMI的重要因素[9]。马向明等[10]测定了波尔山羊在不同CP水平(10.74%、12.00%、13.50%)下的DMI,结果发现CP水平12.00%组山羊的DMI最高,而CP水平13.50%组最低。本试验条件下,A组试验羊一直处于较低的DMI状态,直至9月龄时才与B、C 2组间无显著差异。这可能是10.74%的饲粮CP满足不了A组试验羊营养需求,致胃肠机能发育迟缓,对采食的刺激较小;而9月龄后3组试验羊胃肠机能发育至相似水平。B、C 2组间试验羊DMI在试验期内一直无显著差异,说明13.22%~15.74%的CP水平对试验羊DMI无影响。这与马向明等[10]的研究结果并不一致,可能是受所用试验动物品种及饲养环境等因素的影响所致。
3.2 饲粮CP水平对崂山奶山羊体重、ADG的影响
饲粮CP水平对动物的生长发育具有关键作用,许多学者研究表明,给断奶羔羊提供较高的CP水平的饲粮利于其体重的增加,并且饲粮中CP水平越高,山羊的增重就越快[11, 12, 13]。但Titi等[14]研究表明,高CP水平(18%)饲粮与中CP水平(16%)饲粮对山羊的体重并无显著影响,且试验后期,采食中CP水平(16%)饲粮的山羊体重大于采食高CP水平(18%)饲粮,说明过高CP水平并未对动物体重的增长产生积极的作用。本试验中,饲粮CP水平与试验羊体重之间存在着正相关关系。3组试验羊体重在5月龄时差异均不显著,6~10月龄,C组试验羊体重极显著高于A、B组,B组极显著高于A组,这与前人研究结果[15]相似;饲粮CP水平为15.74%时,试验羊体重最高,至于更高CP水平对其是否有影响还需进一步研究。通过Gompertz曲线方程可得出3组试验羊拐点体重分别为19.23、18.96、18.61 kg,拐点时间分别在6.57、6.05、5.90月龄,即3组试验羊达到性成熟的时间[16],这说明动物采食较高CP水平的饲粮可缩短性成熟的时间,提高繁殖效率。但A、B和C组试验羊实际最大ADG分别出现在10、8、7月龄,晚于模型中的拐点时间,这可能是由于营养及环境因素对试验羊生长产生较大影响,致试验羊实际生长与Gompertz拟合曲线间存在一定的差距。
通过对3组试验羊ADG的比较发现,不同CP水平的饲粮对试验羊ADG的影响与Coskuntuna等[17]的研究结果相同,即试验羊ADG随着饲粮CP水平的增加而增加。但CP水平并不能从很大程度上影响试验羊的绝对生长,从8月龄开始,CP水平对试验羊ADG的影响并不显著,至10月龄3组试验羊ADG维持在相近水平,且A组试验羊ADG高于B、C组,C组最低,这可能是由于A组试验羊达到性成熟的时间较B、C组晚,将绝对生长转缓点推后所致。
3.3 饲粮CP水平对崂山奶山羊氮代谢的影响
正常情况下,随着食入氮量的增加,粪氮、尿氮排出量也相应地增加。Mulligan等[18]认为试验牛食入氮量能够显著影响尿氮排出量,而粪氮排出量却相对稳定,与DMI呈一定比例。王星凌等[19]研究了饲粮CP水平(12.56%、13.96%、15.53%和16.93%)对中国荷斯坦奶牛氮利用的影响,结果发现,饲粮CP水平为12.56%、13.96%、15.53%的奶牛间的粪氮排出量无显著差异,16.93%组奶牛的粪氮排出量高于12.56%~15.53%组,随着饲粮CP水平的提高,尿氮排出量随之增加。本试验中,A组试验羊受低食入氮量的影响,粪氮、尿氮排出量均较B、C组低,而B、C 2组氮排出量较相似;全期来看,饲粮CP水平对粪氮排出量的影响并不显著,而对尿氮排出量的影响比较明显,这基本符合Mulligan等[18]的观点。前期A组试验羊尿氮排出量显著低于B、C 2组,而B、C 2组尿氮排出量相近,说明前期饲粮CP水平在13.22%~15.74%之间时,育成期崂山奶山羊尿氮排出量维持不变。后期随着饲粮CP水平的提高,尿氮排出量也上升,与王星凌等[19]的研究结果一致。通过计算,3组尿氮排出量分别占食入氮量的7.20%、14.17%、16.71%,可看出B、C组间的差距较A、B组间小得多,提示选择沉积氮较高而尿氮排出量较低的饲粮CP水平即可获得较高饲料报酬。
3.4 饲粮CP水平对崂山奶山羊体尺的影响
体尺指标作为动物生长发育的重要指标,显示了动物营养状态和遗传潜力间的作用关系[20]。本试验中,崂山奶山羊各体尺指标均随饲粮中CP水平的升高而升高;各体尺指标增幅中,胸围的增幅最大,体长和胸深增大幅度则次于胸围的增大幅度,这与张蓉等[21]的研究结果相同。从Gompertz模型公式得出各体尺指标出现拐点的顺序中可以看出,动物体尺的发育呈现出不平衡性,先增长长度和高度,其次是深度,最后是宽度和厚度[16]。同时还可发现,3组试验羊体长、体高、胸深、荐高、管围拐点较接近,说明这些体尺指标是由遗传决定的,而饲粮CP水平对其拐点的影响并不显著。
3.5 饲粮CP水平对崂山奶山羊血清生化指标的影响
血液生化物质的代谢规律可有效反映营养物质供给的状况。血清中总蛋白、白蛋白、尿素氮含量变化反映动物机体蛋白质代谢和吸收情况。当饲粮CP不足时,体内因缺乏合成多态性蛋白质的原料,就会使血液中的总蛋白、白蛋白及尿素氮的含量减少[22]。Abdelrahman[23]研究说明,血液中总蛋白的含量随饲粮中CP含量的增加而增加,两者呈显著的正相关,本试验结果与其一致。El-Shabrawy[24]发现,随着动物年龄的增加,血液中总蛋白、白蛋白含量逐渐升高。本试验中,3组试验羊血清中总蛋白及白蛋白含量均随试验的进行呈上升趋势,与El-Shabrawy[24]的结论一致。据Stanley等[25]报道,血清尿素氮含量可显示出饲粮CP在瘤胃中降解及氨基酸平衡的情况。正常情况下血清尿素含量比较稳定,但易受到食入氮量的影响[26]。本试验发现,随饲粮中CP水平的增加,试验羊血清中尿素氮的含量呈现缓慢升高的趋势,这与钟诚等[27]在青山羊上的研究一致。血液中葡萄糖是动物体内不可缺少的营养物质,不仅是动物代谢的唯一能源,也是合成脂肪代谢所必需的还原性辅酶的前提物质,在肝脏的合成与利用下,葡萄糖含量稳定于一定水平,过高过低都对动物机体都是不利的。本试验中,各组血清葡萄糖含量均在2.39~3.90 mmol/L之间,符合李建国等[28]报道的动物血清葡萄糖正常含量范围不应超过6.1 mmol/L的结果,说明饲粮CP水平对试验羊血清葡萄糖含量无过大影响。血液胆固醇含量反映了机体脂类的吸收情况,本试验发现,饲粮CP水平未对血清总胆固醇含量产生显著的影响,与余康等[15]对萨能羊的相关研究结果一致,说明CP水平对脂类吸收无显著影响。血液中谷丙转氨酶与谷草转氨酶活性在正常情况下处于稳定状态,当肝脏发生中毒、炎症时,造成细胞受损,谷丙转氨酶与谷草转氨酶便被释放至血液,使其活性升高[29]。本试验条件下,饲粮CP水平未对血清谷草转氨酶及谷丙转氨酶活性产生显著影响,说明试验饲粮对试验羊肝脏无不良影响。
4 结 论
根据食入氮量(x)与ADG(y)之间的关系y=-0.258 1x2+15.341x-101.88,育成期崂山奶山羊获得最佳生长性能的食入氮量为29.72 g/d。
![]()
表7 Effects of dietary CP level on serum biochemical indicators of Laoshan dairy goats
Table 7 Effects of dietary CP level on serum biochemical indicators of Laoshan dairy goats
| [1] | 戈新,王建华,张宝珣,等.营养水平对崂山奶山羊羔羊生长性能的影响[J]. 饲料研究,2011(3):60-61. ( 1) 1)
|
| [2] | NRC.Nutrient requirements of small ruminants:sheep,goats,cervids,and new world camelids[S]. Washington,D.C.:National Academy Press,2007. ( 1) 1)
|
| [3] | 张丽英.饲料分析及饲料质量检测技术[M]. 3版.北京:中国农业大学出版社,2007. ( 1) 1)
|
| [4] | 张媛,陈斌,李子刚,等.拟合马头山羊体重生长曲线研究[J]. 中国草食动物,2010(2):30-31. ( 1) 1)
|
| [5] | 姜勋平,刘桂琼,杨利国,等.海门山羊生长规律及其遗传分析[J]. 南京农业大学学报,2001,24(1):69-72. ( 1) 1)
|
| [6] | 冯敏山,李祥龙,刘铮铸,等.波尔级进杂交二代山羊体重及体尺生长曲线分析[J]. 中国畜牧杂志,2003,39(4):20-21. ( 1) 1)
|
| [7] | WELLOCK I J,EMMANS G C,KYRIAZAKIS I.Modelling the effects of thermal environment and dietary composition on pig performance:model logic and concepts[J]. Animal Science,2003,77:255-266. ( 1) 1)
|
| [8] | 李勇,蔡辉益,刘国华,等.国外利用生长模型预测动物生长及体组分的研究进展[J]. 当代畜禽养殖业,2011(9):59-64. ( 1) 1)
|
| [9] | VAN D T T.Some animal and feed factors affecting feed intake,behaviour and performance of small ruminants[D]. PhD Thesis.Uppsala:Acta Universitatis agriculturae Sueciae,2006:32. ( 1) 1)
|
| [10] | 马向明,杨在宾,王建民,等.波尔山羊生长期母羊能量及蛋白质需要量研究[J]. 中国草食动物,2009(3):35-36. ( 2) 2)
|
| [11] | RIOS-RINCON F G,ESTRADA-ANGULO A,PLASCENCIA A,et al.Influence of protein and energy level in finishing diets for feedlot hair lambs:growth performance,dietary energetics and carcass characteristics[J]. Asian-Australasian Journal of Animal Sciences,2014,27(1):55-61. ( 1) 1)
|
| [12] | AVILA-STAGNO J,CHAVES A V,HE M F,et al.Effects of increasing concentrations of glycerol in concentrate diets on nutrient digestibility,methane emissions,growth,fatty acid profiles,and carcass traits of lambs[J]. Journal of Animal Science,2013,91(2):829-837. ( 1) 1)
|
| [13] | FORBES J M.Voluntary food intake and diet selection of farm animals[M]. [S.l.]:CABI,2007:56. ( 1) 1)
|
| [14] | TITI H H,TABBAA M J,AMASHEH M G,et al.Comparative performance of Awassi lambs and Black goat kids on different crude protein levels in Jordan[J]. Small Ruminant Research,2000,37(1/2):131-135. ( 1) 1)
|
| [15] | 余康,孙爽,王玉红,等.不同蛋白质水平日粮对不同性别西农萨能羊羔羊生长发育的影响[J]. 中国畜牧兽医,2013,40(2):66-71. ( 2) 2)
|
| [16] | 李婉涛.动物遗传育种学[M]. 北京:中国农业大学出版社,2000:62-63. ( 2) 2)
|
| [17] | COSKUNTUNA L,OGUN S.The effect of different ration protein levels on the fattening performance in the Turkgeldi Lambs[J]. Pakistan Journal of Biological Sciences,2005,8(2):194-197. ( 1) 1)
|
| [18] | MULLIGAN F J,DILLON P,CALLAN J J,et al.Supplementary concentrate type affects nitrogen excretion of grazing dairy cows[J]. Journal of Dairy Science,2004,87(10):3451-3460. ( 2) 2)
|
| [19] | 王星凌,刘春林,赵红波,等.饲粮粗蛋白质水平对中国荷斯坦奶牛产奶性能、氮利用及血液激素的影响[J]. 动物营养学报,2012,24(4):669-680. ( 2) 2)
|
| [20] | 赵玉民.草原红牛及其改良群体遗传与营养互作研究[D]. 博士学位论文.长春:吉林农业大学,2007:32-33. ( 1) 1)
|
| [21] | 张蓉,刁其玉.碳水化合物组成对犊牛生长性能及消化代谢的影响[J]. 塔里木大学学报,2008,20(3):14-20. ( 1) 1)
|
| [22] | ABDEL-GHANI A A,SOLOUMA G M A,ABD EL MOTY A K I,et al.Productive performance and blood metabolites as affected by protected protein in sheep[J]. Open Journal of Animal Sciences,2011,1(2):24-32. ( 1) 1)
|
| [23] | ABDELRAHMAN M M.Protein requirements of growing Shami kids using protected methionine[J]. Journal of Animal and Plant Sciences,2013,17(1):2412-2424. ( 1) 1)
|
| [24] | EL-SHABRAWY H M.Performance of goats fed protected protein during gestation and lactation[J]. Egyptian Journal of Sheep,Goat and Desert Animals Science,2006,1(1):213-232. ( 2) 2)
|
| [25] | STANLEY C C,WILLIAMS C C,JENNY B F,et al.Effects of feeding milk replacer once versus twice daily on glucose metabolism in Holstein and Jersey calves[J]. Journal of Dairy Science,2002,85(9):2335-2343. ( 1) 1)
|
| [26] | 李茂,字学娟,周汉林,等.不同能氮水平日粮对生长期海南黑山羊血液生化指标的影响[J]. 中国农学通报,2009,25(22):17-20. ( 1) 1)
|
| [27] | 钟诚,方国玺,李凤双.青山羊血清含氮生化指标与蛋白质营养代谢关系的研究[J]. 山东农业大学学报,1986,17(1):83-88. ( 1) 1)
|
| [28] | 李建国,孙凤莉,李英,等.代乳粉对羔羊生产性能及血液生化指标的影响[J]. 动物营养学报,2006,18(1):37-42. ( 1) 1)
|
| [29] | KOTRONEN A,JUURINEN L,HAKKARAINEN A,et al.Liver fat is increased in type 2 diabetic patients and underestimated by serum alanine aminotransferase compared with equally obese nondiabetic subjects[J]. Diabetes Care,2008,31(1):165-169. ( 1) 1)
|




