豆粕是主要的蛋白质饲料,但是,豆粕中存在多种抗营养因子,在一定程度上会干扰养殖动物对饲料的消化、吸收和利用,造成养殖动物的生长性能下降。发酵豆粕是利用现代生物工程发酵技术,以优质豆粕为主要原料,将大豆蛋白分解为小分子的蛋白质、小肽、游离氨基酸,并将抗原蛋白降解为低抗原蛋白,同时产生大量的益生菌、乳酸以及未知生长因子等。在陆生动物上的研究表明,发酵豆粕能够促进仔猪肠道发育,改善肠道功能,降低腹泻率[1];可以增强黄羽肉鸡的肠道黏膜 免疫功能[2]。在水生动物上,已有的报道多集中 在发酵豆粕替代鱼粉的研究上,通常以鱼粉组为对照组,通过设置不同梯度得到一个推荐替代比例[3, 4]。目前少见同一批次豆粕发酵前后对鱼类生长性能和肠道组织结构影响的比较。研究证实,豆粕中的抗营养因子会导致大西洋鲑和虹鳟生长性能下降,肠黏膜发生病理变化[5]。因此,本试验拟探讨发酵豆粕替代豆粕对鲤鱼生长性能和肠道组织结构的影响,对发酵豆粕在水产动物配合饲料中应用的有效性进行评价,为生产实践提供理论依据。
1 材料与方法 1.1 试验饲料豆粕和发酵豆粕均由南通巴大饲料有限公司提供,二者为同一来源,即发酵豆粕是同一批次豆粕采用固态厌氧发酵低温干燥法(菌种包括2株地衣芽孢杆菌、2株枯草芽孢杆菌、2株酵母菌,干燥温度不超过60 ℃)制作而成。配制试验饲料前测定豆粕和发酵豆粕的营养组成,实测值见表1。小肽含量由酸溶性蛋白含量(三氯乙酸法测得)减去游离氨基酸含量得出。
| 表1 豆粕与发酵豆粕的营养组成(风干基础) Table 1 Nutrient composition of soybean meal and fermented soybean meal (air-dry basis) |
试验以玉米蛋白粉、豆粕、菜籽粕、棉籽粕为主要的蛋白质源,以豆油为脂肪源配制基础饲料(豆粕含量为39.00%),用发酵豆粕分别替代基础饲料中50%和100%的豆粕,配制成与基础饲料等脂等能的试验饲料1和试验饲料2。饲料组成及营养水平见表2。饲料原料混合均匀后,制成粒径为3.5 mm的颗粒饲料备用。
| 表2 饲料组成及营养水平(风干基础) Table 2 Composition and nutrient levels of diets (air-dry basis) |
试验在成都通威水产科技公司生态池中进行,试验鲤鱼由通威良种场提供。暂养结束后,选择体格健康、初始均重为(49.44±0.38) g的鲤鱼720尾,随机分到9口网箱(1.0 m×2.0 m×1.6 m)中。试验共分3组,每组3个重复(网箱),每个重复80尾鱼。Ⅰ组为对照组,饲喂基础饲料,Ⅱ和Ⅲ组为试验组,分别饲喂试验饲料1和试验饲料2。每天投喂4次,时间依次为08:30、11:30、14:30、17:30,投喂量为体重的2%~3%。溶解氧浓度在5.0 mg/L以上,透明度在40 cm以上,pH在8.0左右,平均水温在26 ℃左右,饲养周期为75 d。
1.3 样品采集与指标分析试验结束后,每组随机取10尾鱼,测定体重和体长,解剖取出内脏,分离肝胰脏并称重,剥离肠道并测量长度。
取中、后肠正中约1 cm长的肠样,固定于10%中性福尔马林溶液中按常规组织切片程序进行脱水、石蜡包埋、切片和苏木精-伊红(HE)染色,切片厚度5~6 μm,用目视测微尺测定每段肠样中10个以上完整皱襞的高度,取其平均值作为该样品皱襞高度的测定结果,同时观察肠道组织结构。
1.4 计算公式饲料系数(feed conversion ratio,FCR)=投饲量/(总增重+死鱼重量);
特定生长率(specific growth rate,SGR,%/d)=100×(ln终末均重-ln初始均重)/饲喂天数;
蛋白质效率(protein efficiency ratio,PER,%)=体增重/蛋白质摄入量;
肥满度(condition factor,CF,%)=100×体重/体长3;
内脏指数(viserosomatic index,VSI,%)=100×内脏重/体重×100;
肝胰脏指数(hepatosomatic index,HSI,%)=100×肝胰脏重/体重×100;
肠长指数(intestinal length index,ILI,%)=100×肠长/体长。
1.5 数据处理与分析
采用SPSS 18.0对数据进行单因素方差分析(one-way ANOVA),若差异显著(P<0.05),则用Duncan氏法多重比较检验组间的差异,结果用平均值±标准差表示。
2 结 果 2.1 发酵豆粕替代豆粕对鲤鱼生长性能的影响由表3可知,发酵豆粕替代50%或100%的豆粕后,饲料系数略有下降,但差异不显著(P>0.05);特定生长率在数值上略有提高,也无显著差异(P>0.05)。与对照组相比,Ⅱ组的蛋白质效率显著提高(P<0.05)。
| 表3 发酵豆粕替代豆粕对鲤鱼生长性能的影响 Table 3 Effects of soybean meal replacement by fermented soybean meal on growth performance of common carp |
由表4可知,发酵豆粕替代50%或100%的普 通豆粕后,肥满度和内脏比无显著变化(P>0.05),但肝胰脏指数显著升高(P<0.05)。
| 表4 发酵豆粕替代豆粕对鲤鱼肥满度、内脏指数、肝胰脏指数的影响 Table 4 Effects of soybean meal replacement by fermented soybean meal on CF,VSI and HSI of common carp |
由表5可知,发酵豆粕替代50%或100%的普通豆粕后,肠长指数和中肠皱襞高度无显著变化(P>0.05),但替代100%的豆粕后后肠皱襞高度显著升高(P<0.05)。
| 表5 发酵豆粕替代普通豆粕对鲤鱼肠道生长发育指标的影响 Table 5 Effects of soybean meal replacement by fermented soybean meal on intestinal growth and development indices of common carp |
肠道组织结构观察:豆粕组(Ⅰ组)肠道有轻微损伤,中肠出现少量上皮细胞脱落,固有层和黏膜下层中细胞成分增多(图1-A);后肠上皮细胞 纹状缘融合,杯状细胞减少(图2-A)。发酵豆粕 组(Ⅲ组)肠道细胞组织结构比较正常,上皮细胞排列整齐,上皮细胞纹状缘发达,黏膜层杯状细胞数量较多,黏膜下层较薄(图1-B和图2-B)。
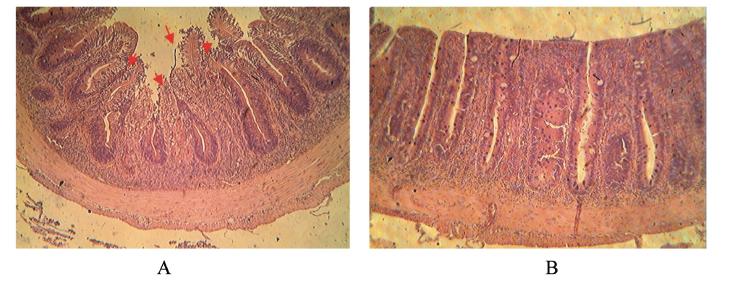 | A图中箭头指向为黏膜上皮细胞部分脱落,黏膜下层变宽。 The arrows in the Fig.A indicate sloughing of epithelium tip and increased width of submucosa. 图1 豆粕组(A)和发酵豆粕组(B)的中肠组织结构观察 Fig. 1 Observation of tissue structure of midgut in soybean meal group (A) and fermented soybean meal group (B) (100×) |
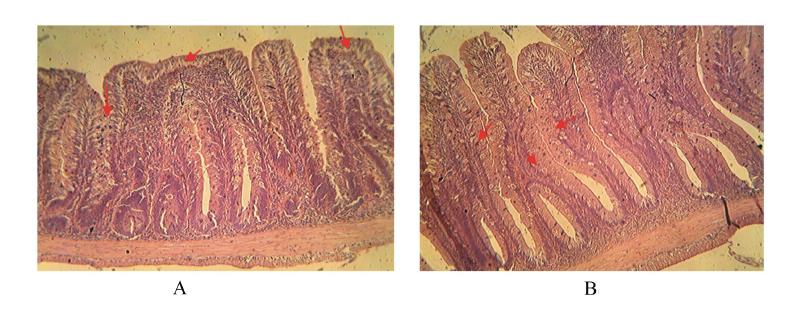 | A图中箭头指向为纹状缘融合,B图中箭头指向为大量杯状细胞。 The arrows in the Fig.A indicate a fusion of striated border, and the arrows in Fig.B indicate a lot of goblet cells. 图2 豆粕组(A)和发酵豆粕组(B)的后肠组织结构观察 Fig. 2 Observation of tissue structure of hindgut in soybean meal group (A) and fermented soybean meal group (B) (100×) |
本试验中发酵豆粕与豆粕为同一来源,是豆粕采用固态厌氧堆积发酵后得到的产品,其粗蛋白质含量较豆粕提高2.8个百分点,说明发酵使得豆粕的粗蛋白质含量有所提高。本试验结果与Hong等[6]和马文强等[7]的报道一致。豆粕发酵后其粗蛋白质含量提高可能有2个方面的原因:一方面,在发酵过程中,细菌的呼吸作用消耗了部分有机物料,使产物总量减少,蛋白质含量相对提高,出现蛋白质的“浓缩效应”;另一方面,有部分增加的蛋白质是细菌含有的菌体蛋白,这也是发酵产品中蛋白质含量提高的真正有意义的部分[8]。饲养试验结果表明,发酵豆粕替代50%或100%的豆粕后对鲤鱼的特定生长率和饲料系数都没有产生显著影响,表明豆粕发酵后对鲤鱼的生长性能没有明显的促进作用。
发酵产品中的酸溶性蛋白含量通常作为评价产品质量优劣的指标之一。本试验发现,豆粕经过发酵后使小肽的含量提高了7.88%,说明发酵能够提高豆粕中可溶性蛋白的含量,这与Hong等[6]的研究结果一致。动物肠道内对蛋白质的吸收除了以游离的氨基酸形式外,大部分是以小肽的形式进行。肠道对小肽的吸收除了具有吸收速度快、耗能低、不饱和等优点外,还可以消除氨基酸之间的竞争,从而提高动物对蛋白质的利用率。本试验结果发现,发酵豆粕替代50%或100%的豆粕后提高了鲤鱼的蛋白质效率。这说明,与豆粕相比,动物对发酵豆粕的蛋白质利用率更高。
3.2 发酵豆粕替代豆粕对鲤鱼肠道组织结构的影响肠道是鱼类吸收营养物质的主要场所[9]。肠道皱襞高度可反映鱼类肠道吸收面积,因此其可作为水生动物肠道吸收能力的重要标识[10]。本试验结果显示,发酵豆粕组后肠皱襞高度显著高于豆粕组,表明豆粕经发酵处理后有利于鲤鱼肠道的发育。大豆及其大豆制品引起肠道皱襞高度降低已有报道,例如:分离大豆蛋白替代白鱼粉导致幼建鲤前肠和后肠的皱襞高度降低,从而引起肠道消化吸收能力下降[11];去皮豆粕替代鱼粉后引起埃及胡子鲇肠道皱襞高度下降[12]。这可能与豆粕中含有的抗原分子抑制肠细胞的生长发育有关。Zhang等[13]研究发现,大豆β-伴球蛋白会抑制鲤鱼肠细胞的生长,进而阻碍肠道的生长发育。另外,Feng等[14]报道,豆粕发酵后产生的小肽能够促进猪小肠黏膜结构的生长发育。因此,豆粕经发酵处理后对肠道的生长发育有一定促进作用。
肠道的消化吸收能力与肠道结构密切相关。张锦秀等[15]报道,大豆分离蛋白和去皮豆粕替代鱼粉后导致鲤鱼前肠和后肠上皮细胞损伤,主要表现为上皮细胞脱落、上皮完整性和形态结构受破坏。此外,豆粕也引起鲤鱼[16]、大西洋鲑[17]后肠上皮脱落、吸收细胞中正常核上空泡减少或消失、黏膜皱襞中轴固有层变宽、结缔组织数量增加、固有层和黏膜下层出现明显的包括淋巴细胞、巨噬细胞和多核细胞在内的炎性细胞浸润、细胞核排列紊乱等肠道上皮完整性和正常形态结构的破坏。本试验中,豆粕组的鲤鱼肠道出现轻微上皮细胞脱落,而同样添加量的发酵豆粕组未见类似情况,这表明发酵处理能减少豆粕中抗营养因子以及抗原对鲤鱼肠道结构的损伤。肠道结构损伤会导致消化吸收能力下降,进一步会影响动物的生长性能[13]。在本试验中,豆粕和发酵豆粕对鲤鱼生长性能的影响并未表现出显著差异。但是,随着养殖时间的延长,豆粕引起的肠道结构损伤可能会降低鲤鱼的生长性能。在黄羽肉鸡上的研究发现,发酵豆粕能改善肉鸡的肠道黏膜免疫功能和微生物菌群[2]。Feng等[18]研究发现,发酵豆粕能提高断奶仔猪的肠道消化酶活力。因此,在饲料中使用发酵豆粕对保证动物的肠道健康有重要意义。
4 结 论① 发酵豆粕替代50%或100%的豆粕后对鲤鱼的生长性能没有明显的促进作用,但蛋白质效率有不同程度提高,表明发酵豆粕的蛋白质品质较普通豆粕有所提升。
② 发酵豆粕替代100%的豆粕后能显著提高鲤鱼后肠的皱襞高度,减少普通豆粕中抗营养因子对鲤鱼肠道结构的损伤,有利于维持肠道功能的正常。
| [1] | 王晓翠,王浩,李杰.发酵豆粕在断奶仔猪生产中的应用研究[J]. 动物营养学报,2011,23(6):919-923. ( 1) 1)
|
| [2] | 许丽惠,祁瑞雪,王长康,等.发酵豆粕对黄羽肉鸡生长性能、血清生化指标、肠道黏膜免疫功能及微生物菌群的影响[J]. 动物营养学报,2013,25(4):840-848. ( 2) 2)
|
| [3] | 罗智,刘永坚,麦康森,等.石斑鱼配合饲料中发酵豆粕和豆粕部分替代白鱼粉的研究[J]. 水产学报,2004,28(2):175-181. ( 1) 1)
|
| [4] | 李惠,黄峰,胡兵,等.发酵豆粕替代鱼粉对斑点叉尾生长和饲料表观消化率的影响[J]. 淡水渔业,2007,37(5):41-44. ( 1) 1)
|
| [5] | 周歧存,麦康森,刘永坚,等.动植物蛋白源替代鱼粉研究进展[J]. 水产学报,2005,29(3):404-410. ( 1) 1)
|
| [6] | HONG K J,LEE C H,KIM S W.Aspergillus oryzae GB-107 fermentation improves nutritional quality of food soybeans and feed soybean meals[J]. Journal of Medicinal Food,2004,7(4):430-435. ( 2) 2)
|
| [7] | 马文强,冯杰,刘欣.微生物发酵豆粕营养特性研究[J]. 中国粮油学报,2008,23(1):121-124. ( 1) 1)
|
| [8] | 杨旭,蔡国林,曹钰,等.固态发酵提高豆粕蛋白含量的条件优化研究[J]. 中国酿造,2008,27(5):17-20,38. ( 1) 1)
|
| [9] | LIN Y,XIAO Q Z.Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Aquaculture,2006,256(1/2/3/4):389-394. ( 1) 1)
|
| [10] | 伍曦,罗辉,冯琳,等.高水平维生素E对幼建鲤生长性能和消化吸收功能的影响[J]. 动物营养学报,2011,23(11):1938-1945. ( 1) 1)
|
| [11] | 张锦秀,周小秋,倪学勤.分离大豆蛋白对幼建鲤生长性能及肠道的影响[J]. 水产学报,2008,32(1):84-90. ( 1) 1)
|
| [12] | 吴莉芳,秦贵信,孙泽威,等.饲料中去皮豆粕替代鱼粉对埃及胡子鲇消化酶活力和肠道组织的影响[J]. 中山大学学报:自然科学版,2010,49(4):99-105. ( 1) 1)
|
| [13] | ZHANG J X,GUO L Y,FENG L,et al.Soybean β-conglycinin induces inflammation and oxidation and causes dysfunction of intestinal digestion and absorption in fish[J]. PLoS One,2013,8(3):e58115. ( 2) 2)
|
| [14] | FENG J,LIU X,XU Z R,et al.Effect of fermented soybean meal on intestinal morphology and digestive enzyme activities in weaned piglets[J]. Digestive Diseases and Sciences,2007,52(8):1845-1850. ( 1) 1)
|
| [15] | 张锦秀.大豆蛋白源对幼建鲤生长性能及肠道免疫的影响[D]. 硕士学位论文.雅安:四川农业大学,2003. ( 1) 1)
|
| [16] | URÁN P,GONÇALVES A,TAVERNE-THIELE J,et al.Soybean meal induces intestinal inflammation in common carp (Cyprinus carpio L.)[J]. Fish & Shellfish Immunology,2008,25(6):751-760. ( 1) 1)
|
| [17] | MURRAY H M,LALL S P,RAJASELVAM R,et al.A nutrigenomic analysis of intestinal response to partial soybean meal replacement in diets for juvenile Atlantic halibut,Hippoglossus hippoglossus,L.[J]. Aquaculture,2010,298(3/4):282-293. ( 1) 1)
|
| [18] | FENG J,LIU X,XU Z R,et al.The effect of Aspergillus oryzae fermented soybean meal on growth performance,digestibility of dietary components and activities of intestinal enzymes in weaned piglets[J]. Animal Feed Science and Technology,2007,134(3/4):295-303. ( 1) 1)
|




