内蒙古自治区是畜牧业大省,绵羊和山羊存栏数居全国首位。近年,由于过度放牧造成土地沙化、荒漠化日益严重,所以饲养方式正在由传统放牧向舍饲或半舍饲过渡。我国北方地区灌木植被较丰富,且具有蛋白质含量高、分布广、价格低廉等特点,将它们开发为反刍动物饲料将有助于解决舍饲和半舍饲条件下我国蛋白质饲料资源紧缺的问题。但鉴于多数灌木植被中含有大量单宁,单宁作为一种抗营养因子,影响反刍动物瘤胃正常发酵,降低纤维物质的分解及蛋白质的消化吸收。饲料中的单宁可以通过形成难消化的单宁-蛋白质复合物和降低消化酶的活性来影响蛋白质的消化[1]。前人研究表明,单宁对动物的负效应主要发生在胃肠道微生物区系层面[2, 3]。针对单宁的抗营养和毒性作用,科研人员进行了大量的研究,设法屏蔽或消除饲料中单宁的毒副作用。近年来,单宁吸附剂——聚乙二醇(PEG)在国内外被广泛用来进行单宁毒性的定性研究和屏蔽单宁对家畜营养代谢的副作用。Foley等[4]研究表明,添加PEG能够提高绵羊对柠条饲料营养物质的消化率,这主要是因为PEG同单宁竞争性结合,从而减弱了单宁对酶和微生物活性的抑制作用,大大提高了营养物质在瘤胃中的消化率和利用率。Motubatse[5]研究表明,在山羊放牧前补饲PEG可大大增加山羊对单宁含量高的粗料的自由采食量。杨加豹等[6]研究表明,添加10% PEG处理的刺槐叶粉可完全消除单宁的不利作用。虽然前人在PEG屏蔽单宁毒副作用方面开展了大量研究,但是单宁对瘤胃微生物区系的影响如何?添加PEG后可以提高动物对富含单宁饲料的采食量和消化率是否是由于其促进了瘤胃微生物的增殖?这方面前人报道较少。为此,本研究测定了在添加2%、6%的单宁以及添加6%单宁+12% PEG后绵羊和山羊瘤胃液pH、氨态氮(NH3-N)和菌体蛋白(MCP)的变化规律,并利用实时定量PCR(RT-PCR)方法定量检测了绵羊和山羊瘤胃固、液相[7]以及全混合食糜中附着的3株优势纤维降解菌——白色瘤胃球菌(Ruminococcus albus,R. albus)、黄色瘤胃球菌(Ruminococcus flavefaciens,R. flavefaciens)、产琥珀酸拟杆菌(Fibrobacter succinogenes,F. succinogenes)的数量变化,以期从瘤胃微生物的角度来探明单宁影响绵羊和山羊对营养物质的消化机制,为开发富含单宁的非常规饲料资源提供科学依据。
1 材料与方法 1.1 试验动物与饲粮 1.1.1 试验动物选用体况良好的1.5岁、体重约45 kg、安装永久性瘤胃瘘管的蒙古绵羊和内蒙古白绒山羊各4只。试验动物按照维持需要的1.2倍饲养,饲养标准参照文献[8]。试验动物统一驱虫,单笼饲养。
1.1.2 基础饲粮试验动物饲喂精粗比为30 ∶ 70的基础饲粮。粗料为青干草,精料为商品羊育肥料(内蒙古正大有限公司)。试验动物每天饲喂2次,自由饮水。基础饲粮营养水平见表1,饲粮中干物质(DM)、有机物(OM)、粗蛋白质(CP)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)和磷(P)的含量按照张丽英[9]的方法测定。
| 表1 基础饲粮营养水平(风干基础)Table 1 Nutrient levels of the basal diet (air-dry basis) |
本试验采用自身对照试验设计,分4期进行,每期试验30 d,其中预试期12 d,正试期18 d。在正试期的第1天晨饲后6 h采集瘤胃内容物测定瘤胃发酵参数和纤维降解菌的数量。试验包含4组,分别为Ⅰ组(对照组,第1期)、Ⅱ组(第2期)、Ⅲ组(第3期)和Ⅳ(第4期)。Ⅰ组饲喂基础饲粮,Ⅱ组和Ⅲ组在饲喂基础饲粮的基础上分别额外添加占采食量2%和6%的单宁,Ⅳ组在饲喂基础饲粮的基础上额外添加占采食量6%单宁+12% PEG。
1.3 单宁与PEG的添加方法单宁(相对分子质量1 701.2)购自国药集团化学试剂有限公司,根据动物每日的采食量将单宁按添加水平称量后均匀混合到每日投喂的精料中供动物采食,待精料全部采食完再投喂粗料。PEG(相对分子质量4 000)购自美国Biosharp公司。前人和本课题组前期研究均指出,PEG的添加量为单宁添加量的2倍时屏蔽单宁毒副作用的效果最佳[10, 11],为此本研究中Ⅳ组PEG的添加量为12%。PEG的投喂方式与单宁相同。
1.4 测定指标与样品制备 1.4.1 测定指标测定绵羊和山羊瘤胃液pH、NH3-N和MCP浓度;采用RT-PCR技术测定绵羊和山羊瘤胃固、液相及全食糜中附着的白色瘤胃球菌、黄色瘤胃球菌和产琥珀酸拟杆菌的数量。
1.4.2 瘤胃内容物的采集与样品的制备在每个正试期第1天,晨饲6 h后从试验动物瘤胃腹囊中采集瘤胃内容物,搅拌均匀用于测定pH;将部分瘤胃内容物迅速分装于冻存管内(定义为全食糜),剩余瘤胃内容物迅速经4层纱布过滤,将残渣(定义为固相)和滤液(定义为液相)分装于自封袋和冻存管内,在液氮中速冻后置于-80 ℃保存,用于纤维降解菌定量。其余滤液经4 000 r/min,离心15 min,取0.5 mL瘤胃液加到预先装有9.5 mL 0.2 mol/L盐酸的玻璃瓶中,用于NH3-N浓度测定。剩余瘤胃液用于测定MCP浓度。NH3-N和MCP待测样品均-20 ℃保存。
1.5 指标测定方法 1.5.1 瘤胃发酵参数的测定方法pH使用pHS-2型酸度计测定;NH3-N浓度参照冯宗慈等[12]提出的比色法进行测定;MCP浓度参照Bradford[13]提出的考马斯亮蓝法进行测定。
1.5.2 瘤胃微生物总DNA的提取采用珠磨砚法提取瘤胃液微生物总DNA,本方法的关键步骤是玻璃珠的用量和振荡破碎细胞及蛋白质的去除。用苯酚 ∶ 氯仿 ∶ 异戊醇(25 ∶ 24 ∶ 1)使蛋白质变性,变性时间确定为15 min,目的是使蛋白质彻底变性并完全去除,从而提高DNA产物的纯度。加入氯仿 ∶ 异戊醇(24 ∶ 1)抽提时,静置时间应足够长,以便离心后液面分界更加清晰,更容易吸取上清,避免蛋白质污染。
1.5.3 3株纤维降解菌的引物设计与合成引物序列及参数见表2,委托上海生工生物股份有限公司合成。
| 表2 瘤胃纤维降解菌的PCR引物Table 2 PCR primers for ruminal cellulolytic bacteria |
反应体系25 μL:模板(粗提总DNA)2 μL,Priemix Taq(TaKaRa Taq Version 2.0 plus dye)12.5 μL,目标基因上游引物、下游引物(10 μmol/L)各1 μL ,双蒸水8.5 μL。
反应程序:95 ℃预变性5 min;95 ℃变性30 s,54~57 ℃(退火温度根据扩增目的基因不同采用不同温度,表2)退火40 s,72 ℃延伸 40 s,40个循环;72 ℃ 8 min,4 ℃保温。PCR扩增产物用1.5%琼脂糖凝胶电泳检测扩增效果并拍照,将目的片段用胶回收试剂盒(美国Axygen公司)进行回收。
1.5.5 PCR扩增产物的克隆按照pGM-T克隆试剂盒使用说明进行连接,连接体系10 μL:10×T4 DNA Ligation Buffer 1 μL,T4 DNA Ligase(3 U/μL)1 μL,pGM-T载体(50 ng/μL)1 μL,回收产物3 μL,双蒸水4 μL。16 ℃过夜连接后,取5 μL连接产物加到50 μL TOP10感受态细胞中,冰浴30 min,42 ℃水浴热激90 s,再冰浴2~3 min,加入500 μL的37 ℃预热的LB液体培养基,150 r/min、37 ℃振荡培养45 min。取100 μL菌液涂于加有Amp、X-gal、IPTG的LB固体培养基平板上,倒置平板,37 ℃培养12~16 h。
1.5.6 阳性质粒的筛选及鉴定挑取蓝色菌斑周围的单个白色菌斑接种到5 mL LB液体培养基(含50~100 μg/mL氨苄青霉素)里,37 ℃振荡培养过夜,进行菌落PCR测定,鉴定为阳性菌落的送检测序。 测序工作委托华大基因科技服务有限公司进行。将阳性质粒测序结果在NCBI的Blast上比对分析,验证正确的菌液,用美国Axygen公司的质粒提取试剂盒提取质粒,制作标准品。
1.5.7 RT-PCR标准曲线的制作提取的质粒用酶标仪测定核酸浓度,并检验质粒的提取纯度,根据下列公式计算出质粒拷贝数,制备标准品。
质粒拷贝数(个/μL)=[6.02×1023(个/mol)×DNA(ng/μL)]/{DNA长度(bp)×660[g/(mol·bp)]}[16]。
然后用已知拷贝数的质粒以10倍浓度梯度稀释至少5个梯度,每梯度3个重复进行RT-PCR,同时用无酶水做阴性对照,根据RT-PCR仪(美国Illumina公司)的Eco软件获得质粒拷贝数和循环阈值(Ct)对应的线性关系的标准曲线。
1.5.8 3株纤维降解菌RT-PCR检测制作质粒标准品的PCR条件和待测样品RT-PCR条件一致,反应体系均为25 μL。定量前将样品浓度统一稀释至10 ng/μL,每个反应体系中加入同Priemix Taq相同量的荧光染料SYBR Green Ⅱ。每个样品3个重复。同时,每次反应都设空白对照并制备标准曲线,将Ct代入标准曲线计算得细菌拷贝数。固相、液相、全食糜中3株纤维降解菌拷贝数的计算公式如下:
细菌拷贝数(个/mL或个/g)=(MQ×C×VD)/(S×V)[17]。
式中:MQ为根据标准曲线Ct计算得到的细菌拷贝数(个);C为样品总DNA浓度(ng/μL);VD为溶解提取的总DNA的双蒸水的体积(μL);S为用于RT-PCR的DNA的量(ng);V为瘤胃液相(mL)或者固相(g)、全食糜内容物(g)样品的用量。
细菌数最终用细菌拷贝数的常用对数[lg(个/g)或lg(个/mL)]表示。
1.6 数据统计采用SAS 8.0软件包中的ANOVA过程进行方差分析,多重比较用Duncan氏法。以P<0.05作为差异显著性判断标准。
2 结 果 2.1 3株纤维降解菌的菌液PCR检测目标片段在胶回收之后进行克隆,挑取得单克隆菌落于液体培养基中,摇菌过夜之后,进行PCR检测,被确证为目的片段后送检测序,菌液PCR结果见图1,可见条带位置与预期PCR产物片段大小一致。
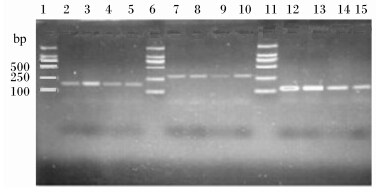 | 1、6、11:DNA分子质量标准 DNA molecule weight maker(DL2000); 2、3、5:白色瘤胃球菌 R.albus; 7、8、9、10:黄色瘤胃球菌 R.flavefaciens; 12、13、14、15:产琥珀酸丝状杆菌 F.succinogenes; 图1 3株纤维降解菌的菌液PCR检测Fig. 1 PCR detection of the three cellulolytic bacteria in bacterial liquid |
通过对阳性克隆插入片段的测序,结果表明阳性克隆片段与白色瘤胃球菌、黄色瘤胃球菌、产琥珀酸拟杆菌的片段同源性很高(92%~100%),且包含完整的引物序列,说明成功构建了有目的片段的质粒,该质粒可用于质粒标准品的制作。 2.3 质粒的标准曲线
对已知拷贝数质粒标准品进行10倍的连续梯度稀释,取5个稀释梯度作为模板进RT-PCR。每个梯度设置3个重复。以拷贝数的常用对数为纵坐标,Ct为横坐标。标准曲线见图2。从图2可以看出,这3株优势瘤胃纤维降解菌的斜率为-0.336 5~-0.216 4,相关系数大于0.993,扩增效率在94%~112%之间,符合RT-PCR的标准曲线要求,引物特异性较高。
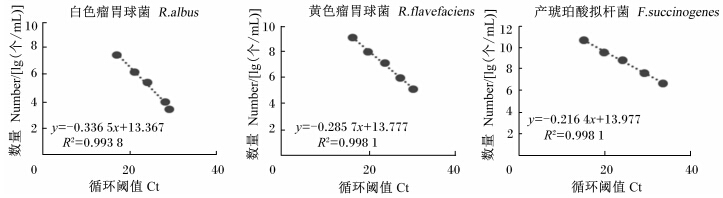 | 图2 3株纤维降解菌质粒的RT-PCR标准曲线Fig. 2 Standard curves of plasmids of the three cellulolytic bacteria for RT-PCR |
从表3可以看出,绵羊和山羊瘤胃液pH组间无显著差异(P>0.05)。山羊Ⅲ组的瘤胃液NH3-N浓度显著低于Ⅰ组(P<0.05),绵羊Ⅲ组的NH3-N浓度与Ⅰ组相比有降低的趋势(P>0.05)。绵羊Ⅱ组和Ⅲ组的瘤胃液MCP浓度显著低于Ⅰ组(P<0.05),山羊Ⅱ组和Ⅲ组的MCP浓度也均低于Ⅰ组(P>0.05)。添加PEG的Ⅳ组瘤胃液NH3-N和MCP浓度都高于单宁添加组,其中绵羊和山羊NH3-N浓度均显著高于Ⅲ组(P<0.05),MCP浓度Ⅳ组相对于Ⅱ组和Ⅲ组有所回升。绵羊和山羊之间比较,除Ⅱ组山羊瘤胃液MCP浓度显著高于绵羊(P<0.05)外,瘤胃液pH、NH3-N和MCP浓度均无显著差异(P>0.05)。
| 表3 不同水平单宁和高单宁饲粮中添加PEG对绵羊和山羊瘤胃发酵参数的影响Table 3 Effects of different levels of tannin and high tannin diets supplemented with PEG on ruminal fermentation parameters in sheep and goats |
从表4可以看出,添加单宁后绵羊瘤胃固相、全食糜、液相白色瘤胃球菌的数量均下降,其中液相Ⅱ组和Ⅲ组均显著低于Ⅰ组(P<0.05),固相Ⅲ组显著低于Ⅰ组(P<0.05)。添加单宁后山羊瘤胃固相和液相白色瘤胃球菌的数量低于Ⅰ组,其中固相Ⅱ组和Ⅲ组与Ⅰ组差异显著(P<0.05)。绵羊和山羊之间比较,Ⅱ组和Ⅲ组绵羊瘤胃固相白色瘤胃球菌的数量显著高于山羊(P<0.05),Ⅳ组绵羊全食糜和液相白色瘤胃球菌的数量均显著高于山羊(P<0.05)。添加PEG绵羊固相、全食糜、液相白色瘤胃球菌的数量均有所升高,Ⅳ组均显著高于Ⅲ组(P<0.05),Ⅳ组全食糜中的数量显著高于Ⅱ组(P<0.05)。山羊固相白色瘤胃球菌的数量Ⅳ组显著高于Ⅱ组和Ⅲ组(P<0.05)。
| 表4 不同水平单宁和高单宁饲粮添加PEG对绵羊和山羊瘤胃白色瘤胃球菌数量的影响Table 4 Effects of different levels of tannin and high tannin diets supplemented with PEG on ruminal quantity of R. albus in sheep and goats |
从表5可以看出,添加单宁后绵羊和山羊瘤胃固相和液相黄色瘤胃球菌的数量均下降,其中固相Ⅱ组和Ⅲ组显著低于Ⅰ组(P<0.05),液相Ⅲ组显著低于Ⅰ组(P<0.05)。绵羊和山羊之间比较,Ⅳ组绵羊瘤胃液相黄色瘤胃球菌的数量显著高于山羊(P<0.05),而固相则为山羊显著高于绵羊(P<0.05)。添加PEG后绵羊固相和全食糜、山羊固相黄色瘤胃球菌的数量均显著高于单宁添加组(P<0.05);液相黄色瘤胃球菌的数量随着单宁添加水平的升高而下降,且添加PEG后液相黄色瘤胃球菌的数量显著高于6%单宁添加组。
| 表5 不同水平单宁和高单宁饲粮添加PEG对绵羊和山羊瘤胃黄色瘤胃球菌数量的影响Table 5 Effects of different levels of tannin and high tannin diets supplemented with PEG on ruminal quantity of R. flavefaciens in sheep and goats |
从表6可以看出,添加单宁后绵羊瘤胃固相和全食糜,山羊瘤胃固相、全食糜和液相产琥珀酸拟杆菌的数量均下降,其中绵羊和山羊固相Ⅱ组和Ⅲ组均显著低于Ⅰ组(P<0.05);绵羊全食糜Ⅲ组、山羊Ⅱ组显著低于Ⅰ组(P<0.05)。绵羊和山羊之间比较,Ⅰ组绵羊液相产琥珀酸拟杆菌数量显著高于山羊(P<0.05),Ⅳ组绵羊固相显著低于山羊(P<0.05)。添加PEG后绵羊和山羊瘤胃固相和全食糜产琥珀酸拟杆菌数量均显著升高(P<0.05),且绵羊全食糜、山羊固相和全食糜产琥珀酸拟杆菌数量添加PEG组达到了Ⅰ组的水平或高于Ⅰ组。
| 表6 不同水平单宁和高单宁饲粮添加PEG对绵羊和山羊瘤胃产琥珀酸拟杆菌的影响Table 6 Effect of different levels of tannin and high tannin diets supplemented with PEG on ruminal quantity of F. succinogenes in sheep and goats |
单宁最主要的负作用是影响瘤胃微生物对蛋白质的降解[18]。本研究得出山羊6%单宁添加组瘤胃液NH3-N浓度显著低于Ⅰ组,这与前人的研究结果是一致的。MCP的合成需要各种营养物质的供应,其中瘤胃可利用能源和可利用氮源是其主要限制因素。Smith等[2]研究指出,单宁能与细菌的细胞壁和细胞膜形成复合物,导致细胞壁和细胞膜形态结构发生改变,从而影响细菌的增殖。本研究中2%和6%单宁添加组瘤胃液MCP浓度均低于Ⅰ组,一方面可能是由于单宁影响了瘤胃细菌的生长,使蛋白质分解菌、纤维降解菌等瘤胃细菌的数量减少,另外可能是由于瘤胃细菌数量的减少直接降低了饲粮中蛋白氮和非蛋白氮的降解,导致可供瘤胃厌氧真菌、纤毛虫和古菌利用的氮源较少,进而降低了MCP的产量。同时,本试验还发现,当基础饲粮中额外添加6%的单宁到试验期第20天左右时,绵羊与山羊的采食量出现不同程度的下降,精神萎靡,粪便粘稠,尿液浑浊,这与课题组前期研究报道的连续采食高比例柠条饲料后试验动物的表现是一致的[11],其原因可能是单宁在瘤胃中降解产生的大量低分子酚类化合物被瘤胃壁吸收,并在血液和体液中蓄积,影响了营养物质的正常代谢。
反刍动物可以有效地消化纤维含量高的粗料,主要是得益于瘤胃内的纤维降解菌。研究发现,饲粮结构会影响瘤胃内纤维降解菌的数量变化,而不同试验动物个体间的降解纤维的菌群也有差异[19]。单宁对动物的抗营养作用主要表现在以下几个方面:首先,单宁与唾液蛋白质和口腔黏液反应可引起收敛作用,对肠道产生刺激和系统毒性;其次,单宁会降低纤维素酶和蛋白水解酶活性,抑制瘤胃纤维降解菌和蛋白质降解细菌的生长[20];此外,单宁能沉降蛋白质,使消化道中的酶失活,从而降低蛋白质的利用率。研究表明,若经过一段时间适应或者接种已经适应含有单宁饲粮动物的瘤胃内容物可以使绵羊很好地利用含有单宁的饲粮,而不呈现出负面效应。单宁通常被认为是瘤胃微生物生长的抑制剂[3]。但也有研究表明,饲粮中含有适量的单宁对于反刍动物的生产性能及环境保护具有一定的积极作用,如降低蛋白质的瘤胃降解率、提高氮的利用率、抑制甲烷的排放、提高肉及乳的品质等[21]。Mueller-Harvey[22]认为,植物蛋白质最容易与单宁结合,因此,蛋白质的消化率下降是进食单宁后的典型反应,同时,也会影响到碳水化合物和淀粉的降解率。本试验研究得出,饲粮中添加2%和6%的单宁,山羊瘤胃固相白色瘤胃球菌、绵羊和山羊瘤胃固相内容物黄色瘤胃球菌和产琥珀酸拟杆菌的数量均显著下降。作者认为这一方面可能是由于单宁与饲粮蛋白质结合,导致瘤胃内细菌生长所必需的氮源减少,对细菌生长和繁殖产生了抑制作用。另一方面可能是由于单宁与细菌的细胞壁和细胞膜形成了复合物,使细菌的细胞壁和细胞膜形态结构发生改变[2],大大降低纤维降解菌的活性。
针对单宁的抗营养和毒性作用,科研人员研究得出,PEG可以同单宁竞争性结合,从而减弱单宁对酶和微生物活性的抑制作用。Moujahed等[23]的研究表明,采食了含单宁的饲粮的绵羊,当在其食用的营养舔砖中添加PEG时,绵羊瘤胃液总挥发性脂肪酸(TVFA)浓度同对照相比显著增加。金龙[24]研究表明,牧草中的缩合单宁能够减少瘤胃降解蛋白质细菌的数量,但添加PEG后,主要蛋白质降解菌的数量迅速增加。Provenza等[25]研究报道,当给绵羊饲喂含不同浓度的单宁饲粮时,绵羊能对PEG的摄取量进行自我调控,以消除单宁进入体内引起的不良反应。在放牧条件下,尽管嫩枝条含有更高的蛋白质,但绵羊却喜欢采食粗老的枝条,原因是嫩枝条的单宁含量较高,然而如果补饲PEG,绵羊便会更愿意采食嫩枝条。这表明PEG对单宁副作用的屏蔽效应影响了绵羊的采食行为[26]。本课题组前期研究表明,按照饲粮单宁含量的2~3倍添加PEG,可以显著提高绵羊瘤胃液NH3-N、MCP和TVFA浓度,提高氮的代谢率[11]。本研究得出,PEG添加组瘤胃液NH3-N浓度显著高于6%单宁添加组,MCP浓度相对于单宁添加组也有所回升;此外,与单宁添加组相比,添加PEG可以显著增加山羊瘤胃固相内容物中白色瘤胃球菌、绵羊和山羊瘤胃固相内容物黄色瘤胃球菌和产琥珀酸拟杆菌的数量,而且添加PEG组上述纤维降解菌的数量达到了与Ⅰ组相似的水平。这一结果表明,PEG可以削弱单宁对瘤胃纤维降解菌生长的负面影响,促进瘤胃细菌的增殖和瘤胃发酵。本研究中,试验动物是舍饲饲养的,室内的温度、湿度以及各方面饲养条件在4期试验中基本一致,因此,本试验中观察到的绵羊和山羊4组间瘤胃发酵参数以及瘤胃纤维降解菌数量的差异主要是由于试验的不同处理所导致的。
不同动物的胃肠道微生态存在差异,因此对抗营养因子的耐受程度也有区别。前人报道,山羊对单宁的耐受能力比绵羊强[27]。山羊在冬、春季节除了采食一部分易消化的牧草外,它们也会采食足够量的灌木来保证对富含单宁饲料的习服。山羊的这种牧食习性使其具有比绵羊更广阔的生存空间。本课题组前期研究发现,不同品质的粗料饲粮条件下绵羊和绒山羊瘤胃微生物区系存在显著差异,绵羊瘤胃厌氧真菌、原虫的数量以及纤维素酶活性显著高于绒山羊,而瘤胃总细菌和纤维降解菌的数量则显著低于绒山羊[28]。本研究得出,饲喂基础饲粮时,除绵羊瘤胃液相产琥珀酸拟杆菌的数量显著高于山羊外,2羊种瘤胃内3株纤维降解菌数量无显著差异;然而添加2%和6%单宁后,山羊瘤胃固相白色瘤胃球菌数量显著低于绵羊,这表明山羊的白色瘤胃球菌可能对单宁更加敏感,其机理还有待于进一步研究。
4 结 论① 添加单宁降低了瘤胃液NH3-N的浓度,影响瘤胃MCP的合成;添加单宁降低了绵羊和山羊瘤胃固相白色瘤胃球菌、黄色瘤胃球菌和产琥珀酸拟杆菌的数量。
② 添加PEG可以削弱单宁对纤维降解菌生长的负面影响,促进3种纤维讲解细菌的生长繁殖,改善瘤胃发酵状况。
③ 添加2%和6%单宁后,山羊瘤胃固相白色瘤胃球菌数量显著低于绵羊。
| [1] | 汪海峰.缩合单宁对反刍动物的营养作用[J]. 中国饲料,2004(12):26-28. ( 1) 1)
|
| [2] | SMITH A H,ZOETENDAL E G,MACKIE R I.Bacterial mechanisms to overcome inhibitory effects of dietary tannins[J]. Microbial Ecology,2005,50(2):197-205. ( 3) 3)
|
| [3] | PATRA A K,SAXENA J.Dietary phytochemicals as rumen modifiers:a review of the effects on microbial populations[J]. Antonie van Leeuwenhoek,2009,96(4):363-375. ( 2) 2)
|
| [4] | FOLEY W,IASON G,MAKKAR H.Transdisciplinary studies of plant secondary metabolites:lessons from ecology for animal science and vice versa[C]//第七届草食动物营养国际学术研讨会文集.北京:中国农业大学,2007:302-327.( 1) 1)
|
| [5] | MOTUBATSE M R,NG'AMBI J W,NORRIS D,et al.Effect of polyethylene glycol 4000 supplementation on the performance of indigenous Pedi goats fed different levels of Acacia nilotica leaf meal and ad libitum Buffalo grass hay[J]. Tropical Animal Health and Production,2008,40(3):229-238. ( 1) 1)
|
| [6] | 杨加豹,徐载春,田育军.刺槐叶单宁含量及聚乙二醇(PEG)对单宁抗营养作用的影响[C]//第四届中国畜牧兽医青年科技工作者学术研讨会论文集.北京:中国畜牧兽医学会,2001:69-72. ( 1) 1)
|
| [7] | 杨金丽,侯先志,高爱武.蒙古绵羊瘤胃固、液相附着微生物的RT-PCR检测[J]. 中国农业科学,2009,42(6):2126-2132. ( 1) 1)
|
| [8] | 张宏福.动物营养参数与饲养标准[M]. 2版.北京:中国农业大学出版社,2010:361,456. ( 1) 1)
|
| [9] | 张丽英.饲料分析及饲料质量检测技术[M]. 3版.北京:中国农业大学出版社,2007:48-145. ( 1) 1)
|
| [10] | SALEM A Z M,ROBINSON P H,EL-ADAWY M M,et al.In vitro fermentation and microbial protein synthesis of some browse tree leaves with or without addition of polyethylene glycol[J]. Animal Feed Science and Technology,2007,138(3/4):318-330. ( 1) 1)
|
| [11] | 刘艳玲.添加PEG对绵羊柠条日粮采食量、消化率及瘤胃发酵参数的影响[D]. 硕士学位论文.呼和浩特:内蒙古农业大学,2009. ( 3) 3)
|
| [12] | 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J]. 内蒙古畜牧科学,1993,21(4):40-41. ( 1) 1)
|
| [13] | BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254. ( 1) 1)
|
| [14] | KOIKE S,KOBAYASHI Y.Development and use of competitive PCR assays for the rumen cellulolytic bacteria:Fibrobacter succinogenes,Ruminococcus albus and Ruminococcus flavefaciens[J]. FEMS Microbiology Letters,2001,204(2):361-366. ( 1) 1)
|
| [15] | DENMAN S E,MCSWEENEY C S.Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J]. FEMS Microbiology Ecology,2006,58(3):572-582. ( 1) 1)
|
| [16] | LEE C,KIM J,SHIN S G,et al.Absolute and relative QPCR quantification of plasmid copy number in Escherichia coli[J]. Journal of Biotechnology,2006,123(3):273-280. ( 1) 1)
|
| [17] | 焦金真,王芃芃,汤少勋,等.浏阳黑山羊胃肠道不同部位重要功能微生物的数量分布特征研究[J]. 畜牧兽医学报,2013,44(10):1590-1599. ( 1) 1)
|
| [18] | MCSWEENEY C S,PALMER B,BUNCH R,et al.Isolation and characterization of proteolytic ruminal bacteria from sheep and goats fed the tannin-containing shrub legume Calliandra calothyrsus[J]. Applied and Environmental Microbiology,1999,65(7):3075-3083. ( 1) 1)
|
| [19] | WEIMER P J,WAGHORN G C,ODT C L,et al.Effect of diet on populations of three species of ruminal cellulolytic bacteria in lactating dairy cows[J]. Journal of Dairy Science,1999,82(1):122-134. ( 1) 1)
|
| [20] | MIN B R,ATTWOOD G T,MCNABB W C,et al.The effect of condensed tannins from Lotus corniculatus on the proteolytic activities and growth of rumen bacteria[J]. Animal Feed Science and Technology,2005,121(1/2):45-58. ( 1) 1)
|
| [21] | 徐晓锋,张力莉.单宁对反刍动物促营养作用的研究进展[J]. 动物营养学报,2011,23(12):2084-2089. ( 1) 1)
|
| [22] | MUELLER-HARVEY I.Unravelling the conundrum of tannins in animal nutrition and health[J]. Journal of the Science of Food and Agriculture,2006,86(13):2010-2037. ( 1) 1)
|
| [23] | MOUJAHED N,KAYOULI C,THEWIS A,et al.Effects of multinutrient blocks and polyethylene glycol 4000 supplies on intake and digestion by sheep fed Acacia cyanophylla Lindl.foliage-based diets[J]. Animal Feed Science and Technology,2000,88(3/4):219-238. ( 1) 1)
|
| [24] | 金龙.紫色达利菊提取缩合单宁对大肠杆菌和瘤胃氮代谢以及瘤胃微生物的影响[D]. 博士学位论文.哈尔滨:东北农业大学,2011. ( 1) 1)
|
| [25] | PROVENZA F D,BURRITT E A,PEREVOLOTSKY A.Self-regulation of intake of polyethylene glycol by sheep fed diets varying in tannin concentrations[J]. Journal of Animal Science,2000,78(5):1206-1212. ( 1) 1)
|
| [26] | TITUS C H,PROVENZA F D,PEREVOLOTSKY A,et al.Supplemental polyethylene glycol influences preferences of goats browsing blackbrush[J]. Journal of Range Management,2001,54(2):161-165. ( 1) 1)
|
| [27] | YÁÑEZ RUIZ D R,MOUMEN A,MARTÍN GARCÍA A I,et al.Ruminal fermentation and degradation patterns,protozoa population,and urinary purine derivatives excretion in goats and wethers fed diets based on two-stage olive cake:effect of PEG supply[J]. Journal of Animal Science,2004,82(7):2023-2032. ( 1) 1)
|
| [28] | 李大彪.绵羊和绒山羊采食行为以及对三种不同粗饲料日粮纤维消化率的比较研究[D]. 博士学位论文.呼和浩特:内蒙古农业大学,2007. ( 1) 1)
|



