2. 湖南农业大学动物科学技术学院, 长沙 410128;
3. 湖南农业大学园艺园林学院, 长沙 410128;
4. 内蒙古农业大学动物科学学院, 呼和浩特 010018
2. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China;
3. College of Horticulture Landscape, Hunan Agricultural University, Changsha 410128, China;
4. College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China
甲烷是仅次于二氧化碳的第二大温室气体,对全球温室效应的贡献率为15%~20%[1]。在全球家畜的甲烷排放量中,反刍动物占97%[2]。2010年,我国反刍家畜甲烷排放量为6.60 Tg[3](1 Tg=1012 g)。反刍家畜排放的甲烷产生于瘤胃和后肠中,据测定,约90%的甲烷由瘤胃产生[4]。另外,反刍家畜胃肠道甲烷排放是饲料能量损失的主要途径之一,可占机体摄入饲粮总消化能的2%~12%[5]。因此,反刍家畜胃肠道甲烷减排的重点在于降低瘤胃甲烷生成。
大黄(Rheum palmatum L.)是蓼科大黄属植物,多年生高大草本植物,在我国主要产于北方地区。大黄化学成分复杂,主要包括草酸钙、蒽醌类、多糖类、鞣质[6, 7, 8]。目前,许多研究表明,大黄具有良好的抗菌作用,尤其对厌氧细菌具有明显的抑制作用[9, 10, 11]。大黄可能对甲烷菌有抑制作用,能够增加瘤胃发酵氢气产量,但是其抑制甲烷生成机制的研究鲜见报道。大黄素属于蒽醌类化合物,是大黄有效抑菌成分之一,其可能改变瘤胃微生物发酵模式、抑制甲烷生成。本试验旨在研究大黄和大黄素对体外瘤胃甲烷、氢气和挥发性脂肪酸生成的影响,为研制反刍家畜甲烷抑制剂和研究甲烷抑制机制提供科学依据。
1 材料与方法 1.1 试验材料与设备 1.1.1 甲烷抑制剂大黄:试验选用药用大黄(Rheum officinale Baill.),105 ℃烘干后粉碎备用。
大黄素:将药用大黄用90%的乙醇在索氏提取器中回流提取后备用[12],成品大黄素含量98.5%。
1.1.2 人工瘤胃培养液选择3只健康、体重在(25.0±2.0) kg的成年湘东黑山羊,安装永久性瘤胃瘘管,作为瘤胃液供体动物,单笼饲养,自由饮水。饲粮精粗比为40 ∶ 60,精饲料组成为玉米47.00%,豆粕24.00%,麦麸22.00%,食盐0.77%,石粉2.23%,预混料4.00%。粗饲料为玉米秸秆,整个试验期内,每头瘘管羊每天饲喂精饲料200 g,粗饲料300 g,自由饮水。每天08:30和18:00分2次等量饲喂。人工瘤胃营养液的配制参照Menke等[13]的方法。晨饲前1 h,通过瘤胃瘘管采集新鲜瘤胃液,迅速装入保温瓶带回实验室。将采集的瘤胃液用6层脱脂纱布过滤,量取500 mL迅速加入到准备好的2 000 mL人工瘤胃营养液中(瘤胃液与人工瘤胃营养液体积比为1 ∶ 4),制成混合人工瘤胃培养液,其中整个过程的温度保持在39.5 ℃,通入纯二氧化碳以保持厌氧环境(以刃天青变成无色来判断),用磁力搅拌器搅拌以保持瘤胃液与营养液混合均匀。
1.1.3 体外瘤胃发酵设备本试验采用的全自动体外瘤胃发酵设备,包括厌氧瓶、三通电磁阀、培养箱、压力传感器、计算机和气相色谱仪[14]。培养箱设定:振荡频率50 r/min和培养温度39.5 ℃。厌氧瓶通过导管与三通电磁阀和压力传感器连接。压力传感器与计算机连接,每分钟测定并记录瓶中压力,通过压力与气体体积间关系计算气体生成量。三通电磁阀受计算机控制,当厌氧瓶中压力超过9 kPa,电磁阀打开,厌氧瓶中气体释放,并通过导管进入气相色谱仪(安捷伦7890A,美国)测定发酵瓶顶部空间氢气和甲烷含量。氢气(甲烷)产量根据厌氧瓶顶部空间大小、压力与气体体积的转化系数和氢气(甲烷)含量进行计算[15]。
1.2 试验方法 1.2.1 试验设计试验设8组:对照组(无任何处理,A组);大黄组的4个添加量分别是0.5、1.0、2.0和2.5 mg/mL(依次为B1、B2、B3和B4组),根据有关报道,药用大黄中有效抑菌成分蒽醌类含量为5%左右[16],大黄组中B1、B2、B3和B4组蒽醌类含量分别为0.025、0.050、0.100和0.125 mg/mL;大黄素组的3个添加量分别是0.06、0.12和0.24 mg/mL(依次为C1、C2和C3组)。每个培养瓶为1个平行,重复3次(每次所使用的供体瘘管羊不同)。
1.2.2 体外瘤胃发酵试验操作称取0.6 g底物(0.3 g玉米粉+0.3 g稻草秸秆)置入145 mL厌氧发酵瓶中,分别添加不同量的大黄或大黄素后,置于39.5 ℃的培养箱中预热。然后向厌氧发酵瓶中通入二氧化碳以保证发酵瓶中为厌氧环境。最后用瓶口分液器(Eppendorf)向每个发酵瓶中加入60 mL人工瘤胃培养液。
1.2.3 发酵液样品采集与挥发性脂肪酸产量测定24 h发酵终止后,取2 mL发酵液,15 000 r/min和4 ℃条件下离心10 min后,取1 mL上清液体,加入0.1 mL 25%偏磷酸固定,静置15 min后,-20 ℃保存并过夜。样品在常温条件下解冻,15 000 r/min和4 ℃条件下再次离心10 min,取0.6 mL装于测定瓶中,在气相色谱仪(安捷伦7890A,美国)中测定发酵液样品中挥发性脂肪酸各组分含量,计算产量。
1.3 计算公式应用非线性软件(NLREG)程序,按照Wang等[17, 18]的模型对体外瘤胃发酵产气曲线进行拟合,模型及相关参数的计算公式如下:
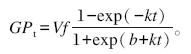
式中:GPt为t时刻的累积产气量(mmol/g),Vf为潜在最大产气量(mmol/g),k为产气速率[mmol/(g·h)],b为形状参数。下式同。
起始底物降解速率[FRD0,mmol/(g·h)],即当t=0时的底物降解速率,计算公式参考Wang等[17, 18]的模型,数学表达方程为:
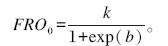
数据用Excel初步记录并做简单处理,然后采用SPSS 12.0软件对数据利用一般线性模型(GLM)程序进行方差(ANOVA)分析和Duncan氏法多重比较,使用正交多项比较(orthogonal polynomial contrast)分析各个指标随大黄和大黄素添加量变化的趋势。P<0.05时,差异显著。
2 结果与分析 2.1 大黄和大黄素对瘤胃发酵参数的影响添加大黄对体外瘤胃发酵气体生成曲线的影响较小(图1)。由表1可见,与对照组相比,B4组 潜在最大产气量、产气量和起始底物降解速率分别减少了21.7%、2.9%和23.4%(P<0.05)。随着大黄添加量的增加,产气量、产气速率和起始底物降解速率均呈先升高后降低的二次曲线变化趋势(P<0.05),潜在最大产气量呈线性上升的变化趋势(P<0.05)。与对照组相比,C3组显著降低了潜在最大产气量、产气量(P<0.05),各大黄素组均显著降低了起始底物降解速率(P<0.05)。随着大黄素添加量的增加,潜在最大产气量、产气量和起始底物降解速率均呈线性下降的变化趋势(P<0.05)。与对照组相比,C3组潜在最大产气量、产气量和起始底物降解速率分别减少了26.6%、29.2%和25.1%(P<0.05)。与大黄组相比,添加大黄素对体外模拟瘤胃发酵气体的生成曲线影响更大(图1)。C3组体外发酵产气量显著低于大黄组(P<0.05)(表1)。
 | 图1 不同添加量的大黄和大黄素对体外瘤胃发酵气体生成曲线的影响
Fig. 1 Effects of different supplemental levels of rhubarb and emodin on gas production curve of in vitro rumen fermentation |
| 表1 不同添加量的大黄和大黄素对体外瘤胃发酵产气参数的影响 Table 1 Effects of different supplemental levels of rhubarb and emodin on parameters of gas production of in vitro rumen fermentation |
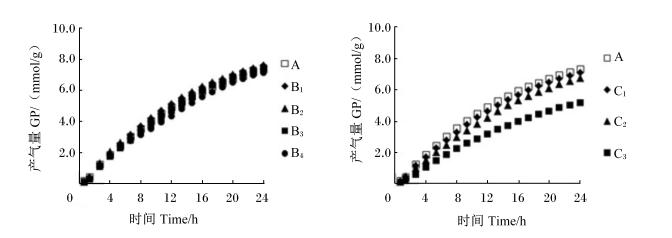
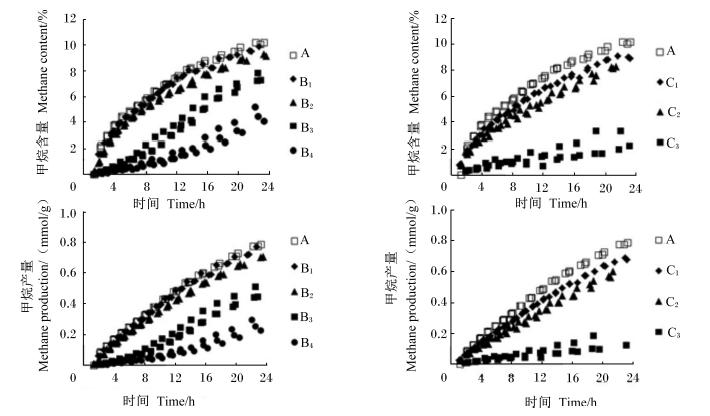
不同添加量的大黄和大黄素对体外瘤胃发酵甲烷、氢气含量及产量的影响见表2,甲烷含量及产量曲线见图2,生成速率曲线见图3,氢气含量及产量曲线见图4。
 | 图2 不同添加量的大黄和大黄素对体外瘤胃发酵甲烷含量及产量曲线的影响 Fig. 2 Effects of different supplemental levels of rhubarb and emodin on methane content and production curves of in vitro rumen fermentation |
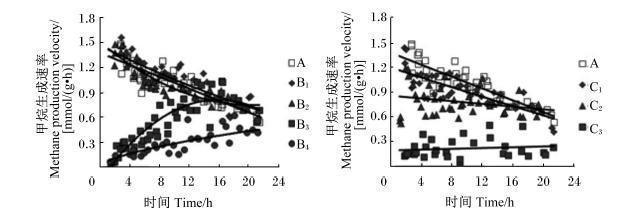 | 黑色实线反映了甲烷生成速率随着发酵时间的变化趋势。 Solid black line reflected the trend of rate of methane production against incubation time. 图3 不同添加量的大黄和大黄素对体外瘤胃发酵甲烷生成速率曲线的影响 Fig. 3 Effects of different supplemental levels of rhubarb and emodin on the velocity curve of methane production of in vitro rumen fermentation |
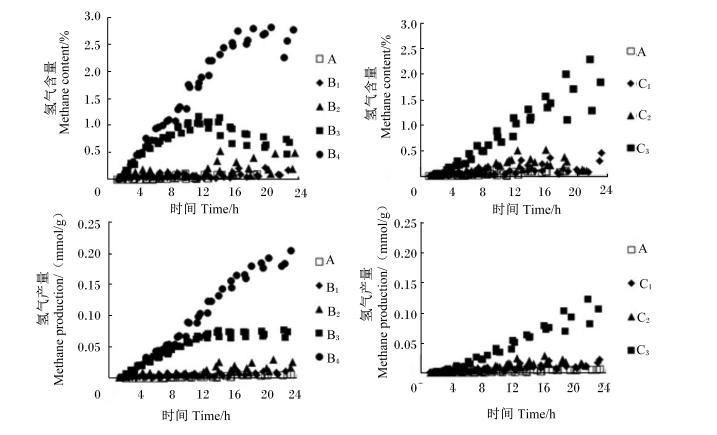 | 图4 不同添加量的大黄和大黄素对体外瘤胃发酵氢气含量及产量曲线的影响 Fig. 4 Effects of different supplemental levels of rhubarb and emodin on hydrogen content and production curves of in vitro rumen fermentation |
| 表2 不同添加量的大黄和大黄素对体外瘤胃发酵甲烷、氢气含量及产量的影响 Table 2 Effects of different supplemental levels of rhubarb and emodin on contents and production of methane and hydrogen of in vitro rumen fermentation |
添加大黄和大黄素对甲烷含量及产量的生成曲线影响较大(图2)。由表2可见,与对照组相比,B2、B3和B4组甲烷含量及产量显著降低(P<0.05),B1、B2、B3和B4组分别降低了5.1%、11.5%、39.7%、66.7%。随着大黄和大黄素添加量的增加,甲烷含量及产量呈线性下降的变化趋势(P<0.05)。随着发酵时间的推移,对照组、B1、B2组的甲烷生成速率均呈现不断下降的变化趋势;B3组的甲烷生成速率呈现先上升后下降的变化趋势;B4组的甲烷生成速率呈现不断上升的变化趋势;随着发酵时间的推移, C1和C2组甲烷生成速率呈现不断下降的变化趋势,C3组的甲烷生成速率最低且没有明显变化(图3)。由表2可见,与对照组相比,大黄素显著降低了甲烷含量及产量(P<0.05),C1、C2和C3组分别降低了12.8%、25.6%、80.8%。 2.2.2 氢气含量及产量
大黄素对氢气含量及产量的生成曲线影响较大(图4)。由表2可见,与对照组相比,B3、B4和C3组显著增加了氢气含量及产量(P<0.05)。随着大黄和大黄素添加量的增加,氢气含量及产量呈线性上升的变化趋势(P<0.05)。
B3组的氢气产量0~12 h呈现不断上升的变化趋势,12 h以后无明显变化,氢气产量是对照组 的12倍,氢气含量随时间呈现先上升后下降的变化趋势;B4组的氢气产量随时间呈现不断上升的变化趋势,其氢气产量是对照组的32倍,氢气含量0~16 h呈现不断上升的变化趋势,16 h以后无明显变化(图4)。由表2可见,C1和C2组氢气产量与对照组相近;C3组氢气产量及含量在0~24 h呈现不断上升趋势,氢气产量是对照组的17倍。
2.3 不同添加量大黄和大黄素对挥发性脂肪酸产量及组成的影响
由表3可知,添加大黄和大黄素影响了挥发性脂肪酸产量及组成。与对照组相比,B4和C3组乙酸、异丁酸产量和乙丙比显著降低(P<0.05),而丙酸产量无显著变化(P>0.05)。随着添加量的增 加,大黄组的乙酸、丙酸、丁酸和总挥发性脂肪酸 产量均呈先升高后降低的二次曲线变化趋势(P<0.05),异丁酸、异戊酸和乙丙比均呈线性下降的变化趋势(P<0.05),大黄素组的乙酸、异丁酸、异戊酸、乙丙比和总挥发性脂肪酸产量均呈线性下降的变化趋势(P<0.05),丙酸产量呈先降低后升高的二次曲线变化趋势(P<0.05)。
| 表3 不同添加量的大黄和大黄素体外发酵瘤胃挥发性脂肪酸产量和组成的影响 Table 3 Effects of different supplemental levels of rhubarb and emodin on volatile fatty acids production and composition of in vitro rumen fermentation |
许多研究表明,大黄含有大黄酸、大黄素、大黄酚、大黄甲醚和芦荟大黄素等蒽醌类的抑菌成分,具有抑制微生物活性的功能[19]。瞿冬梅[20]报道,大黄对金黄色葡萄球菌、大肠杆菌、沙门氏菌等常见细菌的最小抑菌浓度分别为6.250、3.125、6.250 mg/mL。熊炎斌等[21]通过体外试验证实大黄在6.250 mg/mL时能够抑制变形链球菌的生长,并且随着药物浓度的增加,抑菌作用逐渐增强。
本试验结果显示,添加2.5 mg/mL大黄显著降低了产气量和产气速率,说明大黄具有抑制瘤胃微生物活性的功能。但是,适当添加大黄可能增加或者不影响产气量和产气速率。大黄中含有较多容易被瘤胃微生物降解和利用的非结构性碳水化合物,其中包括脂肪酸、葡萄糖、果糖、淀粉、多糖等,有助于生成更多气体,进而导致其潜在最大产气量呈增多趋势。
体外模拟瘤胃发酵的起始底物降解速率(<12 h)有助于了解反刍家畜对饲料饲草的消化降解情况,原因在于反刍家畜瘤胃的液相和固相滞留时间分别小于14和22 h[22]。起始底物降解速率越大,越有助于反刍家畜对饲料饲草的消化和利用。尽管起始底物降解速率随大黄添加量增加呈先升高后降低的二次曲线变化趋势,但低剂量大黄对起始底物降解速率影响较小。这些结果提示,适当添加大黄可能不会影响反刍家畜对饲料饲草的降解、消化和利用。
大黄对瘤胃产甲烷菌具有直接抑制作用[23]。本次试验结果显示,添加大黄降低了甲烷含量及产量。大黄抑制甲烷生成可能与其蒽醌类成分有关。王丽凤[24]报道,9,10-蒽醌类可以降低瘤胃甲烷产生,这可能是因为蒽醌类能够直接作用于甲烷菌,阻断电子传递链,并在电子传递和与细胞色素有关的ATP合成的藕联反应中起解藕联作用,从而阻止甲基辅酶(CH3-CoM)被还原成甲烷,降低甲烷产量。Kung等[25]试验表明,蒽醌类可以显著减少甲烷产量,且甲烷产量随着蒽醌类浓度的提高不断下降。另有研究表明,大黄通过影响细菌叶酸和酶系统,进而阻碍细菌核酸和蛋白质合成,抑制细菌生长与繁殖。尽管大黄具有抑制甲烷生成的功能,但是大黄抑制甲烷生成的效果随着发酵时间的延长可能减弱。例如,大黄添加量为2.0 mg/mL时,甲烷生成速率随着时间呈现先上升后下降的趋势。甲烷生成速率呈上升趋势说明大黄抑制甲烷生成能力逐渐减弱,但是,随着发酵底物的消耗,甲烷生成速率最终呈现下降趋势。
氢气是甲烷菌利用二氧化碳合成甲烷的重要前体物质,甲烷菌活性抑制常常伴随氢气的累积。本试验显示,添加大黄(≥1.0 mg/mL)增加了氢气的含量及产量。这说明,大黄抑制了甲烷菌利用氢气,从而导致氢气累积。Kung等[25]试验表明,添加蒽醌类可以显著提高氢气产量。García-González等[23]认为蒽醌类可以直接作用于甲烷菌,对于甲烷菌的生长和繁殖产生抑制作用,进而导致甲烷的产量减少和氢气产量增加。
甲烷菌抑制不仅伴随着氢气产量增加,还会影响挥发性脂肪酸产量和组成。瘤胃内氢气(纤维降解)产量增加一方面会促进丙酸生成,另一方面会抑制乙酸的生成,最终使得丙酸产量增加,乙酸产量减少。本试验结果显示,大黄的添加改变了瘤胃的发酵模式,使其趋向于丙酸型发酵。而添加量为0.5和1.0 mg/mL的大黄没有显著影响挥发性脂肪酸产量及组成,这可能与大黄中的非结构性碳水化合物有关。额外添加的非结构性碳水化合物发酵有助于生成更多挥发性脂肪酸。Garcia-Lopez等[26]指出,添加蒽醌类使瘤胃内总挥发性脂肪酸及乙酸产量下降,丙酸和戊酸产量增加。大黄中的蒽醌类抑制瘤胃内甲烷的合成和氢气的消耗,氢气累积进而抑制挥发性脂肪酸生成和改变挥发性脂肪酸的组成。
3.2 大黄素对体外模拟瘤胃甲烷、氢气和挥发性脂肪酸生成的影响产气量不仅可以综合反映饲料饲草在瘤胃中的可发酵程度,还能体现瘤胃微生物活动的总体状况。产气量越高,瘤胃对碳水化合物降解、消化程度越强,有助于反刍家畜对饲料饲草能量的利用[27]。在本次试验结果中,大黄素组产气量均低于大黄组,其中0.24 mg/mL大黄素显著低于大黄组。大黄含有非结构性碳水化合物,会额外增加发酵底物中碳水化合物含量,从而使产气量增加。有研究结果表明,大黄素对革兰氏阴性菌和革兰氏阳性菌均有抑制作用,尤其是对常见的厌氧性细菌有较强的抑制作用,例如8 μg/mL大黄素能使76%~91%的厌氧菌生长受抑[28]。这些结果说明,大黄素是大黄的有效抑菌成分之一,添加大黄素会降低瘤胃对碳水化合物降解和消化。另外,大黄素显著降低了起始底物降解速率(<12 h),说明添加大黄素可能会影响反刍家畜对饲料饲草的降解、消化和利用。
大黄中蒽醌类约占5%[16]。大黄组B1、B2、B3和B4组蒽醌类分别为0.025、0.050、0.100和0.125 mg/mL。按照不同添加量大黄组和大黄素组的蒽醌类含量进行排序,各组蒽醌类含量的顺序应是C3>B4>C2>B3>C1>B2>B1。许多研究发现,随着蒽醌类含量增加,抑菌效果增强,理论分析各处理的抑菌强弱顺序为C3>B4>C2>B3>C1>B2>B1。本试验结果显示,尽管B3和C2组的蒽醌类含量相近(分别为0.10、0.12 mg/mL),B3组甲烷含量及产量显著低于C2组,B3组的氢气含量及产量显著高于C2组。这说明,B3组的甲烷生成抑制程度高于C2组。大黄素仅是蒽醌类中的一种成分,大黄的其他蒽醌类抑制甲烷生成的作用效果高于大黄素。
大黄素组的挥发性脂肪酸及各组分的产量变化趋势与大黄组相似,大黄和大黄素改变瘤胃发酵模式,即趋向于丙酸型发酵。大黄和大黄素抑制瘤胃甲烷生成,导致氢气累积,瘤胃氢分压升高,乙酸生成受到抑制,丙酸合成增加,降低了乙丙比。
4 结 论① 适当添加大黄(≤1.0 mg/mL)可能不会影响反刍家畜对饲料的降解、消化和利用,而大黄素的添加会显著降低起始底物降解速率,影响反刍家畜对饲料的降解、消化和利用。
② 大黄的蒽醌类中,含有抑制甲烷生成效果强于大黄素的化学成分。
③ 添加大黄(≥1.0 mg/mL)和大黄素,可以显著抑制瘤胃甲烷的生成,增加氢气产量,改变瘤胃的发酵模式,使其向丙酸发酵类型转变。
| [1] | DE VISSCHER A,VAN CLEEMPUT O.Simulation model for gas diffusion and methane oxidation in landfill cover soils[J]. Waste Management,2003,23(7):581-591. ( 1) 1)
|
| [2] | 程胜利,肖玉萍,杨保平,等.反刍动物甲烷排放现状及调控技术研究进展[J]. 中国草食动物科学,2013,33(5):56-59. ( 1) 1)
|
| [3] | 王荣,王敏,邓近平,等.基于IPCC Tier 1层级分析中国反刍家畜胃肠道甲烷排放格局和变化(1990-2010)[J]. 生态学报,2015,doi:10.5846/stxb201312022868. ( 1) 1)
|
| [4] | MURRAY R M,BRYANT,A M,LENG R A.Rates of production of methane in the rumen and large intestine of sheep[J]. British Journal of Nutrition,1976,36(1):1-14. ( 1) 1)
|
| [5] | JOHNSON K A,JOHNSON D E.Methane emissions from cattle[J]. Journal of Animal Science,1995,73(8):2483-2492. ( 1) 1)
|
| [6] | 南海江,许旭东,陈士林,等.大黄属植物研究进展[J]. 天然产物研究与开发,2009,21(4):690-701. ( 1) 1)
|
| [7] | 谢燕,李国文,马越鸣.大黄多糖研究进展[J]. 中国新药杂志,2010,19(9):755-758. ( 1) 1)
|
| [8] | 郭志伟,刘琳娜.大黄及其有效成分的药理研究概况[J]. 中国药房,2006,17(22):1741-1743. ( 1) 1)
|
| [9] | IBRAHIM M,KHAN A A,TIWARI S K,et al.Antimicrobial activity of Sapindus mukorossi and Rheum emodi extracts against H. pylori:in vitro and in vivo studies[J]. Word Journal of Gastroenterology,2006,12(44):7136-7142. ( 1) 1)
|
| [10] | AGARWAL S K,SINGH S S,VERMA S,et al.Antifungal activity of anthraquinone derivatives from Rheum emodi[J]. Journal of Ethnopharmacology,2000,72(1/2) :43-46. ( 1) 1)
|
| [11] | WANG J,ZHAO H,KONG W,et al.Microcalorimetric assay on the antimicrobial property of five hydroxyanthraquinone derivatives in Rhubarb (Rheum palmatum L.) to Bifidobacterium adolescentis[J]. Phytomedicine,2010,17(8/9):684-689. ( 1) 1)
|
| [12] | 朱庆玲,李瑞和,石文宏.大黄中大黄素的提取工艺研究[J]. 时珍国医国药,2006,17(3):388-389. ( 1) 1)
|
| [13] | MENKE K H,RAAB L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science,1979,93(1):217-222. ( 1) 1)
|
| [14] | MUETZEL S,HUNT C L,TAVENDALE M H.Brief communication:evaluating rumen fluid from sheep and cattle as inoculum in a newly developed automated in vitro rumen batch culture system[J]. Proceedings of the New Zealand Society of Animal Production,2011,71:240-242. ( 1) 1)
|
| [15] | WANG M,JANSSEN P H,SUN X Z, et al.A mathematical model to describe in vitro kinetics of H2 gas accumulation[J]. Animal Feed Science and Technology,2013,184(1/2/3/4):1-16. ( 1) 1)
|
| [16] | 肖培根,陈碧珠,王立为,等.大黄属的植物亲缘关系、化学成分与疗效间联系性的初步研究[J]. 药学学报,1980,15(1):33-39. ( 2) 2)
|
| [17] | WANG M,TANG S X,TAN Z L.Modeling in vitro gas production kinetics:derivation of Logistic-Exponential (LE) equations and comparison of models[J]. Animal Feed Science and Technology,2011,165(3/4):137-150. ( 2) 2)
|
| [18] | WANG M,TANG S X,SUN X Z,et al.Deriving fractional rate of degradation of logistic-exponential (LE) model to evaluate early in vitro fermentation[J]. Animal,2013,7(6):920-929. ( 2) 2)
|
| [19] | 李淑娟,董晓华,武海霞,等.大黄及其有效成分药理作用研究进展[J]. 医学综述,2005,11(l):76-78. ( 1) 1)
|
| [20] | 瞿冬梅.从中草药大黄中提取化妆品防腐剂的研究[D]. 硕士学位论文.无锡:江南大学,2009. ( 1) 1)
|
| [21] | 熊炎斌,李德玲,刘持平,等.几种植物药对变形链球菌生长、产酸、黏附影响的体外实验[J]. 中华口腔医学杂志,1997,32(5):261. ( 1) 1)
|
| [22] | OSHITA T,SUDO K,NONAKA S,et al.The effect of feed regimen on chewing time,digesta passage rate and particle size distribution in Holstein non-lactating cows fed pasture ad libitum[J]. Livestock Science,2008,113(2/3):243-250. ( 1) 1)
|
| [23] | GARCÍA-GONZÁLEZ R,LÓPEZ S,FERNÁNDEZ M,et al.Dose-response effects of Rheum officinale root and Frangula alnus bark on ruminal methane production in vitro[J]. Animal Feed Science and Technology,2008,145(1/2/3/4):319-334. ( 2) 2)
|
| [24] | 王丽凤.日粮中添加甲烷抑制剂对绵羊瘤胃中甲烷产量影响的研究[D]. 硕士学位论文.呼和浩特:内蒙古农业大学,2004. ( 1) 1)
|
| [25] | KUNG L,TUNG R S,SLYTER L L.In vitro effects of the ionophore lysocellin on ruminal fermentation and microbial populations[J]. Journal of Animal Science,1992,70(1):281-288. ( 2) 2)
|
| [26] | GARCIA-LOPEZ P M,KUNG L,ODOM J M.In vitro inhibition of microbial methane production by 9,10-anthraquinone[J]. Journal of Animal Science,1996,74(9):2276-2284. ( 1) 1)
|
| [27] | NEWBOLD C J,LASSALAS B,JOUANY J P.The importance of methanogens associated with ciliate protozoa in ruminal methane production in vitro[J]. Letters in Applied Microbiology,1995,21(4):230-234. ( 1) 1)
|
| [28] | 大黄素.百度百科 [2013-12-19]. http://baike.baidu.com/link?url=qqZXEVBB0yzx0T_eJtMLuMbgU4G3Mzd-olXehXXFbQ_HR6SfcEb2PmJtSLtPuYdm. ( 1) 1)
|




