牛磺酸是广泛存在于人和动物体内的一种游离的含硫活性物质,其不仅能从食物中直接获取,还能通过半胱氨酸氧化转氨基作用内源生成。大量研究已经证实牛磺酸具有多种生理功能,如抗氧化作用、抗炎症反应、维持糖代谢以及血管舒张等[1,2,3]。不仅如此,由于牛磺酸在动物机体内可同时作为神经递质,其在神经退化性疾病上的作用已经在动物营养和医疗等领域得到了广泛的关注。
肝脏是合成牛磺酸的主要场所,大量临床和基础研究表明牛磺酸对肝脏损伤有保护作用。如Wei等[4]研究报道,牛磺酸能够抑制分裂原激活的蛋白激酶(p38MAPK)的磷酸化以及核转录因子κB(NF-κB)的活性,从而缓解牛磺胆酸诱导的大鼠肝脏损伤。不仅如此,体外试验也证实了牛磺酸对氧化应激等诱导的肝脏细胞损伤也具有保护作用[5]。而目前关于牛磺酸预处理对脂多糖(LPS)诱导的小鼠急性肝脏损伤的保护作用研究较少,因此,本试验旨在探讨添加2.5%的牛磺酸对LPS诱导的小鼠急性肝脏损伤的缓解效果,以期为肝脏损伤的预防和治疗及牛磺酸在动物营养上的运用提供参考。 1 材料与方法 1.1 试验动物和试剂
30只癌症研究小鼠(ICR小鼠),雄性,体重(22±3) g,购于重庆市腾鑫生物技术有限公司。牛磺酸(T103829-100 g,纯度99%)和LPS(L118716,纯度99%)购于阿拉丁试剂有限公司。 1.2 试验设计
小鼠预饲3 d后,随机分为3组,每组10只(n=10):对照组和LPS组饲喂基础饲粮(基础饲粮购于重庆市腾鑫生物技术有限公司),牛磺酸组在基础饲粮中添加2.5%的牛磺酸。牛磺酸的添加量参照Maia等[6]的研究结果设定。小鼠饲养在人工控制的环境中,12 h光照(07:00—19:00)和12 h黑暗,温度(23±2) ℃,湿度(50±10)%,自由采食和饮水。正式试验开始1周后,LPS组和牛磺酸组小鼠腹腔注射10 mg/kg的LPS(LPS溶解于生理盐水,注射剂量为0.2 mL/只),对照组小鼠腹腔注射同体积的生理盐水。LPS注射24 h后,小鼠屠宰取样。 1.3 测定指标和方法 1.3.1 平均日增重和肝脏指数
试验期内,每日称量小鼠体重,计算平均日增重。LPS注射24 h后,所有小鼠颈椎脱臼死后无菌摘取肝脏,用滤纸吸去血液,用眼科剪剪去脂肪和系膜后称重,计算肝脏指数。 肝脏指数(g/kg)=肝脏重量(g)/体重(kg)。 1.3.2 血清谷丙转氨酶(ALT)和谷草转氨酶(AST)活性的测定
小鼠处死前,于眼眶采血,3 500 r/min离心10 min,取上清用全自动生化分析仪测定血清中ALT和AST活性,测定试剂盒购于南京建成生物工程研究所。 1.3.3 肝脏氧化应激参数的检测
准确称取部分肝脏组织,按重量(g) ∶ 体积(mL)=1 ∶ 9 的比例加入预冷的生理盐水,冰水浴条件下机械匀浆,2 500 r/min离心10 min,取上清用于检测肝脏丙二醛(MDA)含量以及谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性,检测试剂盒均购于南京建成生物工程研究所。 1.3.4 肝脏组织形态检测
取1 cm×1 cm×1 cm左右的肝脏组织样品,保存于10%的福尔马林溶液,然后制作石蜡切片,并进行苏木精-伊红(HE)染色。 1.3.5 肝脏抗氧化基因及转录因子E2相关因子2(Nrf2)、Kelch样ECH相关蛋白(Keap1)表达的测定
肝脏总RNA的提取参照Trizol说明书,然后取1 μg总RNA立即采用TaKaRa Prime Script RT Reagent Kit反转录试剂盒反转。实时荧光定量方法参照TaKaRa SYBR Premix Ex Taq定量试剂盒说明书。利用2-△△Ct对定量结果进行整理分析[5],△△Ct=(Ct靶基因-Ct内参基因)试验组-(Ct靶基因-Ct内参基因)对照组。实时荧光定量PCR引物序列见表1。
| 表1 实时荧光定量PCR引物 Table 1 The primer sequences for real-time qPCR |
用Excel对试验数据进行统计整理,然后采用SPSS 19.0对各组数据进行单因素方差分析(one-way ANOVA),然后用Duncan氏法进行多重比较,P<0.05为差异显著。数据均采用平均值±标准误表示。 2 结果与分析 2.1 牛磺酸对LPS处理小鼠平均日增重和肝脏指数的影响
由表2可知,LPS注射前,各组平均日增重无显著差异(P>0.05);注射LPS后,LPS组平均日增重较对照组显著下降(P<0.05),而牛磺酸组则与这2组均没有显著差异(P>0.05)。此外,LPS组肝脏指数较对照组显著上升(P<0.05),而牛磺酸组肝脏指数则与对照组差异不显著(P>0.05),说明添加牛磺酸缓解了小鼠肝脏损伤。
| 表2 小鼠平均日增重和肝脏指数 Table 2 Average daily gain and liver index of mice (n=10) |
由表3可知,与对照组相比,LPS组血清ALT和AST活性分别增加了61%和30%(P<0.05),由此可见LPS造成了小鼠肝脏损伤。与对照组相比,牛磺酸组血清ALT和AST活性分别增加了40%(P<0.05)和18%(P>0.05),这说明,在本试验中,添加2.5%的牛磺酸对LPS诱导的肝脏损伤起到了一定的缓解作用。
| 表3 小鼠血清ALT和AST活性 Table 3 Serum ALT and AST activities of mice (n=10) |
由表4可知,与对照组相比,腹腔注射LPS显著增加了肝脏MDA含量并降低了GPx的活性(P<0.05);添加牛磺酸对LPS引起的肝脏MDA含量增加和GPx活性降低起到了一定的缓解作用,但是差异不显著(P>0.05)。各组肝脏SOD和CAT活性均没有显著变化(P>0.05)。
| 表4 小鼠肝脏氧化应激参数 Table 4 Liver oxidative stress parameters of mice (n=10) |
由图1可知,对照组小鼠肝脏组织细胞排列紧密有序,结构完整,未出现任何损伤迹象;LPS组小鼠肝脏细胞排列紊乱疏松,且呈现出中性淋巴细胞侵润;而牛磺酸组较LPS组肝脏损伤情况要轻。
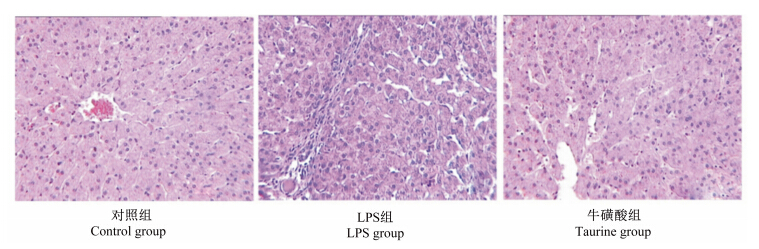 | 图1 肝脏形态学检测 Fig. 1 Liver morphological detection (400×) |
由图2可知,与对照组相比,腹腔注射LPS显著下调了肝脏GPx1、SOD1以及Nrf2的相对表达量(P<0.05);尽管添加牛磺酸对肝脏SOD1的相对表达量没有产生显著影响(P>0.05),但是显著上调了肝脏GPx1和Nrf2的相对表达量(P<0.05),并且GPx1的相对表达量还达到与对照组差异不显著(P>0.05)。此外,牛磺酸和LPS处理对肝脏GPx2、SOD2、CAT以及Keap1的相对表达量均没有显著影响(P>0.05)。
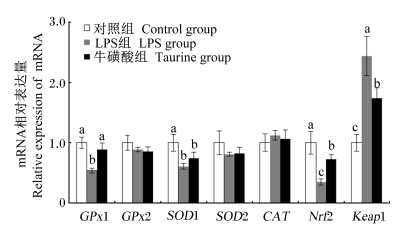 | GPx1:谷胱甘肽过氧化物酶1 glutathione peroxidase 1;GPx2:谷胱甘肽过氧化物酶2 glutathione peroxidase 2;SOD1:超氧化物歧化酶1 superoxide dismutase 1;SOD2:超氧化物歧化酶2 superoxide dismutase 2;CAT:过氧化氢酶 catalase;Nrf2:转录因子E2相关因子2 nuclear factor E2related factor 2;Keap1:Kelch样ECH相关蛋白1 Kelch like ECH associated protein 1。 同一指标数据柱无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 In the same index, value columns with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). 图2 小鼠肝脏抗氧化基因及Nrf2和 Keap1的表达 Fig. 2 The expression of liver antioxidant genes,Nrf2 and Keap1 of mice (n=10) |
Li等[7]研究表明,腹腔注射100 mg/kg的LPS显著增加了断奶仔猪肝细胞的核溶解、核固缩以及细胞增殖血液ALT和AST活性。Roller等[8]研究了LPS对小鼠肝脏的损伤作用,结果发现LPS诱导了肝细胞的凋亡反应,且显著增加了血液ALT和AST活性,其机制可能是由于LPS介导了环氧化酶的表达。在本试验中,注射10 mg/kg LPS影响了小鼠的肝脏形态和肝脏指数,且显著增加了血清ALT和AST活性,与上述前人报道一致。正常情况下,ALT和AST主要存在于肝脏细胞内,当肝脏受到损伤时,ALT和AST被释放进入血液,因此血液ALT和AST活性是主要的肝脏损伤指标[9]。Maia等[6]研究报道,添加2.5%牛磺酸能够显著缓解小鼠氧化应激损伤,且对生产性能具有一定的促进作用。因此,本试验选用2.5%作为牛磺酸的添加量,结果发现牛磺酸显著降低了小鼠的肝脏指数,并对LPS诱导的血清ALT和AST活性升高起到了一定的缓解。此外,其他一些研究也表明牛磺酸对四氯化碳(CCl4)和冷缺血再灌注诱导的大鼠肝脏损伤均具有保护作用[10,11]。然而,Deminice等[12]最近研究表明,添加牛磺酸并没有对胆碱缺乏诱导的大鼠肝脏损伤起到缓解作用。这可能是由于牛磺酸对不同肝脏损伤模型的敏感性存在差异等造成的。
许多研究已经证实,肝脏损伤往往伴随着氧化应激,且氧化应激对肝脏损伤或肝脏疾病的发生和发展具有促进作用[13,14]。Zhu等[15]研究表明,在CCl4诱导的大鼠肝脏损伤模型中,肝脏脂质氧化和MDA含量显著增加;Kim等[16]也报道了大鼠在急性热应激后肝脏MDA含量显著增加,微阵列分析发现与氧化应激和脂质过氧化反应相关的基因转录上调,脂质过氧化反应增强。在本试验中,注射LPS显著增加了小鼠肝脏MDA含量,并抑制了肝脏GPx的活性。MDA是脂质氧化产物,目前已经被广泛当作一种氧化应激标记物,而GPx是机体抗氧化系统的重要组成部分。由此可见,本试验中LPS诱导了小鼠肝脏氧化应激。近年来,牛磺酸的抗氧化作用已经得到证实,因此牛磺酸也被广泛用于氧化应激相关疾病的研究。Zhang等[17]建立了铁诱导的氧化损伤,结果表明添加牛磺酸显著缓解了脂质氧化,并提高了抗氧化物酶的活性,从而抑制了氧化应激介导的肝脏细胞凋亡。而在本试验中,尽管添加牛磺酸对LPS诱导的肝脏MDA含量增加和GPx活性降低具有一定的缓解作用,但是差异不显著。这与Jeon等[18]的研究结果存在一定的分歧,他们报道牛磺酸能够显著抑制LPS诱导的氧自由基产生,从而缓解了氧化损伤。通过仔细比较发现,Jeon等[18]的试验与本研究存在很大的差异,例如牛磺酸和LPS作用剂量和检测指标等,这些差异可能最终导致了研究结果的不一致。
抗氧化基因的表达对抗氧化物酶的释放起着直接调控作用,因此本试验进一步检测了肝脏抗氧化基因的表达。与肝脏抗氧化物酶活性一致,LPS抑制了肝脏GPx1和SOD1的表达,但是对GPx2、SOD2以及CAT的表达没有显著影响。此外,本试验还发现添加牛磺酸显著缓解了LPS对GPx1表达的抑制作用。目前有关于牛磺酸对GPx1表达的上调作用鲜有报道,但是Chang等[19]研究也表明,在饮水中添加0.35%或0.70%的牛磺酸可通过上调过氧化物酶体增殖物激活受体α(PPAR-α)和偶联蛋白2(UCP2)的表达介导SOD和CAT活性,从而缓解高脂饲粮诱导的小鼠肝脂肪变性和氧化应激。此外,Chen等[20]也报道了牛磺酸能够缓解酒精诱导的肝脏炎症基因上调,从而缓解氧化损伤。
大量研究表明,氧化应激能够激活多条信号通路,从而介导抗氧化基因转录与表达。Nrf2/Keap1信号通路是介导氧化应激的一条重要通路,研究表明,Nrf2敲出小鼠更容易受到氧自由基的攻击,造成氧化损伤[21,22]。此外,Nrf2/Keap1信号通路在肝脏疾病、癌症以及一些氧化应激相关疾病上起着重要的作用[23,24]。正常情况下,Nrf2在细胞质内与Keap1紧密结合,并快速降解。而在氧化应激条件下,Keap1蛋白半胱氨酸残基增多,从而引起Keap1结构发生变化,进而失去了与Nrf2结合的活性。细胞质游离的Nrf2能够转移到细胞核内,从而介导抗氧化基因转录和表达[25]。Nrf2/Keap1信号通路下游涉及到多种抗氧化基因的表达,其中包括GPx、SOD、CAT、过氧化物酶、硫氧还蛋白(Trx)、血红素加氧酶(HO-1)以及醌氧化还原酶等抗氧化物酶[25]。Agca等[26]研究表明,牛磺酸能够激活Nrf2信号,从而缓解糖尿病大鼠脑氧化损伤。此外,体外试验也证明了牛磺酸处理RAW 264.7巨噬细胞能够增加Nrf2向细胞核转移,并上调Trx和HO-1等抗氧化基因的表达,从而缓解过氧化氢(H2O2)诱导的氧化应激[27]。在本试验中,肝脏Keap1的表达没有受到LPS和牛磺酸的显著影响,LPS下调了肝脏Nrf2的表达,而添加牛磺酸显著缓解了LPS对Nrf2表达的抑制。由此可以推断,牛磺酸激活了Nrf2/Keap1信号通路,从而介导了抗氧化基因的表达,近增强了小鼠肝脏抗氧化能力并缓解了LPS诱导的肝脏损伤。 4 结 论
腹腔注射LPS诱导了小鼠肝脏损伤和氧化应激,而添加2.5%的牛磺酸显著降低了LPS诱导小鼠的肝脏指数,且上调了肝脏GPx1和Nrf2的表达,对LPS诱导的肝脏损伤和氧化应激均起到一定的缓解作用。
| [1] | RIPPS H,SHEN W.Review:taurine:a "very essential" amino acid[J]. Molecular Vision,2012,18:2673-2686. ( 1) 1)
|
| [2] | STIPANUK M H,UEKI I.Dealing with methionine/homocysteine sulfur:cysteine metabolism to taurine and inorganic sulfur[J]. Journal of Inherited Metabolic Disease,2011,34(1):17-32. ( 1) 1)
|
| [3] | STIPANUK M H.Role of the liver in regulation of body cysteine and taurine levels:a brief review[J]. Neurochemical Research,2004,29(1):105-110. ( 1) 1)
|
| [4] | WEI S D,HUANG Q Y,LI J Z,et al.Taurine attenuates liver injury by downregulating phosphorylated p38 MAPK of Kupffer cells in rats with severe acute pancreatitis[J]. Inflammation,2012,35(2):690-701. ( 1) 1)
|
| [5] | REDMOND H P,WANG J H,BOUCHIER-HAYES D.Taurine attenuates nitric oxide-and reactive oxygen intermediate-dependent hepatocyte injury[J]. Archives of Surgery,1996,131(12):1280-1287. ( 2) 2)
|
| [6] | MAIA A R,BATISTA T M,VICTORIO J A,et al.Taurine supplementation reduces blood pressure and prevents endothelial dysfunction and oxidative stress in post-weaning protein-restricted rats[J]. PLoS One,2014,9(8):e105851. ( 2) 2)
|
| [7] | LI Q,LIU Y L,CHE Z Q,et al.Dietary L-arginine supplementation alleviates liver injury caused by Escherichia coli LPS in weaned pigs[J]. Innate Immunity,2012,18(6):804-814. ( 1) 1)
|
| [8] | ROLLER J,LASCHKE M W,SCHEUER C,et al.Heme oxygenase (HO)-1 protects from lipopolysaccharide (LPS)-mediated liver injury by inhibition of hepatic leukocyte accumulation and improvement of microvascular perfusion[J]. Langenbeck's Archives of Surgery,2010,395(4):387-394. ( 1) 1)
|
| [9] | GURUNG R B,PURBE B,GYAWALI P,et al.The ratio of aspartate aminotransferase to alanine aminotransferase (AST/ALT):the correlation of value with underlying severity of alcoholic liver disease[J]. Kathmandu University Medical Journal,2013,11(43):233-236. ( 1) 1)
|
| [10] | TASCI I,MAS N,MAS M R,et al.Ultrastructural changes in hepatocytes after taurine treatment in CCl4 induced liver injury[J]. World Journal of Gastroenterology,2008,14(31):4897-4902. ( 1) 1)
|
| [11] | WETTSTEIN M,HÄUSSINGER D.Taurine attenuates cold ischemia-reoxygenation injury in rat liver[J]. Transplantation,2000,69(11):2290-2296. ( 1) 1)
|
| [12] | DEMINICE R,ROSA F T,DA SILVA L E C M,et al.Taurine supplementation does not decrease homocysteine levels and liver injury induced by a choline-deficient diet[J]. Life Sciences,2014,105(1/2):43-47. ( 1) 1)
|
| [13] | LIU Y T,YANG L Q,TAO K M,et al.Protective effects of hydrogen enriched saline on liver ischemia reperfusion injury by reducing oxidative stress and HMGB1 release[J]. BMC Gastroenterology,2014,14(1):12. ( 1) 1)
|
| [14] | MATSUO K,SASAKI E,HIGUCHI S,et al.Involvement of oxidative stress and immune- and inflammation-related factors in azathioprine-induced liver injury[J]. Toxicology Letters,2014,224(2):215-224. ( 1) 1)
|
| [15] | ZHU X,ZHANG F,ZHOU L,et al.Diallyl trisulfide attenuates carbon tetrachloride-caused liver injury and fibrogenesis and reduces hepatic oxidative stress in rats[J]. Naunyn-Schmiedeberg's Archives of Pharmacology,2014,387(5):445-455. ( 1) 1)
|
| [16] | KIM K J,HONG H D,LEE O H,et al.The effects of Acanthopanax senticosus on global hepatic gene expression in rats subjected to heat environmental stress[J]. Toxicology,2010,278(2):217-223. ( 1) 1)
|
| [17] | ZHANG Z Y, LIU D,YI B,et al.Taurine supplementation reduces oxidative stress and protects the liver in an iron-overload murine model[J]. Molecular Medicine Reports,2014,10(5):2255-2262. ( 1) 1)
|
| [18] | JEON S H,LEE M Y,RAHMAN M M,et al.The antioxidant,taurine reduced lipopolysaccharide (LPS)-induced generation of ROS,and activation of MAPKs and Bax in cultured pneumocytes[J]. Pulmonary Pharmacology & Therapeutics,2009,22(6):562-566. ( 2) 2)
|
| [19] | CHANG Y Y,CHOU C H,CHIU C H,et al.Preventive effects of taurine on development of hepatic steatosis induced by a high-fat/cholesterol dietary habit[J]. Journal of Agricultural and Food Chemistry,2011,59(1):450-457. ( 1) 1)
|
| [20] | CHEN X,SEBASTIAN B M,TANG H,et al.Taurine supplementation prevents ethanol-induced decrease in serum adiponectin and reduces hepatic steatosis in rats[J]. Hepatology,2009,49(5):1554-1562. ( 1) 1)
|
| [21] | KURZATKOWSKI D M,TROMBETTA L D.Maneb causes pro-oxidant effects in the hippocampus of Nrf2 knockout mice[J]. Environmental Toxicology and Pharmacology,2013,36(2):427-436. ( 1) 1)
|
| [22] | WRUCK C J,FRAGOULIS A,GURZYNSKI A,et al.Role of oxidative stress in rheumatoid arthritis:insights from the Nrf2-knockout mice[J]. Annals of the Rheumatic Diseases,2011,70(5):844-850. ( 1) 1)
|
| [23] | GIUDICE A,ARRA C,TURCO M C.Review of molecular mechanisms involved in the activation of the Nrf2-ARE signaling pathway by chemopreventive agents[J]. Methods in Molecular Biology,2010,647:37-74. ( 1) 1)
|
| [24] | SINHA D,BISWAS J,BISHAYEE A.Nrf2-mediated redox signaling in arsenic carcinogenesis:a review[J]. Archives of Toxicology,2013,87(2):383-396. ( 1) 1)
|
| [25] | STEPKOWSKI T M,KRUSZEWSKI M K.Molecular cross-talk between the NRF2/KEAP1 signaling pathway,autophagy,and apoptosis[J]. Free Radical Biology and Medicine,2011,50(9):1186-1195. ( 2) 2)
|
| [26] | AGCA C A,TUZCU M,HAYIRLI A,et al.Taurine ameliorates neuropathy via regulating NF-κB and Nrf2/HO-1 signaling cascades in diabetic rats[J]. Food and Chemical Toxicology,2014,71:116-121. ( 1) 1)
|
| [27] | JANG J S,PIAO S Y,CHA Y N,et al.Taurine chloramine activates Nrf2,increases HO-1 expression and protects cells from death caused by hydrogen peroxide[J]. Journal of Clinical Biochemistry and Nutrition,2009,45(1):37-43. ( 1) 1)
|




