2. 延边大学农学院, 延吉 133000
2. College of Agriculture, Yanbian University, Yanji 133000, China
多年来,反刍动物营养学家和微生物学家一直致力于通过调控瘤胃微生物系统来改善反刍动物家畜的生产效率,抗生素和离子载体的使用已经成功地实现了这个目标。然而,由于抗生素耐药性危机范围的扩大,欧盟已于2006年1月禁止了在动物饲料中使用抗生素。基于此,科学们家的兴趣转向了可以控制特定微生物菌群进而调控瘤胃发酵的抗生素替代品。研究表明饲粮中添加酵母菌制剂可以改善反刍动物健康及生产性能。因此,酵母菌制剂已经广泛应用于反刍动物营养中。尽管如此,目前关于酵母菌制剂在反刍动物生产中应用效果的报道并不一致,而导致其应用效果不一致的原因还不清楚。本文总结了近年来有关酵母菌制剂在反刍动物研究及应用的最新进展,在此基础上综述了酵母菌制剂对反刍动物生产性能的影响、可能的作用机制及影响其使用效果的因素,为深入认识酵母菌制剂的作用机制及其合理有效应用奠定基础。 1 酵母菌制剂简介
酵母菌作为一种有价值的动物饲料成分已经应用很多年。酵母菌是一种重要的蛋白质和氨基酸来源,同时酵母菌中富含维生素,尤其是B族维生素和维生素E及一些必需的矿物质和饲粮纤维资源[1]。此外,酵母菌的细胞壁中含有葡聚糖、甘露糖等多糖成分,这些多糖已被广泛的应用于非反刍动物营养中。酵母菌的化学组成主要取决于培养条件及生长基的组成,酵母菌概略营养组成见表1。
| 表1 酵母菌概略营养组成(干物质基础) Table 1 Approximate nutrient composition of yeast (DM basis)[1] |
反刍动物营养中应用较为普遍的酵母菌种是酿酒酵母菌。目前常见的用于动物产生的酵母菌制剂产品有2大类。一类产品保证高数量的活酵母菌,并作为活酵母菌制剂(LYC)销售,如活干酵母菌。这类产品普遍的特点是有高浓度的活性细胞(>109 CFU/g),干燥酵母菌仍保存着细胞活力及代谢活性,进入肠道后会与原肠道微生物相互作用,发挥“益生菌”的作用;另一类产品以含有酵母菌和用于酵母菌生长的培养基的方式销售,暂称为酵母菌培养物制剂(YC),这类产品一般不含或是仅含少量的活酵母菌,含有大量酵母菌培养物成分,它们只是作为营养活性成分和营养底物使用,在瘤胃中发挥“益生素”的效果。因为酿酒酵母菌不是正常的瘤胃微生物菌群的优势成员,所以不能在瘤胃中长期定植,一旦被摄入,稳定且较高的活酵母菌浓度能够在瘤胃中持续24~30 h,且没有显著生长,如果没有新的摄入,4~5 d后酵母菌浓度下降到无法检测的水平[2]。因此无论是以“益生菌”的活菌形式饲喂还是以“益生素”的培养物形式饲喂,在生产中都需要从饲粮中持续供给。 2 酵母菌制剂对反刍动物采食和生产性能的 影响 2.1 采食
目前关于酵母菌制剂对反刍动物采食量影响的报道并不一致。有的研究表明,YC增加了动物干物质(DM)采食量[3],而有的研究表明YC对动物DM采食量并没有影响,即使使用同种YC,其对DM采食量的影响也存在差异[4]。LYC对反刍动物采食量的影响也不一致。尽管如此,更多使用LYC的研究表明,LYC增加了奶牛[5]及肉牛[6]的采食量。此外,Bach等[7]的研究认为,使用LYC后动物的采食行为发生了明显的变化,与没有供给LYC的奶牛的采食间隔(4.32 h)相比,供给LYC的奶牛的采食间隔缩短(3.32 h),作者认为LYC改变的是动物的采食模式,而非采食量本身。因此,酵母菌制剂对动物采食的影响还存在争议,这可能与使用的产品种类、动物生理状态及基础饲粮有关。 2.2 增重、产奶量
虽然使用酵母菌制剂对动物生产力的影响并不总是正效应,但大多数的研究表明,酵母菌制剂对反刍动物生产性能的提高是有益的。研究表明,YC可以增加奶牛产奶量[8],提高肉牛的日增重[9],但同时也有无影响[10]甚至减少日增重的报道[11]。De Ondarza等[12]对饲喂奶牛同种LYC的14组试验数据分析后发现,LYC显著提高了产奶量(+1.15 kg/d)。此外LYC还改善了肉牛的平均日增重及末重[6]。一项对所有酵母菌制剂类型(YC和LYC)和所有奶用反刍动物(奶牛、奶山羊、母羊)荟萃分析的结论表明,添加酵母使产奶量提高了1.2 g/kg BW[13]。对酵母菌制剂用于肉用的反刍动物的影响的综合分析表明,影响效果从没有显著增加到可以增加日增重20%,平均增重为8.7%[14]。 2.3 产品质量
目前关于添加酵母菌制剂对反刍动物产品质量的影响并不一致。研究表明,YC添加能使乳脂率提高5.77%~33.46%,乳蛋白率略有增加,乳糖率有增有降,乳总固形物率显著增加[15];添加LYC显著提高了乳总固形物率[16],改善了乳的组成(乳脂率和乳蛋白率)[17]。也有研究表明LYC对乳脂率和乳蛋白率的影响并不显著,但是由于增加了总的产奶量,所以乳脂和乳中真蛋白质的产量要高于未添加LYC的对照组。Jouany[18]认为添加酵母菌制剂对奶牛生产性能和乳成分含量的积极影响可能源自采食量的增加和营养物质消化率的改善。关于酵母菌制剂对肉牛屠宰性能及肉品质的影响报道相对较少。最新的研究表明,添加YC降低了阉公牛的热胴体重,但却提高了牛肉的等级[11],说明酵母菌制剂对牛肉品质有一定的改善作用。 3 酵母菌制剂对反刍动物应用效果的可能机制
关于酵母菌制剂对反刍动物生产性能改善的原因已经被广泛地讨论,目前较为一致的观点在于其对瘤胃发酵环境的改善和对特殊微生物菌群生长及活性的影响[14]。关于酵母菌制剂对瘤胃微生物的影响机制目前还没有完全弄清,有研究者认为,酵母菌制剂提供的生长因子是对瘤胃特殊微生物菌群影响的原因所在。但有研究发现经高压蒸汽处理的酵母菌制剂(已失去代谢活性)对于增加瘤胃菌数量是没有效果的[19]。然而,有代谢活性的酵母菌制剂成功地增加了瘤胃微生物的数量[20]。因此,更多的研究者认为,酵母菌的代谢活性才是酵母菌制剂发挥有益作用的一个最重要原因。酵母菌可能通过对瘤胃内“氧气的消耗”及与瘤胃微生物“竞争发酵底物”或是产生对瘤胃微生物具有抑制效应的小肽,最终影响了瘤胃特殊菌群的生长和活性[21]。
尽管如此,以上提及的任何一种单一理论都不能完全解释酵母菌制剂对瘤胃微生物的影响。 因此,酵母菌制剂对瘤胃微生物的影响可能是各 种机制综合作用的结果。对此,需要开展更多的研究。酵母菌制剂通过对瘤胃内环境及微生物菌群的影响,促进了动物瘤胃发育、改善了瘤胃内环境、提高了饲料养分的消化及能量的利用、增强了动物免疫水平、维持了动物健康,最终改善了动物的生产性能(图1)。
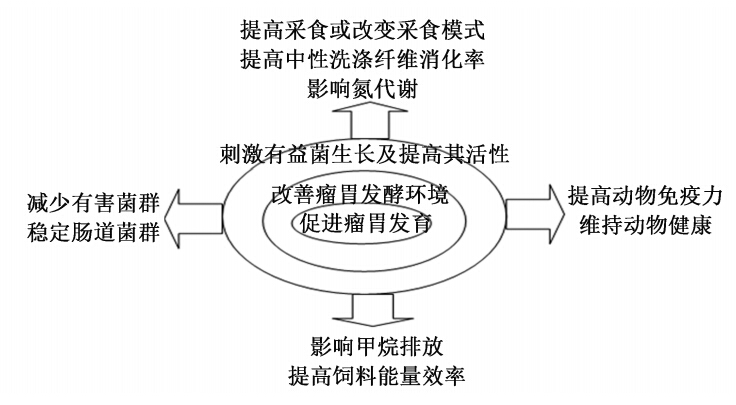 | 图1 酵母菌制剂对反刍动物的影响可能机制 Fig. 1 Possible mechanisms of yeast preparation for ruminants |
研究表明,酵母菌制剂可促进瘤胃发育。YC可以增加羔羊瘤胃乳头的高度、宽度及瘤胃壁的厚度[22]。LYC对牛生产性能的积极影响也与瘤胃发育参数如瘤胃乳头长度和宽度及瘤胃壁厚度的改善密切相关[9]。酵母菌制剂对瘤胃发育的影响与其加速瘤胃菌群的建立有关。每天给无菌的羔羊饲喂LYC,提高了纤维降解菌菌群在瘤胃的定植速率及菌群的稳定性[23]。只有细菌菌群在瘤胃定植后,纤毛原虫才能建立,给羔羊饲喂活干酵母菌后其瘤胃纤毛原虫定植更加迅速[24]。综上,酵母菌制剂可以加速反刍动物瘤胃微生物菌群的建立,间接地促进了瘤胃发育。 3.2 改善瘤胃发酵环境 3.2.1 对瘤胃中氧气含量的影响
酵母菌制剂对微生物活性的刺激可能与活酵母菌降低了瘤胃液中氧气的含量有关。尽管普遍认为瘤胃是厌氧的,但是瘤胃气体中仍含有0.5%~1.0%的氧气,在采食、饮水、反刍及唾液分泌期间每天进入绵羊瘤胃的氧气高达16 L。瘤胃中氧气的含量与微生物数量及活性密切相关。多数的瘤胃微生物对氧是高度敏感的,尤其是纤维降解菌。氧气可以抑制纯培养的瘤胃细菌的生长及对纤维的附着。有研究表明,有呼吸缺陷的酿酒酵母菌不能增加瘤胃细菌数量,但野生型的菌种可以消耗氧,有效地增加了细菌活性[25]。在活酵母菌存在时,羔羊[24]、绵羊[26]和奶牛[27]瘤胃液的氧化还原电势更低,这表明活酵母菌为厌氧的瘤胃微生物区系的生长和活性创造了更加有利的生态环境,改善了瘤胃发酵功能。此外,因酵母菌制剂可以提供微生物及相关生长因子,所以其对氧化还原电势的影响,不仅与对氧气的直接消耗有关,还可能与对其相关的微生物区系的影响有关。 3.2.2 对瘤胃液pH的影响
瘤胃液pH是一个与瘤胃功能密切相关的关键参数。pH的下降,可导致乳酸产生菌的数量超过乳酸利用菌的数量,进一步导致了乳酸在瘤胃的积累。当瘤胃液pH过低时,微生物的多样性也会下降,原虫数量会急剧下降,微生物菌群被改变,并可能诱发瘤胃酸中毒、炎症反应,影响瘤胃壁的完整性及动物健康。
酵母菌制剂具有稳定瘤胃液pH及降低乳酸的作用,这种作用被认为是高精料饲喂模式下酵母菌制剂产生有益影响的最重要原因。体内外的研究都已证实,LYC具有稳定瘤胃液pH降低乳酸浓度的作用[28, 29, 30]。目前的研究认为,LYC对瘤胃液pH的影响机制与对瘤胃微生物及对动物采食行为的影响有关,对瘤胃微生物的影响包括对乳酸代谢菌数量和整体菌群数量的影响。研究表明,活酵母菌可以刺激乳酸利用菌如埃氏巨型球菌(Megasphaera elsdenii)和反刍 兽月形单胞菌(Selenomonas ruminantium)生长并增强其活性[29, 31],这种作用与活酵母菌直接供给乳酸发酵菌必需生长因子如氨基酸、肽、维生素及有机酸等有关[30];此外,活酵母菌还可与牛链球菌(S.bovis)竞争发酵底物,进而减少乳酸产生。据报道,活酵母菌对糖的利用能力要高于牛链球菌,因此限制了牛链球菌对糖的利用,也就间接的减少了乳酸的产生[32];另据报道,活酵母菌对瘤胃液pH的影响还与其对原虫的刺激有关[33]。瘤胃原虫可以快速吞食淀粉颗粒,这样就与水解淀粉的细菌形成了一个有效的竞争[34]。由于原虫对淀粉的发酵速度比水解淀粉的细菌慢,并且其主要的发酵终产物是挥发性酸而非乳酸,所以,活酵母菌对原虫的影响也是其对瘤胃液pH发挥稳定作用的原因之一。综上,LYC通过对瘤胃特定菌群及瘤胃整体菌群的刺激[35],加强了微生物的生长,优化了发酵耦合,使更多的被消化的碳水化合物被用于生成微生物蛋白,减少了用于发酵或生成挥发性脂肪酸终产物的碳的数量,因此,降低了瘤胃酸中毒的发生几率[36]。
值得注意的是,酵母菌制剂对瘤胃液pH的影响还与其改变动物的采食行为有关。据报道,在高精料饲喂条件下,育肥牛会改变它们1 d中的采食行为(少食勤食)以抵消瘤胃酸中毒的可能[37]。有研究表明,饲喂活酵母菌制剂增加了圈养泌乳奶牛平均瘤胃液pH,同时缩短了奶牛的采食间隔(3.32 h vs. 4.42 h)[7]。因此,采食行为的改变也是酵母菌制剂对瘤胃液pH产生影响的一个原因。 3.3 对中性洗涤纤维(NDF)消化率的影响
酵母菌制剂通过对瘤胃发酵环境的改善及对瘤胃微生物生长及活性的影响,提高了饲料NDF消化率。尽管效果并不总是积极的[38],但YC或LYC改善了瘤胃NDF的消化[10, 39]。这与益生菌酵母菌对纤维降解菌的生长及活性的刺激有关。在体外研究中,酿酒酵母菌株刺激了真菌游动孢子的萌发、纤维降解菌[40]及真菌在植物细胞壁上的定植[39],刺激了产琥珀酸丝状杆菌(Fibrobacter succinogenes)S85的生长,并降低了白色瘤胃球菌(Ruminococcus albus)7、黄色瘤胃球菌(Ruminococcus flavefaciens)FD1及溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)D1的生长延滞期[41]。
体内研究发现,每日饲喂LYC的羔羊纤维降解菌定植的更早,并且即使在安装瘤胃瘘管的特殊应激期,纤维降解菌仍保持很高的水平且很稳定。此外,在这类LYC存在时,多数的多糖酶和糖苷酶活性都增强[28]。此外,LYC增加了高精料饲喂条件下绵羊瘤胃中的3种主要的纤维降解菌产琥珀酸丝状杆菌、白色瘤胃球菌及黄色瘤胃球菌的16S rRNA的比例,其中白色瘤胃球菌和黄色瘤胃球菌的16S rRNA的基因拷贝数量增加了2~4倍[42]。这个效果解释了常见报道的使用酵母菌制剂后瘤胃纤维物质降解率得到改善这一现象。尽管如此,Callaway等[43]研究表明LYC能够加速产琥珀酸丝状杆菌S85和黄色瘤胃球菌FD1对纤维滤纸的降解速率,但是降解程度上并没有影响。Jouany[5]认为酵母菌制剂对纤维物质消化的有益影响可能部分与饲喂酵母菌后观测到的DM采食量增加有关。 3.4 影响氮代谢
尽管酵母菌制剂对氮的微生物代谢影响的研究资料比较缺乏,而且还存在争议。但已有的一系列证据表明,酵母菌制剂可以改变瘤胃氮代谢[44]。研究表明LYC可以减少反刍动物瘤胃液氨的浓度[45],增加微生物蛋白合成[46]。这与酵母菌对蛋白质分解菌的生长和活性的影响有关,研究发现活酵母菌的小肽可对细菌的蛋白酶产生直接的抑制性效应[47]。然而,也有研究表明,酵母菌制剂对到达十二指肠的微生物氮的数量和组成未产生积极的影响[48]。一项对奶牛相关试验的荟萃分析表明,饲粮中的可溶性氮(如氨、氨基酸和肽)水平是酵母菌制剂影响氮代谢的一个关键参数[49]。饲粮中的可溶性氮与碳水化合物供给间有一个合适的平衡,活酵母菌就会加强微生物的生长及减少氮损失,增加机体可利用的氮量。因此,关于酵母菌制剂对瘤胃氮代谢的影响结果的差异可能与试验饲粮或选用的酵母菌种有关,对此需要更多深入的研究。 3.5 影响氢代谢及甲烷产量
生成甲烷是氢清除的关键代谢途径,这对瘤胃中植物细胞壁的有效降解十分重要,但同时也造成了饲料能量的损失。体外的研究发现,共培养乙酸生成菌和甲烷合成菌时,氢主要用于甲烷的合成,但当有活酵母菌存在时,活酵母菌刺激了乙酸生成细菌对氢的利用,同时以高于5倍的数量刺激了乙酸的生成[50]。此外,Lynch等[51]报道了苜蓿和一种活酵母菌制剂经48 h的混合瘤胃菌孵育后,甲烷产量减少了20%,其中的作用机制与氢利用的转移有关。酵母菌制剂将能量从甲烷转移到乙酸,提高了反刍动物能量利用效率,同时减少了甲烷的排放。然而,目前关于酵母菌制剂对氢转移机制及甲烷生成影响的研究很少,而且结果也不一致[52, 53]。这可能与使用的菌种不同有关。利用瘤胃模拟发酵技术对不同酵母菌株甲烷产量影响的结果表明,甲烷产量存在一个强烈的菌种效应,其试验结果从没有影响到甲烷产量降低58%[54]。 3.6 影响肠道菌群及机体免疫
酵母菌在瘤胃中仍可保持一定活性,其通过瘤胃可能对肠道菌群平衡产生有益的影响,因此可能影响免疫系统及动物的健康。在人工瘤胃中,与酵母菌同批孵育对大肠杆菌(Escherichia coli)O157 ∶ H7和单核球增多性李斯特菌(Listeria monocytogenes)可产生不利的影响,给绵羊饲喂酵母菌后病原体下降了50%[55],山羊饲喂LYC(酿酒酵母菌SCI-1077)后,粪中的大肠杆菌数量降低,同时总的乳酸杆菌数量显著增加[56]。这样的影响一方面与LYC对瘤胃液pH调节产生的有益影响及与大肠杆菌竞争肠道表面的受体有关,另一方面与活酵母菌制剂优化了瘤胃的消化,减少了营养物残渣的数量,限制了病原菌的发展有关。另据报道,瘤胃内环境的酸化会增加霉菌毒素的吸收及降低微生物解毒作用[57],所以通过酵母菌对瘤胃液pH的控制可降低霉菌毒素对动物的影响。有关酵母菌制剂对反刍动物免疫影响的研究表明,饲喂YC可以显著增加绒山羊血清免疫球蛋白A(IgA)含量,并提高血清免疫球蛋白G(IgG)含量[58]。此外,LYC对限制炎症因子的释放具有积极影响。 4 影响酵母菌制剂应用效果的因素 4.1 菌种选择
酵母菌制剂对反刍动物生产性能的影响具有菌种依赖性。一些研究已经表明,并不是所有的酵母菌株都有刺激瘤胃细菌的能力。对超过50个菌株的试验表明,其中只有7个菌株具有刺激瘤胃纤维降解菌生长的作用[59]。另外的一些研究表明,只有很少数的酵母菌株同时具有增强有益的纤维降解菌和相关的乳酸利用菌的能力。此外,不同的酵母菌株在刺激瘤胃关键菌群方面也是存在差异的[25]。这些研究结论解释了酵母菌制剂对反刍动物应用效果差异的原因。此外,因为很多早期的研究在酵母菌制剂的定性上不明确,那些没有效果的研究很可能是使用了没有刺激活性的酵母菌株。 4.2 基础饲粮
基础饲粮是影响酵母菌制剂应用效果的一个重要因素[36]。一般来说,当给动物饲喂平衡性很好的饲粮时,酵母菌制剂获得的影响效果最小,因为平衡性好的饲粮促进了肠道菌群的稳定。相反,当饲粮的平衡性较差时,酵母菌制剂应用效果会更加明显。此外,饲粮原料属性也是影响酵母菌制剂效果的重要因素,其决定了酵母菌对真菌和纤维降解菌在纤维基质上的定植的刺激程度[39]。有研究表明,相同的酵母菌株显著地改善了孵育在瘘管奶牛瘤胃尼龙袋中的40种玉米青贮的NDF降解率,改善程度的差异取决于玉米青贮的可消化性[60]。实际上,酵母菌对低可消化青贮NDF的降解作用更好。这些结果表明,试验中使用的基础饲粮可能是导致酵母菌制剂应用效果差异的一个重要原因。 4.3 动物的生理状况
目前的研究表明,酵母菌制剂在反刍动物瘤胃微生物受到影响时使用效果更佳明显。这包括饲料过渡期(断奶、放牧、加强饲养程序)或是在受到应激期间(高温、运输)。在这些特殊的条件下,添加高水平的酵母菌制剂对于瘤胃的作用更加明显,更有益于动物生产性能的改善。Bruno等[61]的研究表明,给处于热应激的泌乳奶牛每天饲喂30 g/d酿酒酵母培养物,增加了奶牛的产奶量。 4.4 产品种类
酵母菌制剂的产品种类也可能是影响其应用效果的一个因素。大多数的研究者认为仅有LYC才能产生对瘤胃发酵及在消化上有益的变化。Lynch等[51]通过体外试验比较了LYC和无活性酵母菌的酵母菌制剂对瘤胃液pH的影响,结果发现无活性酵母菌制剂组pH降低,而LYC组pH升高。Oeztuerk[62]的体外研究结论认为,在降低瘤胃液pH、提高丙酸产量方面,LYC要比蒸汽处理的LYC更有效。Dawson等[19]报道了经高压处理的酵母菌对瘤胃中维降解菌的数量是没有影响的,酵母菌必须能够在加工、储存和肠道环境中存活,才能发挥对反刍动物的有益影响。另有研究者认为,活的酵母菌对于产生有益的影响并不是必要的,在YC提取物中的代谢物被认为是“有活性”的组分。Vyas等[63]的体内研究表明,活性与非活性酵母都对减少亚急性瘤胃酸中毒(SARA)发生率产生了积极的效应,且二者对瘤胃液pH的影响并无差异。目前为止,关于酵母菌制剂的有益影响是否必需以活性形式添加才能保证的争论仍在继续,除非有更多的有确定性意义的研究被开展。 4.5 其他因素
其他因素包括饲料中的其他添加剂及动物的年龄和体重等因素。Phillips等[64]研究发现,当YC与莫能菌素同时使用时,YC的促生长作用被会抑制,Swyers等[11]的研究也发现类似的现象。此外,Swyers等[11]认为牛的年龄及体重越大,越不利于酵母菌制剂作用效果的发挥。 5 小结与展望
酵母菌制剂是一种天然的饲料添加剂,其使用不涉及对健康负面影响的问题,对环境无不利影响。此外酵母菌制剂对反刍动物的生产力和健康水平有明显的改善作用,从这个意义上看酵母菌制剂在反刍动物营养上会有广阔的应用前景。在实践生产中应特别考虑上述影响因素对其使用效果的限制作用。
目前关于酵母菌制剂对反刍动物瘤胃微生物影响的机制还没弄清楚,其在生产中的应用效果也不一致。因此,在将来的研究中,深入研究酵母菌对肠道菌群代谢和生理特性的影响,将有助于我们更好的理解酵母菌与肠道微生物间的相互作用,也有助于我们开发新的对反刍动物营养有更好改善作用的酵母菌制剂。此外,进一步扩充各种饲粮及天然原料对酵母菌制剂使用效果的数据,对于酵母菌制剂的应用效果的预测更加有利。酵母菌的使用对饲料效率的改善作用已被证明,其对污染物的排放有一个间接的影响,深入研究酵母菌制剂对目标微生物(如氮利用菌、甲烷细菌)的直接影响及其影响机制将具有重要的现实意义;目前的研究表明酵母菌制剂对反刍动物健康及产品质量会产生积极影响,但对于影响机制的研究相对较少,因此开展对与之相关的动物免疫、肠道有害菌群及脂肪代谢等研究工作,对于深入认识酵母菌制剂的作用机制、开展新的益生酵母菌种的选择及对其有针对性地基因改造等都将具有重要意义。
| [1] | PACHECO M T, CABALLERO-CÓRDOBA G M, SGARBIERI V C.Composition and nutritive value of yeast biomass and yeast protein concentrates[J]. Journal of Nutritional Science and Vitaminology, 1997, 43(6):601-612. ( 2) 2)
|
| [2] | DURAND-CHAUCHEYRAS F, FONTY G, BERTIN G, et al.Fate of Levucell® SC I-1077 yeast additive during digestive transit in lambs[J]. Reproduction, Nutrition, Development, 1998, 38(3):275-280. ( 1) 1)
|
| [3] | SODER K J, HOLDEN L A.Dry matter intake and milk yield and composition of cows fed yeast prepartum and postpartum[J]. Journal of Dairy Science, 1999, 82(3):605-610. ( 1) 1)
|
| [4] | DANN H M, DRACKLEY J K, MCCOY G C, et al.Effects of yeast culture (Saccharomyces cerevisiae) on prepartum intake and postpartum intake and milk production of Jersey cows[J]. Journal of Dairy Science, 2000, 83(1):123-127. ( 1) 1)
|
| [5] | JOUANY J P.Optimizing rumen functions in the close-up transition period and early lactation to drive dry matter intake and energy balance in cows[J]. Animal Reproduction Science, 2006 , 96(3/4):250-264. ( 2) 2)
|
| [6] | GALVÀO K N, SANTOS J E P, COSCIONI A, et al.Effect of feeding live yeast products to calves with failure of passive transfer on performance and patterns of antibiotic resistance in fecal Escherichia coli[J]. Reproduction Nutrition Development, 2005, 45(4):427-440. ( 2) 2)
|
| [7] | BACH A, IGLESIAS C, DEVANT M.Daily rumen pH pattern of loose-housed dairy cattle as affected by feeding pattern and live yeast supplementation[J]. Animal Feed Science and Technology, 2007, 136(1/2):146-153. ( 2) 2)
|
| [8] | ZHANG R Y, YOON I, ZHU W Y, et al.Effect of Saccharomyces cerevisiae fermentation product on lactation performance and lipopolysaccharide concentration of dairy cows[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(8):1137-1143. ( 1) 1)
|
| [9] | LESMEISTER K E, HEINRICHS A J, GABLER M T.Effects of supplemental yeast (Saccharomyces cerevisiae) culture on rumen development, growth characteristics, and blood parameters in neonatal dairy calves[J]. Journal of Dairy Science, 2004, 87(6):1832-1839. ( 2) 2)
|
| [10] | MALEKKHAHI M, TAHMASBI A M, NASERIAN A A, et al.Effects of essential oils, yeast culture and malate on rumen fermentation, blood metabolites, growth performance and nutrient digestibility of baluchi lambs fed high-concentrate diets[J]. Journal of Animal Physiology and Animal Nutrition, 2014, doi:10.1111/jpn.12230. ( 2) 2)
|
| [11] | SWYERS K L, WAGNER J J, DORTON K L, et al.Evaluation of Saccharomyces cerevisiae fermentation product as an alternative to monensin on growth performance, cost of gain, and carcass characteristics of heavy-weight yearling beef steers[J]. Journal of Animal Science, 2014, 92(6):2538-2545. ( 4) 4)
|
| [12] | DE ONDARZA M B, SNIFFEN C J, DUSSERT L, et al.Case study:multiple-Study analysis of the effect of live yeast on milk yield, milk component content and yield, and feed efficiency[J]. Professional Animal Scientist, 2010, 26(6):661-666. ( 1) 1)
|
| [13] | DESNOYERS M, GIGER-REVERDIN S, BERTIN G, et al.Meta-analysis of the influence of Saccharomyces cerevisiae supplementation on ruminal parameters and milk production of ruminants[J]. Journal of Dairy Science, 2009, 92(4):1620-1632. ( 1) 1)
|
| [14] | DENEV S A, PEEVA T Z, RADULOVA P, et al.Yeast cultures in ruminant nutrition[J]. Bulgarian Journal of Agricultural Science, 2007, 13:357-374. ( 2) 2)
|
| [15] | 甄玉国.饲用微生态制剂——酵母培养物及其在反刍动物中的应用[J]. 饲料工业, 2005, 26(1):5-9. ( 1) 1)
|
| [16] | NIKKHAH A, BONADAKI M D, ZALI A.Effects of feeding yeast (Saccharomyces cerevisiae) on productive performance of lactating Holstein dairy cow[J]. Iranian Journal of Agricultural Science, 2004, 35:53-60. ( 1) 1)
|
| [17] | FORMIGONI A, PEZZI P, TASSINARI M, et al.Effect of yeast culture (Yea-Sacc 1026) supplementation on italian dairy cow performance[C]//Proceedings of the 21st annual symposium nutritional biotechnology in the feed and food industries.Lexington:[s.n.], 2005:125.( 1) 1)
|
| [18] | JOUANY J P.Dvacet let výzkumu kvasinkových kultur a jejich masivní nástup v souèasné dobì ve výzivì pøez-dnáškového turné firmy alltech[C]//Sbor.evropského pøednáškového turné firmy Alltech.Brno:[s.n.], 2001:29-39.( 1) 1)
|
| [19] | DAWSON K A, NEWMAN K E, BOLING J A.Effects of microbial supplements containing yeast and lactobacilli on roughage-fed ruminal microbial activities[J]. Journal of Animal Science, 1990, 68(10):3392-3398. ( 2) 2)
|
| [20] | DING G Z, CHANG Y, ZHAO L P, et al.Effect of Saccharomyces cerevisiae on alfalfa nutrient degradation characteristics and rumen microbial populations of steers fed diets with different concentrate-to-forage ratios[J]. Journal of Animal Science and Biotechnology, 2014, 5(1):24. ( 1) 1)
|
| [21] | OEZTUERK H, SAGMANLIGIL V.Role of live yeasts in rumen ecosystem[J]. Deutsche Tierärztliche Wochenschrift, 2009, 116(7):244-248. ( 1) 1)
|
| [22] | 寇慧娟, 陈玉林, 刘敬敏, 等.酵母培养物对羔羊生产性能、营养物质表现消化率及瘤胃发育的影响[J]. 西北农林科技大学学报:自然科学版, 2011, 39(8):46-50. ( 1) 1)
|
| [23] | CHAUCHEYRAS-DURAND F, FONTY G.Establishment of cellulolytic bacteria and development of fermentative activities in the rumen of gnotobiotically-reared lambs receiving the microbial additive Saccharomyces cerevisiae CNCM I-1077[J]. Reproduction Nutrition Development, 2001, 41:57-68. ( 1) 1)
|
| [24] | CHAUCHEYRAS-DURAND F, FONTY G.Influence of a probiotic yeast (Saccharomyces cerevisiae CNCM I-1077) on microbial colonization and fermentations in the rumen of newborn lambs[J]. Microbial Ecology in Health and Disease, 2002, 14(1):30-36. ( 2) 2)
|
| [25] | NEWBOLD C J, WALLACE R J, MCINTOSH F M.Mode of action of the yeast Saccharomyces cerevisiae as a feed additive for ruminants[J]. British Journal of Nutrition, 1996, 76(2):249-261. ( 2) 2)
|
| [26] | JOUANY J P, MATHIEU F, SENAUD J, et al.The effect of Saccharomyces cerevisiae and Aspergillus oryzae on the digestion of the cell wall fraction of a mixed diet in defaunated and refaunated sheep rumen[J]. Reproduction Nutrition Development, 1998, 38(4):401-416. ( 1) 1)
|
| [27] | MARDEN J P, JULIEN C, MONTEILS V, et al.How does live yeast differ from sodium bicarbonate to stabilize ruminal pH in high-yielding dairy cows?[J]. Journal of Dairy Science, 2008, 91(9):3528-3535. ( 1) 1)
|
| [28] | FONTY G, CHAUCHEYRAS-DURAND F.Effects and modes of action of live yeasts in the rumen[J]. Biologia, 2006, 61(6):741-750. ( 2) 2)
|
| [29] | PINLOCHE E, MCEWAN N, MARDEN J P, et al.The effects of a probiotic yeast on the bacterial diversity and population structure in the rumen of cattle[J]. PLoS One, 2013, 8(7):e67824. ( 2) 2)
|
| [30] | LILA Z A, MOHAMMED N, YASUI T, et al.Effects of a twin strain of Saccharomyces cerevisiae live cells on mixed ruminal microorganism fermentation in vitro[J]. Journal of Animal Science, 2004, 82(6):1847-1854. ( 2) 2)
|
| [31] | ROSSI F, DI LUCCIA A, VINCENTI D, et al.Effects of peptidic fractions from Saccharomyces cerevisiae culture on growth and metabolism of the ruminal bacteria Megasphaera elsdenii[J]. Animal Research, 2004, 53(3):177-186. ( 1) 1)
|
| [32] | CHAUCHEYRAS F, FONTY G, GOUET P, et al.Effects of a strain of Saccharomyces cerevisiae (Levucell SC), a microbial additive for ruminants, on lactate metabolism in vitro[J]. Canadian Journal of Microbiology, 1996, 42(9):927-933. ( 1) 1)
|
| [33] | BROSSARD L, CHAUCHEYRAS-DURAND F, MICHALET-DOREAU B, et al.Dose effect of live yeasts on rumen microbial communities and fermentations during butyric latent acidosis in sheep:new type of interaction[J]. Animal Science, 2006, 82(6):829-836. ( 1) 1)
|
| [34] | OWENS F N, SECRIST D S, HILL W J, et al.Acidosis in cattle:a review[J]. Journal of Animal Science, 1998, 76(1) :275-286. ( 1) 1)
|
| [35] | ANDO S, KHAN R I, TAKAHASI J, et al.Manipulation of rumen fermentation by yeast:the effects of dried beer yeast on the in vitro degradability of forages and methane production[J]. Asian-Australasian Journal of Animal Sciences, 2004, 17(1):68-72. ( 1) 1)
|
| [36] | CHAUCHEYRAS-DURAND F, WALKER N D, BACH A.Effects of active dry yeasts on the rumen microbial ecosystem:past, present and future[J]. Animal Feed Science and Technology, 2008, 145(1/2/3/4):5-26. ( 2) 2)
|
| [37] | MIALON M M, MARTIN C, GARCIA F, et al.Effects of the forage-to-concentrate ratio of the diet on feeding behaviour in young Blond d'Aquitaine bulls[J]. Animal, 2008, 2(11):1682-1691. ( 1) 1)
|
| [38] | ANGELES S C, MENDOZA G D, COBOS M A, et al.Comparison of two commercial yeast cultures (Saccharomyces cerevisiae) on ruminal fermentation and digestion in sheep fed on corn-stover diet[J]. Small Ruminant Research, 1998, 31(1):45-50. ( 1) 1)
|
| [39] | CHAUCHEYRAS-DURAND F, AMEILBONNE A, WALKER N D, et al.Effect of a live yeast, Saccharomyces cerevisiae I-1077 on in situ ruminal degradation of alfalfa hay and fibre-associated microorganisms[J]. Journal of Animal Science, 2010, 88:145. ( 3) 3)
|
| [40] | CHAUCHEYRAS F, FONTY G, BERTIN G, et al.Effects of live Saccharomyces cerevisiae cells on zoospore germination, growth, and cellulolytic activity of the rumen anaerobic fungus, Neocallimastix frontalis MCH3[J]. Current Microbiology, 1995, 31(4):201-205. ( 1) 1)
|
| [41] | GIRARD I D, DAWSON K A.Effects of a yeast culture on the growth characteristics of representative ruminal bacteria[J]. Journal of Animal Science, 1994, 72(Suppl.1):300. ( 1) 1)
|
| [42] | MOSONI P, CHAUCHEYRAS-DURAND F, BÉRA-MAILLET C, et al.Quantification by real-time PCR of cellulolytic bacteria in the rumen of sheep after supplementation of a forage diet with readily fermentable carbohydrates:effect of a yeast additive[J]. Journal of Applied Microbiology, 2007, 103(6):2676-2685. ( 1) 1)
|
| [43] | CALLAWAY T R, CARNEIRO DE MELO A M, RUSSELL J B.The effect of nisin and monensin on ruminal fermentations in vitro[J]. Current Microbiology, 1997, 35(2):90-96. ( 1) 1)
|
| [44] | DAWSON K A.Manipulating rumen microbial population to improve animal productivity[C]//Proceedings intermountain nutrition conference animal nutrition, health and profit.USA:Utah State University, 2002:1-22.( 1) 1)
|
| [45] | KAMRA D N, CHAUDHARY L C, NEETA-AGARWAL R, et al.Growth performance, nutrient utilization, rumen fermentation and enzyme activities in calves fed on Saccharomyces cerevisiae supplemented diet[J]. Indian Journal of Animal Sciences, 2002, 72(6):472-475. ( 1) 1)
|
| [46] | OEZTUERK H, SCHROEDER B, BEYERBACH M, et al.Influence of living and autoclaved yeasts of Saccharomyces boulardii on in vitro ruminal microbial metabolism[J]. Journal of Dairy Science, 2005, 88(7):2594-2600. ( 1) 1)
|
| [47] | CHAUCHEYRAS-DURAND F, MASSÉGLIA S, FONTY G.Effect of the microbial feed additive Saccharomyces cerevisiae CNCM I-1077 on protein and peptide degrading activities of rumen bacteria grown in vitro[J]. Current Microbiology, 2005, 50(2):96-101. ( 1) 1)
|
| [48] | PUTNAM D E, SCHWAB C G, SOCHA M T, et al.Effect of yeast culture in the diets of early lactation dairy cows on ruminal fermentation and passage of nitrogen fractions and amino acids to the small intestine[J]. Journal of Dairy Science, 1997, 80(2):374-384. ( 1) 1)
|
| [49] | SNIFFEN C J, CHAUCHYRAS-DURAND F, DE ONDARZA M B, et al.Predicting the impact of a live yeast strain on rumen kinetics and ration formulation[C]//Proceedings of the southwest nutrition and management conference.Tempe:[s.n], 2004:53-59.( 1) 1)
|
| [50] | CHAUCHEYRAS-DURAND F, FONTY G, BERTIN G.Effects of a microbial additive, Levucell SC, on growth and metabolism of a ruminal acetogenic bacterial strain in vitro[C]//Proceedings of rumen function conference.Chicago:[s.n.], 1997:33.( 1) 1)
|
| [51] | LYNCH H A, MARTIN S A.Effects of Saccharomyces cerevisiae culture and Saccharomyces cerevisiae live cells on in vitro mixed ruminal microorganism fermentation[J]. Journal of Dairy Science, 2002, 85(10):2603-2608. ( 2) 2)
|
| [52] | MATHIEU F, JOUANY J P, SENAUD J, et al.The effect of Saccharomyces cerevisiae and Aspergillus oryzae on fermentations in the rumen of faunated and defaunated sheep;protozoal and probiotic interactions[J]. Reproduction Nutrition Development, 1996, 36(3):271-287. ( 1) 1)
|
| [53] | MCGINN S M, BEAUCHEMIN K A, COATES T, et al.Methane emissions from beef cattle:effects of monensin, sunflower oil, enzymes, yeast, and fumaric acid[J]. Journal of Animal Science, 2004, 82(11):3346-3356. ( 1) 1)
|
| [54] | NEWBOLD C J, RODE L M.Dietary additives to control methanogenesis in the rumen[J]. International Congress Series, 2006, 1293:138-147. ( 1) 1)
|
| [55] | NEWBOLD C J, OLVERA-RAMIREZ A.The use of yeast-based probiotics to meet new challenges in ruminant production[J]. Journal of Animal Science, 2006, 84(Suppl.1):425-556. ( 1) 1)
|
| [56] | CHEVAUX E, FABRE M M.Probiotic yeast in small ruminants[J]. Feed Mix, 2007, 15(1):28029. ( 1) 1)
|
| [57] | BOUDRA H.Mycotoxins:an insidiously menacing factor for the quality of forages and the performances of the ruminants[J]. Fourrages, 2009, 199:265-280. ( 1) 1)
|
| [58] | ZHANG A Z , LU D X , LIU D C, et al.Effects of yeast culture on immune indices of cashmere goats[J]. Chinese Journal of Animal Nutrition, 2008, 20(2):163-169. ( 1) 1)
|
| [59] | DAWSON K A, HOPKINS D M.Differential effects of live yeast on the cellulolytic activities of anaerobic ruminal bacteria[J]. Journal of Animal Science, 1991, 69(Suppl.1):531. ( 1) 1)
|
| [60] | GUEDES C M, GONÇALVES D, RODRIGUES M A M, et al.Effects of a Saccharomyces cerevisiae yeast on ruminal fermentation and fibre degradation of maize silages in cows[J]. Animal Feed Science and Technology, 2008, 145(1/2/3/4):27-40. ( 1) 1)
|
| [61] | BRUNO R G S, RUTIGLIANO H M, CERRI R L, et al.Effect of feeding Saccharomyces cerevisiae on performance of dairy cows during summer heat stress[J]. Animal Feed Science and Technology, 2009, 150(3/4):175-186. ( 1) 1)
|
| [62] | OEZTUERK H.Effects of live and autoclaved yeast cultures on ruminal fermentation in vitro[J]. Journal of Animal and Feed Sciences, 2009, 1:142-150. ( 1) 1)
|
| [63] | VYAS D.活性干酵母和灭活干酵母对肉用小母牛亚急性瘤胃酸中毒、瘤胃发酵及营养物质消化率的影响[J]. 中国畜牧兽医, 2014, 41(5):243. ( 1) 1)
|
| [64] | PHILLIPS W A, VONTUNGELN D L.The effect of yeast culture on the poststress performance of feeder calves[J]. Nutrition Reports International, 1985, 32:287-294. ( 1) 1)
|




