随着自由基研究的不断深入,氧化应激和抗氧化保护作用的理论引起广泛关注。当内源性防御系统不能有效保护机体抵抗自由基的攻击时,大量的活性氧簇(reactive oxygen species,ROS)、活性氮簇(reactive nitrogen species,NOS)等高活性分子易造成蛋白质损伤、DNA突变、细胞膜磷脂氧化以及低密度脂蛋白改性,进而刺激机体产生危害健康的疾病,如动脉硬化、糖尿病、白内障、肉鸡腹水综合征等[1, 2, 3]。而抗氧化肽具有抑制、延缓脂质过氧化并清除体内过剩自由基的作用,可有效保护机体免受自由基侵害,因此当机体内自由基过剩且自身无法及时清除时,摄入适量抗氧化肽可预防氧化应激的发生并降低疾病的发病率。这些抗氧化肽来源于动物、植物与微生物,以动物源性抗氧化肽占主要地位。这类物质被机体吸收后通过内分泌、旁分泌等作用方式传递各种信息,从而能够进一步的调节动物生长、发育、繁殖和代谢等生命活动过程[4]。因此就动物源性抗氧化肽的种类、生物学功能及结构进行研究具有重要的理论意义和实践意义。 1 动物源性抗氧化肽的种类
动物源性抗氧化肽是指来源于动物蛋白质,由动物自身的组织或器官产生内源的(肌肽、鹅肌肽、高肌肽等)或是从动物体蛋白质水解物中获取的具有抑制生物大分子过氧化或清除体内自由基作用的肽类物质。与因具毒副作用而限量添加的化学合成抗氧化剂[丁基羟基茴香醚(BHA)、2,6-二叔丁基-4-甲基苯酚(BHT)等]相比,该类活性物质具有稳定性高、活性强、高营养、易吸收、安全低毒等优点。根据存在方式的差异,动物源性抗氧化肽又可分为内生肽和蛋白水解肽。 1.1 内生抗氧化肽
目前,动物体内具有抗氧化活性的内生肽研究最成熟的是肌肽和谷胱甘肽。肌肽化学结构为β-丙氨酰-L-组氨酸,是一种具有极强抗氧化活性的天然二肽,主要存在于动物的肌肉和脑等有氧代谢活跃的组织内,浓度为5~70 mmol/L。肌肽在肌肽合成酶的作用下生成,而由肌肽酶降解,主要抗氧化作用是螯合金属离子、清除自由基并抑制脂质过氧化[5]。
谷胱甘肽是由谷氨酸、半胱氨酸及甘氨酸组成的三肽,包括还原型谷胱甘肽和氧化型谷胱甘肽2种形式(比例约为100 ∶ 1),主要存在于动物肝胰腺、肌肉及血液中。它与机体内抗氧化酶[如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)等]处于动态平衡状态,对抗坏血酸、α-生育酚、β-胡萝卜素等动物体内抗氧化剂有再生作用,进而发挥抗氧化、解毒等生物学功能[6]。 1.2 蛋白水解抗氧化肽
抗氧化肽是以休眠形式存在于母蛋白质序列中的特异性蛋白质片段,当水解释放后才能表现抗氧化活性[7]。近年来,国内外研究工作者已从多种动物蛋白质水解液中分离出具有抗氧化活性的肽段,水解底物主要包括肉、蛋、乳3个方面。
富含蛋白质的肉类及其副产物是制备抗氧化肽的优质原料,包括畜禽肉、鱼肉、内脏、血液等[8]。目前多数研究报道是从水产动物的肌肉蛋白质、内脏、皮等蛋白质水解液中分离纯化得到抗氧化活性高的小分子肽,而关于畜禽等动物肉源抗氧化肽的研究较少。第1篇关于猪肌原纤维蛋白制备抗氧化肽的报道发现5种来源于木瓜蛋白酶水解液的抗氧化肽,分别为丝氨酰-甘氨酰-缬氨酰-苏氨酸(SGVT)、异亮氨酰-谷氨酰-丙氨酰-谷氨酰-甘氨酰-谷氨酰(IEAEGE)、天冬氨酰-丙氨酰-谷氨酰胺-谷氨酰-赖氨酰-亮氨酰-谷氨酰(DAQEKLE)、谷氨酰-谷氨酰-亮氨酰-天冬氨酰-天冬酰胺-丙氨酰-亮氨酰-天冬酰胺(EELDNALN)和缬氨酰-脯氨酰-丝氨酰-异亮氨酰-天冬氨酰-天冬氨酰-谷氨酰胺-谷氨酰-谷氨酰-亮氨酰-甲硫酸(VPSIDDQEELM)[9]。随着蛋白质资源的日益匮乏,深度挖掘现有资源的利用价值,如利用内脏、血液、皮等肉类加工下脚料获取具有抗氧化活性的肽段,已成为食品、医药等相关领域瞩目的焦点。
禽蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等4部分组成,其蛋白质含量丰富,是制备生物活性肽的理想原料。Tanzadehpanah等[10]利用胰蛋白酶水解鸵鸟蛋清得到自由基清除率高、金属离子螯合能力强的分子质量为1 317.65 u的抗氧化肽[亮氨酰-苏氨酰-谷氨酰-谷氨酰胺-谷氨酰-丝氨酰-甘氨酰-缬氨酰-脯氨酰-缬氨酰-甲硫氨酰-赖氨酸(LTEQESGVPVMK)]。蛋黄中蛋白质含量约占干物质的30%,其蛋白酶解液对脂质自氧化有较好的抑制作用,对食物贮存防腐有重要意义[11]。
乳源抗氧化肽是以新鲜的母乳、奶粉、酪蛋白等原料,通过蛋白酶水解或微生物发酵法将乳源蛋白质转化为具有抗氧化活性的小分子肽类。这些小分子肽类表现出较强的抗氧化活性,如清除自由基和过氧化物、螯合金属离子、促进DNA合成、加速组织细胞再生减缓衰老、调节机体免疫功能等。Gómez-Ruiz等[12]的研究发现,绵羊的κ-酪蛋白经消化酶水解并分离纯化得到的肽[组氨酰-脯氨酰-组氨酰-脯氨酰-组氨酰-亮氨酰-丝氨酰-苯丙氨酸(HPHPHLSF)]抑制脂肪氧化的能力与抗氧剂BHT的效果类似,并推论绵羊酪蛋白是一种预防氧化应激的天然抗氧化剂。 2 动物源性抗氧化肽的生物学功能 2.1 抗氧化
在病理条件下,机体内源性抗氧化防御系统不能有效清除环境因素(高温、氧化剂、辐射等)诱发的ROS,自由基蓄积,通过磷脂酰肌醇3-激酶[PI(3)K/Akt]、丝裂原活化蛋白激酶(MAPK)等信号传导通路诱导细胞凋亡或增殖等(图1)。而动物源性抗氧化肽可再生体内抗氧化物质,有效清除活性氧和自由基,维持机体细胞内氧化还原动态平衡,延缓或抑制脂质过氧化,螯合过渡区金属离子,预防癌症、哮喘、肉鸡腹水综合征等氧化应激相关疾病的发生[13]。
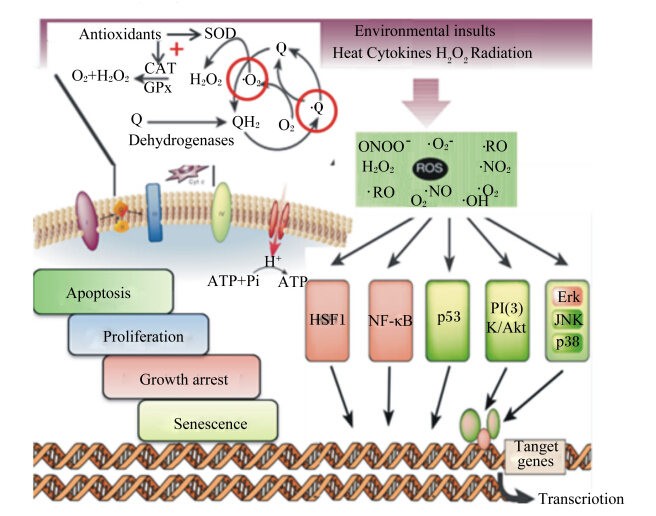 | Antioxidants:抗氧化剂;SOD:超氧化物歧化酶 superoxide dismutase;CAT:过氧化氢酶 catase;GPx:谷胱甘肽过氧化物酶 glutathione peroxidase;Dehydrogenases:脱氢酶;H2O2:过氧化氢;O2:氧气;H2O:水;·O2-:超氧阴离子;·OH:羟自由基;Environmental insults:环境损伤;Heat:热;Radiation:辐射;Cytokines:细胞因子;Apoptosis:细胞凋亡;Proliferation:细胞增殖;Growth arrest:生长停滞;Senescence:衰老;HSF1:热休克转录因子1 heat-shock transcription factor 1;NF-κB:核转录因子-κB nuclear factor-kappa B;PI(3)K/Akt:磷脂酰肌醇3-激酶;MAPK:丝裂原活化蛋白激酶 mitogen-activated protein kinase;ONOO-:过氧化亚硝酸离子;RO:烷氧自由基;NO:一氧化氮自由基;NO2:二氧化氮自由基;Erk:细胞外信号调节蛋白激酶 extracellular-signal-regulated kinases;JNK:c-Jun氨基端激酶 c-Jun N-terminal kinase;Target 图1 自由基生成及作用途径 Fig. 1 The generation and pathway of free radicals[17] |
Suetsuna等[14]从酪蛋白酶解液中分离纯化获得活性位点为谷氨酰-亮氨酸(Glu-Leu)、序列为酪氨酰-苯丙氨酰-酪氨酰-谷氨酰-亮氨酸(Tyr-Phe-Tyr-Pro-Glu-Leu,YFYPEL)的小分子肽,该肽段对超氧阴离子(superoxide anion,·O-2)、羟自由基(hydroxyl radical,·OH)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)等自由基的清除能力强,并有助于抑制食品加工或贮藏过程中的不饱和脂肪酸自氧化。Jia等[15]从复合蛋白酶水解鳕鱼的产物中分离得到DPPH清除率较高的寡肽,而Kim等[16]制备的分子质量为1 801 u的抗氧化肽[谷氨酰-丝氨酰-苏氨酰-缬氨酰-脯氨酰-谷氨酰-精氨酰-苏氨酰-组氨酰-脯氨酰-丙氨酰-半胱氨酰-脯氨酰-天冬氨酰/天冬酰胺-苯丙氨酰-天冬氨酸/天冬酰胺 (ESTVPERTHPACPBFB)]抑制脂质过氧化能力 高于α-生育酚,且对·O-2、·OH、DPPH、过氧化氢(H2O2)等自由基清除率高。 2.2 对动物免疫功能的影响
动物源性抗氧化肽不仅能够维持机体的氧化还原平衡,还参与调节淋巴细胞与单核细胞的分裂增殖,维持细胞免疫,对动物机体免疫调节有重要的生理作用。研究表明,用肌肽等动物源性抗氧化肽饲喂鸡、猪、水产等动物,可有效增强动物体的免疫力,提高抗病力,进而减少死亡率。吕锦芳等[18]等采用不同剂量的肌肽饲喂肉鸡,中、大剂量组(40、60 mg/L)的肌肽可显著促进肉鸡胸腺、脾脏、法氏囊等免疫器官的生长发育和提高新城疫抗体滴度水平。周婷婷[19]研究指出,饲粮中添加适量的谷胱甘肽可显著提高吉富罗非鱼血清与肝脏中溶菌酶、碱性磷酸酶、酸性磷酸酶、一氧化氮合成酶等非特性免疫酶的活性,增加机体的非 特异性免疫能力。研究表明,具有较强抗氧化活性的蚕蛹多肽可有效提高D-半乳糖致衰老小鼠的胸腺指数、脾脏指数与血清中白细胞数,缓解小鼠衰老导致的免疫低下症状,加强小鼠的免疫功能[20]。 2.3 对动物生长性能及肉品质的影响
目前,动物源性抗氧化肽在动物养殖方面的研究较少,且抗氧化肽的生产成本也限制其在养殖领域的推广应用。仅有少量研究报道称,饲粮中添加肌肽、谷胱甘肽等动物源性抗氧化肽可促进蛋白质合成与细胞增殖,提高机体抗氧化酶SOD、过氧化氢酶(CAT)与GPx的沉积,减少组织中脂质过氧化产物(丙二醛、活性氧)含量,降低细胞的氧化损伤程度,进而影响动物的生长性能与抗氧化能力。
赵红霞等[21]研究显示,饲粮中添加100 mg/kg谷胱甘肽,可显著提高草鱼初期的日增重和生长速度,提高血液IGF-1水平,介导生长激素促生长效应,进而提高动物生长性能,并促进鱼体营养代谢,提高全鱼蛋白质含量。Ma等[22]用添加100 mg/kg肌肽的饲粮饲喂育肥猪8周后发现,肌肽能够提高猪肉的pH,降低滴水损失,提高红度值,改善肉品质。 徐浩翔[23]研究表明,饲粮中添加肌肽和维生素E可显著提高猪肉红度值,改善肉品质。此外,有相关研究表明,肌肽对肉鸡的生长性能无显著影响,但能提高胸肌重和腿肌重,降低肌肉剪切力,改善肉品质的嫩度和贮存时间[24]。 2.4 抗应激
热应激是畜禽对外界高温环境所产生的非特异性防御应答反应,严重制约猪、鸡等动物的生长发育与繁殖,给全球畜牧养殖业造成巨大的经济损失[25]。研究表明,热应激激活动物体内的下丘脑-垂体-肾上腺轴,分泌大量儿茶酚胺类激素,致使ROS产量过高,破坏机体氧化-抗氧化平衡系统,进而危害畜禽健康[26, 27]。目前关于抗氧化肽作用于热应激的研究甚少,但抗氧化肽具有清除过量ROS并增强机体抗氧化力的作用,因此可推论动物源性抗氧化肽可预防或延缓热应激的危害。 2.5 抗癌功能
如图1所示,在病理条件下,ROS生成与消除失衡,致使ROS介导的氧化应激破坏DNA、膜脂、蛋白质等生物大分子,诱导细胞凋亡,导致机体健康紊乱,进而诱发癌症、神经变性等疾病[28]。癌症是当前威胁人类生命的主要疾病之一,化疗药物、辐射、手术等方法并不能有效降低癌症的死亡率,而抗氧化肽具有抑制恶性细胞增生的作用,是极具开发潜力的癌症预防或治疗药物。Chen等[29]从毛蚶中分离得到的抗氧化肽H3对宫颈癌细胞(HeLa)、肝癌细胞(HepG2)、大肠癌细胞(HT-29)半抑制浓度分别为10.8、10.1和10.5 μg/mL,表现出显著的抗肿瘤活性。但抗氧化肽抗癌方面的研究仍停留在体外试验研究阶段,体内试验或临床研究甚少,究其原因可能是抗氧化肽的分离纯化方法未普及推广,且长期使用的安全性尚不明确,仍需建立大量的生理模型以研究抗氧化肽对癌细胞的生物学作用。
除以上显著生物学功能外,动物源性抗氧化肽还表现出抗疲劳、抗衰老、降压、降血脂、抑制血管紧张素转换酶(angiotensin converting enzyme,ACE)、抗菌等活性。Davalos等[30]从胃蛋白酶水解蛋清的产物中分离纯化得到具有抗氧化和ACE抑制特性的小分子肽[酪氨酰-丙氨酰-谷氨酰-精氨酰-酪氨酰-脯氨酰-异亮氨酰-亮氨酸(YAERYPIL)],Escudero等[31]从西班牙干腌火腿中获得的抗氧化肽段可有效调节大鼠的原发性高血压。这些结果均证实了动物源性抗氧化肽兼具多种功能特性的可行性,然而抗氧化肽同时发挥多种活性的体内作用途径及机制尚未见确切报道,仍待进一步研究。 3 动物源性抗氧化肽功能与其结构的关系
动物源性抗氧化肽具有清除体内自由基的功能,能减轻自由基对机体的损伤,并抑制脂质过氧化,螯合过渡金属离子,是一种理想的天然抗氧化剂[32, 33, 34]。然而,活性肽发挥抗氧化活性的作用机理至今未得到充分阐明,被普遍认同的观点是活性肽的抗氧化功能与其本身组成、结构及疏水性密切相关[35]。 3.1 氨基酸
氨基酸的种类和组成是活性肽发挥抗氧化功能的必要条件,这也是许多学者认同的作用模式。因采用的原料、酶、制备条件不同,抗氧化肽的氨基酸组成、序列、结构等有差异,目前研究得到的抗氧化肽分子质量大多在500~3 000 u,而发挥抗氧能力的氨基酸主要有疏水性氨基酸、酸性氨基酸、芳香族氨基酸、含硫氨基酸等。
大部分抗氧化肽在N端包含疏水性氨基酸(缬氨酸、亮氨酸、脯氨酸、酪氨酸、色氨酸等),其非极性脂肪烃侧链能够加强抗氧化肽与疏水性多不饱和脂肪酸互作,促进活性肽在脂溶体系中的溶解性,含疏水性氨基酸的肽类通过与氧结合或抑制脂质中氢的释放,延缓脂质过氧化链反应,从而保护脂质体系与膜质完整性[36, 37]。Liu等[38]的研究也明确指出含有酪氨酸的二肽具有很强的自由基淬灭能力。除疏水性氨基酸外,酸性氨基酸(天冬氨酸、谷氨酸等)侧链羧基及氨基基团与金属离子螯合,钝化金属离子的氧化作用,减弱自由基链反应,达到抗氧化效果[9, 39]。而芳香族氨基酸则是以提供电子的方式将自由基转变为稳定的分子形态,并通过共振结构维持其稳定性,从而提高自由基清除能力。研究发现,组氨酸咪唑基的降解,向缺电子自由基提供质子,诱捕脂质过氧化自由基并螯合金属离子,从而表现出较强的抗氧化能力[40]。此外,含硫氨基酸半胱氨酸和蛋氨酸中的巯基将氢转移到高度氧化性的自由基中并使之还原,而在反应中生成的硫化物或二硫化物又可与氧气结合,预防组织内氧化应激的发生。 3.2 空间结构
研究报道,活性肽的空间结构对其发挥抗氧化功能有重要作用。Chen等[29]和Chen等[35]将组氨酰-组氨酰-脯氨酰-亮氨酸(HHPL)或亮氨酰-组氨酸(LH)序列转为组氨酰-组氨酰-亮氨酰-脯氨酸(HHLP)或组氨酰-亮氨酸(HL)结构,两者的活性都显著下降,将脯氨酰-组氨酰-组氨酸(PHH)结构中第2位的L-组氨酸用D-组氨酸替代发现肽段的抗氧化性显著下降,并指出氨基酸序列、肽键本身以及肽的构象可能对肽的抗氧化性有显著影响。Chan等[41]利用电子自旋共振研究了肌肽及相关的含组氨酸的二肽的自由基淬灭能力,也得出相似的结论。 3.3 疏水性
活性肽的疏水性与其抗氧化功能的发挥有密切关系。多数研究者认为抗氧化肽的N端为疏水性氨基酸,C端为亲水性氨基酸,但也有学者得出不同的结论,这可能与蛋白质水解体系、测定方法等差异相关。有研究报道称N端或C端氨基酸缺失(组氨酸、赖氨酸等)并不影响活性肽的抗氧化能力,但另有研究指出在抗氧化方面N端和C端的末端氨基酸具有协同或拮抗作用[29, 42]。所以活性肽末端氨基酸的疏水性对抗氧化机制的作用研究应立足于活性肽末端氨基酸缺失,针对不同底物来源的抗氧化肽,充分考虑末端氨基酸特性对抗氧化效果的影响。
此外,另有研究报道指出抗氧化肽的作用机制可能与肽段的空间构象、螺旋程度等相关。总体而言,对抗氧化肽功能与结构的关系及作用机制仍需深入研究,但活性肽的总体抗氧化能力并非某个因素的单独作用,应归因于氨基酸序列、种类、构象、水解条件等多因子的协同作用,这也是后续抗氧化功能效应与作用机理研究的出发点。 4 小 结
糖尿病、关节炎、动脉硬化、肉鸡腹水综合征等疾病均与自由基代谢失衡导致的氧化应激相关,而适当摄入抗氧化肽可有效清除体内过剩的ROS,防止脂质过氧化,保护细胞和线粒体的正常结构和功能,进而有效预防或降低疾病的发生。而且我国动物资源丰富,从肉、蛋、奶等产品及其加工副产物中提取制备动物源性抗氧化肽安全性高,可操作性强。加之抗氧化肽具有分子质量小、易吸收、活性强等特点,在饲料、医药、食品等方面展现出广阔的应用前景。然而除了肌肽、谷胱甘肽等传统的具有强抗氧化活性的肽已应用于医药、食品、保健品及饲料外,其他动物源性抗氧化肽仍停留在实验室的生产和提取阶段,而且活性肽的体内代谢与作用机制尚未明确。另外,目前大部分对于蛋白质水解物或者抗氧化肽的研究仍止步于体外化学评价法,体内检测因动物福利、伦理等问题而受到诸多限制,无法真正评估抗氧化肽在人或动物体内的功效。由此可见,动物源性抗氧化肽的研究较为薄弱,仍有水解条件不易控制、分离纯化难、生产成本高,检测方法不规范统一、作用机制不明确等问题亟待解决,这无疑也是今后动物源性抗氧化肽研究主攻方向。
| [1] | GIACCO F, BROWNLEE M.Oxidative stress and diabetic complications[J]. Circulation Research, 2010, 107(9):1058-1070. ( 1) 1)
|
| [2] | JOHANSEN J S, HARRIS A K, RYCHLY D J, et al.Oxidative stress and the use of antioxidants in diabetes:linking basic science to clinical practice[J]. Cardiovascular Diabetology, 2005, 4(1):1-11. ( 1) 1)
|
| [3] | VALKO M, RHODES C, MONCOL J, et al.Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions, 2006, 160(1):1-40. ( 1) 1)
|
| [4] | 任兴宏, 方廖琼, 何成明.天然动物源性活性肽的研究进展[J]. 重庆工学院学报:自然科学版, 2009, 23(5):55-59. ( 1) 1)
|
| [5] | DECKER E A.The role of phenolics, conjugated linoleic acid, carnosine, and pyrroloquinoline quinone as nonessential dietary antioxidants[J]. Nutrition Reviews, 1995, 53(3):49-58. ( 1) 1)
|
| [6] | LU S C.Regulation of hepatic glutathione synthesis:current concepts and controversies[J]. The FASEB Journal, 1999, 13(10):1169-1183. ( 1) 1)
|
| [7] | SARMADI B H, ISMAIL A.Antioxidative peptides from food proteins:a review[J]. Peptides, 2010, 31(10):1949-1956. ( 1) 1)
|
| [8] | RYAN J T, ROSS R P, BOLTON D, et al.Bioactive peptides from muscle sources:meat and fish[J]. Nutrients, 2011, 3(9):765-791. ( 1) 1)
|
| [9] | SAIGA A, TANABE S, NISHIMURA T.Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agriculture and Food Chemistry, 2003, 51(12):3661-3667. ( 2) 2)
|
| [10] | TANZADEHPANAH H, ASOODEH A, CHAMANI J.An antioxidant peptide derived from Ostrich (Struthio camelus) egg white protein hydrolysates[J]. Food Research International, 2012, 49(1):105-111. ( 1) 1)
|
| [11] | CHAY PAK TING B P, MINE Y, JUNEJA L R, et al.Comparative composition and antioxidant activity of peptide fractions obtained by ultrafiltration of egg yolk protein enzymatic hydrolysates[J]. Membranes, 2011, 1(3):149-161. ( 1) 1)
|
| [12] | GÓMEZ-RUIZ J Á, LÓPEZ-EXPÓSITO I, PIHLANTO A, et al.Antioxidant activity of ovine casein hydrolysates:identification of active peptides by HPLC-MS/MS[J]. European Food Research and Technology, 2008, 227(4):1061-1067. ( 1) 1)
|
| [13] | SINGH S, SINGH R P.In vitro methods of assay of antioxidants:an overview[J]. Food Reviews International, 2008, 24(4):392-415. ( 1) 1)
|
| [14] | SUETSUNA K, UKEDA H, OCHI H.Isolation and characterization of free radical scavenging activities peptides derived from casein[J]. The Journal of Nutritional Biochemistry, 2000, 11(3):128-131. ( 1) 1)
|
| [15] | JIA J P, ZHOU Y G, LU J Z, et al.Enzymatic hydrolysis of Alaska pollack (Theragra chalcogramma) skin and antioxidant activity of the resulting hydrolysate[J]. Journal of the Science of Food and Agriculture, 2010, 90(4):635-640. ( 1) 1)
|
| [16] | KIM S Y, JE J Y, KIM S K.Purification and characterization of antioxidant peptide from hoki (Johnius belengerii) frame protein by gastrointestinal digestion[J]. The Journal of Nutritional Biochemistry, 2007, 18(1):31-38. ( 1) 1)
|
| [17] | FINKEL T, HOLBROOK N J.Oxidants, oxidative stress and the biology of ageing[J]. Nature, 2000, 408(6809):239-247. ( 1) 1)
|
| [18] | 吕锦芳, 宁康健, 程郁昕, 等.肌肽对肉鸡免疫器官发育及ND疫苗免疫效果的影响[J]. 中国家禽, 2006, 28(19):64-66. ( 1) 1)
|
| [19] | 周婷婷.谷胱甘肽对吉富罗非鱼生长性能和抗氧化功能的影响[D]. 硕士学位论文.武汉:华中农业大学, 2012. ( 1) 1)
|
| [20] | 卢楠, 毛恺, 廖鲜艳, 等.蚕蛹多肽提高D-半乳糖致衰老小鼠的抗氧化及免疫能力[J]. 食品工业科技, 2013, 34(12):331-334. ( 1) 1)
|
| [21] | 赵红霞, 谭永刚, 周萌, 等.饲料中添加谷胱甘肽对草鱼生长、生理指标和抗病力的影响[J]. 中国水产科学, 2007, 14(4):678-683. ( 1) 1)
|
| [22] | MA X Y, JIANG Z Y, LIN Y C, et al.Dietary supplementation with carnosine improves antioxidant capacity and meat quality of finishing pigs[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(6):e286-e295. ( 1) 1)
|
| [23] | 徐昊翔.日粮中添加肌肽和维生素E对育肥猪抗氧化性能和肉品质的影响[D]. 硕士学位论文.南京:南京农业大学, 2013. ( 1) 1)
|
| [24] | HU X X, HONGTRAKUL K, JI C, et al.Effect of carnosine on growth performance, carcass characteristics, meat quality and oxidative stability in broiler chickens[J]. The Journal of Poultry Science, 2009, 46(4):296-302. ( 1) 1)
|
| [25] | 杨培歌.热应激对肥育猪肌肉品质及其代谢物的影响[D]. 硕士学位论文.北京:中国农业科学院, 2014. ( 1) 1)
|
| [26] | LIN H, DECUYPERE E, BUYSE J.Acute heat stress induces oxidative stress in broiler chickens[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2006, 144(1):11-17. ( 1) 1)
|
| [27] | KALYANARAMAN B, FELIX C C, SEALY R.Electron spin resonance-spin stabilization of semiquinones produced during oxidation of epinephrine and its analogues[J]. The Journal of Biological Chemistry, 1984, 259(1):354-358. ( 1) 1)
|
| [28] | QIAN Z J, JUNG W K, KIM S K.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin, Rana catesbeiana Shaw[J]. Bioresource Technology, 2008, 99(6):1690-1698. ( 1) 1)
|
| [29] | CHEN L L, SONG L Y, LI T F, et al.A new antiproliferative and antioxidant peptide isolated from Arca subcrenata[J]. Marine Drugs, 2013, 11(6):1800-1814. ( 3) 3)
|
| [30] | DÁVALOS A, MIGUEL M, BARTOLOMÉ B, et al.Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9):1939-1944. ( 1) 1)
|
| [31] | ESCUDERO E, ARISTOY M C, NISHIMURA H, et al.Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3):306-311. ( 1) 1)
|
| [32] | ZHANG Y F, DUAN X, ZHUANG Y L.Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromis niloticus) skin gelatin[J]. Peptides, 2012, 38(1):13-21. ( 1) 1)
|
| [33] | DUAN X, OCEN D, WU F F, et al.Purification and characterization of a natural antioxidant peptide from fertilized eggs[J]. Food Research International, 2014, 56:18-24. ( 1) 1)
|
| [34] | SAMPATH KUMAR N S, NAZEER R A, JAIGANESH R.Purification and biochemical characterization of antioxidant peptide from horse mackerel (Magalaspis cordyla) viscera protein[J]. Peptides, 2011, 32(7):1496-1501. ( 1) 1)
|
| [35] | CHEN H M, MURAMOTO K, YAMAUCHI F, et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agriculture and Food Chemistry, 1998, 46(1):49-53. ( 2) 2)
|
| [36] | DI BERNARDINI R, RAI D K, BOLTON D, et al.Isolation, purification and characterization of antioxidant peptidic fractions from a bovine liver sarcoplasmic protein thermolysin hydrolyzate[J]. Peptides, 2011, 32(2):388-400. ( 1) 1)
|
| [37] | SUETSUNA K, CHEN J R.Isolation and characterization of peptides with antioxidant activity derived from wheat gluten[J]. Food Science and Technology Research, 2002, 8(3):227-230. ( 1) 1)
|
| [38] | LIU Q, KONG B H, XIONG Y L, et al.Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry, 2010, 118(2):403-410. ( 1) 1)
|
| [39] | RAJAPAKSE N, MENDIS E, JUNG W K, et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2):175-182. ( 1) 1)
|
| [40] | SUETSUNA K.Antioxidant peptides from the protease digest of prawn (Penaeus japonicus) muscle[J]. Marine Biotechnology, 2000, 2(1):5-10. ( 1) 1)
|
| [41] | CHAN W K M, DECKER E A, LEE J B, et al.EPR spin-trapping studies of the hydroxyl radical scavenging activity of carnosine and related dipeptides[J]. Journal of Agriculture and Food Chemistry, 1994, 42(7):1407-1410. ( 1) 1)
|
| [42] | MENDIS E, RAJAPAKSE N, KIM S K.Antioxidant properties of a radical-scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. Journal of Agriculture and Food Chemistry, 2005, 53(3):581-587. ( 1) 1)
|




