2. 甘肃农业大学动物科学技术学院, 兰州 730070;
3. 农业部奶及奶制品质量监督检验测试中心, 北京 100193;
4. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China;
3. Ministry of Agriculture-Milk and Dairy Product Inspection Center, Beijing 100193, China;
4. State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
乳蛋白是乳中重要的营养组成成分,具有较高的营养价值,是衡量乳品质高低的重要指标之一[1]。作为可以把吸收的营养物质转化为乳成分的“生物工厂”—乳腺上皮细胞,是唯一具有分泌功能的细胞,其数量和功能很大程度上决定着乳产量和乳蛋白的合成量[2]。奶牛乳腺上皮细胞主要合成2大类乳蛋白——酪蛋白(80%)和乳清蛋白[3]。
已有的研究表明,探究反刍动物乳腺对氨基酸的吸收代谢模式以及关键基因的调控作用,为提高乳腺乳蛋白的产量,改善乳品质提供有效途径[4, 5, 6]。作为奶牛营养物质的氨基酸,不仅可作为蛋白质合成的底物,而且通过刺激哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路中mTOR复合物1影响其下游因子的基因表达和蛋白质磷酸化级联反应,调节乳蛋白的合成[7, 8, 9, 10]。mTOR是雷帕霉素的靶分子,是一种丝氨酸/苏氨酸激酶,可调节蛋白质合成、降解和细胞能量代谢等重要的生理功能,在细胞增殖和分化等过程中起着中心调控点的作用[11, 12, 13]。其中,这种调节作用对支链氨基酸最为显著[14, 15]。
Mabjeesh等[16]发现,在奶山羊泌乳早期和晚期,进入乳腺的游离亮氨酸的量大于其合成乳蛋白的量,由此可以推断亮氨酸在乳腺内除了合成蛋白质之外,还参与了其他的生理过程。Kimball等[17]发现,亮氨酸对肌蛋白合成是通过mTOR信号通路介导的mRNA翻译起始而实现的。最近还有研究表明,在乳腺上皮细胞中添加适量的亮氨酸能够促进乳蛋白的合成[18, 19]。但同时也有研究结果指出,组氨酸的添加抑制了mTOR和核糖体S6蛋白激酶(ribosomal protein S6 kinase,S6K1)的磷酸化,使乳蛋白合成减少至65%[19]。因此,推测亮氨酸或组氨酸通过对mTOR信号通路的不同调控作用,最终影响乳蛋白的合成。目前的工作还缺乏对mTOR信号通路中关键基因表达研究。
本研究以体外培养的永生化奶牛乳腺上皮细胞(CMECs-H)为模型,利用噻唑蓝(MTT)比色法探讨不同浓度梯度的亮氨酸或组氨酸添加水平以及培养时间对CMECs-H增殖的影响;同时检测酪蛋白和mTOR信号通路相关基因的表达。为进一步探索亮氨酸或组氨酸通过mTOR信号通路影响酪蛋白合成机制的重要意义。
1 材料与方法 1.1 试验材料 1.1.1 主要仪器冷冻离心机(索福Legend,德国)、恒温CO2培养箱(Thermo,美国)、倒置显微镜(Olympus,日本)、细胞计数仪(Bio-Rad TC10,美国)、RNA浓度测定仪(Thermo,美国)、凝胶成像系统(Thermo,美国)、IQ5荧光定量PCR仪(Bio-Rad,美国)、酶标仪(Thermo,美国)等。
1.1.2 主要试剂DMEM/F12培养基(Gibco,货号:11995-065/11765-054)、厄尔平衡溶液(EBSS,北京雷根生物技术有限公司,货号:CC0043)、胎牛血清(FBS,Gibco,货号:10099-141)、青链霉素(碧云天生物技术研究所,货号:C0222)、胰酶(碧云天生物技术研究所,货号:C0203)、L-亮氨酸(Sigma,货号:L8912-100G)、L-组氨酸(Sigma,货号:H-5659-25G)、RNA提取试剂盒(TIANGEN,货号:74106)、反转录试剂盒(TaKaRa,货号:DRR037A)、荧光定量试剂盒(TaKaRa,货号:DRR820A)、噻唑蓝(MTT,Sigma,货号:0793-5G)、二甲基亚砜(DMSO,Sigma,货号:D4540)等。
CMECs-H:以实验室已经建立的原代奶牛乳腺上皮细胞体系为基础,采用携带SV40大T抗原基因的逆转录病毒感染原代奶牛乳腺上皮细胞,经过传代培养,获得的一株细胞系。
1.2 试验方法 1.2.1 奶牛乳腺上皮永生系细胞培养实验室前期已建立奶牛乳腺上皮细胞体外培养体系[20]。将CMECs-H置于含有10%FBS的DMEM/F12生长培养基中,在38 ℃、5%二氧化碳(CO2)培养箱中培养。当细胞长满培养皿(Corning,430165)的90%时,用胰酶溶液于38 ℃、5%CO2的恒温培养箱中消化,待细胞质回缩,细胞间隙增大缩成圆形时,用培养基终止消化反应;反复吹打后,收集细胞悬液于离心管,900 r/min室温离心5 min;弃上清液,加入新鲜的含有10%FBS的DMEM/F12生长培养基,制成细胞悬浮液。
1.2.2 MTT比色法检测细胞增殖试验处理将细胞密度调整到大约1×105个/mL接种到96孔培养板(Corning,3599),每孔100 μL,用含有10%胎牛血清的DMEM/F12生长培养基贴壁处理24 h,用不含FBS的DMEM/F12生长培养饥饿培养过夜,细胞处理时用EBSS(表1)代替正常培养基。阴性对照组是EBSS,阳性对照组是EBSS+10%FBS,试验组是在阴性对照组的基础上分别补充0.15、0.45、0.90、1.35、2.70、5.40、10.80、21.60、32.40 mmol/L 9个浓度的亮氨酸和0.15、0.60、1.20、1.60、2.40、4.80、9.60、14.40、28.80 mmol/L 9个浓度的组氨酸,分别培养12和24 h后进行MTT比色法检测。最后用全自动酶标仪检测各孔450 nm波长下的吸光度值(OD450)来判定细胞增殖状况。细胞相对增殖率(relative growth rate,RGE)计算公式:RGR=试验组OD450/对照组OD450。每种处理设6个重复,每组试验重复3次。
| 表1 厄尔平衡溶液组成 Table 1 Composition of the Earle’s balanced salt solution medium |
将CMECs-H接种到含有10%FBS的DMEM/F12生长培养基的培养皿(Thermo 172958)中贴壁处理24 h,用不含FBS的DMEM/F12生长培养基饥饿培养过夜,然后对细胞进行6 h的以下处理:阴性对照组(EBSS),阳性对照组(EBSS+10%FBS),试验组分别是在阴性对照组基础上添加0.45、1.35、5.40、10.80 mmol/L 4个浓度的亮氨酸和0.15、1.20、4.80、9.60 mmol/L 4个浓度的组氨酸。每种处理3个重复,每组试验重复3次。
1.2.3.2 样品RNA提取处理结束后提取CMECs-H总RNA,采用NanoDrop1000检测RNA纯度及260和280 nm波长下的吸光度值的比值(OD260/OD280,OD260/280),样品浓度保持在200 ng/μL左右,OD260/280测定值在1.8~2.0,可用于后续的反转录反应。
1.2.3.3 反转录采用500 ng RNA/10 μL体系,参照TaKaRa的Prime Script RT reagent Kit With gDNA Eraser试剂盒说明书进行反转录操作。取2 μL 5×Prime Script Buffer 2 (for Real Time),0.5 μL Prime Script RT Enzyme Mix Ⅰ,0.5 μL Oligo dT Primer,配制成混合液并混匀后置于冰上,加入2 μg模板RNA,再加入RNase-free水补足到10 μL,最后将反应体系置于PCR仪上,37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。这样就得到了cDNA第一链,样品长期保存可放-20 ℃。
1.2.3.4 qRT-PCR反应以cDNA为模板,参照TaKaRa的SYBR Green说明书进行qRT-PCR方法检测mRNA的表达,选用核糖体(RPS9)基因为内参。试验中所用的13个基因的引物均由上海生工基因有限公司合成(引物见表2),其定量反应体系为20 μL:10 μL SYBR Premix Ex TaqTMⅡ(2×),0.8 μL PCR primer primer,0.8 μL PCR reverse primer,2 μL cDNA,6.4 μL RNase-free 水。反应程序为第1阶段95 ℃ 30 s,1个循环;第2阶段退火延伸95 ℃ 5 s,60 ℃ 34 s,40个循环。熔解曲线程序为55 ℃ 30 s,41个循环。合成的cDNA贮存于-20 ℃冰箱中,备用。利用IQ5实时定量序列检测软件(Bio-Rad versa Doc,美国)自动读取循环阈值(Ct值)。
| 表2 引物序列 Table 2 Primer sequences |
采用2-ΔΔCt法分析奶牛乳腺上皮细胞中目的基因mRNA的相对表达量,所有结果用SAS 9.2软件ANOVA程序进行方差分析,平均值多重比较采用Duncan氏法进行,P<0.05时表示差异显著,P<0.01表示差异极显著,结果均以平均值±标准误表示。qRT-PCR数据统计参见Livak等[26]的方法进行。
2 结果与分析 2.1 亮氨酸或组氨酸对永生化乳腺上皮细胞增殖的 影响由表3和图1所示,除了亮氨酸浓度为0.15 mmol/L时,在其他添加浓度的条件下,同一浓度不同培养时间对CMECs-H的增殖影响差异不显著(P>0.05);而同一时间不同浓度对CMECs-H的增殖有不同程度的影响。其中,当在EBSS中添加0.15~5.40 mmol/L的亮氨酸,培养12 h时,对CMECs-H增殖有显著促进作用(P<0.01);而随着亮氨酸的浓度增大(10.80~32.40 mmol/L)抑制体外培养的CMECs-H的增殖。
| 表3 亮氨酸对CMECs-H的相对生长率 Table 3 Effects of Leu on CMECs-H relative growth rate (n=3) |
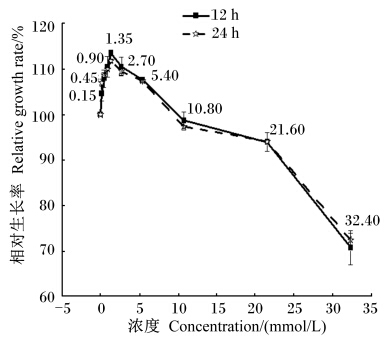 | 图1 亮氨酸对CMECs-H相对生长率的影响 Fig. 1 Effect of Leu on CMECs-H relative growth rate |
由表4和图2所示,当添加同一浓度不同培养时间的组氨酸对CMECs-H增殖影响差异不显著(P>0.05);而同一时间不同浓度对CMECs-H的增殖有不同程度的影响。其中,当在EBSS溶液中添加0.15~4.80 mmol/L的组氨酸,培养12和24 h,对CMECs-H有显著增殖作用(P<0.05);而随着组氨酸浓度增大(14.40~28.80 mmol/L)抑制CMECs-H的增殖。培养时间的作用效果如图2所示,在最适浓度范围内12 h的增殖作用略微弱于24 h。
| 表4 组氨酸对CMECs-H的相对生长率 Table 4 Effects of His on CMECs-H relative growth rate (n=3) |
 | 图2 组氨酸对CMECs-H相对生长率的影响Fig. 2 Effects of His on CMECs-H relative growth rate |
由表5可见,以体外培养的CMECs-H为模型,在EBSS溶液中添加0.45~10.80 mmol/L范围的的亮氨酸,与阴性对照组相比,αs1-酪蛋白(αs1-casein,CSN1S1)、αs2-酪蛋白(αs2-casein,CSN1S2)和κ-酪蛋白(κ-casein,CSN3)基因表达均显著上调(P<0.05);β-酪蛋白(β-casein,CSN2)基因表达上调(P=0.054)。这说明亮氨酸能促进乳腺上皮细胞中酪蛋白基因的表达。但是不同浓度水平的亮氨酸对相同酪蛋白的基因促进效果不同。在试验组中,当亮氨酸的添加浓度为5.40 mmol/L时,CSN1S1和CSN1S2基因表达量最高;而当亮氨酸的添加浓度为1.35 mmol/L时,CSN2基因的表达量最高;而当亮氨酸的添加浓度为0.45 mmol/L时,CSN3基因的表达量最高。
| 表5 亮氨酸氨酸对酪蛋白相关基因表达量的影响 Table 5 Effects of Leu on expression amount of genes encoding casein (n=3) |
由表6可见,与阴性对照组相比,在EBSS溶液中添加组氨酸显著影响酪蛋白基因表达量(P<0.05)。但是随着组氨酸浓度的升高其基因表达量呈下降趋势。不同浓度的组氨酸对相同酪蛋白的基因促进效果不同,在试验组中,当组氨酸的添加浓度为1.20 mmol/L时,CSN1S2和CSN3基因表达量最高;而当组氨酸的添加浓度为0.15 mmol/L时,CSN1S1和CSN2基因的表达量最高。
| 表6 组氨酸氨酸对酪蛋白相关基因表达量的影响 Table 6 Effects of His on expression amount of genes encoding casein (n=3) |
由表7可见,与阴性对照组相比,添加亮氨酸上调mTOR复合物1中的mTOR、mTOR复合物1中的绑定蛋白(binds to the kinase domain of mTOR,stabilizes protein of raptor,GβL)、mTOR调控蛋白(regulatory-associated protein of mTOR,raptor)基因的表达。当亮氨酸的添加浓度为0.45~5.40 mmol/L时,mTOR、raptor和GβL基因的表达量显著升高(P<0.05),当亮氨酸的浓度为1.35 mmol/L时,这3个基因的表达量在试验组中达到最高。但随着亮氨酸浓度的增加,这3个基因的表达量降低。
| 表7 亮氨酸对mTOR信号通路相关基因表达量的影响 Table 7 Effects of Leu on expression amount of genes related to mTOR signaling pathway (n=3) |
当添加亮氨酸时,mTOR信号通路下游基因:S6K1、真核翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1,4EBP1)、真核细胞翻译延伸因子2(eukaryotic elongation factor 2,eEF2)、核糖体蛋白S6(ribosomal protein S6,rps6)和真核翻译起始因子4E(eukaryotic translation initiation factor 4E,EIF4E)的表达也上调,但添加不同浓度的亮氨酸对mTOR通路中不同下游基因表达的促进效果不同。S6K1基因的表达量随着亮氨酸浓度的增加而减少;在试验组中,当亮氨酸的添加浓度为0.45 mmol/L时,S6K1表达量最高;当亮氨酸的添加浓度为1.35 mmol/L时,4EBP1和eEF2表达量最高;而EIF4E和rps6表达量最高时,亮氨酸的添加浓度为5.40 mmol/L。
由表8可见,当添加组氨酸时,与阴性对照组相比,raptor、4EBP1、eEF2、EIF4E和rps6基因的表达量随着组氨酸浓度的增加而增加。在试验组中,当组氨酸的浓度为4.80 mmol/L时,GβL的表达量达到最高;当组氨酸的浓度为0.15 mmol/L时,mTOR基因的表达量最高;而S6K1基因的表达量最高时,组氨酸的添加浓度为1.20 mmol/L。
| 表8 组氨酸对mTOR信号通路相关基因表达量的影响 Table 8 Effects of His on expression amount of genes encoding mTOR signaling pathway (n=3) |
激素、氨基酸、生长因子等因素影响体外乳腺上皮细胞的增殖、分化、泌乳等功能[27]。本研究在不含FBS的EBSS溶液中单一添加不同浓度的亮氨酸或组氨酸,研究发现,亮氨酸或组氨酸可以促进CMECs-H增殖,但是随着浓度的增加细胞增殖率反而下降,这可能与氨基酸过量供应导致利用效率降低有关[28]。庞学艳等[14]研究结果表明,亮氨酸作为外源添加的营养素对奶牛乳腺上皮细胞增殖具有一定的促进作用。同时Mercier等[29]指出,乳腺上皮细胞的数量很大程度上决定乳蛋白的合成量。李喜艳[24]的研究结果表明,当添加不同时间的赖氨酸或蛋氨酸会影响乳腺上皮细胞的增殖。其添加48 h对细胞的增值效果最强,原因是奶牛乳腺上皮细胞对外源添加营养素的适应期需要24 h,随着时间的延长,细胞生长代谢使得培养基的营养素浓度降低,对原代奶牛乳腺上皮细胞的增殖作用减弱。这与我们的研究结果不一致,本研究结果表明添加时间的不同并不会显著影响其增殖效果。
3.2 亮氨酸或组氨酸对mTOR信号通路介导酪蛋白合成相关基因表达的影响庞学燕等[14]利用qRT-PCR检测体外培养乳腺组织中CSN3表达量时发现,外源补充177.15 mg/L的亮氨酸能够显著促进CSN3基因的表达且能够显著促进CSN3的合成。有研究表明在乳腺上皮细胞中,必需氨基酸(EAA)通过调节mTOR信号通路中mTOR、4EBP1、eEF2和rps6因子的磷酸化进而影响乳蛋白合成[30, 31]。Toerien等[7]通过对饥饿22 h的泌乳奶牛静脉灌注氨基酸的研究,其结果表明,乳腺组织中灌注EAA增强了mTOR靶点S6K的磷酸化,同时也促进了乳蛋白的合成,EAA提高或趋向于提高乳腺内mTOR的活性,这表明mTOR信号通路能够调控乳蛋白产量。这为进一步研究EAA对体外培养的奶牛乳腺上皮细胞乳蛋白合成的机制提供了依据。
本试验采用qRT-PCR方法分别检测单一添加不同浓度的亮氨酸或组氨酸对CMECs-H中乳蛋白相关基因表达。结果表明,在EBSS溶液中添加浓度范围为0.45~10.80 mmol/L的亮氨酸,与阴性对照组相比,CSN1S1、CSN1S2和CSN3基因表达均显著上调;CSN2基因表达上调。在EBSS溶液中添加0.15~9.60 mmol/L浓度范围的组氨酸,与阴性对照组相比,CSN1S1、CSN2和CSN3基因表达均显著上调。但是不同浓度的亮氨酸和组氨酸对相同酪蛋白相关基因的促进效果不同,当亮氨酸浓度为5.40 mmol/L时,CSN1S1、CSN1S2基因表达量最高;当亮氨酸浓度为1.35 mmol/L时,CSN2基因表达量最高。当亮氨酸浓度为0.45 mmol/L时,CSN3基因表达量最高。这说明当EBSS中亮氨酸添加浓度为0.45~5.40 mmol/L时,酪蛋白相关基因的表达作用较强。这和其他研究者文章中所述的“适宜浓度的氨基酸能够促进泌乳相关基因的表达”的结果一致[14]。当亮氨酸浓度为5.40 mmol/L时,CSN1S1和CSN1S2基因表达量最高;当组氨酸浓度为0.15 mmol/L时,CSN1S1和CSN2基因表达量最高。这与前人报道的一致[19]。但从结果我们可以看出,无论添加多大浓度的亮氨酸或组氨酸,在影响乳蛋白或与mTOR信号通路相关基因时,基本是EBSS+10%FBS这一组作用最强。这可能是因为FBS中还有细胞生长过程中所需的较全面的蛋白因子及其他一些生物活性物质和营养物质,这也可以说明氨基酸之间的互作作用或是氨基酸与其他营养素之间的互作作用使与泌乳相关基因的表达强于单个氨基酸的作用。
4 结 论EBSS溶液中单一添加亮氨酸的浓度为0.15~5.40 mmol/L,组氨酸浓度为0.15~9.60 mmol/L范围时,促进CMECs-H增殖。随着浓度的增加,2种氨基酸对CMECs-H的增殖有抑制作用,说明亮氨酸或组氨酸对CMECs-H增殖的影响具有剂量依赖性。同样,亮氨酸或组氨酸对CMECs-H中酪蛋白的合成也具有剂量依赖性,当亮氨酸或组氨酸在最佳添加范围,可以调控酪蛋白和mTOR信号通路中与乳蛋白翻译相关基因的表达,潜在影响乳蛋白的合成。
| [1] | 杨金勇.蛋氨酸、赖氨酸及其二肽对奶牛乳腺上皮细胞酪蛋白αs1基因表达的影响[D]. 硕士学位论文.杭州:浙江大学, 2006:9-18. ( 1) 1)
|
| [2] | SINGH K, ERDMAN R A, SWANSON K M, et al.Epigenetic regulation of milk production in dairy cows[J]. Journal of Mammary Gland Biology and Neoplasia, 2010, 15(1):101-112. ( 1) 1)
|
| [3] | 李庆章.奶牛乳腺发育与泌乳生物学[M]. 北京:科学出版社, 2014:251-252. ( 1) 1)
|
| [4] | BRODERICK G A, STEVNSON M J, PATTON R A, et al.Effect of supplementing rumen-protected methionine on production and nitrogen excretion in lactating dairy cows[J]. Journal of Dairy Science, 2008, 91(3):1092-1102. ( 1) 1)
|
| [5] | SOCHA M T, PUTNAM D E GARTHWAITE B D, et al.Improving intestinal amino acid supply of pre- and postpartum dairy cows with rumen-protected methionine and lysine[J]. Journal of Dairy Science, 2005, 88(3):1113-1126. ( 1) 1)
|
| [6] | 曹洋, 艾阳, 张源淑.乳蛋白合成的信号通路与营养调控[J]. 畜牧与兽医, 2014, 6(7):133-136. ( 1) 1)
|
| [7] | TOERIEN C A, TROUT D R, CANT J P.Nutritional stimulation of milk protein yield of cows is associated with changes in phosphorylation of mammary eukaryotic initiation factor 2 and ribosomal s6 kinase 1[J]. The Journal of Nutrition, 2010, 140(2):285-292. ( 2) 2)
|
| [8] | TOERIEN C A, CANT J P.Abundance and phosphorylation state of translation initiation factors in mammary glands of lactating and nonlactating dairy cows[J]. Journal of Dairy Science, 2007, 90(6):2726-2734. ( 1) 1)
|
| [9] | 袁国铖.不同类型日粮对泌乳奶牛乳腺组织胰岛素通路及JAK-STAT信号通路的影响[D]. 硕士学位论文.兰州:甘肃农业大学, 2013 . ( 1) 1)
|
| [10] | GERMAN T, BARASH I.Characterization of an epithelial cell line from bovine mammary gland[J]. In Vitro Cellular & Developmental Biology:Animal, 2002, 38(5):282-292. ( 1) 1)
|
| [11] | 陈洪菊, 屈艺, 母得志.mTOR信号通路的生物学功能[J]. 生命的化学, 2010, 30(4):555-561. ( 1) 1)
|
| [12] | DEGUIL J, PERAULT-POCHAT M C, CHAVANT F, et al.Activation of the protein p70S6K via ERK phosphorylation by cholinergic muscarinic receptors stimulation in human neuroblastoma cells and in mice brain[J]. Toxicology Letters, 2008, 182(1/2/3):91-96. ( 1) 1)
|
| [13] | 曾波航, 庄莹, 陈静琦, 等.雷帕霉素对肺癌细胞mTOR信号通路相关蛋白表达的作用[J]. 肿瘤防治研究, 2011, 38(10):1105-1108. ( 1) 1)
|
| [14] | 庞学燕, 季昀, 田青, 等.亮氨酸对κ-酪蛋白合成的影响及相关信号通路的研究[J]. 中国畜牧杂志, 2013, 49(9):38-41. ( 4) 4)
|
| [15] | KIMBALL S R, JEFFERSON L S.New functions for amino acids:effects on gene transcription and translation[J]. The American Journal of Clinical Nutrition, 2006, 83(2):500S-507S. ( 1) 1)
|
| [16] | MABJEESH S J, KYLE C E, MACRAE J C, et al.Vascular sources of amino acids for milk protein synthesis in goats at two stages of lactation[J]. Journal of Dairy Science, 2002, 85(4):919-929. ( 1) 1)
|
| [17] | KIMBALL S R, JEFFERSON L S.Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis[J]. The Journal of Nutrition, 2006, 136(1S):227S-231S. ( 1) 1)
|
| [18] | APPUHAMY J A D R N, KNOEBEL N A, NAYANANJALIE W A D, et al.Isoleucine and leucine independently Regulate mTOR signaling and protein synthesis in MAC-T cells and bovine mammary tissue slices[J]. The Journal of Nutrition, 2012, 142(3):484-491. ( 1) 1)
|
| [19] | PRIZANT R L, BARASH I.Negative effects of the amino acids lys, his, and thr on s6k1 phosphorylation in mammary epithelial cells[J]. Journal of Cellular Biochemistry, 2008, 105(4):1038-1047. ( 3) 3)
|
| [20] | HU H, WANG J Q, BU D P, et al.In vitro culture and characterization of a mammary epithelial cell line from Chinese Holstein dairy cow[J]. PLoS Ooe, 2009, 4(11):e7636. ( 1) 1)
|
| [21] | 徐柏林.精氨酸对乳腺上皮细胞中酪蛋白合成的影响及其调控机制[D]. 硕士学位论文.扬州:扬州大学, 2012:2-55. ( 1) 1)
|
| [22] | SIGL T, MEYER H H D, WIEDEMANN S.Gene expression analysis of protein synthesis pathways in bovine mammary epithelial cells purified from milk during lactation and short-term restricted feeding[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(1):84-95. ( 1) 1)
|
| [23] | HAYASHI A A, NONES K, ROY N C, et al.Initiation and elongation steps of mRNA translation are involved in the increase in milk protein yield caused by growth hormone administration during lactation[J]. Journal of Dairy Science, 2009, 92(5):1889-1899. ( 1) 1)
|
| [24] | 李喜艳.奶牛乳腺上皮细胞中赖氨酸蛋氨酸配比模式对酪蛋白合成的影响及机理研究[D]. 硕士学位论文.北京:中国农业科学院, 2011:1-32. ( 2) 2)
|
| [25] | 胡菡, 王加启, 李发弟, 等.高温诱导体外培养奶牛乳腺上皮细胞的应激响应[J]. 农业生物技术学报, 2011, 19(2):287-293. ( 1) 1)
|
| [26] | LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408. ( 1) 1)
|
| [27] | EHMANN U K, PETERSON W D, Jr, MISFELDT D S.To grow mouse mammary epithelial cells in culture[J]. Journal of Cell Biology, 1984, 98(3):1026-1032. ( 1) 1)
|
| [28] | RAGGIO G, PACHECO D, BERTHIAUME R, et al.Effect of level of metabolizable protein on splanchnic flux of amino acids in lactating dairy cows[J]. Journal of Dairy Science, 2004, 87(10):3461-3472. ( 1) 1)
|
| [29] | MERCIER J C, GAYE P.Early events in secretion of main milk proteins:occurrence of precursors[J]. Journal of Dairy Science, 1982, 65(2):299-316. ( 1) 1)
|
| [30] | APPUHAMY J A D R, BELL A L, NAYANANJALIE W A D, et al.Essential amino acids regulate both initiation and elongation of mRNA translation independent of insulin in MAC-T cells and bovine mammary tissue slices[J]. The Journal of Nutrition, 2011, 141(6):1209-1215. ( 1) 1)
|
| [31] | APELO S I A, SINGER L M, LIN X Y, et al.Isoleucine, leucine, methionine, and threonine effects on mammalian target of rapamycin signaling in mammary tissue[J]. Journal of Dairy Science, 2014, 97(2):1047-1056. ( 1) 1)
|




