2. 中国农业科学院饲料研究所, 国家水产饲料安全评价基地, 北京 100081
2. National Aquafeed Safety Assessment Station, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
乙氧基喹琳(ethoxyquin,EQ)是一种化学合成的可以清除过氧化脂质自由基的芳香胺,又称为抗氧喹、虎皮灵、山道喹、乙氧喹等,它是一种油状液体,很容易渗透到饲料组分中,对蛋白质、脂肪,尤其是维生素,有很好的抗氧化作用[1]。关于EQ对生长的作用说法不一,有研究表明添加50、125 mg/kg EQ可以促进大黄鱼[2]、雏鸡[3]的生长,也有试验表明添加0~1 350 mg/kg的EQ对大西洋鲑的生长没有显著影响[4]。过量的EQ可能会使机体产生生理胁迫[5, 6],比如抑制ATP酶的产生和活性,影响呼吸链的传递等。当机体受到胁迫时,会产生大量的活性氧自由基(reactive oxygen species,ROS),自由基通过破坏膜结构、DNA等对组织造成损伤,一些外源性的抗氧化剂可以通过提高机体抗氧化酶的活性,减少脂质过氧化来提高自身的抗氧化能力。同时也有结果显示EQ会引发维生素过敏症、上皮组织膜加厚等[7, 8],但对肝脏的影响鲜有报道。
大口黑鲈(Micropterus salmoides),又名加州鲈,我国于20世纪70年代从美国加利福利亚州引进,并在1983年人工繁殖成功,现已发展成我国重要的淡水养殖品种之一。大口黑鲈作为肉食性鱼类对脂肪要求较高,为100.0~154.5 g/kg[9],而且本身对18碳脂肪酸合成多不饱和脂肪酸(PUFAs)的能力有限[10],对饲料氧化也很敏感[11]。饲料中脂肪尤其是高不饱和脂肪酸容易被氧化,一般在饲料中添加EQ可防止其被氧化,但脂肪代谢和氧化是非常复杂的过程,很多问题有待研究[12]。脂肪氧化过程中会产生大量ROS,鱼体自身有清除自由基的抗氧化防御体系,EQ是一种酚类抗氧化剂,可以清除自由基,是否对抗氧化防御体系中的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽硫转移酶(GST)等有影响需要进一步研究。虽然EQ目前的应用十分广泛,但对它的使用风险尚未确定。因此,本试验参考欧盟对动物饲料中EQ单独或与其他抗氧化剂复合使用时的最高推荐剂量150 mg/kg(2004/C 50/01),以大口黑鲈为靶动物,对EQ进行耐受性评价试验,以确定其在水产饲料中的安全限量。
1 材料与方法 1.1 试验鱼试验用大口黑鲈于2013年5月购自佛山市三水白金水产种苗有限公司。试验正式开始前,试验鱼在养殖系统中暂养2周,暂养期间投喂对照组饲料。
1.2 试验饲料本试验依据农业部《饲料与饲料添加剂水产靶动物耐受性评价试验规程》设计,EQ来自泰兴瑞泰化工有限公司,有效成分含量为95%。在大口黑鲈的基础饲料中分别添加0(对照)、150、300、1 500 mg/kg的EQ,依次命名为FFO、FFO-150、FFO-300、FFO-1500,其中150 mg/kg为参考欧盟最高推荐添加剂量,而300和1 500 mg/kg分别是它的2和10倍。另设一个氧化鱼油的负对照饲料,即用氧化鱼油替代基础饲料中的新鲜鱼油,命名为OFO。5种试验饲料的组成及营养水平见表1。将5种试验饲料制成直径为2.0 mm的挤压膨化沉性料(EXT50A,洋工机械,北京),自然晾干后于-20 ℃保存备用,并进行脂肪过氧化值(peroxide value,POV)、酸价(acid value,AV)、丙二醛(malonaldehyde,MDA)含量、茴香胺值(anisidine value,AnV)等指标的测定。为模拟生产中饲喂情况,在正式试验开始后,饲料存放于室温条件下。饲料中的水分、粗蛋白质、粗脂肪、粗灰分和总能含量分别采用105 ℃常压干燥法、凯氏定氮法、酸水解全脂肪测定法、550 ℃灼烧法和氧弹仪燃烧法测定。
1.3 试验分组及饲养管理试验在国家水产饲料安全评价基地(北京南口)室内循环流水养殖系统中进行。随机挑选体质健康、个体均匀的大口黑鲈(平均体重4.01 g),分配到容积为0.26 m3的圆锥形养殖桶中。本试验设计5个组,每组6个重复(桶),每桶30尾鱼。
| 表1 试验饲料组成及营养水平Table 1 Composition and nutrient levels of experimental diets |
试验鱼每天表观饱食投喂2次,投喂时间分别为08:00、17:00。定期检测水质,水质保持在溶氧(DO)浓度>7.0 mg/L,总氨氮(NH+4-N)浓度<0.3 mg/L,pH=7.5~8.5,水温23~25 ℃。
1.4 测定指标 1.4.1 生长性能养殖70 d后,分别对各桶鱼称重并计算生长性能指标,计算公式如下:
存活率(SR)=100×终末鱼数量/初始鱼数量;
增重率(WGR)=100×(终末总重-初始总重+死亡鱼体总重)/初始总重;
特定生长率(SGR)=100×(ln终末均重-ln初始均重)/试验天数;
饲料系数(FCR)=摄食量/鱼体增重;
摄食率(FR)=100×摄食量/[(终末总重+初始总重+死亡鱼体总重)/2]/试验天数。
1.4.2 形体指标每桶随机取3尾鱼测量体长、体重、内脏重、肝脏重并计算形体指标,计算公式如下:
肥满度(CF)=平均体重/平均体长3;
肝体比(HSI)=100×肝脏重/体重;
脏体比(VSI)=100×内脏重/体重。
1.4.3 抗氧化指标每桶随机取5尾鱼,将取出的肝脏、心脏、肌肉和鳃存放于-80 ℃待测。本试验所用试剂盒均购自南京建成生物工程研究所,测定指标有SOD、CAT、GST活性,MDA含量及总抗氧化能力(T-AOC)。
1.4.4 肝脏组织切片从OFO、FFO、FFO-150和FFO-1500组每桶随机取2尾鱼,每尾鱼取约0.5 cm×0.5 cm×0.5 cm大小的2块肝脏组织,用0.7%生理盐水清洗后放入10%甲醛固定液中。经酒精逐级脱水、透明、透蜡、包埋后,用组织切片机切片,用苏木精-伊红(HE)染色法染色后在光学显微镜(Leica DM2500,Leica,德国)下拍照。
1.5 数据统计与分析试验数据以平均值±标准误(mean±SE)表示,所有数据用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法多重比较检验组间差异的显著性,显著性水平为P<0.05。
2 结 果 2.1 EQ对大口黑鲈生长性能的影响由表2可知,各组FR没显著差异(P>0.05);OFO组的FBW、SGR均显著低于FFO、FFO-150、 FFO-1500组(P<0.05),且WGR显著低于FFO、FFO-300、FFO-1500组(P<0.05),其他各组间无显著差异(P>0.05);EQ的添加提高了大口黑鲈的SR,其中FFO-300、FFO-1500组显著高于OFO和FFO组(P<0.05);OFO组的FCR显著高于其他各组(P<0.05),其他各组间无显著差异(P>0.05)。
| 表2 EQ对大口黑鲈生长性能的影响Table 2 Effects of EQ on growth performance of largemouth bass (Micropterus salmoides)(n=6) |
由表3可知,FFO-150组的CF显著高于OFO组(P<0.05),其余各组间差异不显著(P>0.05);FFO-1500组的VSI、HSI与FFO组差异不显著(P>0.05),但显著高于其他各组(P<0.05)。
| 表3 EQ对大口黑鲈形体指标的影响Table 3 Effects of EQ on body indexes of largemouth bass (Micropterus salmoides) (n=6) |
表4显示,各组的SOD、CAT活性及T-AOC没有显著差异(P>0.05);GST活性和MDA含量均随EQ添加剂量的增加呈下降趋势,其中FFO-300、FFO-1500组的GST活性显著高于其他组(P<0.05),FFO-1500组的MDA含量显著低于其他组(P<0.05),其他组间差异不显著(P>0.05)。
| 表4 EQ对大口黑鲈肝脏抗氧化指标的影响Table 4 Effects of EQ on antioxidant indexes in liver of largemouth bass (Micropterus salmoides) (n=6) |
表5显示,各组的GST活性无显著差异(P>0.05),其余各抗氧化酶活性和MDA含量在OFO、FFO组间亦没有显著差异(P>0.05);SOD活性在FFO-1500组达到最高,显著高于其他各组(P<0.05),同时FFO-150、FFO-300组的SOD活性也显著高于OFO和FFO组(P<0.05);各EQ添加组的CAT活性与FFO组差异不显著(P>0.05),但FFO-150组显著高于OFO组(P<0.05);FFO-300和FFO-1500组的T-AOC显著高于OFO、FFO、FFO-150组(P<0.05);MDA含量在FFO-300组最低,显著低于OFO、FFO、FFO-150组(P<0.05)。
| 表5 EQ对大口黑鲈肌肉抗氧化指标的影响Table 5 Effects of EQ on antioxidant indexes in muscle of largemouth bass (Micropterus salmoides) (n=6) |
表6显示,OFO和FFO组的SOD、CAT、GST活性及T-AOC均没有显著差异(P>0.05);各EQ添加组的SOD活性显著低于FFO、OFO组(P<0.05),FFO与OFO组间差异不显著(P>0.05);FFO-300组的CAT活性显著高于其他各组(P<0.05),其他各组间差异不显著(P>0.05);FFO-300组的T-AOC显著高于FFO组(P<0.05),与FFO-150、FFO-1500组差异不显著(P>0.05);MDA含量随EQ添加剂量的增加呈下降趋势,在OFO组最高,FFO-1500组最低,除FFO-300、FFO-1500组间差异不显著(P>0.05)外,其他各组间均有显著差异(P<0.05)。
| 表6 EQ对大口黑鲈鳃抗氧化指标的影响Table 6 Effects of EQ on antioxidant indexes in gill of largemouth bass (Micropterus salmoides) (n=6) |
表7显示,各组SOD活性无显著差异(P>0.05);各EQ添加组的CAT活性和T-AOC均显著低于FFO和OFO组(P<0.05),FFO与OFO组间差异不显著(P>0.05);心脏组织中未检测出GST;FFO-300和FFO-1500组的MDA含量显著低于OFO组(P<0.05),但各EQ添加组与FFO组间差异不显著(P>0.05)。
| 表7 EQ对大口黑鲈心脏抗氧化指标的影响Table 7 Effects of EQ on antioxidant indexes in heart of largemouth bass (Micropterus salmoides) (n=6) |
OFO、FFO、FFO-150和FFO-1500组大口黑鲈的肝脏在低倍镜(100倍)下就可以观察到部分个体出现了不同程度的损伤(图1)。OFO组观察了12尾鱼的肝脏切片,2尾正常,核分布均匀;7尾出现脂肪泡,肝细胞变大,核移位;3尾逐渐出现肝纤维化。FFO组观察了12尾鱼,2尾正常;7尾出现轻微损伤,肝细胞变大或融合,有脂肪泡;3尾出现严重损伤。FFO-150组观察了11尾鱼,3尾正常;6尾有少量脂肪泡,肝细胞肿大,脂肪泡变性等;2尾出现肝细胞肿大及部分纤维化。FFO-1500组观察了12尾鱼,4尾正常;7尾轻度损伤,有少量脂肪泡,肝细胞变大,但核分布还是比较均匀的;1尾出现脂肪泡变性及部分纤维化。
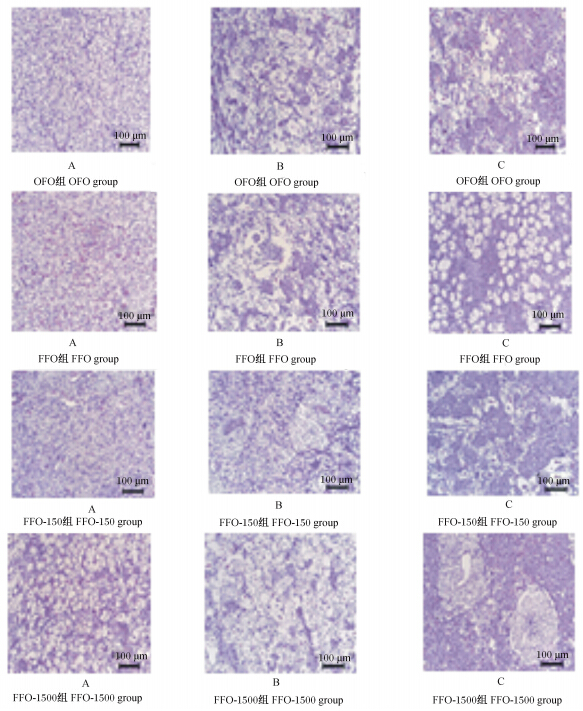 | 图1 大口黑鲈正常(A)、轻度损伤(B)、受损严重(C)肝脏组织切片Fig. 1 Tissue slices of liver of largemouth bass (Micropterus salmoides) including normal (A), minor injury (B),major injury (C) |
在饲料的加工和储存过程中饲料中的脂肪尤其是高不饱和脂肪酸极其容易氧化,而鱼油中含有大量高不饱和脂肪酸,氧化鱼油可以显著降低鲤鱼(Cyprinus carpio L.)[13]、大西洋鲑(Salmo salar)[14]、石斑鱼(Epinephelus coioides)[15]、黑鲷(Acanthopagrus schlegeli)[16]等的生长。在大西洋鲑[4]的研究中,0~1 500 mg/kg EQ的添加对其生长没有产生显著影响,但添加超过150 mg/kg的EQ会影响大黄鱼(Pseudosciaena crocea)、加州鲈(Lateolabrax japonicus)[1]的生长,达到350 mg/kg时会显著抑制雏鸡的生长[3]。本试验显示,添加1 500 mg/kg EQ对大口黑鲈的生长性能和存活率仍有促进作用,这可能与不同动物的耐受性有关, 也和基础饲料中的脂肪来源和脂肪含量有关。
Saxena等[5]报道400 mg/kg的EQ会抑制大菱鲆的摄食,Berdikova-Bohne等[4]在大西洋鲑饲料中添加EQ到15 000 mg/kg时出现了拒食现象,但Ohshima等[3]的结果与本试验一致,饲料中添加0~2 000 mg/kg EQ时没有影响大口黑鲈摄食。不稳定的脂肪容易快速分解成脂肪酸烷氧基自由基,再进一步分解为醛、酮、醇和羧酸等,这些物质又是导致不良风味产生的关键原因[17]。Fontagné等[18]发现,西伯利亚鲟(Acipenser baeri)能很好地吸收饲料中被氧化的脂肪,西伯利亚鲟生长速度的下降主要是由于饲料脂肪氧化所引起的胁迫造成的,并非摄食率降低所致。Kestemont等[19]和王珺[2]的研究均表明EQ是通过有效保护饲料中脂肪,防止其氧化来促进生长的。不同鱼类对饲料脂肪氧化敏感性也存在着种属差异[20],大口黑鲈对饲料的氧化比较敏感,而且本身对18碳脂肪酸合成多不饱和脂肪酸的能力有限[14],因此EQ的添加显著提高了试验鱼的生长,这可能与EQ可以延缓饲料里脂肪氧化、防止氧化胁迫有关。
3.2 EQ对大口黑鲈肝脏、肌肉、鳃和心脏组织抗氧化功能的影响当出现氧化胁迫的时候,机体会产生大量ROS,而过量的ROS会导致组织的脂质过氧化[21],机体为了维持平衡会启动自身的抗氧化防御系统,SOD、CAT、GST作为其中重要的抗氧化酶发挥重要作用,此外MDA是脂质过氧化的终产物,也是评价机体脂质过氧化程度和间接反映细胞损伤程度的重要指标。
本试验中,EQ对大口黑鲈肝脏中SOD、CAT活性及T-AOC没有产生显著影响,但FFO-300、FFO-1500组肝脏GST的活性显著低于OFO和FFO组。GST在肝脏中活性最高,具有催化一些内源或者外来有害物质的亲电子基团与还原性谷胱甘肽结合进而达到解毒的功能[22]。还有研究表明,有些GST也具有CAT的活性[23, 24],GST活性升高是肝脏受到外源或内源性物质伤害的一个重要指标[25, 26]。EQ可以提高小鼠肝脏中的GST活性,进而缓解肝脏损伤[27],但本试验结果与之相反,可能原因是EQ降低了MDA的含量,从而降低了肝脏的氧化应激,不需要机体产生过多的GST保护肝脏,而且这也与切片组织中1 500 mg/kg EQ降低了肝脏损伤相一致。
随EQ添加剂量的增加,大口黑鲈肌肉中SOD、CAT活性及T-AOC也随之提高,与此同时MDA含量降低。SOD是体内第1个与氧自由基反应的抗氧化酶[28],可以使超氧阴离子(O-2)歧化为过氧化氢(H2O2),CAT催化H2O2转变成水(H2O)和氧气(O2)[29],这2种酶之间相互作用,清除体内的氧自由基,降低脂质过氧化产物的生成。氧自由基可以通过破坏肌肉的细胞膜的完整性、攻击肌红蛋白等物质而达到影响肌肉的持水性、风味和色泽[30, 31]。李华等[32]研究显示,肉品的SOD活性升高、MDA含量降低可有效延长货架期,这与本试验的结果一致,说明EQ不仅可以提高肌肉的抗氧化能力,而且有助于维持良好的肉质。
鳃是鱼体进行氧化呼吸和物质交换的场所。EQ添加组(FFO-150、FFO-300、FFO-1500组)鳃中SOD活性显著低于OFO、FFO组,但FFO-300组鳃中CAT活性和T-AOC显著高于OFO、FFO组,而且随着EQ的增加,鳃中MDA的含量逐渐降低,在FFO-1500组达到最低。EQ本身作为一种抗氧化剂,也可以清除一些自由基,因此可能当它含量少的时候主要是通过机体抗氧化酶来降低脂质过氧化产物,含量高的时候自身就可以达到很好的清除作用,但EQ在鳃中的代谢机理尚不清楚。
EQ添加组心脏中MDA含量与OFO、FFO组没有显著差异,这与Bailey等[33]的结果相同,即EQ添加量在500、1 000 mg/kg时没有对鸡心脏MDA含量产生显著影响。但也有研究表明只有高剂量的抗氧化剂才能降低小鼠心脏中MDA的含量[34]。哺乳动物中,GST在氧化应激或局部缺血性再灌注引起的心肌细胞损伤中占有重要的调整作用[35, 36],而且GST的同工酶种类各异,在不同的组织中表达水平不同。本试验在大口黑鲈心脏中未检测出GST,可能原因是GST在大口黑鲈的心脏中不表达或对大口黑鲈心脏应激反应不敏感。
3.3 EQ对大口黑鲈肝脏组织学的影响依据《饲料与饲料添加利水产靶动物耐受性评价试验规程》,本研究只针对OFO、FFO、FFO-150和FFO-1500组的大口黑鲈肝脏进行临床组织病理学分析。各组大口黑鲈的肝脏都出现了不同程度的损伤,有大量脂肪泡变性,甚至纤维化,包括FFO-150和FFO-1500组,这2组鱼肝脏组织出现病变的几率和2个对照组(OFO、FFO组)没有显著差异,但是对肝脏的损伤有一定的缓解作用,其原因可能是,饲料在室温、自然光照条件下放置10周,饲料还是会发生一定程度的氧化,特别是对未添加外源性抗氧化剂的FFO组,当鱼类摄食氧化的饲料时会导致肝脏受到损伤[37, 38],出现脂肪肝、脂肪泡变性等现象。本试验中所测定的各组大口黑鲈肝脏组织均出现了一定比例的损伤,但结果显示FFO-1500组的肝脏组织与FFO-150组相比肝脏损伤有所缓减,说明肝脏的病变并不是EQ引起的。还有研究表明大口黑鲈对脂质过氧化比较敏感[15],轻微的脂肪氧化(POV为3.23 meq/kg饲料)就会导致生长的抑制。
4 结 论本研究结果证实,饲料中添加150 mg/kg EQ具有抗氧化保护作用且对大口黑鲈是安全的,安全系数为10倍。但从存活率和抗氧化保护功能来看,建议大口黑鲈饲料中EQ的最高推荐量为300 mg/kg。
| [1] | PRYOR W A, STRICKLAND T, CHURCH D F.Comparison of the efficiencies of several natural and synthetic antioxidants in aqueous SDS [sodium dodecyl sulfate] micelle solutions[J]. Journal of the American Chemical Society, 1998, 110(7):2224-2229. ( 2) 2)
|
| [2] | 王珺.乙氧基喹啉、氧化鱼油和烟酸铬对大黄鱼与鲈鱼生长性能的影响及其(或代谢物)在鱼体组织中残留的研究[D]. 博士学位论文.青岛:中国海洋大学, 2010. ( 2) 2)
|
| [3] | OHSHIMA M, LAYUG D, YOKOTA H, et al.Effect of graded levels of ethoxyquin in alfalfa leaf extracts on carotenoid and cholesterol concentrations in chicks[J]. Animal Feed Science and Technology, 1996, 62(2/3/4):141-150. ( 3) 3)
|
| [4] | BERDIKOVA-BOHNE V J, LUNDEBYE A K, HAMRE K.Accumulation and depuration of the synthetic antioxidant ethoxyquin in the muscle of Atlantic salmon (Salmo salar L.)[J]. Food and Chemical Toxicology, 2008, 46(5):1834-1843. ( 3) 3)
|
| [5] | SAXENA T B, ZACHARIASSEN K E, JØRGENSEN L.Effects of ethoxyquin on the blood composition of turbot, Scophthalmus maximus L.[J]. Comparative Biochemistry and Physiology Part C:Pharmacology, Toxicology and Endocrinology, 2000, 127(1):1-9. ( 2) 2)
|
| [6] | REYES J L, HERNÁNDEZ M E, MELÉNDEZ E, et al.Inhibitory effect of the antioxidant ethoxyquin on electron transport in the mitochondrial respiratory chain[J]. Biochemical Pharmacology, 1995, 49(3):283-289. ( 1) 1)
|
| [7] | ALANKO K, JOLANKI R, ESTLANDER T, et al.Occupational'multivitamin allergy'caused by the antioxidant ethoxyquin[J]. Contact Dermatitis, 1998, 39(5):263-264. ( 1) 1)
|
| [8] | MANSON M M, GREEN J A, DRIVER H E.Ethoxyquin alone induces preneoplastic changes in rat kidney whilst preventing induction of such lesions in liver by aflatoxin B1[J]. Carcinogenesis, 1987, 8(5):723-728. ( 1) 1)
|
| [9] | PORTZ L, CYRINO J E P, MARTINO R C.Growth and body composition of juvenile largemouth bass Micropterus salmoides in response to dietary protein and energy levels[J]. Aquaculture Nutrition, 2001, 7(4):247-254. ( 1) 1)
|
| [10] | SUBHADRA B, LOCHMANN R, RAWLES S, et al.Effect of dietary lipid source on the growth, tissue composition and hematological parameters of largemouth bass (Micropterus salmoides)[J]. Aquaculture, 2006, 255(1/2/3/4):210-222. ( 1) 1)
|
| [11] | YUAN Y, CHEN Y J, LIU Y J, et al.Dietary high level of vitamin premix can eliminate oxidized fish oil-induced oxidative damage and loss of reducing capacity in juvenile largemouth bass (Micropterus salmoides)[J]. Aquaculture Nutrition, 2014, 20(2):109-117. ( 1) 1)
|
| [12] | GUTTERIDGE J M C, HALLIWELL B.The measurement and mechanism of lipid peroxidation in biological systems[J]. Trends in Biochemical Sciences, 1990, 15(4):129-135. ( 1) 1)
|
| [13] | 任泽林, 曾虹, 霍启光, 等.氧化鱼油对鲤肝胰脏抗氧化机能及其组织结构的影响[J]. 大连水产学院学报, 2000, 15(4):235-243. ( 1) 1)
|
| [14] | KOSHIO S, ACKMAN R G, LALL S P.Effects of oxidized herring and canola oils in diets on growth, survival, and flavor of Atlantic salmon, Salmo salar[J]. Journal of Agricultural and Food Chemistry, 1994, 42(5):1164-1169. ( 2) 2)
|
| [15] | 张朝正.氧化鱼油和高氟饲料对石斑鱼的危害性评估[D]. 硕士学位论文.广州:中山大学, 2005. ( 2) 2)
|
| [16] | 彭士明, 陈立侨, 叶金云, 等.饲料中添加氧化鱼油对黑鲷幼鱼生长的影响[J]. 水产学报, 2007, 31(增刊):109-115. ( 1) 1)
|
| [17] | HAMRE K, KOLÅS K, SANDNES K, et al.Feed intake and absorption of lipid oxidation products in Atlantic salmon (Salmo salar) fed diets coated with oxidised fish oil[J]. Fish Physiology and Biochemistry, 2001, 25(3):209-219. ( 1) 1)
|
| [18] | FONTAGNÉ S, BAZIN D, BRÈQUE J, et al.Effects of dietary oxidized lipid and vitamin A on the early development and antioxidant status of Siberian sturgeon (Acipenser baeri) larvae[J]. Aquaculture, 2006, 257(1/2/3/4):400-411. ( 1) 1)
|
| [19] | KESTEMONT P, VANDELOISE E, MÉLARD C, et al.Growth and nutritional status of Eurasian perch Perca fluviatilis fed graded levels of dietary lipids with or without added ethoxyquin[J]. Aquaculture, 2001, 203(1/2):85-99. ( 1) 1)
|
| [20] | TOCHER D R, MOURENTE G, VAN DER EECKEN A, et al.Comparative study of antioxidant defence mechanisms in marine fish fed variable levels of oxidised oil and vitamin E[J]. Aquaculture International, 2003, 11(1/2):195-216. ( 1) 1)
|
| [21] | HALLIWELL B, GUTTERIDGE J M C.Oxygen toxicity, oxygen radicals, transition metals and disease[J]. The Biochemical Journal, 1984, 219(1):1-14. ( 1) 1)
|
| [22] | 聂立红, 王声湧, 胡毅玲.谷胱甘肽硫-转移酶研究进展[J]. 中国病理生理杂志, 2000, 16(11):1240-1243. ( 1) 1)
|
| [23] | HORTON J K, ROY G, PIPER J T, et al.Characterization of a chlorambucil-resistant human ovarian carcinoma cell line overexpressing glutathione S-transferase μ[J]. Biochemical Pharmacology, 1999, 58(4):693-702. ( 1) 1)
|
| [24] | 马森.谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展, 2008, 29(10):53-56. ( 1) 1)
|
| [25] | SEN A, KIRIKBAKAN A.Biochemical characterization and distribution of glutathione S-transferases in leaping mullet (Liza saliens)[J]. Biochemistry, 2004, 69(9):993-1000. ( 1) 1)
|
| [26] | XU Z R, BAI S J.Effects of waterborne Cd exposure on glutathione metabolism in Nile tilapia (Oreochromis niloticus) liver[J]. Ecotoxicology and Environmental Safety, 2007, 67(1):89-94. ( 1) 1)
|
| [27] | BENSON A M, BATZINGER R P, OU S Y L, et al.Elevation of hepatic glutathione S-transferase activities and protection against mutagenic metabolites of benzo(a)pyrene by dietary antioxidants[J]. Cancer Reaearch, 1978, 38(12):4486-4495. ( 1) 1)
|
| [28] | WINSTON G W, DI GIULIO R T.Prooxidant and antioxidant mechanisms in aquatic organisms[J]. Aquatic Toxicology, 1991, 19(2):137-161. ( 1) 1)
|
| [29] | DAVID M, MUNASWAMY V, HALAPPA R, et al.Impact of sodium cyanide on catalase activity in the freshwater exotic carp, Cyprinus carpio (Linnaeus)[J]. Pesticide Biochemistry and Physiology, 2008, 92(1):15-18. ( 1) 1)
|
| [30] | TSUCHIHASHI H, KIGOSHI M, IWATSUKI M, et al.Action of β-carotene as an antioxidant against lipid peroxidation[J]. Archives of Biochemistry and Biophysics, 1995, 323(1):137-147. ( 1) 1)
|
| [31] | ECHEVARME C, RENERRE M, LABAS R.Metmyoglobin reductase activity in bovine muscles[J]. Meat Science, 1990, 27(2):161-172. ( 1) 1)
|
| [32] | 李华, 曾勇庆, 魏述东, 等.猪宰后肌肉SOD与MDA的变化及其对肉质特性的影响[J]. 畜牧兽医学报, 2010, 41(3):257-261. ( 1) 1)
|
| [33] | BAILEY C A, SRINIVASAN L J, MCGEACHIN R B.The effect of ethoxyquin on tissue peroxidation and immune status of single comb White Leghorn cockerels[J]. Poultry Science, 1996, 75(9):1109-1112. ( 1) 1)
|
| [34] | LEIBOVITZ B, HU M L, TAPPEL A L.Dietary supplements of vitamin E, beta-carotene, coenzyme Q10 and selenium protect tissues against lipid peroxidation in rat tissue slices[J]. The Journal of Nutrition, 1990, 120(1):97-104. ( 1) 1)
|
| [35] | RÖTH E, MARCZIN N, BALATONYI B, et al.Effect of a glutathione S-transferase inhibitor on oxidative stress and ischemia-reperfusion-induced apoptotic signalling of cultured cardiomyocytes[J]. Experimental and Clinical Cardiology, 2011, 16(3):92-96. ( 1) 1)
|
| [36] | YIN L, HAN X, YU Y, et al.Antioxidant effect of Selenium-containing glutathione S-transferase in rat cardiomyocytes[J]. Chemical Research in Chinese Universities, 2012, 28(3):454-458. ( 1) 1)
|
| [37] | CHEN Y J, LIU Y J, YANG H J, et al.Effect of dietary oxidized fish oil on growth performance, body composition, antioxidant defence mechanism and liver histology of juvenile largemouth bass Micropterus salmoides[J]. Aquaculture Nutrition, 2012, 18(3):321-331. ( 1) 1)
|
| [38] | YUN B, XUE M, WANG J, et al.Effects of lipid sources and lipid peroxidation on feed intake, growth, and tissue fatty acid compositions of largemouth bass (Micropterus salmoides)[J]. Aquaculture International, 2013, 21(1):97-110. ( 1) 1)
|




