2. 湖南农业大学动物科技学院, 长沙 410128;
3. 双胞胎(集团) 股份有限公司, 南昌 330000
2. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China;
3. Twins Group, Co., Ltd., Nanchang 330000, China
壳寡糖(chito-oligosaccharide,COS)学名为β-1,4-寡聚-葡萄糖胺。COS分子带有活性氨基基团,而且可被动物直接吸收入血作用于靶细胞,在提高机体抗氧化能力方面发挥着重要作用[1]。COS可被巨噬细胞内吞[2],刺激巨噬细胞产生多种细胞因子和活性氮氧化物[3]。金黎明等[4]发现,COS可降低小鼠血清中谷草转氨酶、谷丙转氨酶活性和肝脏组织中的丙二醛(MDA)含量,保护肝脏不受四氯化碳的损伤,提高肝脏抗氧化力;Liu等[5]发现,在培养人脐静脉内皮细胞中添加COS,能增加其超氧化歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的活性,抑制过氧化氢生成活性氧。另外,COS可络合金属离子,形成重金属-大分子复合物,抑制由金属离子催化的氧化性损伤以及羟自由基的产生[6, 7]。
妊娠期动物机体代谢途径与非妊娠状态有所不同,这种差异随妊娠进程表现更为明显。妊娠后期,胎儿的迅速发育对氧气与养分需求增加迅速,对母体造成严重的代谢负担[8],更容易导致氧化应激[9, 10],而产生的自由基可损伤胎盘绒毛,导致绒毛细胞膜、线粒体膜和胎盘功能异常,影响胎儿在子宫内的发育[11]。此外,应激导致的氧化损伤还会造成母猪泌乳性能和机体免疫机能下降,严重影响母猪自身健康、利用年限及其子代发育[12, 13, 14]。因此,抗氧化损伤修复措施的合理选择对繁殖母猪意义十分突出。本试验研究通过妊娠后期母猪饲粮中添加COS,以考察COS对母猪及新生仔猪抗氧化能力的影响。 1 材料与方法 1.1 试验材料
COS为水溶性COS,聚合度在2~10之间,以3~4糖为主,分子质量≤2 000 u,纯度为10%,由中泰和(北京)科技发展有限公司提供。 1.2 试验动物与试验设计
选择体重接近(185 kg左右)、胎次接近(3~5胎)、预产期一致和与配公猪一致的健康“长×白”二元杂母猪16头,随机分为2组,每组8个重复,每个重复1头母猪。对照组饲喂的基础饲粮参照NRC(1998)推荐的哺乳母猪饲粮营养水平设计配方,基础饲粮组成及营养水平见表1;COS组在基础饲粮上添加30 g/t的COS(按10%纯度COS折算成纯品的添加量),每天08:30及15:00饲喂2次,每头母猪投料量在1.8 kg/d左右。试验从母猪妊娠85 d开始至产仔结束,在江西双胞胎集团赣州安远金塘原种猪场进行,严格按照猪场防疫和饲养管理制度进行操作。
| 表1 饲粮基础组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
记录母猪产仔数、健仔数(体重大于800 g)、初生个体重、窝重、产程(首个仔猪产出到胎盘排出的时间间隔)。
妊娠110 d前腔静脉采血10 mL,仔猪出生后,于其吃奶前每窝随机选择1头与窝平均体重相近(1.60±0.04) kg的仔猪,前腔静脉采血5 mL,加肝素钠,轻轻混匀,室温静置30 min后离心收集血浆。采用比色法检测血液中总超氧化物歧化酶(TSOD)、GSH-Px、过氧化氢酶(CAT)活性及MDA含量,试剂盒购自南京建成生物工程研究所,方法按说明书进行。
将采血后的仔猪屠宰,采集肝脏、十二指肠、空肠、回肠、结肠,以1.5 mL EP管装好,放入液氮速冻后转至-80 ℃冰箱中保存。
采用Trizol(Invitrogen公司,美国)法提取组织中总RNA,具体操作方法参照Simms等[15],然后将RNA浓度调节一致,取100 ng进行反转录,反转录试剂盒购自TaKaRa公司(日本),具体方法按说明书进行,再利用Real-time PCR法检测组织中锰超氧化物歧化酶(Mn-SOD)、铜锌超氧化物歧化酶(CuZn-SOD)、CAT、谷胱甘肽过氧化物酶1(GPX1)、谷胱甘肽过氧化物酶4(GPX4)基因的相对表达量,基因的引物设计如表2。
| 表2 实时荧光定量聚合酶链反应引物序列 Table 2 Primer sequence of real-time PCR |
试验数据经Excel 2010初步整理后,运用SPSS 19.0统计软件的t检验法进行组间差异显著性比较,以P<0.05为差异显著,结果以平均值±标准误( ±SEM)表示。 2 结果与分析 2.1 妊娠后期母猪饲粮中添加COS对母猪繁殖性能的影响
由表3可知,妊娠后期母猪饲粮中添加COS对母猪繁殖性能没有显著的影响(P>0.05),但是在一定程度上可以缩短母猪产程。
| 表3 妊娠后期母猪饲粮中添加COS对母猪繁殖性能的影响 Table 3 Effects of dietary COS in late-gestation sows on reproductive performance of sows (n=8) |
由表4可知,妊娠后期母猪饲粮中添加COS显著提高了血液中TSOD活性(P<0.05),并有降低MDA含量的趋势(P>0.05),但对GSH-Px及CAT活性无显著影响(P>0.05)。
| 表4 妊娠后期母猪饲粮中添加COS对母猪血液抗氧化指标的影响 Table 4 Effects of dietary COS in late-gestation sows on blood antioxidant indicators of sows (n=8) |
由表5可知,妊娠后期母猪饲粮中添加COS显著提高了新生仔猪血液中GSH-Px、CAT活性(P<0.05),并有降低MDA含量的趋势(P>0.05),而新生仔猪血液中TSOD活性差异不显著(P>0.05)。
| 表5 妊娠后期母猪饲粮中添加COS对新生仔猪血液抗氧化力的影响 Table 5 Effects of dietary COS in late-gestation sows on blood antioxidant indicators of piglets (n=8) |
由图1至图5可知,妊娠后期母猪饲粮中添加COS增加了新生仔猪抗氧化基因GPX1在十二指肠及结肠中的相对表达量,显著了降低了GPX1在空肠中的相对表达量(P<0.05);GPX4在空肠中相对表达量显著上升(P<0.05),且在回肠中的相对表达量有上升趋势(P>0.05),与血液中GSH-Px活性的变化一致。Mn-SOD和CuZn-SOD的相对表达量2组之间均没有显著差异(P>0.05);COS组CAT的相对表达量在回肠中显著升高(P<0.05),且在肝脏中相对表达量有上升的趋势(P<0.05),与新生仔猪血液中CAT活性变化规律一致。
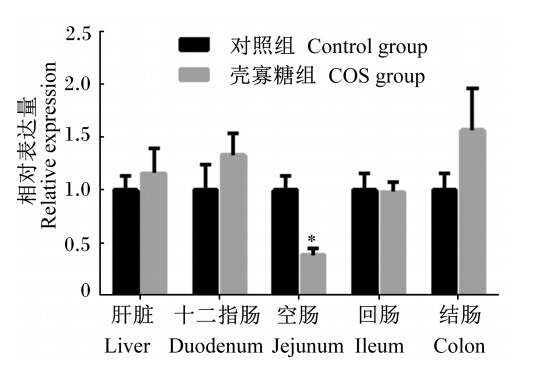 | 图1 GPX1在初生仔猪各组织的相对表达量 Fig. 1 The relative expression of GPX1 in tissues of piglets |
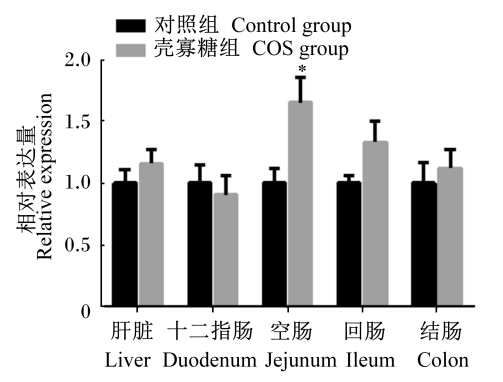 | 图2 GPX4在初生仔猪各组织的相对表达量 Fig. 2 The relative expression of GPX4 in tissues of piglets |
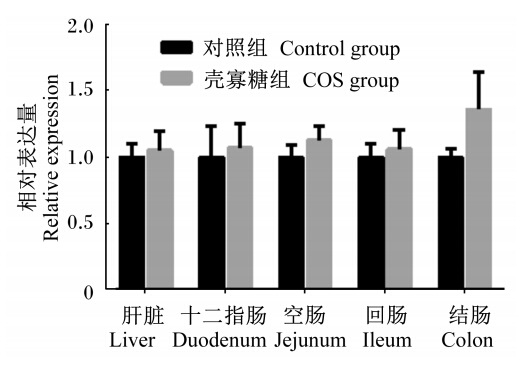 | 图3 Mn-SOD在仔猪各组织的相对表达量 Fig. 3 The relative expression of Mn-SOD in tissues of piglets |
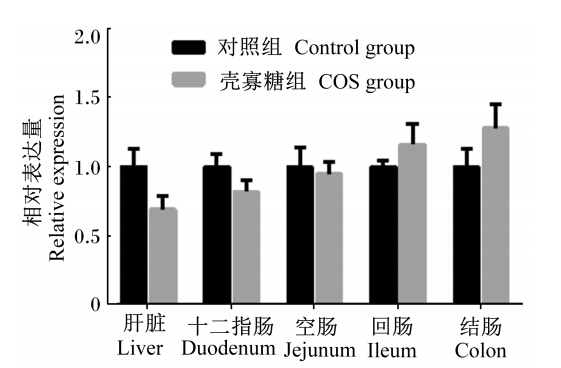 | 图4 CuZn-SOD在仔猪各组织的相对表达量 Fig. 4 The relative expression of CuZn-SOD in tissues of piglets |
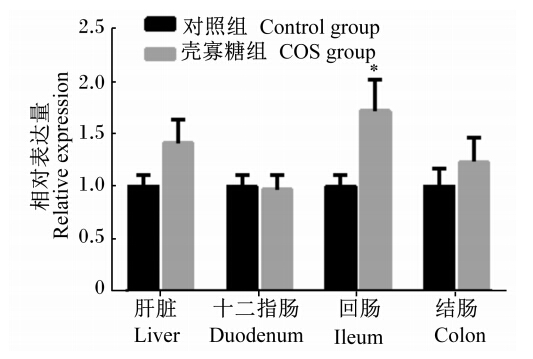 | 数据注上标*表示与对照组差异显著(P<0.05)。 Value columns with * mean significant difference compared with control group (P<0.05).图5 CAT在初生仔猪各组织的相对表达量 Fig. 5 The relative expression of CAT in tissues of piglets |
机体应激过程中产生的自由基具有强氧化性,可损害机体组织与细胞,可使机体内大分子蛋白质氧化生成其他自由基(如蛋白质-过氧羟自由基)和蛋白质氧化性产物,如造成蛋白质分子侧链中氧化性氨基酸的生成、蛋白质片断化、氨基酸或者蛋白质的亚硝基化以及蛋白质糖基化产物的生成[16]。羟自由基亦可与核苷酸碱基和脱氧核糖链直接反应,形成大量修饰化碱基,其中8-羟基鸟嘌呤(8-OHdG)是碱基主要的损伤形式[17]。另外,自由基与细胞膜系统中的一些不饱和脂肪酸结合,加剧脂质过氧化的发生,生成反应活性很高的醛类(如MDA),这些醛类会与核酸、蛋白质等大分子物质交联聚合,引起基因突变[1]。
COS是一种具有抗氧化作用的功能性添加剂,研究发现,COS能减少机体自由基的数量。Sun等[18]的体外研究表明,COS对细胞中超氧阴离子有较好的清除作用,其能力甚至与维生素C、SOD的作用相当;另外一些学者发现COS对羟自由基[19]、1,1-二苯基-2-三硝基苯肼(DPPH)[20]自由基亦有较好的清除效果,并且清除作用会随着COS浓度升高而增强。在本研究中,母猪和仔猪血液中MDA含量均有不同程度下降,而MDA是机体内自由基攻击细胞膜后脂质过氧化产物[21],其含量可间接反映出机体细胞受自由基攻击的严重程度[22],说明妊娠后期母猪饲粮中添加COS能减少机体内自由基的产生。
此外,饲粮中添加COS具有提高机体抗氧化酶活性的作用,Yoon等[23]通过体外试验发现,COS具有缓解急性肾衰竭引起的抗氧化酶活性下降的作用。Liu等[5]发现,利用COS干预由过氧化氢引起的血管内皮细胞抗氧化损伤模型,能有效提高细胞内SOD、GSH-Px、一氧化氮(NO)等抗氧化酶的活性。国内一些学者也发现,COS能缓解糖尿病[24]、肝损伤[25]模型中抗氧化酶下降的现象,提高机体SOD、GSH-Px等抗氧化酶的活性。本研究中,妊娠后期母猪饲粮中添加COS使妊娠后期血液中TSOD活性上升了17.4%,MDA含量下降了40.6%,证明COS对母猪的抗氧化能力具有一定的改善作用。胎儿在母体内通过胎盘与母体进行营养物质、代谢产物、气体、生物活性物质等的交换,胎盘通过血液循环以满足胎儿生长发育对营养物质的需要[26],且胎盘则可以通过形态和功能的变化来适应胎儿对营养物质的不断需求[27],因此母体的营养水平及健康状况直接影响孕期胎儿的发育。在本研究中,妊娠后期母猪饲粮中添加COS使新生仔猪血液中GSH-Px活性显著上升,提高了其组织中调控基因GPX4相对表达量,然而在仔猪空肠中,COS组GPX1相对表达量出现下降现象,而GPX4是物种生存所必需的,被敲除后会导致动物死亡[28, 29],这说明GPX4对整个抗氧化系统起到决定性作用,另外,Malandrakis等[30]对金头鲷的急性应激试验发现,GPX1与GPX4出现相反的表达规律;COS亦提高了仔猪血液中CAT活性及基因相对表达量;但2个处理之间新生仔猪体内SOD活性及基因相对表达量没有发生明显的变化。GSH-Px、SOD、CAT为机体内重要的抗氧化酶,在机体自由基清除上发挥着重要作用,其活性直接反映出机体的抗氧化能力[31]。表明妊娠后期母猪饲粮中添加COS可提高新生仔猪抗氧化能力。 4 结 论
妊娠后期(85 d至产仔)母猪饲粮中添加30 g/t COS可能通过提高母猪抗氧化酶活性缩短母猪产程,从而影响母猪的繁殖能力;同时,还可提高新生仔猪体内抗氧化酶活性及其上游调控基因的表达,提高仔猪抗氧化力。
| [1] | AAM B B, HEGGSET E B, NORBERG A L, et al.Production of chitooligosaccharides and their potential applications in medicine[J]. Marine Drugs, 2010, 8(5):1482-1517. ( 2) 2)
|
| [2] | 韩艳萍, 赵鲁杭, 吴海明.壳寡糖激活巨噬细胞的机制[J]. 浙江大学学报:医学版, 2006, 35(3):265-272. ( 1) 1)
|
| [3] | YU Z J, ZHAO L H, KE H P.Potential role of nuclear factor-kappaB in the induction of nitric oxide and tumor necrosis factor-alpha by oligochitosan in macrophages[J]. International Immunopharmacology, 2004, 4(2):193-200. ( 1) 1)
|
| [4] | 金黎明, 杨艳, 刘万顺, 等.壳寡糖及其衍生物对CCl4诱导的小鼠肝损伤的保护作用[J]. 山东大学学报:理学版, 2007, 42(7):1-4. ( 1) 1)
|
| [5] | LIU H T, LI W M, XU G, et al.Chitosan oligosaccharides attenuate hydrogen peroxide-induced stress injury in human umbilical vein endothelial cells[J]. Pharmacological Research, 2009, 59(3):167-175. ( 2) 2)
|
| [6] | MUZZARELLI R A A.Natural chelating polymers:alginic acid, chitin and chitosan[M]. Michigan:Pergamon Press, 1973. ( 1) 1)
|
| [7] | ESUMI K, TAKEI N, YOSHIMURA T.Antioxidant-potentiality of gold-chitosan nanocomposites[J]. Colloids and Surfaces B:Biointerfaces, 2003, 32(2):117-123. ( 1) 1)
|
| [8] | VANNUCCHI C I, JORDAO A A, VANNUCCHI H.Antioxidant compounds and oxidative stress in female dogs during pregnancy[J]. Research in Veterinary Science, 2007, 83(2):188-193. ( 1) 1)
|
| [9] | BERNARDI F, CONSTANTINO L, MACHADO R, et al.Plasma nitric oxide, endothelin-1, arginase and superoxide dismutase in pre-eclamptic women[J]. Journal of Obstetrics and Gynaecology Research, 2008, 34(6):957-963. ( 1) 1)
|
| [10] | BERCHIERI-RONCHI C B, KIM S W, ZHAO Y, et al.Oxidative stress status of highly prolific sows during gestation and lactation[J]. Animal, 2011, 5(11):1774-1779. ( 1) 1)
|
| [11] | 赵世民.医学自由基的基础与临床[M]. 济南:山东大学出版社, 1993:210-215. ( 1) 1)
|
| [12] | FLOWERS B, DAY B N.Alterations in gonadotropin secretion and ovarian function in prepubertal gilts by elevated environmental temperature[J]. Biology of Reproduction, 1990, 42(3):465-471. ( 1) 1)
|
| [13] | ZHAO Y, FLOWERS W L, SARAIVA A, et al.Effect of heat stress on oxidative stress status and reproductive performance of sows[J]. Journal of Animal Science, 2011, 89(2):108. ( 1) 1)
|
| [14] | ZHAO Y, FLOWERS W L, SARAIVA A, et al.Effect of social ranks and gestation housing systems on oxidative stress status, reproductive performance, and immune status of sows[J]. Journal of Animal Science, 2013, 91(12):5848- 5858. ( 1) 1)
|
| [15] | SIMMS D, CIZDZIEL P E, CHOMCZYNSKI P.TRIzol:a new reagent for optimal single-step isolation of RNA[J]. Focus, 1993, 15(4):532-535. ( 1) 1)
|
| [16] | DIZDAROGLU M, NACKERDIEN Z, CHAO B C, et al.Chemical nature of in vivo DNA base damage in hydrogen peroxide-treated mammalian cells[J]. Archives of Biochemistry and Biophysics, 1991, 285(2):388-390. ( 1) 1)
|
| [17] | TOYOKUNI S, UCHIDA K, OKAMOTO K, et al.Formation of 4-hydroxy-2-nonenal-modified proteins in the renal proximal tubules of rats treated with a renal carcinogen, ferric nitrilotriacetate[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(7):2616-2620. ( 1) 1)
|
| [18] | SUN T, XIE W M, XU P X.Superoxide anion scavenging activity of graft chitosan derivatives[J]. Carbohydrate Polymers, 2004, 58(4):379-382. ( 1) 1)
|
| [19] | XIE W M, XU P X, LIU Q.Antioxidant activity of water-soluble chitosan derivatives[J]. Bioorganic & Medicinal Chemistry Letters, 2001, 11(13):1699-1701. ( 1) 1)
|
| [20] | 张吉, 刘洪涛, 李秀英, 等.壳寡糖对自由基的清除及对N9小胶质细胞的保护作用[J]. 食品科学, 2010, 31(7):81-85. ( 1) 1)
|
| [21] | ESTERBAUER H, SCHAUR R J, ZOLLNER H.Chemistry and biochemistry of 4-hydroxynonenal, malonaldehyde and related aldehydes[J]. Free Radical Biology and Medicine, 1991, 11(1):81-128. ( 1) 1)
|
| [22] | PETER M.Ototoxic effects of free radical generated during metabolism of drugs and other chemical[J]. Parm Toxicol, 1987, 60:11. ( 1) 1)
|
| [23] | YOON H J, MOON M E, PARK H S, et al.Effects of chitosan oligosaccharide (COS) on the glycerol-induced acute renal failure in vitro and in vivo[J]. Food and Chemical Toxicology, 2008, 46(2):710-716. ( 1) 1)
|
| [24] | 刘冰, 刘万顺, 韩宝芹, 等.壳寡糖对胰岛β细胞的保护及其体内抗氧化作用的研究[J]. 高技术通讯, 2007, 17(9):968-973. ( 1) 1)
|
| [25] | 许青松, 宫德正, 谭成玉, 等.壳寡糖对四氯化碳致急性肝损伤小鼠的保护作用[J]. 中国海洋药物杂志, 2006, 25(5):31-33. ( 1) 1)
|
| [26] | CAMPOS P, SILVA B A N, DONZELE J L, et al.Effects of sow nutrition during gestation on within-litter birth weight variation:a review[J]. Animal, 2012, 6(S5):797-806. ( 1) 1)
|
| [27] | LARQUÉ E, RUIZ-PALACIOS M, KOLETZKO B.Placental regulation of fetal nutrient supply[J]. Current Opinion in Clinical Nutrition & Metabolic Care, 2013, 16(3):292-297. ( 1) 1)
|
| [28] | MAIORINO M, SCAPIN M, URSINI F, et al.Distinct promoters determine alternative transcription of gpx-4 into phospholipid-hydroperoxide glutathione peroxidase variants[J]. Journal of Biological Chemistry, 2003, 278(36):34286-34290. ( 1) 1)
|
| [29] | YANT L J, RAN Q T, RAO L, et al.The selenoprotein GPX4 is essential for mouse development and protects from radiation and oxidative damage insults[J]. Free Radical Biology and Medicine, 2003, 34(4):496-502. ( 1) 1)
|
| [30] | MALANDRAKIS E E, EXADACTYLOS A, DADALI O, et al.Molecular cloning of four glutathione peroxidase (GPx) homologs and expression analysis during stress exposure of the marine teleost Sparus aurata[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2014, 168:53-61. ( 1) 1)
|
| [31] | SOHAL R S, SOHAL B H, ORR W C.Mitochondrial superoxide and hydrogen peroxide generation, protein oxidative damage, and longevity in different species of flies[J]. Free Radical Biology and Medicine, 1995, 19(4):499-504. ( 1) 1)
|




