随着生活水平的不断提高及营养科学研究的进步,人们对牛奶的品质要求也越来越高。乳脂是牛奶中的重要组成部分,也是牛奶品质重要衡量指标之一,与其他固体成分(乳蛋白和乳糖)相比,乳脂的含量易受饲粮调控而发生改变[1]。在奶牛饲粮中添加调节剂可调控乳脂含量,但是化学药物和抗生素的残留问题一直困扰着乳产品的安全,研究开发新型、安全、绿色饲料添加剂代替化学添加剂成为一种必然趋势。
植物提取物具有天然性、残留少、绿色环保等特点,已经成为畜牧养殖和科研机构研究的重点。茶皂素,又称油茶皂苷,是一种从山茶科植物中提取的五环三萜类植物皂苷总称[2],由7种配基、4种糖体和2种有机羧酸组成,主要存在于茶种子和茶叶中[3]。茶皂素在抗氧化、抗渗消炎、抑菌、抗溶血等方面都能发挥作用[4]。茶皂素不仅是一种天然的表面活性剂而且具有广泛的生物活性作用,还可用作反刍动物瘤胃发酵调控剂,改善动物生产性能[5]。叶均安等[6]研究发现在体外培养底物中分别添加0.25%、0.50%和1.00%茶皂素,瘤胃原虫生长受到可不同程度的抑制,瘤胃发酵状况得到改善。来海良等[7]报道在瘤胃液体外培养物中添加茶皂素可抑制瘤胃原虫的数量增加,增加瘤胃微生物的数量,使瘤胃发酵合成微生物蛋白的产量增多。苑文珠[8]研究证明,体外培养的条件下添加茶皂素提高了瘤胃发酵产气量,总挥发性脂肪酸及乙酸、丙酸、丁酸的产量增加。彭春雨等[9]研究报道,在奶牛饲粮中添加茶皂素和植物蜕皮甾酮可提高产奶量,但对乳脂率、乳料比和血液生化指标均无显著影响,分析其原因可能与添加剂量少有关。在蛋白质水平与分子水平上,关于茶皂素对乳腺上皮细胞合成乳脂的影响研究还鲜见报道,本试验目的在于通过研究茶皂素对奶牛乳腺上皮细胞增殖及乳脂合成关键酶含量和基因表达的影响,探究茶皂素对奶牛乳腺合成乳脂的影响。 1 材料与方法 1.1 材料 1.1.1 试验材料
茶皂素购自浙江东方茶叶有限公司常山分公司,皂甙含量≥95%。
选用1头体况良好体重约550 kg,年龄为4岁2胎、泌乳期为100 d、日均产奶量约30 kg/d的荷斯坦奶牛作为试验动物,由北京市顺义区中地畜牧科技有限公司提供。 1.1.2 试验动物取材
常规麻醉,在乳房基部至乳头连线中央切开长约5 cm的切口,采取1 g左右的乳腺组织,置于事先准备好的DMEM/F-12完全培养液(30%胎牛血清、300 IU/mL青霉素、300 IU/mL链霉素)中,带回实验室做进一步处理,方法参照文献[10],采用胰蛋白酶、胶原酶消化液分离获取乳腺上皮细胞,该方法时间短,得到细胞纯度高[11]。 1.2 试验设计
将茶皂素用二甲基亚砜(DMSO)溶解,配成不同浓度梯度的储存液,于-20 ℃保存备用,使用前用2% DMEM/F-12维持培养液进行稀释,使其终浓度分别为0(对照)、0.05、0.25、0.50、1.00、5.00、10.00、20.00、40.00、60.00、80.00、100.00 μg/mL,收集处于对数期的乳腺上皮细胞,调整细胞悬液浓度使乳腺上皮细胞密度为100~10 000个/孔,加入不同浓度梯度的茶皂素溶液,每个浓度梯度设5个重复;37 ℃、5% CO2培养箱中分别孵育24、48、72 h后,检测乳腺上皮细胞增殖状况;根据细胞增殖测定结果,修正茶皂素溶液浓度梯度为0、0.50、5.00、20.00 μg/mL,选取同一代的生长性能良好的乳腺上皮细胞,添加不同浓度茶皂素溶液培养。每瓶加3 mL茶皂素溶液,每组设3个重复,于37 ℃、5% CO2培养箱中培养36 h后,消化细胞,测细胞中乙酰辅酶A羧化酶(ACACA)、脂肪酸合成酶(FASN)、硬脂酰辅酶A去饱和酶(SCD)的含量;每个浓度梯度设3个重复,37 ℃、5% CO2培养箱中培养4、24、48 h后,采用实时荧光定量PCR,以β肌动蛋白(β-actin)为参照基因,测定目的基因SCD、ACACA、FASN基因mRNA相对表达水平。 1.3 指标测定与方法 1.3.1 乳腺上皮细胞鉴定
在6孔细胞培养板中,加入一块盖玻片,让玻片与板底完好接触,在盖玻片的中央滴加消化好的细胞悬液,于30 ℃、5% CO2培养箱中培养,待细胞长至80%左右时弃培养液,取出盖玻片,用磷酸盐缓冲液(PBS)清洗3次,每次3 min;-20 ℃在甲醇 ∶ 丙酮(1 ∶ 1)中于4 ℃固定5 min后,快速用PBS洗涤;用羊血清封闭液常温孵育15 min;用PBS清洗3次,每次3 min;加入抗角蛋白18一抗120 μL(1 ∶ 100),置湿盒中4 ℃过夜,再次用PBS洗涤;加入二抗[异硫氰酸荧光素(FITC)标记羊抗小鼠]120 μL(1 ∶ 100)于室温避光孵育1 h,用PBS洗清3次,每次3 min;将1滴抗荧光猝灭剂滴于培养板上,封固,阴性对照用PBS代替一抗;在倒置数码荧光显微镜下观察角蛋白18的特异性表达,并拍照[12]。乳腺上皮细胞鉴定方法参照文献[13]。 1.3.2 乳腺上皮细胞增殖
噻唑蓝(MTT)法检测茶皂素对奶牛乳腺上皮细胞数量的影响。 1.3.3 乳脂合成关键酶含量
用酶联免疫分析(ELISA)试剂盒测定细胞内SCD、ACACA、FASN的含量。 1.3.4 乳脂合成关键酶基因mRNA相对表达水平
采用相对定量的方法,以β-actin参照基因,测定目的基因mRNA相对表达水平。根据实时荧光定量PCR引物设计原则,使用Primer Premier 5.0和Oligo 6软件设计引物(表1),并由上海生物工程股份有限公司合成。实时荧光定量PCR程序参照Brilliant Ⅲ Ultra-Fast SYBR Green QPCR Master Mix试剂盒进行。溶解曲线均为单一峰值。根据实时荧光定量PCR原始检测结果,采用2-ΔΔCt相对定量计算公式分析细胞内SCD、ACACA、FASN基因mRNA相对表达水平。计算公式如下:
F=2-ΔΔCt=2-(ΔCt待测目的基因-ΔCt对照组目的基因)=2-{(待测组目的基因Ct平均值-待测组内参基因Ct平均值)-(对照组目的基因Ct平均值-对照组内参基因Ct平均值)}。
| 表1 实时荧光定量PCR引物序列及参数 Table 1 Primer sequences and parameters for fluorescence-based quantitative real-time PCR |
使用Excel整理试验数据,采用相对定量2-ΔΔCt法对试验数据进行数据计算和整理。采用SPSS 17.0统计软件中的one-way ANOVA进行单因素方差分析,采用Duncan氏法进行平均值的多重比较。 2 结 果 2.1 乳腺上皮细胞培养及鉴定
本试验采用时间短、纯度高的酶消化法分离培养乳腺上皮细胞, 得到的原代细胞呈放射状生长,纯化3代后获得纯度95%以上的乳腺上皮细胞,培养过程中上皮细胞呈铺路石样,如图1所示。
 | 图1 原代乳腺上皮细胞 Fig. 1 Primary mammary epithelial cells |
采用上皮细胞特征性物质角蛋白18对纯化后的细胞进行鉴定,角蛋白18能与FITC标记的二抗结合而使细胞质着色。在荧光显微镜下发绿色荧光,说明所培养的细胞为乳腺上皮细胞,而不加一抗的阴性对照组则不显荧光,如图2所示。
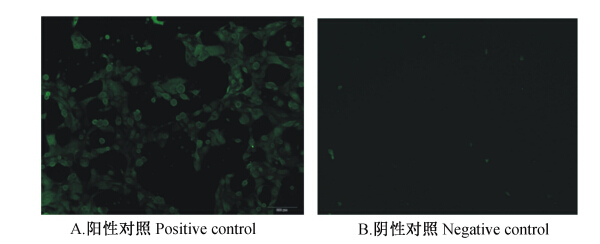 | 图2 角蛋白18结合的乳腺上皮细胞 Fig. 2 Mammary epithelial cells combined with keratin 18 |
由图3可知,茶皂素对奶牛乳腺上皮细胞的增殖具有抑制作用。茶皂素与细胞共育24 h后,0~10.00 μg/mL茶皂素浓度组乳腺上皮细胞数差异不显著(P>0.05),与0 μg/mL茶皂素浓度组相比,从20.00 μg/mL茶皂素浓度组开始会极显著抑制细胞增殖(P<0.01);茶皂素与细胞共育48 h后,0~20.00 μg/mL茶皂素浓度组乳腺上皮细胞数差异不显著(P>0.05),与0 μg/mL组相比,从40.00 μg/mL茶皂素浓度组开始会极显著抑制细胞增殖(P<0.01);茶皂素与细胞共育72 h后,0~5.00 μg/mL茶皂素浓度组乳腺上皮细胞数差异不显著(P>0.05),与0 μg/mL组相比,从10.00 μg/mL茶皂素浓度组开始会极显著抑制乳腺上皮细胞增殖(P<0.01)。鉴于茶皂素会不同程度抑制乳腺上皮细胞的增殖,所以,选用低剂量茶皂素浓度组,即对细胞增殖影响不显著的试验组进行后续试验,即0、0.50、5.00、20.00 μg/mL茶皂素浓度梯度组。
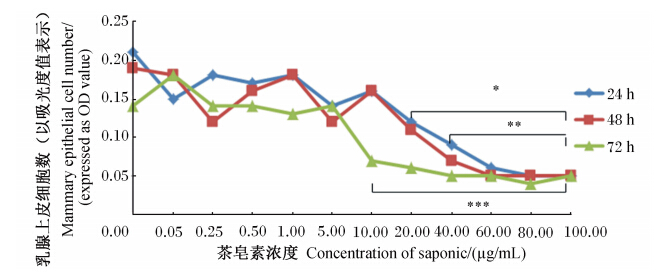 | *、** 、*** 分别表示24、48、72 h时与对照组组差异极显著(P<0.01)。 *, ** and *** mean significantly different from control group at 24, 48 and 72 h (P<0.01), respectively.图3 茶皂素对乳腺上皮细胞增殖的影响 Fig. 3 Effects of tea saponin on mammary epithelial cell proliferation |
由表2可见,茶皂素与乳腺上皮细胞共育36 h后,各组ACACA、FASN、SCD含量均无显著差异(P>0.05)。其中,与对照组相比,ACACA含量0.5、5.0、20.00 μg/mL茶皂素浓度组有一定程度的上升;与对照组相比,FASN含量0.50、5.00 μg/mL茶皂素浓度组表现上升趋势,而在20.00 μg/mL茶皂素浓度组表现下降趋势;SCD含量在0.50、5.00、20.00 μg/mL茶皂素浓度组与对照组相比均呈现下降趋势。
| 表2 茶皂素浓度对乳腺上皮细胞SCD、ACACA、FASN含量的影响 Table 2 Effects of tea saponin on SCD,ACACA and FASN contents in mammary epithelial cell |
由表3可见,乳腺上皮细胞与茶皂素共育4、24、48 h后,各组ACACA基因mRNA相对表达水平差异不显著(P>0.05),其中,24 h时在0.50、5.00 μg/mL茶皂素浓度组有所下降,但在20.00 μg/mL茶皂素浓度组又有所回升。由表4可见,乳腺上皮细胞与茶皂素共育4、24、48 h后,各组FASN基因mRNA相对表达水平差异不显著(P>0.05),其中,共育4 h后,基因mRNA相对表达水平有所提高,之后表现下降趋势。由表5可见,乳腺上皮细胞与茶皂素共育4、24、48 h后,与对照组相比,SCD基因mRNA相对表达水平在茶皂素浓度为0.50、5.00、20.00 μg/mL时受茶皂素的抑制作用显著(P<0.05),其基因mRNA相对表达水平在24 h后分别下调到0.17、0.05、0.12,48 h后分别下调到0.08、0.05、0.18。
| 表3 茶皂素对乳腺上皮细胞ACACA基因mRNA相对表达水平的影响 Table 3 Effects of tea saponin on the relative expression level of ACACA mRNA in mammary epithelial cell |
| 表4 茶皂素对乳腺上皮细胞FASN基因mRNA相对表达水平的影响 Table 4 Effects of tea saponin on the relative expression level of FASN mRNA in mammary epithelial cell |
| 表5 茶皂素对乳腺上皮细胞SCD基因mRNA相对表达水平的影响 Table 5 Effects of tea saponin on the relative expression level of SCD mRNA in mammary epithelial cell |
乳腺上皮细胞是乳脂的合成场所,乳腺上皮细胞正常的生命周期活动是分泌乳脂的前提保证。细胞增殖是指通过细胞分裂增加细胞数量,它既是生物繁殖的根本途径,又是维持细胞数量平衡和机体正常功能所必需的基础条件。而细胞凋亡(apoptosis)是指死亡信号诱发细胞凋亡的过程,是细胞生理性死亡的普遍形式[14]。各种细胞内因素及机体外界因素如化学物质作用、温度变化、pH变化等都会对细胞周期产生重要影响,从而影响细胞的增殖与调亡。朱丽丽等[15]的研究结果表明重楼皂甙能够抑制SGC-7901细胞的增殖。吴葆华等[16]研究结果同样表明桔梗皂苷D对人结肠癌SW620细胞的增殖产生抑制作用。彭春燕[17]研究结果显示100和200 μg/mL浓度组的桔梗总皂苷相对空白组存在显著性差异,能够显著抑制山羊乳腺上皮细胞的增殖。这些研究均与本试验的研究结果相似。
本试验通过MTT法检测茶皂素对乳腺上皮细胞增殖的影响,结果显示茶皂素与乳腺上皮细胞共育24 h后,从20.00 μg/mL茶皂素浓度组开始会极显著地抑制细胞增殖;茶皂素与细胞共育48 h后,从40.00 μg/mL茶皂素浓度组开始会极显著地抑制细胞增殖;茶皂素与细胞共育72 h后,从10.00 μg/mL茶皂素浓度组开始会极显著地抑制细胞增殖。从试验结果可以看出,乳腺上皮细胞与茶皂素共育的时间越长,茶皂素开始对乳腺上皮细胞增殖产生显著抑制的浓度越低,分析原因可能是茶皂素作用于乳腺上皮细胞可能有一定过程,但是具体的作用机制尚不清楚。本试验探究与分析了茶皂素对乳腺上皮细胞增殖的影响规律,同时可为进一步研究茶皂素对乳脂合成的影响提供浓度选择的试验依据。 3.2 茶皂素对乳脂合成关键酶含量和基因表达的影响
牛乳脂主要由是甘油三酯(triglyceride,TG)构成,而机体合成甘油三酯主要有2条途径:乳腺上皮细胞以乙酰辅酶A为原料从头合成全部的C14脂肪酸和1/2的C16脂肪酸;C18以上的长链脂肪酸全部是由乳腺上皮细胞从血液中吸收的[18]。ACACA、FASN、SCD是乳脂合成中的重要酶系,其中,ACACA、FASN主要对脂肪酸从头合成起作用,而脂蛋白酯酶则主要对从血液中摄取发挥作用,SCD同时调节以上2条途径[19]。目前,关于茶皂素对乳脂合成作用的研究比较少,茅慧玲等[20]的研究结果表明饲粮中添加茶皂素可以显著降低肌肉中饱和脂肪酸的含量,而对不饱和脂肪酸含量有增加趋势,但未达到显著水平。王延芳[21]试验结果也表明油茶皂素可控制高脂小鼠的体重,验证了油茶皂素的减肥作用,油茶皂素碱水解产物和酸水解产物明显降低血清中的胆固醇含量。
本试验研究发现,在蛋白质水平上,上述3种酶受茶皂素调控的作用不显著,除ACACA含量有一定程度的上调外,其余基本呈下降趋势。而在基因水平上,SCD基因mRNA相对表达水平在0.50、5.00、20.00 μg/mL茶皂素浓度组时出现显著下降。这说明茶皂素对奶牛乳脂合成关键酶基因mRNA相对表达水平的影响随着其浓度、作用时间及酶基因的不同而有所变化,一定范围内具有抑制作用。
茶皂素广泛存在于茶叶、茶籽中,而我国自古以来就是茶叶大国,因此具有巨大的茶皂素资源,虽然茶皂素作为表面活性剂和生物活性剂在农业[22]、工业[23]、渔业养殖[24]等有一定的应用,但是尚未得到充分开发利用。周奕毅[25]、Hu等[26]研究报道茶皂素可作为反刍动物瘤胃发酵调控剂,影响瘤胃微生物区系结构,改善瘤胃微生物发酵,提高饲粮蛋白质利用率,降低甲烷产量,提高饲料转化率,改善反刍动物生产性能。牛奶生物活性脂肪酸研究方面揭示瘤胃和乳腺对脂肪酸合成具有协同机制[27],但茶皂素对这种协同机制的影响,目前尚不清楚。本试验研究发现茶皂素能在一定程度上可抑制乳腺上皮细胞的增殖和乳脂合成关键酶基因的表达,为解决低脂乳品和化学添加剂残留问题提供了新的解决思路,同时为进一步研究茶皂素作为调控奶牛生产性能与牛乳品质的天然饲料添加剂提供了研究基础。 4 结 论
茶皂素对乳腺上皮细胞增殖具有抑制作用,但具有浓度依赖性,同时受到作用时间的影响;茶皂素一定程度上可显著抑制乳脂合成关键酶SCD基因mRNA相对表达水平,而对ACACA、FASN基因mRNA相对表达水平无显著影响。
| [1] | 孙妍.不同中短链与长链脂肪酸比例对奶牛乳脂含量及组成的影响[D]. 硕士学位论文.北京:中国农业科学院, 2012:5-42. ( 1) 1)
|
| [2] | 李俊, 张爱玉, 齐永杰, 等.茶树油粕中茶皂素研究进展[J]. 食品科学, 2012, 33(1):276-279. ( 1) 1)
|
| [3] | 张开慧.茶皂素的国内外研究进展[J]. 西部大开发, 2011(2):33-34. ( 1) 1)
|
| [4] | LAI Z F, SHAO Z Q, CHEN Y Z, et al.Effects of sasanquasaponin on ischemia and reperfusion injury in mouse hearts[J]. Journal of Pharmacological Sciences, 2004, 94(3):313-324. ( 1) 1)
|
| [5] | WANG J K, YE J A, LIU J X.Effects of tea saponins on rumen microbiota, rumen fermentation, methane production and growth performance-a review[J]. Tropical Animal Health and Production, 2012, 44(4):697-706. ( 1) 1)
|
| [6] | 叶均安, 刘建新, 板桥久雄.茶皂素对瘤胃原虫的抑制效果[J]. 中国饲料, 2001, 1(2):30-32. ( 1) 1)
|
| [7] | 来海良, 王一义.茶皂素对湖羊瘤胃培养物发酵的影响[J]. 现代农业科技, 2010(23):300-302. ( 1) 1)
|
| [8] | 苑文珠.茶皂素对湖羊生产性能及瘤胃发酵的影响[D]. 硕士学位论文.杭州:浙江大学, 2002:1-32. ( 1) 1)
|
| [9] | 彭春雨, 孟庆翔, 任丽萍, 等.植物提取物对奶牛产奶性能和血液指标的影响[J]. 饲料研究, 2011(7):8-10. ( 1) 1)
|
| [10] | 王亨, 吴培福, 邱昌伟, 等.荷斯坦奶牛乳腺上皮细胞的体外培养[J]. 畜牧与兽医, 2007, 39(4):41-43. ( 1) 1)
|
| [11] | 李喜艳, 王加启, 魏宏阳, 等.奶牛乳腺上皮细胞的体外培养方法及其应用概述[J]. 华北农学报, 2010, 25(增刊):31-35. ( 1) 1)
|
| [12] | HU H, WANG J Q, BU D P, et al.In vitro culture and characterization of a mammary epithelial cell line from Chinese Holstein dairy cow[J]. PLoS One, 2009, 4(11):e7636. ( 1) 1)
|
| [13] | TONG H L, LI Q Z, GAO X J, et al.Establishment and characterization of a lactating dairy goat mammary gland epithelial cell line[J]. In Vitro Cellular & Developmental Biology-Animal, 2012, 48(3):149-155. ( 1) 1)
|
| [14] | 陈建晖, 佟慧丽, 李庆章, 等.奶牛乳腺上皮细胞系的建立[J]. 畜牧兽医学报, 2009, 40(5):743-747. ( 1) 1)
|
| [15] | 朱丽丽, 李惠芬.重楼皂苷对SGC-7901细胞增殖抑制及诱导凋亡的实验研究[J]. 时珍国医国药, 2009, 20(6):1501-1502. ( 1) 1)
|
| [16] | 吴葆华, 陈喆, 吕望, 等.桔梗皂苷D抑制人结肠癌SW620细胞增殖及其机制的研究[J]. 中国药学杂志, 2013, 48(增刊):354-358. ( 1) 1)
|
| [17] | 彭春燕.苷类物质对山羊乳腺上皮细胞增殖及酪蛋白基因表达的影响[D]. 硕士学位论文.江苏:扬州大学, 2011:2-54. ( 1) 1)
|
| [18] | 王红芳.外源反-10, 顺-12共轭亚油酸对牛乳腺上皮细胞脂肪合成的影响及其分子机制[D]. 硕士学位论文.泰安:山东农业大学, 2011:8-60. ( 1) 1)
|
| [19] | 庞坤, 韩立强.油脂对反刍动物乳腺脂肪关键合成酶分子调控的研究进展[J]. 中国农学通报, 2012, 28(8):1-5. ( 1) 1)
|
| [20] | 慧玲, 陈雪君, 林嘉, 等.日粮中添加茶皂素和豆油对羔羊生长性能以及肌肉脂肪酸的影响[C]//中国畜牧兽医学会动物营养学分会第十次学术研讨会论文集.北京:中国畜牧兽医学会动物营养学分会, 2008, 327-330.( 1) 1)
|
| [21] | 王延芳.油茶皂素及其水解产物的分离及降血脂抗氧化活性研究[D]. 硕士学位论文.广州:华南理工大学, 2012:5-74. ( 1) 1)
|
| [22] | 夏春华, 杨钟鸣, 朱伯荣, 等.茶皂素在农药工业中应用研究进展[J]. 茶叶科学, 2000, 20(2):82-88. ( 1) 1)
|
| [23] | 张国运, 曹丽云, 吴建鹏, 等.茶皂素提取工艺及其应用研究进展[J]. 日用化学工业, 2006, 36(3):174-177. ( 1) 1)
|
| [24] | 杨强, 张石蕊.茶皂素在动物生产中的应用[J]. 中国饲料, 2007(8):8-10. ( 1) 1)
|
| [25] | 周奕毅.茶皂素抑制湖羊甲烷生成的微生物学机制研究[D]. 硕士学位论文.杭州:浙江大学, 2009:1-66. ( 1) 1)
|
| [26] | HU W L, LIU J X, YE J A, et al.Effect of tea Saponin on rumen fermentation in vitro[J]. Animal Feed Science and Technology, 2005, 120(3/4):333-339. ( 1) 1)
|
| [27] | 王加启.牛奶乳脂肪和乳蛋白的合成与调控机理[J]. 饲料与畜牧, 2011(2):8-14. ( 1) 1)
|




