2. 成都动物园, 成都 610080;
3. 动物疫病与人类健康四川省重点实验室, 雅安 652014
2. Chengdu Zoo, Chengdu 610080, China;
3. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Ya'an 625014, China
肠道菌群是寄居在机体肠道的微生物群,数量庞大,种类繁多,与机体的各项生理功能密切相关,直接参与宿主的食物消化、营养吸收、能量代谢、免疫应答等诸多生理活动[1, 2, 3]。自机体出生时肠道菌群便开始形成,随宿主生长发育,胃肠道生理变化,肠道菌群群落结构不断动态发展,通过大量研究证实,宿主的年龄是决定肠道菌群组成的一个重要因素[4]。目前,研究川金丝猴肠道菌群结构的报道较少,尤其是针对不同年龄段川金丝猴的研究更是未见报道。
随着分子生物学技术的革新,研究人员对于肠道菌群的研究越来越深入,对肠道菌群的研究水平不断提高[5],推动了动物微生态学研究的发展。分子生物学技术弥补了传统培养技术的缺陷,为研究肠道菌群多样性开辟了新的途径[6, 7, 8, 9]。分子生物学以肠道细菌DNA为研究对象,通过分析其种类和相对数量更能全面真实反映肠道菌群的多样性。川金丝猴是我国特有的野生动物,为国家Ⅰ级保护动物,本研究采用聚合酶链反应-变性梯度凝胶电泳(PCR-DGGE)和荧光定量PCR技术研究不同年龄段川金丝猴肠道菌群组成,分析其肠道菌群多样性差异,探讨伴随年龄变化川金丝猴肠道菌群的动态发展情况,为其生存带来福利。
1 材料和方法 1.1 样品采集川金丝猴来于四川省成都市成都动物园,参考文献[10]将9只川金丝猴划分为幼年(<2岁,n=3)、成年(4~7岁,n=3)、老年(>8岁,n=3)3个年龄阶段进行研究,于2013年12月采集每个年龄段川金丝猴粪样各3份。所有粪样采集时争取在排泄后20 min内完成,冰盒保存带回实验室后,-20 ℃冷冻保存。
1.2 主要仪器Dcode Universial Detection System PCR-DGGE电泳仪,Bio-Rad公司;GS800 Calibrated Densitometer凝胶成像系统,Bio-Rad公司;HZS-H水浴振荡器,哈尔滨市东联电子技术开发有限公司;SIGMA1-14小型高速离心机,Applied Biosystems公司;CFX-96实时荧光定量PCR扩增仪,Bio-Rad公司;Thermo Scientific BioMate 3S分光光度仪,赛默飞世尔科技公司。
1.3 主要试剂E.Z.N.A. StoolDNAKit试剂盒购自Omega公司;PCR-DGGE成套试剂购自Bio-Rad公司;SYBR Premix Ex TaqTM Ⅱ试剂盒、pMD18-T载体和Taq酶购自大连宝生生物公司;2×Taq MasterMix购自北京康为世纪生物科技有限公司;16S rDNA的PCR引物由上海博亚生物技术有限公司合成。
1.4 细菌总DNA的提取采用E.Z.N.A. StoolDNAKit试剂盒提取粪样细菌基因组总DNA,为提高革兰氏阳性菌的破壁效率,在70 ℃温育13 min后,增加90 ℃温育10 min的步骤,其余步骤按照说明书操作。
1.5 PCR-DGGE指纹图谱分析不同年龄段川金丝猴肠道菌群多样性 1.5.1 总DNA 16S rDNA V3区PCR扩增参照文献[11],根据细菌16S rRNA基因V3区片段(339~539)设计1对引物:上游引物(带GC发夹结构):5’-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGACTCC
TACGGGAGGCAGCAGT-3’;下游引物:5’-GTATTACCGCGGCTGCTGGCAC-3’。PCR反应体系(25 μL):上、下游引物(10 pmoL/μL)各1.0 μL,2×Taq MasterMix 12 μL,DNA模板1.0~2.0 μL,ddH2O补至25 μL,并设置阴性对照。PCR扩增条件:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,30个循环,最后72 ℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳检测片段大小和浓度。 1.5.2 PCR-DGGE技术分析不同年龄段川金丝猴肠道菌群多样性参照文献[12]进行PCR-DGGE凝胶电泳,凝胶梯度为35%~65%,变性方向与电泳方向一致。100%变性溶液含7 moL/L尿素和40%去离子甲酰胺。使用1×TAE缓冲液,100 V 60 ℃电泳16~18 h。硝酸银染色后,通过凝胶成像系统扫描成像。
1.6 荧光定量PCR技术分析不同年龄段川金丝猴肠道菌群结构 1.6.1 特异性片段的PCR扩增参考文献[13, 14],对川金丝猴粪样中真细菌(eubacteria)、乳酸杆菌属(Lactobacillus spp.)、肠杆菌科(Enterobacteriaceae)、双歧杆菌属(Bifidobacterium spp.)的16S rDNA基因特异性引物(表1)进行扩增。PCR反应体系(25 μL):2×Taq MasterMix 12.5 μL,上、下游引物(10 pmoL/μL)各1 μL,模板2 μL,ddH2O 8.5 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性15 s,退火温度(Tm)下退火30 s,72 ℃延伸30 s,40个循环;最后,72 ℃延伸5 min。PCR产物用1.0%琼脂糖电泳检测。
| 表1 目标菌群引物序列 Table 1 Primer sequences of target flora |
采用琼脂糖胶回收试剂盒割胶纯化回收PCR产物。按试剂盒方法用pMD18-T载体连接PCR纯化产物,以大肠杆菌DH5α制备的感受态细胞转化连接产物,在氨苄青霉素平板上进行蓝白斑试验筛选阳性克隆。
1.6.3 相应标准曲线构建按质粒DNA提取试剂盒纯化上述阳性克隆重组质粒DNA,然后用核酸浓度仪测定重组质粒DNA的光密度(OD)值。按如下公式换算成拷贝数:
DNA拷贝数=6.02×1023(拷贝数/mol)×
DNA重量(g)/{DNA片段长度(dp)×
660[g/(mol·dp)]}。
将得到己知拷贝数的阳性模板用ddH2O 10倍系列梯度稀释,直至每微升溶液的拷贝数小于1(100~10-10)。将每个浓度梯度的阳性模板在优化后的定量PCR条件下进行测定,获得相应的Ct值,以各浓度梯度起始模板数的对数值为X轴,相应的Ct值为Y轴作回归曲线,得出定量PCR标准曲线。
1.6.4 荧光定量PCR检测样品菌群含量采用SYBR Premix Ex TaqTM Ⅱ试剂盒对DNA样品和上述重组质粒DNA构建的标准曲线样品进行绝对荧光定量PCR检测。荧光定量PCR反应体系(25 μL):SYBR Premix Ex TaqTM Ⅱ12.5 μL,上、下引物各1 μL,模板2 μL,ddH2O 8.5 μL。反应程序:95 ℃预变性5 min;95 ℃变性15 s,Tm下退火30 s,72 ℃延伸30 s,35个循环。
1.7 数据分析运用凝胶定量软件Quantity One v4.62对PCR-DGGE指纹图谱分析,采用UPGMA法进行聚类分析,并计算生物多样性指数。对PCR-DGGE指纹图谱的条带进行二进制缺失换算,运用SAS 9.1软件进行主成分分析,得出荧光定量数据换算值,运用SPSS 20.0进行方差分析。生物多样性指数计算公式为:
H=-ΣPilnPi;
E=H/Hmax;
Hmax=lnS。
式中:H为Shannon指数;Pi为样品中单一条带的强度在该样品所有条带总强度中所占的比率;E为样品均匀度;Hmax为最大的物种多样性指数;S为某个样品中所有条带数目总和,即丰度。
2 结果与分析 2.1 PCR-DGGE技术分析不同年龄段川金丝猴肠道菌群多样性差异采用UPGMA法对不同年龄段川金丝猴样品进行聚类分析,结果见图1。PCR-DGGE指纹图谱中电泳条带亮度反映了菌群的优势状况,条带数量和位置的复杂性代表了每个样品所包含菌群的多样性。不同年龄段的川金丝猴明显区分,老年与幼年分别聚为一簇。每个节点的数字为相似度,成年组内相似度较高,最高为0.72,最低为0.41;幼年最高为0.64,最低为0.54;老年最高为0.49,最低为0.41。组间成年与幼年的相似度较高,为0.41,老年与两者的相似度较低,为0.33。成年与幼年样品的明亮条带较多,两者之间条带数量差异不明显,但其所在位置有明显的区别,成年样品的条带多趋于中段,幼年样品则多趋于上段;老年样品的明亮条带则较少,说明成年与幼年川金丝猴优势菌群相对老年比较丰富。
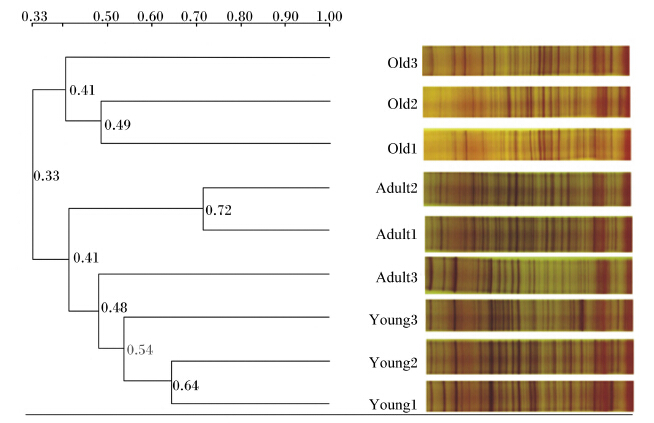 | Old:老年;Adult:成年;Young:幼年。下图同The same as below。图1 不同年龄段川金丝猴肠道菌群聚类分析 Fig. 1 Clustering analysis of gut microbiome of Rhinopithecus roxellana in different ages |
将PCR-DGGE指纹图谱中条带的数量与强弱转化为Shannon指数、丰富度、均匀度,并采用单因素方差分析法比较不同年龄段川金丝猴肠道菌群生物多样性指数,结果见表2。Shannon指数与丰富度显示结果一致,各年龄段川金丝猴肠道菌群在Shannon指数与丰富度上无显著性差异(P>0.05);但均匀度结果显示,老年川金丝猴显著低于幼年与成年(P<0.05),而成年与幼年无显著性差异(P>0.05)。上述结果表明,老年川金丝猴肠道菌群在均匀度上明显低于幼年与成年,各年龄段川金丝猴在优势菌群上存在明显差异。
| 表2 不同年龄段川金丝猴肠道菌群生物多样性比较 Table 2 Comparison of biological diversity of gut microbiome of Rhinopithecus roxellana in different ages |
通过软件Quantity One v4.62将PCR-DGGE指纹图谱的条带进行二进制转导,运用主成分分析法对各年龄段川金丝猴样品进行分析。如图2所示,各年龄段样品明显分散在不同区域,成年与幼年样品分群聚集较为明显,而老年样品则较分散,说明老年样品组内之间的差异性较高,而幼年与成年样品组内相似度较高。主成分分析反映出幼年样品聚合程度高于成年样品,相对老年,幼年与成年的距离较为接近。
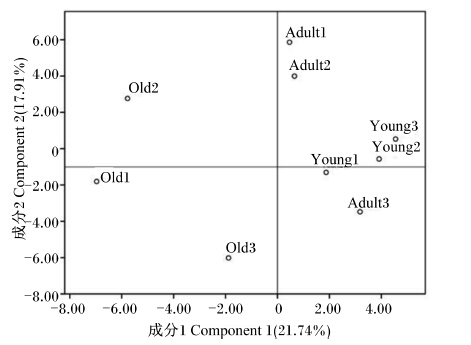 | 图2 主成分分析不同年龄段川金丝猴肠道菌群 Fig. 2 PCA of gut microbiome of Rhinopithecus roxellana in different ages |
对不同年龄段川金丝猴样品中真细菌、Lactobacillus spp.、Enterobacteriaceae、Bifidobacterium spp.菌群进行荧光定量PCR检测,结果见表2。幼年样品中真细菌的数量极显著少于成年(P<0.01),显著多于老年(P<0.05);成年样品中真细菌的数量极显著多于老年(P<0.01),但三者的数量均在同一数量级(1011)。幼年样品中Enterobacteriaceae的数量显著少于成年(P<0.05),同时显著少于老年(P<0.05),成年与老年之间无显著差异(P>0.05)。成年样品中Lactobacillus spp.的数量极显著多于幼年(P<0.01),同时极显著多于老年(P<0.01),幼年与老年之间无显著差异(P>0.05)。老年样品中Bifidobacterium spp.的数量极 显著少于成年(P<0.01),同时极显著少于幼年 (P<0.01);幼年极显著少于成年(P<0.01)。上述结果说明各年龄段川金丝猴肠道菌群结构存在明显差异。
| 表3 不同年龄段川金丝猴菌群数量比较 Table 3 Comparison of gut microbiome number of Rhinopithecus roxellana in different ages 拷贝数/g |
随着生物技术的进步,动物微生态领域的研究越来越广泛,使得研究金丝猴肠道菌群成为可能[15]。本研究同时采用PCR-DGGE和荧光定量PCR技术研究川金丝猴的肠道菌群,在定性的基础上,定量检测肠道中常见的菌群,即真细菌、Lactobacillus spp.、Enterobacteriaceae、Bifidobacterium spp.的数量, 能更全面反映川金丝猴的肠道菌群信息。
研究表明,哺乳动物出生时是无菌的,但随着出生胃肠道开始有外来微生物栖息并定植,胃肠道微生物的组成在出生后1年内就建立[16]。研究发现,婴儿胃肠道中占主导地位的菌群是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)[17, 18]。与成年哺乳动物的1 000多种微生物相比,婴儿肠道中只有约10种微生物,在其机体发育成长中,不同种类的外源微生物进入肠道,在适宜情况下定植,肠道菌群多样性逐渐增加。从幼年与成年川金丝猴的结果比较来看,肠道菌群Shannon指数两者差异不显著,但优势条带的位置和亮度有明显差别;幼年与老年川金丝猴肠道菌群生物多样性无显著差异,但幼年川金丝猴肠道菌群的优势条带明显多于老年川金丝猴。幼年川金丝猴肠道菌群中真细菌、Enterobacteriaceae、 Bifidobacterium spp.和Lactobacillus spp.的数量显著或极显著少于成年川金丝猴,贺锐等[19]研究中也发现肠道菌群中Bifidobacterium spp. 的数量随年龄增长有增加的趋势。推测幼年川金丝猴的肠道菌群还在发展中,优势菌群也在演变;到了成年时期,肠道菌群的平衡状态较为稳定,其数量与多样性都变化不大。健康成年动物肠道菌群根据其代谢功能特点可分为3类:第1类为乳酸菌,包括双歧杆菌、乳杆菌和链球菌等;第2类为腐败菌,如拟杆菌、梭菌、消化球菌、大肠杆菌和葡萄球菌等;第3类为瘤胃球菌和巨型球菌等[20]。Wu等[15]采用限制性片段长度多态性(RFLP)分析技术并结合克隆技术分析了滇金丝猴肠道菌群结构,发现滇金丝猴肠道中占主导地位的菌群是Firmicutes、Proteobacteria、Bacteroidetes、纤维杆菌门(Fibrobacteres)、螺旋体门(Spirochaetes)和Actinobacteria。随着年龄的增长,到了老年时期胃肠道生理机能下降[21, 22],胃肠黏膜渗透性增加[23],肠道菌群结构受到影响,相应的多样性与肠道菌群数量降低。老年川金丝猴肠道菌群生物多样性虽然与幼年和成年川金丝猴无明显差异,但其肠道菌群结构明显与2个年龄段存在差别,并且从指纹图谱看其优势菌群数量明显低于幼年和成年川金丝猴。老年川金丝猴肠道菌群中Bifidobacterium spp.的数量极显著低于成年和幼年川金丝猴,Lactobacillus spp.的数量显著低于成年川金丝猴,这与Mueller等[24]研究人肠道菌群的结果相似,并且其结果还显示老年人的肠道菌群中Enterobacteriaceae的数量较高,本研究中老年川金丝猴肠道菌群中Enterobacteriaceae的数量只显著高于幼年川金丝猴,与成年川金丝猴无显著差异。与大多数研究得出的老年时期肠道菌群中Bifidobacterium spp.的数量减少[25, 26, 27, 28, 29]的结论一致,在本研究中老年川金丝猴肠道菌群中Bifidobacterium spp.的数量极显著低于幼年和成年川金丝猴。Stsepetova等[30]揭示出肠道中Lactobacillus spp.数量与年龄相关,并发现老年人肠道中Lactobacillus spp.的数量高于中年人。而在本研究中,老年川金丝猴肠道菌群中Lactobacillus spp.的数量极显著低于成年川金丝猴。川金丝猴肠道菌群的多样性与优势菌群数量伴随年龄增长不断变化,其肠道菌群多样性呈增加到减少的一个趋势,而优势菌群的数量变化不一致,有的呈增加的趋势,有的呈减少的趋势。
4 结 论伴随着年龄的增长,川金丝猴肠道菌群的多样性发生变化,尤其是优势菌群不断发展演变,到老年时期优势菌群数量明显减少;同时,川金丝猴肠道中各菌群的数量也在不断地发生变化,但变化趋势不一致。
| [1] | LEY R E, PETERSON D A, GORDON J I.Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124(4):837-848. ( 1) 1)
|
| [2] | FREDRIK BACKHED, RUTH E L, JUSTIN L S, et al.Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307:1915-1920. ( 1) 1)
|
| [3] | O'HARA A M, SHANAHAN F.The gut flora as a forgotten organ[J]. EMBO reports, 2006, 7(7):688-693. ( 1) 1)
|
| [4] | YATSUNENKO T, REY F E, MANARY M J, et al.Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486(7402):222-227. ( 1) 1)
|
| [5] | ECKBURG P B, BIK E M, BERNSTEIN C N, et al.Diversity of the human intestinal microbial flora[J]. Science, 2005, 308(5728):1635-1638. ( 1) 1)
|
| [6] | MUYZER G, DE WAAL E C, UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3):695-700. ( 1) 1)
|
| [7] | 毛华明, 马松成, 陈静, 等.大额牛瘤胃细菌16S rRNA基因序列分析[J]. 中国农业科学, 2008, 41(11):3769-3775. ( 1) 1)
|
| [8] | FREY J C, ROTHMAN J M, PELL A N, et al.Fecal bacterial diversity in a wild gorilla[J]. Applied and Environmental Microbiology, 2006, 72(5):3788-3792. ( 1) 1)
|
| [9] | XU B, HUANG Z X, WANG X Y, et al.Phylogenetic analysis of the fecal flora of the wild pygmy loris[J]. American Journal of Primatology, 2010, 72(8):699-706. ( 1) 1)
|
| [10] | 梁冰, 戚汉君.笼养川金丝猴不同年龄阶段的发育特征[J]. 动物学报, 2001, 47(4):381-387. ( 1) 1)
|
| [11] | WALTER J, HERTEL C, TANNOCK G W, et al. Detection of Lactobacillus, Pediococcus, Leuconostoc, and Weissella species in human feces by using group-specific PCR primers and denaturing gradient gel electrophoresis[J]. Applied and Environmental Microbiology, 2001, 67(6):2578-2585. ( 1) 1)
|
| [12] | 倪学勤, 曾东, 周小秋.采用PCR-DGGE技术分析蛋鸡肠道细菌种群结构及多样性[J]. 畜牧兽医学报, 2008, 39(7):955-961. ( 1) 1)
|
| [13] | RINTTILA T, KASSINEN A, MALINEN E, et al.Development of an extensive set of 16S rDNA-targeted primers for quantification of pathogenic and indigenous bacteria in faecal samples by real-time PCR[J]. Journal of Applied Microbiology, 2004, 97(6):1166-1177. ( 1) 1)
|
| [14] | HEILIG H G H J, ZOETENDAL E G, VAUGHAN E E, et al.Molecular diversity of Lactobacillus spp. and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA[J]. Applied and Environmental Microbiology, 2002, 68(1):114-123. ( 1) 1)
|
| [15] | WU C, YANG F, GAO R, et al.Study of fecal bacterial diversity in Yunnan snub-nosed monkey (Rhinopithecus bieti) using phylogenetic analysis of cloned 16S rRNA gene sequences[J]. African Journal of Biotechnology, 2013, 9(38):6278-6289. ( 2) 2)
|
| [16] | PALMER C, BIK E M, DIGIULIO D B, et al.Development of the human infant intestinal microbiota[J]. PLoS Biology, 2007, 5(7):e177. ( 1) 1)
|
| [17] | HUURRE A, KALLIOMAKI M, RAUTAVA S, et al.Mode of delivery-effects on gut microbiota and humoral immunity[J]. Neonatology, 2007, 93(4):236-240. ( 1) 1)
|
| [18] | KOENIG J E, SPOR A, SCALFONE N, et al.Succession of microbial consortia in the developing infant gut microbiome[J]. Proceedings of the National Academy of Sciences, 2011, 108(Suppl.1):4578-4585. ( 1) 1)
|
| [19] | 贺锐, 张翀, 赵翠生, 等.不同月龄婴儿肠道微生态改变的临床研究[J]. 国际检验医学杂志, 2014(24):153-155. ( 1) 1)
|
| [20] | MITSUOKA T.Significance of dietary modulation of intestinal flora and intestinal environment[J]. Bioscience and Microflora, 2000, 19(1):15-25. ( 1) 1)
|
| [21] | SAUNIER K, DORE J.Gastrointestinal tract and the elderly: functional foods, gut microflora and heal thy ageing[J]. Digestive and Liver Disease, 2002, 34:19-24. ( 1) 1)
|
| [22] | HOLT P R.Gastrointestinal disease in the elderly[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2003, 6:41-48. ( 1) 1)
|
| [23] | PANDA A, ARIONA A, SAPEY E, et al.Human innate immunosenescence:causes and consequences for immunity in old age[J]. Trends in Immunology, 2009, 30(7):325-333. ( 1) 1)
|
| [24] | MUELLER S, SAUNIER K, HANISCH C, et al.Differences in fecal microbiota in different European study populations in relation to age, gender and country:a cross-sectional study[J]. Applied and Environmental Microbiology, 2006, 72(2):1027-1033. ( 1) 1)
|
| [25] | BARTOSH S, FITE A, MACFARLANE G T, et al.Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota[J]. Applied and Environmental Microbiology, 2004, 70(6): 3575-3581. ( 1) 1)
|
| [26] | HOPKINS M J, SHARP R, MACFARLANE G T.Age and disease related changes in intestinal bacterial populations assessed by cell culture, 16S rRNA abundance, and community cellular fatty acid profiles[J]. Gut, 2001, 48(2):198-205. ( 1) 1)
|
| [27] | TIIHONEN K, TYNKKYNEN S, OUWEHAND A, et al.The effect of ageing with and without non-steroidal anti-inflammatory drugs on gastrointestinal microbiology and immunology[J]. British Journal of Nutrition, 2008, 100(1): 130-137. ( 1) 1)
|
| [28] | MARIAT D, FIRMESSE O, LEVENEZ F, et al.The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age[J]. BMC Microbiology, 2009, 9(1):123. ( 1) 1)
|
| [29] | BIAGI E, NYLUND L, CANDELA M, et al.Through ageing, and beyond: gut microbiota and inflammatory status in seniors and centenarians[J]. PLoS One, 2010, 5(5):e10667. ( 1) 1)
|
| [30] | STSEPETOVA J, SEPP E, KOLK H, et al.Diversity and metabolic impact of intestinal Lactobacillus species in healthy adults and the elderly[J]. British Journal of Nutrition, 2011, 105(08):1235-1244. ( 1) 1)
|




