2. 黑龙江八一农垦大学动物科技学院, 大庆 163319
2. College of Animal Science and Veterinary, Heilongjiang Bayi Agricultural University, Daqing 163319, China
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是以肝实质细胞脂肪贮积和脂肪变性为特征的临床病理综合征[1]。近年来,由于脂肪和高糖等摄入增加、激素食品泛滥等因素,使NAFLD发病率逐年增高。NAFLD在鸡、狗、猪、牛、羊以及鱼等动物也可发生,是各种动物的原发或者继发性疾病[2, 3],在鸡、鸭的发病率较高,给禽类养殖业造成了严的重经济损失[4]。有文献报道转录因子NF-E2相关因子(nuclear factor erythroid 2-like 2,Nrf2)基因的缺失会明显加重NAFLD的进程[5]。Nrf2可降低肝脏对氧化应激的敏感性,保持肝脏功能的稳定以及阻止肝脏疾病的发生,在肝损伤、脂肪肝、肝纤维化及肝癌等方面具有保护作用[6],但Nrf2是否会改变高脂饲粮诱导的肝细胞毒性尚不清楚。因此,本试验采用高脂饲粮诱导NAFLD模型,结合基因敲除,研究Nrf2基因缺失对NAFLD小鼠肝脏氧化应激的影响。 1 材料与方法 1.1 试验动物
野生型(wild type,WT)和Nrf2基因敲除(knock out,KO)ICR雄性小鼠,18~20 g,购自南京军区总医院实验中心,小鼠基因型鉴定由中国人民解放军南京军区总医院动物中心鉴定[鉴定号:SCXK(军)2007-012],本实验室采用PCR法对小鼠基因型进行鉴定。小鼠分笼饲养,试验前空腹过夜,自由饮水。 1.2 高脂饲粮(high fat diet,HFD)的制备方法
胆固醇由天津虔诚伟业科技发展有限公司提供,批号:20100122;胆盐、糊精均由北京奥博星生物技术有限责任公司提供,批号:20120202;猪油为超市购买。HFD的配方由前期试验确定[7],按照普通饲料68.5%、猪油15%、胆固醇1%、胆盐0.5%和糊精15%,称取各种成分,将胆固醇和胆盐与普通饲粮(normal diet,ND)粉末混合均匀,再加入熬制好的猪油,待混合均匀后,加入糊精和一定比例的水,用制粒机压制成型后,烘干备用。 1.3 动物模型的分组
将WT和KO小鼠,分别随机分成2组,分别饲喂ND和HFD。各组分别表示为WT-ND、WT-HFD、KO-ND、KO-HFD。自由采食,自由饮水,试验期为8周。试验过程中,每周记录各小鼠体重,每天观察各组小鼠外观形态变化、采食行为及其对外界反应等。 1.4 样品的采集和处理
在第8周末禁食12 h后,眼球采血后处死小鼠。全血3 000 r/min离心10 min分离血清,-20 ℃冻存,用于血清学指标的检测。断颈处死小鼠,腹部正中十字切口,暴露肝脏,预冷生理盐水冲洗后,去除多余结缔组织,滤纸吸干。在肝脏最大叶距边缘5 mm处取小块肝组织,一部分液氮冻存,用于酶活性检测;一部分用10%中性甲醛溶液固定,用于苏木精-伊红(HE)和油红染色,制作切片。 1.5 血清学指标的检测
采用Beckman CX4型全自动生化分析仪测定血清谷丙转氨酶(alanine aminot ransferase,ALT)、谷草转氨酶(aspartat eaminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)和总蛋白(total protein,TP)的含量或活性。其中ALT、AST和ALP活性采用速率法检测,TG和TC含量采用液体双试剂酶法检测,HDL和LDL含量采用直接法检测,TP含量采用双缩脲法测定。 1.6 肝脏酶活性的检测
谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和丙二醛(malondialdehyde,MDA)含量或活性测定试剂盒购置南京建成生物工程研究所。按试剂盒说明书要求,分别取10%匀浆上清0.5 mL,加试剂一应用液2 mL混匀,3 500 r/min离心10 min,取上清液1 mL进行显色反应。 1.7 数据处理
所有计量数据表示为平均值±标准差,数据处理与分析采用SAS 6.12的GLM程序进行,以P<0.05作为差异显著性判断标准。 2 结 果 2.1 HFD对小鼠生长性能的影响
从表1小鼠的体重动态变化来看,WT-ND、KO-ND、WT-HFD和KO-HFD各组之间相比,小鼠的初始体重和末体重没有显著差异(P>0.05),各组小鼠在饲养期内的日增重和日采食量也没有显著差异(P>0.05)。
| 表1 高脂饲粮对小鼠生长性能的影响 Table 1 Effects of high fat diet on growth performance of mice |
WT和KO小鼠血清学指标结果见表2。与对照组小鼠比较,WT和KO高脂诱导NAFLD模型组小鼠TC、LDL含量和ALT、AST活性极显著升高(P<0.01),ALP活性显著或极显著升高(P<0.01或P<0.05),TP含量极显著降低(P<0.01),但TG和HDL含量变化不显著(P>0.05);与WT对照组小鼠比较,KO小鼠TC含量和ALP活性极显著升高(P<0.01),HDL含量显著升高(P<0.05),TP含量极显著降低(P<0.01),ALT活性显著降低(P<0.05),但TG、LDL含量和AST活性变化不显著(P>0.05);与WT高脂诱导NAFLD模型组小鼠比较,KO高脂诱导NAFLD模型组小鼠HDL含量和ALP活性极显著升高(P<0.01),TG含量和ALT活性显著升高(P<0.05),LDL含量极显著降低(P<0.01),TC含量和AST活性显 著降低(P<0.05),但TP含量变化不显著(P>0.05)。
| 表2 高脂饲粮诱导小鼠肝脏中血清学指标的变化 Table 2 Changes of high fat diet induced serum index of liver in mice |
HFD诱导8周后,WT和KO小鼠肝脏均通过肉眼观察,可见对照组小鼠的肝脏呈红褐色,表面光滑,边缘锐利,质软有弹性(图1中A和C);而NAFLD模型组小鼠的肝脏呈黄褐色,体积均匀性增大,肝脏质地较硬,包膜紧张,边缘钝而厚,表面及切面呈灰黄色,有油腻感(图1中B和D)。HE染色后,对照组小鼠肝脏无脂肪变性,小鼠肝细胞形态正常,肝索排列整齐,肝小叶结构正常,细胞中央有大而圆的核,无明显脂肪滴,基本未见炎症细胞(图1中E和G)。NAFLD模型组小鼠肝细胞核的相对大小不均,发生脂肪变性(小泡和大泡性脂肪变性)并伴有肝细胞坏死和炎性细胞浸润。WT高脂小鼠肝脏表现出的小泡性脂肪变性,KO高脂小鼠肝脏表现出严重的大泡性脂肪变性和温和的小泡性脂肪变性(图1中F和H)。油红染色后,对照组小鼠肝脏有少量的脂肪滴红染(图1中I和K);HFD的NAFLD模型组小鼠肝脏有明显的红色脂肪滴(图1中J和L)。
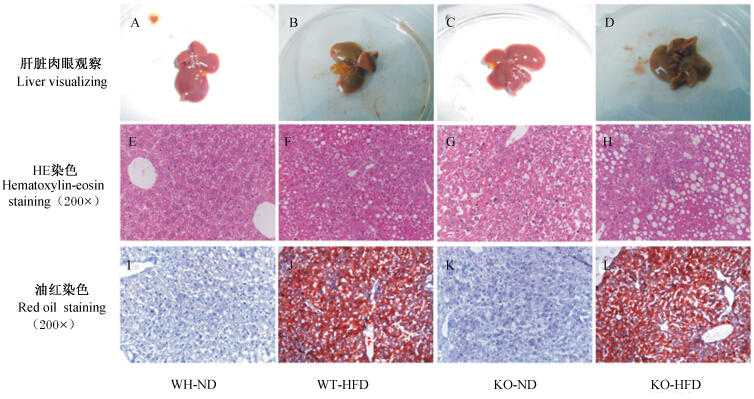 | 图1 高脂饲粮诱导小鼠肝脏病理学变化 Fig. 1 High fat diet induced pathological changes of liver in mice |
HFD诱导8周后,肝脏中的GSH、SOD、POD和MDA含量或活性变化如表2所示。与对照组小鼠相比较,WT和KO高脂诱导NAFLD模型组小鼠肝脏中GSH含量和SOD活性显著或极显著降低(P<0.05或P<0.01),而POD活性和MDA含量显著或极显著升高(P<0.05或P<0.01)。与WT小鼠相比,KO高脂诱导NAFLD模型组小鼠肝脏中MDA含量增加49%,但GSH含量及SOD和POD活性变化不显著(P>0.05)。与WT对照组小鼠相比,KO小鼠肝脏中SOD、POD活性和MDA含量显著或极显著升高(P<0.05或P<0.01),而GSH含量极显著降低(P<0.01)。
| 表3 肝脏中GSH、MDA含量和SOD、POD活性变化 Table 3 Changes of GSH,MDA content and SOD,POD activity in liver |
本研究中采用高脂饲粮,分别饲喂野生型ICR小鼠和Nrf2基因敲除小鼠,通过各项指标检测对模型建立进行评价。试验中以AST、ALT和ALP作为肝细胞损伤的敏感指标,在高脂饲粮诱导后,不论在野生型小鼠还是基因缺失型小鼠都显著升高,符合建模评定标准[8]。模型组小鼠血清中TC含量显著高对照组,这与在有关患有NAFLD疾病中TC水平升高的报道相一致[9]。邵洛林等[10]通过Pearson相关分析显示,高脂饲粮饲喂小鼠后,TC和LDL肝指数与Nrf2的表达呈正相关,本试验中KO组小鼠TC和LDL含量显著低于WT组小鼠,与文献报道相一致,同时,Tanaka等[11]和Kim等[12]研究发现,由于高脂饲粮诱导时间的不同,Nrf2及其靶基因的表达趋势也不相同,这也可能是导致KO小鼠TC和LDL含量降低的原因,其机制还有待进一步研究。KO组比WT组的LDL、TC含量显著降低,而HDL含量显著升高,表明Nrf2基因缺失条件下,小鼠肝脏中脂类转运至外周的能力降低,而由外周转运至肝脏能力升高,所以容易造成脂肪在肝脏中蓄积,这与病理变化中KO高脂小鼠肝脏表现出严重的大泡性脂肪变性相一致。
本试验病理结果显示,对照组小鼠肝脏HE染色,肝脏细胞基本保持完整,肝小叶结构正常;油红染色后,基本没有红染的细胞;而模型组小鼠肝脏脂肪变性明显,表明高脂饲粮诱导8周后在ICR小鼠及Nrf2基因敲除ICR小鼠成功构建NAFLD模型。 3.2 高脂饲粮对肝脏抗氧化应激酶活性的影响
本试验研究了高脂饲粮诱导下,野生型和Nrf2基因缺失型小鼠肝脏中,抗氧化酶活性的变化。GSH是细胞中主要的非蛋白疏基和主要的还原剂之一,是组织中氧化应激检测的主要指标。GSH具有抗氧化性能和保护细胞免受氧化应激诱导的毒性的作用。GSH含量下降可能是消耗增加或/和合成下降所造成的[13]。高脂饲粮诱导NAFLD模型的过程中GSH含量的降低,暗示了氧化应激的发生,GSH含量降低的程度也反映了疾病的严重程度。我们的研究中观察到与报道相似的结果。在高脂饲粮诱导下,野生型和Nrf2基因缺失型小鼠肝脏中GSH含量与对照组相比显著降低。MDA是多不饱和脂肪酸过氧化分裂所形成的三碳化合物,是脂质过氧化损伤反应的产物之一,也是反映氧化应激损害的经典、有效的指标之一。NAFLD疾病过程中MDA含量的增加也暗示了氧化应激的发生,同样与疾病的严重程度有关。MDA含量的增加与GSH含量的降低同时印证了氧化应激反应的发生。SOD能够催化超氧化物通过歧化反应转化为氧气和过氧化氢,是肝脏中重要的抗氧化酶。它可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,复原因自由基造成的对细胞伤害。有资料报道,在NAFLD动物模型中SOD活性降低[14],有关人类NAFLD报道中,部分资料显示SOD活性降低[15, 16, 17, 18]。POD代表着机体中的脂质过氧化程度,当机体中因为某些疾病因素导致脂质过氧化的时候,相应的过氧化物酶也就会同时增加。
在本研究的过程中,以上4种酶的活性变化均与资料报道相一致。证明了本研究采用高脂饲粮诱导的NAFLD模型引起了肝脏氧化应激的发生,且由于Nrf2基因的缺失增加了高脂饲粮诱导MDA含量变化。 4 结 论
① 本试验经饲喂高脂饲粮成功构建了ICR小鼠及Nrf2基因敲除ICR小鼠NAFLA模型。
② 高脂饲粮诱导NAFLA模型小鼠肝脏发生氧化应激。
| [1] | MACHADO M V, CORTEZ-PINTO H.Non-alcoholic fatty liver disease:what the clinician needs to know[J]. World Journal of Gastroenterology, 2014, 20(36):12956-12980. ( 1) 1)
|
| [2] | 王明琼, 杨立军, 李盼盼, 等.奶牛脂肪肝临床诊断指标的筛选[J]. 中国兽医杂志, 2014, 50(5):43-45. ( 1) 1)
|
| [3] | 赵芹, 张海军, 武书庚, 等.吡咯喹啉醌对脂肪肝蛋鸡肝损伤的保护作用机制[J]. 动物营养学报, 2014, 26(3):651-658. ( 1) 1)
|
| [4] | 姜锦鹏, 宁康健, 吕锦芳, 等.实验性鸡脂肪肝出血综合征模型的建立与评价[J]. 中国实验动物学报, 2012, 20(3):69-73. ( 1) 1)
|
| [5] | CHOWDHRY S, NAZMY M H, MEAKIN P J, et al.Loss of Nrf2 markedly exacerbates nonalcoholic steatohepatitis[J]. Free Radical Biology and Medicine, 2010, 48:357-371. ( 1) 1)
|
| [6] | TANG W, JIANG Y F, PONNUSAMY M, et al.Role of Nrf2 in chronic liver disease[J]. World Journal of Gastroenterology, 2014, 20(36):13079-13087. ( 1) 1)
|
| [7] | 李晓冲, 徐尚, 张秀英, 等.C57BL6J小鼠非酒精性脂肪肝模型的建立[J]. 中国兽医杂志, 2013, 49(1):6-8. ( 1) 1)
|
| [8] | 中华肝病学会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J]. 中华肝脏病杂志, 2010, 18(3):163-166. ( 1) 1)
|
| [9] | MOFRAD P, CONTOS M J, HAQUE M, et al.Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values [J]. Hepatology, 2003, 6(37):1286-1292. ( 1) 1)
|
| [10] | 邵洛林, 许伟华, 周成军, 等.Nrf2在小鼠非酒精性脂肪性肝病发病机制中的作用[J]. 山东大学学报, 2010, 48(3):53-46. ( 1) 1)
|
| [11] | TANAKA Y, ALEKSUNES L M, YEAGER R L, et al.NF-E2-related factor 2 inhibits lipid accumulation and oxidative stress in mice fed a high-fat diet[J]. The Journal of Pharmacology and Experimental Therapeutics, 2008, 325 (2):655-664. ( 1) 1)
|
| [12] | KIM S, SOHN I, AHN J I, et al.Hepatic gene expression profiles in a long-term high-fat diet-induced obesity mouse model[J]. Gene, 2004, 340 (1):99-109. ( 1) 1)
|
| [13] | PASTORE A, FEDERICI G, BERTINI E, et al.Analysis of glutathione:implication in redox and detoxification[J]. Clinica Chimica Acta, 2003, 333:19-39. ( 1) 1)
|
| [14] | ZOU Y, LI J, LU C, et al.High-fat emulsion-induced rat model of nonalcoholic steatohepatiis[J]. Life Science, 2006, 79:1100-1107. ( 1) 1)
|
| [15] | SARICAM T, KIRCALI B, KOKEN T.Assessment of lipid peroxidation and antioxidant capacity in non-alcoholic fatty liver disease[J]. Turkish Journal of Gastroenterology, 2005, 16:65-70. ( 1) 1)
|
| [16] | VIDELA LA, RODRIGO R, ORELLANA M, et al.Oxidative stress-related parameters in the liver of non-alcoholic fatty liver disease patients[J]. Clinical Science, 2004, 106:261-268. ( 1) 1)
|
| [17] | KORUK M, TAYSI S, SAVA S MC, et al.Oxidative stress and enzymatic antioxidant status in Patients with nonalcoholic steatohepatiis[J]. Annals of Clinical and Laboratory Science, 2004, 34:57-62. ( 1) 1)
|
| [18] | BHARDWAJ P, MADAN K, THAREJA S, et al.Comparative redox status in alcoholic liver disease and nonalcoholic fatty liver disease[J]. Hepatology International, 2008, 2:202-208. ( 1) 1)
|




