早期断奶对仔猪生长发育带来一系列不良影响,造成其食欲差、消化不良、腹泻等仔猪早期断奶综合征。产生这一后果的生理基础是由于断奶应激影响仔猪肠道组织的形态结构、消化道微生态区系的平衡。同时断奶应激也严重影响免疫系统和酶系统发育及健全[1]。越来越多的研究表明乳酸菌类微生态制剂具有减少哺乳和断奶仔猪消化道疾病发生、提高机体免疫力的功效,从而有效缓解早期断奶应激引起的仔猪免疫功能下降,是仔猪生产中一种理想的饲料添加剂[2, 3]。
嗜酸乳杆菌(Lactobacillus acidophilus,L. acidophilus)是少数可以存活并定植于肠道内的益生菌之一,其在肠道内的定植能力强于其他微生物。它能竞争性地定植于小肠上皮细胞,产生细菌素和有机酸,维持肠道内低pH环境,促进肠道中微生态环境的正常化[4, 5, 6]。Lin等[7]、Lin等[8]、Aween等[9]研究证实L. acidophilus可抑制大肠杆菌、鼠伤寒沙门氏菌、猪霍乱沙门氏菌、葡萄球菌、枯草杆菌等的生长。L. acidophilus ATCC4356通过降低氧化应激、炎症反应可减弱小鼠动脉粥样硬化进程[10]。新生的肠道无菌仔猪喂饲L. acidophilus菌剂时,可显著提高能量与脂肪代谢的转录组水平[11];适当剂量L. acidophilus NCFM(3.2×106 CFU)可增强新生仔猪对胃肠炎病毒(轮状病毒)的免疫力,仔猪回肠、脾脏和血液的轮状病毒特异性抗体、免疫球蛋白G(lgG)抗体分泌细胞(ASCs)、记忆B细胞均明显提高[12]。鉴于乳酸杆菌在肠道黏膜定殖具有宿主特异性,即土著菌株比外来菌株更易于定殖黏膜细胞,且引起黏膜免疫反应所需菌量显著低于外来益生菌所需的剂量[13, 14],而其中的L. acidophilus较其他乳杆菌更易定植于肠道上皮细胞,形成屏障,抑制病原菌的生长[15, 16, 17],本研究拟从仔猪粪便中分离筛选L. acidophilus,并对其进行驯化,使其作为微生态制剂在仔猪生长发育与防御肠道疾病中发挥作用。 1 材料与方法 1.1 试验材料 1.1.1 样品采集
采集江西农业大学养猪场未使用过任何抗生素药物的15日龄仔猪新鲜粪便。 1.1.2 培养基
MRS培养基:蛋白胨 10 g/L,牛肉膏 10 g/L,酵母粉 5 g/L,磷酸钾(K2HPO4) 2 g/L,柠檬酸二铵 2 g/L,乙酸钠 5 g/L,葡萄糖 20 g/L,吐温80 g/L 1 mL,七水硫酸镁(MgSO4·7H2O) 0.58 g/L,四水硫酸锰(MnSO4·4H2O) 0.25 g/L,pH 5.5。
生理生化鉴定培养基:包括牛肉膏蛋白胨液体培养基、明胶液化培养基、V-P试验培养基、PY基础培养基、PYG培养基、硝酸盐液体培养基、吲哚试验培养基、碳水化合物培养基等均按参考文献[18]配制。 1.2 试验方法 1.2.1 猪肠道L. acidophilus的分离纯化
称取采集的样品1 g,置于含99 mL 0.85%无菌生理盐水的三角瓶中,振荡15 min,使样品充分混匀,10倍系列梯度稀释至10-7,配制成不同稀释度菌悬液。分别用不同稀释度的菌悬液涂布于MRS平板培养基,37 ℃,培养48 h。
挑取MRS平板培养基上疑似乳酸菌单菌落,革兰氏染色,镜检。选取革兰氏阳性、杆状单菌落,在MRS平板培养基上划线,37 ℃,培养48 h。重复上述步骤4次。最后,平板单菌落至斜面培养,保存。 1.2.2 猪肠道L. acidophilus的鉴定 1.2.2.1 形态特征观察
将上述分离纯化菌株分别划线至PY基础培养基,37 ℃培养48 h。观察单菌落形态特征。经革兰氏染色后,光学显微镜观察菌体形态特征。 1.2.2.2 生理生化特性鉴定
参照《常见细菌系统鉴定手册》[19]、《乳酸细菌分类鉴定及试验方法》[18],对上述分离纯化的L. acidophilus疑似菌株进行生理生化特测定与分析。 1.2.2.3 高效液相测定发酵液乳酸含量
测试菌株接种于MRS液体培养基,摇瓶转速180 r/min,在37 ℃下培养48 h。发酵液经10 000 r/min离心后,取上清液,用超纯水适当稀释,即得待测液。
色谱条件:使用Aminex HPX-87H分析柱,流动相为0.005 mol/L硫酸,柱温50 ℃,检测波长210 nm,进样量15 μL[20]。 1.2.2.4 16S rDNA序列分析
采用细菌16S rRNA通用引物(7f:5’-CAGAGTTTGATCCTGGCT-3’;1540r:5’-AGGAGGTGATCCAGCCGCA-3’),引物由上海生工生物技术服务有限公司合成。PCR反应体系(25 μL):dNTP mix(每个10 mmol/L) 0.5 μL,10×Taq reaction Buffer 2.5 μL,Taq (5 U/μL) 0.2 μL,模板1 μL,正向、反向引物各0.5 μL,ddH2O 14.8 μL。反应条件:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 35 s,72 ℃ 90 s,循环35次,72 ℃ 8 min。扩增产物经1%琼脂糖凝胶电泳检测,测序由该公司完成。
菌株测序后的序列信息用BLAST软件分析,选择GenBank数据库进行同源性比较。用分子进化遗传学分析(molecular evolutionary genetics analysis,MEGA)6.0软件分析处理所测菌株序列与下载同源性较高序列,构建菌株系统发育树。 1.2.3 菌株La-5耐酸性能驯化
以菌株La-5为出发菌制成菌悬液。取100 mL菌悬液,6 000 r/min离心15 min,收集菌体。菌体转入pH=4.5的MRS液体培养基驯化,摇瓶培养24 h后,取50 mL驯化培养液离心,沉淀菌体再转入pH=5.5的MRS液体培养基富集,再摇瓶培养12 h。按上述方式,依次用pH为4.0、3.5、3.0、2.5、2.0和1.5的MRS培养基驯化,pH=5.5的MRS培养基富集。最后,富集菌液用平板涂布纯化,挑取单菌落斜面保藏。经耐酸驯化后的菌株命名为菌株La-5a。
取20 mL菌株La-5与La-5a的菌悬液,离心,沉淀菌体分别接入pH为1.5、2.0、2.5、3.0、3.5、4.0和5.5的MRS培养基,摇瓶培养4 h。采用pH=5.5的MRS培养基平板计数,测定不同pH的MRS培养液的活菌数。以pH=5.5的MRS为对照组,其他6个pH的MRS为试验组,计算菌株存活率,并绘制活菌数、存活率与pH的关系图。 1.2.4 菌株La-5a耐胆盐性能驯化
取菌株La-5a菌悬液100 mL,按1.2.3方法离心,沉淀菌体转入含0.1%胆盐MRS液体培养基驯化,摇瓶培养24 h后,离心,沉淀菌体转入无胆盐MRS液体培养基,摇瓶富集培养12 h。按上述方法,依次用含0.3%、0.5%、0.7%和1.0%胆盐MRS培养基进行摇瓶驯化、无胆盐MRS培养基摇瓶富集。最后,富集菌液用平板涂布纯化,挑取单菌落斜面保藏。经耐胆盐驯化后的菌株命名为菌株La-5b。
取20 mL菌株La-5和La-5b的菌悬液,离心,沉淀菌体分别接入含胆盐0、0.20%、0.25%、0.30%、0.35%、0.40%和0.50%的MRS培养基,摇瓶培养4 h。采用平板计数法,利用MRS琼脂培养基,测定不同胆盐含量MRS培养液中的活菌数。以胆盐含量0为对照组,其他6个胆盐含量为试验组,计算菌株存活率,并绘制活菌数、存活率与胆盐含量的关系图。 1.2.5 菌株La-5b耐热性能驯化
取菌株La-5b菌悬液50 mL,离心,沉淀菌体转入含MRS液体培养基150 mL三角瓶中,置40 ℃水浴热激驯化处理30 min后,取20 mL菌液离心,沉淀菌体转入MRS液体培养基,富集培养24 h。按上述方法,依次再用45、50、55、60、65和70 ℃水浴热激驯化和富集。最后,富集菌液用平板涂布纯化,挑取单菌落斜面保藏。经高温驯化后的菌株命名为La-5c。
分别取菌株La-5和La-5c菌悬液20 mL,离心,沉淀菌体转入含100 mL MRS液体培养基的三角瓶,再将三角瓶分别置于37、40、45、50、55、60、65和70 ℃水浴热激处理30 min。采用平板计数法,用MRS平板培养基,测定不同温度处理后的活菌数。以37 ℃为对照组,其他7个温度为试验组,计算菌株存活率,并绘制活菌数、存活率与温度的关系图。 2 结果与分析 2.1 细菌形态特征
利用MRS平板培养基从15日龄仔猪粪便中共分离42株具有乳酸菌典型菌落形态特征的菌株。经多次划线纯化、革兰氏染色、镜检,获得13株菌落直径较大、长势较好的杆状菌株,分别编号为菌株La-1至La-13(图1)。其菌落特征为:大部分菌落乳白色,少数透明(菌株La-1、La-3和La-7);边缘整齐;大部分凸起,少数无凸起(菌株La-3、La-7、La-9和La-12)、湿润。
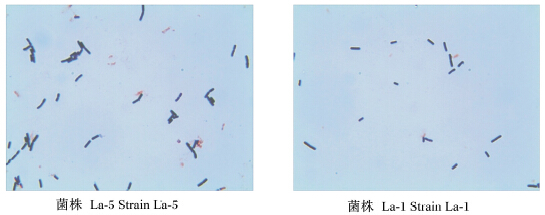 | 图1 分离纯化菌株La-5与La-1的形态特征图 Fig. 1 The morphologic character of strains La-1 and La-5 screened by isolating and purifying (1 000×) |
参照文献[18]、[19],对分离纯化的13株进行初步鉴定,结果表明,菌株La-1、La-2、La-4、La-5、La-6、La-7、La-8、La-9和La-10的过氧化氢酶试验、硝酸盐还原试验、明胶液化试验、吲哚试验、硫化氢试验以及氧化酶试验均为阴性。菌株La-3和La-11吲哚试验阳性,其他试验均为阴性。菌株La-12硝酸盐还原试验、吲哚试验及氧化酶试验为阳性,其他试验均为阴性。菌株La-13硝酸盐还原试验、吲哚试验为阳性,其他试验均为阴性。综合试验结果排除菌株La-3、La-11、La-12和La-13为乳酸杆菌属。
对剩余9株菌株La-1、La-2、La-4、La-5、La-6、La-7、La-8、La-9和La-10进行碳水化合物产酸发酵试验(表1)。结果表明,菌株La-5、La-6、La-8和La-9的4株菌发酵碳水化合物产酸特性与L. acidophilus的完全相同。比较菌株La-5,La-6,La-8和La-9生长态势及形态,菌株La-5在MRS琼脂平板上的长势优于其他3株,单菌落较大而饱满,菌体为较粗长杆状,且其发酵48 h的MRS培养液pH低于其他3株菌株。进一步采用高效液相法对其发酵液产乳酸、乙酸性能进行测定,结果见图2。La-5菌株发酵液经过滤、3倍稀释后,高效液相测定乳酸含量为11.52 g/L,乙酸为2.99 g/L,表明该菌具有发酵产乳酸的能力。因此选择菌株La-5为后续研究菌株。
| 表1 乳酸菌的碳水化合物发酵产酸结果 Table 1 The results of carbohydrates reaction by lacto acid bacteria |
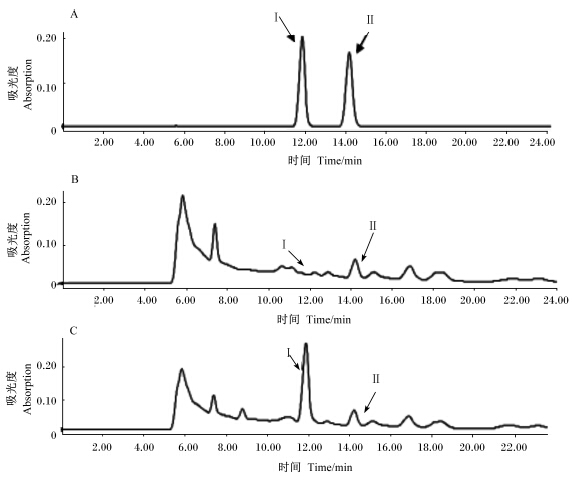 | A: 乳酸、乙酸标品图谱Chromatogram of L-lactic acid and acetic acid standard solution,Ⅰ: L-乳酸L-lactic acid 2.87 g/L,Ⅱ: 乙酸 acetic acid 3.56 g/L。B: MRS培养基稀释3倍图谱Chromatogram of MRS medium diluting 3 times,Ⅰ: L-乳酸 L-lactic acid 2.57 g/L,Ⅱ: 乙酸 acetic acid 2.87 g/L。C: 菌株La-5发酵液稀释3倍图谱Chromatogram of fermentation broth diluting 3 times by strain La-5,Ⅰ: L-乳酸 L-lactic acid 11.52 g/L,Ⅱ: 乙酸 acetic acid 2.99 g/L 图2 菌株La-5发酵液L-乳酸、乙酸的液相色谱图 Fig. 2 Chromatogram of L-lactic acid and acetic acid of fermentation broth by strain La-5 |
利用细菌引物7f/1540r对菌株La-5的16S rRNA扩增、测序。获得基因片段大小为1 430 bp。在GenBank数据库中进行16S rRNA序列比对,与菌株La-5(登录号:KJ850588)相似度最高的菌株L. acidophilus(NR075045、NR117812),相似性达100%。利用MEGA 6.06构建菌株系统发育树,确定菌株La-5进化地位(图3)。菌株La-5与L. acidophilus(NR075045、NR117812)处于同一支,自展值100%,说明这一亚支稳定性好。结合菌株La-5的形态特征、生理生化检测结果,将该菌株鉴定为L. acidophilus。
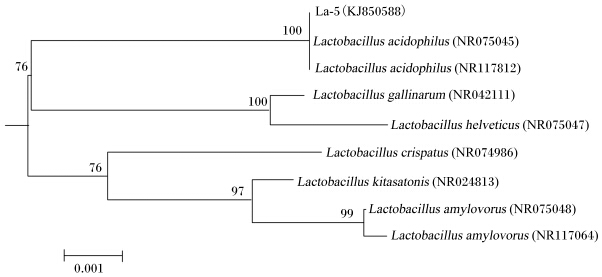 |
Lactobacillus acidophilus:嗜酸乳杆菌;Lactobacillus gallinarum:鸡乳杆菌;Lactobacillus helveticus:瑞士乳杆菌;Lactobacillus crispatus:卷曲乳杆菌;Lactobacillus kitasatonis:北里乳杆菌;Lactobacillus amylovorus:嗜淀粉乳杆菌。 分支点上的数字代表1 000次重排的自展值,标尺代表0.001核苷酸距离,括号中的编号为GenBank登录号。 The numbers on branches indicate bootstrap values calculated from 1 000 resampling. Scale bar 0.001 represent sequence divergence. Numbers in brackets are the sequences accession number in GenBank. 图3 菌株La-5 16S rRNA序列系统发育树分析Fig. 3 The phylogenetic tree of strain La-5 based on 16S rRNA gene sequences |
对分离筛选的菌株La-5采用稀盐酸调整MRS液体培养基酸度,模拟动物胃酸,进行菌株耐酸性能驯化(1.2.3方法),以提高其耐受胃酸环境的能力,保证足量活菌进入肠道发挥益生作用。经不同pH处理4 h后,利用平板计数法,分别测定出发菌株La-5和驯化后菌株La-5a,的活菌数及存活率(图4)。结果表明:经耐酸驯化后获得的菌株La-5a在同等酸度条件下,其活菌数与存活率均高于原始菌株La-5,特别在低酸度(pH=1.5~3)时,驯化后菌株存活率明显高于原始菌株,高出36%~44%,但极低pH(1.5)对菌株La-5a仍具有一定抑制作用,存活率为37%,原始菌株为0.6%。
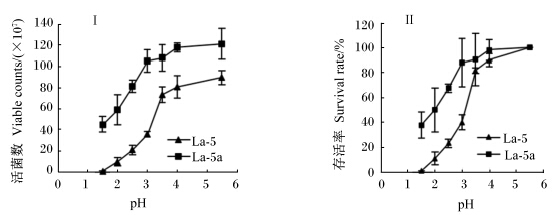 | 图4 在不同pH条件下处理4 h后菌株的活菌数(Ⅰ)及存活率(Ⅱ) Fig. 4 Viable counts (Ⅰ) and survival rate (Ⅱ) of strains La-5 and La-5a under the condition of different pH for 4 h |
采用耐酸性菌株La-5a为出发菌株,用含胆盐的MRS培养基进行耐胆盐性能驯化。经驯化后菌株La-5b与原始菌株La-5在不同胆盐浓度下处理4 h后的生长情况见图5。菌株La-5b对胆盐耐受能力明显优于菌株La-5。胆盐浓度达0.5%时,前者存活率仍有27.30%,而后者仅为4.03%;动物小肠胆汁盐浓度在0.03%~0.3%之间波动,在此范围内驯化菌株存活率为85%~90%之间,而菌株La-5为28%~53%,两者差异明显。
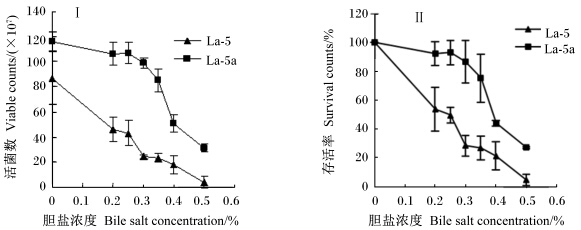 | 图5 在不同胆盐含量条件下处理4 h后菌株La-5和La-5b的活菌数(Ⅰ)及存活率(Ⅱ) Fig. 5 Viable counts (Ⅰ) and survival rate (Ⅱ) of strains La-5 and La-5b under the condition of different bile salt concentrations for 4 h |
胆盐驯化后菌株La-5b经耐热性处理后(1.2.5方法),与原始菌株La-5比较,在45~50 ℃之间其存活率明显高于原始菌株,50 ℃时菌株La-5c存活率为66.1%,而菌株La-5 <0.01%;当温度达55 ℃处理30 min后,前者仍有7.5%的存活率;甚至高达70 ℃处理后,还有极少量菌生存,而原始菌株在温度达50 ℃处理后,已无法检测到生存菌株(图6)。
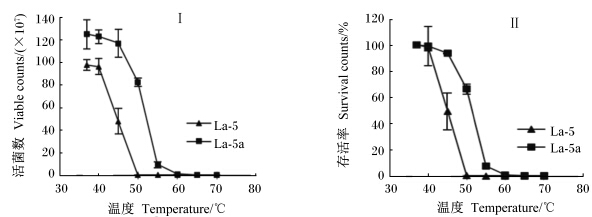 | 图6 在不同温度条件下处理30 min后菌株La-5和La-5c的活菌数和存活率 Fig. 6 Viable counts (Ⅰ) and survival rate (Ⅱ) of strains La-5 and La-5b under the condition of different temperatures for 30 min |
1900年,L. acidophilus首次从人体胃肠道分离,并命名为Bacillus acidophilus。1970年Hanson和Moquot修改为现在的名称。随着细菌鉴定及特征性描述方式方法的发展,L. acidophilus的种群分类经历了多次修订,并在纷繁多样的乳酸杆菌类群中归为亚群中的一个种[21]。该菌为革兰阳性、杆状细菌,通过糖酵解(EMP)途径厌氧发酵产乳酸[22],根据生物合成途径有关基因组分析,认为L. acidophilus为营养缺陷型细菌,其生长繁殖需提供14种氨基酸,同时不能合成多种辅酶因子及维生素(包括核黄素、维生素B6,烟酰胺、生物素、叶酸等)[23],菌株也因此需采用营养丰富的MRS(deMan、Rogosa和Sharpe)为其常规培养基。
早在1971年Van der Waaij等[24]证实胃肠道菌群是一个复杂、稳定的生境,对外源微生物具有清除能力。Lidbeck等[25]给受试者每天饮用含L. acidophilus发酵牛奶,其肠道乳酸菌含量明显提高,但一旦停止饮用,乳酸菌数量又回复到原有水平。Vinderola等[13]用外源、内源L. acidophilus等益生菌喂饲小鼠,表明内源性乳酸菌激活小鼠肠道黏膜免疫反应所需饲喂菌量(104个/d)远小于外源益生菌(107个/d)。鉴于乳酸菌在肠道内定 殖的复杂性以及宿主种属的特异性,本文采集养 猪场的未使用过任何抗生素药物的15日龄仔猪新鲜粪便,利用MRS培养基选择性地富集乳酸菌,再采用平板划线法培养单菌落,多次分离纯化乳酸菌。通过对分离纯化菌株进行形态学观察、生理生化检测、产乳酸性能测定、16S rDNA序列分析以及建立系统发育树,最后确定猪源肠道菌株La-5为L. acidophilus。
哺乳仔猪胃内pH为4.0左右,断奶后升至5.5~6.0,以后逐步下降,60日龄后可达到正常水平,为2.0~3.5[26]。哺乳仔猪的胆囊内胆汁分泌量很少,胆汁量在出生后3周内缓慢增加,小肠内胆盐浓度在0.03%~0.30%波动[27]。而食物进入猪胃后,完全排空的时间3~15日龄约为l.5 h,1月龄为3~5 h,2月龄为16~19 h[28]。因此,一方面,经喂饲的微生态菌剂必须能耐受胃肠的低胃酸及高浓度胆盐,才能到达动物肠道,定殖于上皮细胞黏膜,发挥益生效应。另一方面乳酸菌适宜生长温度为37 ℃,高温不利于菌株的生长及产酸,甚至导致细胞的死亡。而菌剂的发酵生产过程中,提高发酵温度可降低生产能耗、减少染菌;同时乳酸菌制品的加工过程如巴氏消毒等易造成活菌数大量减少,因此改良菌株对环境的耐受性已引起国内外研究者的广泛关注。吴惠芬等[29]研究分离自仔猪肠道的乳酸菌L5和L7对低pH和胆盐的耐受性,表明在pH为1.5和2.5条件下经处理30 min后,菌株数量显著下降;当胆盐浓度高于0.2%时,2个菌株的生长极差;菌株L5在50 ℃下可成活,且呈正常生长趋势,但对80 ℃及以上的耐热能力显著降低。杨桂梅等[30]研究2株分离自猪肠道的益生性屎肠球菌E1和E7对pH、胆盐及温度的耐受特性,结果显示菌株E1和E7在pH=2作用2 h后仍能检测到活菌;胆盐浓度升高至0.6%时,活菌数降到102.5 CFU/mL。
细菌的逆境生存机制之一是适应反应,即当细胞暴露于适度逆境下,细菌可获得对更严峻逆境的抗逆性。此种应激反应使细菌获得在致死环境下生存的可能。另一逆境生存机制是交叉保护。逆境条件下,细菌不仅获得对该逆境的抗性,同时表现出对另一不相关逆境的抗性。在与不断变化的周围环境抗争进程中,细菌已拥有对逆境进行检测、监控和反应精致系统[31, 32]。根据细菌此种特性,采用渐进式改变菌株生长环境,驯化筛选抗逆性优良菌株,具有目标明确、操作简便以及筛选的菌株遗传性状稳定等优点,在工业生产上是一种行之有效的育种技术。本研究通过逐步提高培养基的酸度、胆盐浓度及培养高温,淘汰抵抗性弱的菌株,富集耐受低pH、高浓度胆盐及高温的变异株,使菌株在pH=1.5~3内存活率达38%~47%,在胆盐浓度0.03%~0.3%时存活率在85%~90%之间,在50 ℃时仍有66%的存活率。
革兰氏阳性细菌耐酸性机制包括应激蛋白表达、质子泵过量表达、质子消耗代谢途径修饰等[33]。Van de Guchte等[34]认为乳酸杆菌的耐酸性是通过消耗质子驱动力进行酸应激反应,依赖ATP将质子外排至胞外,质子移位膜ATP酶(F0F1-ATP酶)既可利用质子合成ATP,也能经ATP水解将质子外排。L. acidophilus处于低pH条件下,atp基因转录被激活,引起F0F1-ATP酶活性增强,而使菌株的耐酸性增强[34]。添加外源性天冬氨酸也能增加干酪乳杆菌(L. casei)耐酸性,原因在于天冬氨酸使细胞糖酵解和三羧酸循环途径的中间产物含量升高,从而产生更多的ATP,其通过水解将胞内质子排出胞外[35]。在德氏乳杆菌保加利亚菌(Lactobacillus delbrueckii sub sp. bulgaricus)中,酸性阶段菌株的组氨酸激酶和应答调控蛋白均被诱导表达。由此构建该菌株应答调控蛋白JN675228/JN675229的基因突变体,显示突变菌株的耐酸性强于对照菌株[36, 37]。同样乳酸菌对胆盐的应激反应也是一个复杂的生理过程。Lee等[38]研究指出胆盐浓度达1.2 g/L以上时,对罗伊氏乳杆菌(Lactobacillus reuteri)生长有明显抑制作用,通过蛋白质组学分析揭示在不同浓度胆盐培养基生长的菌株蛋白质组成存在明显差异,其中包括糖代谢、核苷酸代谢、氨基酸合成以及转录翻译等蛋白质。在胆盐培养基中,菌株L. reuteri CRL 1098的细胞膜与细胞壁存在部分剥离,细胞收缩等现象。胆盐抗性菌株L. delbrueckii sub sp. lactis 200的10对小鼠肠道黏附性减弱。研究证实在胆盐存在下,蛋白质延长因子Tu的表达被抑制,此因子与肠道黏附蛋白质的合成有关[39, 40, 41]。L. acidophilus等益生菌多为不含芽孢的厌氧或兼性厌氧菌,抗逆性差。因此,优质的益生菌不仅应具备在生产、储存条件下保证有大量活菌数的特性,同时须能通过宿主胃环境,克服其肠道其他菌的拮抗与抑制作用,竞争性地以充足活菌到达肠道,并能定殖于肠黏膜。本研究驯化的菌株La-5c较从仔猪肠道分离纯化的原始菌株La-5的耐酸、胆盐及高温能力有大幅度提高。但该菌株能否在仔猪肠道黏膜定殖、对仔猪的生长发育与抗病性的影响以及喂饲仔猪的适宜剂量等还有待进一步的研究。 4 结 论
从仔猪新鲜粪便分离纯化的菌株La-5采用形态、生理生化、16S rRNA基因序列及系统发育树分析,确定为L. acidophilus。通过逐步驯化后,驯化菌株La-5c对酸、胆盐、高温的耐受能力明显高于原始菌株La-5。
| [1] | 程学慧, 彭健.早期断奶仔猪肠道损伤与营养调控[J]. 饲料博览, 2001(9):26-28. ( 1) 1)
|
| [2] | CHYTILOVÁ M, MUDROÑOVÁ D, NEMCOVÁ R, et al.Anti-inflammatory and immunoregulatory effects of flax-seed oil and Lactobacillus plantarum-BiocenolTM LP96 in gnotobiotic pigs challenged with enterotoxigenic Escherichia coli[J]. Research in Veterinary Science, 2013, 95(1):103-109. ( 1) 1)
|
| [3] | TRASINO S E, DAWSON H D, URBAN J F, Jr., et al.Feeding probiotic Lactobacillus paracasei to Ossabaw pigs on a high-fat diet prevents cholesteryl-ester accumulation and LPS modulation of the Liver X receptor and inflammatory axis in alveolar macrophages[J]. The Journal of Nutritional Biochemistry, 2013, 24(11):1931-1939. ( 1) 1)
|
| [4] | 赵瑞香, 李元瑞, 郭洋.嗜酸乳杆菌抑菌特性的研究[J]. 中国微生态学杂志, 2001, 13(6):318-319. ( 1) 1)
|
| [5] | SCAPIN D, GRANDO W F, ROSSI E M, et al.Antagonistic activity of Lactobacillus acidophilus LA10 against Salmonella enterica serovar Enteritidis SE86 in mice[J]. Brazilian Journal of Microbiology, 2013, 41(1):57-61. ( 1) 1)
|
| [6] | NAKAZATO G, PAGANELLI F L, LAGO J C, et al.Lactobacillus acidophilus decreases Salmonella Typhimurium invasion in vivo[J]. Journal of Food Safety, 2011, 31(2):284-289. ( 1) 1)
|
| [7] | LIN W H, YU B, JANG S H, et al.Different probiotic properties for Lactobacillus fermentum strains isolated from swine and poultry[J]. Anaerobe, 2007, 13(3/4):107-113. ( 1) 1)
|
| [8] | LIN C K, TSAI H C, LIN P P, et al.Lactobacillus acidophilus LAP5 able to inhibit the Salmonella choleraesuis invasion to the human Caco-2 epithelial cell[J]. Anaerobe, 2008, 14(5):251-255. ( 1) 1)
|
| [9] | AWEEN M M, HASSAN Z, MUHIALDIN B J, et al.Antibacterial activity of Lactobacillus acidophilus strains isolated from honey marketed in malaysia against selected multiple antibiotic resistant (MAR) gram-positive bacteria[J]. Journal of Food Science, 2012, 77(7):M364-M371. ( 1) 1)
|
| [10] | CHEN L H, LIU W W, LI Y M, et al.Lactobacillus acidophilus ATCC 4356 attenuates the atherosclerotic progression through modulation of oxidative stress and inflammatory process[J]. International Immunopharmacology, 2013, 17(1):108-115. ( 1) 1)
|
| [11] | KUMAR A, VLASOVA A N, LIU Z, et al.In vivo gut transcriptome responses to Lactobacillus rhamnosus GG and Lactobacillus acidophilus in neonatal gnotobiotic piglets[J]. Gut Microbes, 2014, 5(2):152-164. ( 1) 1)
|
| [12] | LIU F N, WEN K, LI G H, et al.Dual functions of Lactobacillus acidophilus NCFM as protection against rotavirus diarrhea[J]. Journal of Pediatric Gastroenterology and Nutrition, 2014, 58(2):169-176. ( 1) 1)
|
| [13] | VINDEROLA C G, MEDICI M, PERDIGÓN G.Relationship between interaction sites in the gut, hydrophobicity, mucosal immunomodulating capacities and cell wall protein profiles in indigenous and exogenous bacteria[J]. Journal of Applied Microbiology, 2004, 96(2):230-243. ( 2) 2)
|
| [14] | AFRC R F.Probiotics in man and animals[J]. Journal of Applied Bacteriology, 1989, 66(5):365-378. ( 1) 1)
|
| [15] | SAREM-DAMERDJI L, SAREM F, MARCHAL L, et al.In vitro colonization ability of human colon mucosa by exogenous Lactobacillus strains[J]. FEMS Microbiology Letters, 1995, 131(2):133-137. ( 1) 1)
|
| [16] | BERNET M F, BRASSART D, NEESER J R, et al.Lactobacillus acidophilus LA 1 binds to cultured human intestinal cell lines and inhibits cell attachment and cell invasion by enterovirulent bacteria[J]. Gut, 1994, 35(4):483-489. ( 1) 1)
|
| [17] | YUN B, OH S, GRIFFITHS M W.Lactobacillus acidophilus modulates the virulence of Clostridium difficile[J]. Journal of Dairy Science, 2014, 97(8):4745-4758. ( 1) 1)
|
| [18] | 凌代文, 东秀珠.乳酸细菌分类鉴定及实验方法[M]. 北京:中国轻工业出版社, 1999:, 117-127. ( 3) 3)
|
| [19] | 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:, 289-294. ( 2) 2)
|
| [20] | 田芬, 陈俊亮, 霍贵成.嗜酸乳杆菌和双歧杆菌的主代谢产物分析[J]. 中国食品学报, 2013, 13(6):220-226. ( 1) 1)
|
| [21] | ANJUM N, MAQSOOD S, MASUD T, et al.Lactobacillus acidophilus:characterization of the species and application in food production[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(9):1241-1251. ( 1) 1)
|
| [22] | KANDLER O, WEISS N.Genus Lactobacillus Beijerinck 1901, 212A-L[C]//SNEATH P H A, MAIR N C, SHARPE M E, et al.Bergey's Manual of Systematic Bacteriology.Vol.2.Baltimore:The Williams and Wilkins Co.1986:1209-1234. ( 1) 1)
|
| [23] | ALTERMANN E, RUSSELL W M, AZCARATE-PERIL M A, et al.Complete genome sequence of the probiotic lactic acid bacterium Lactobacillus acidophilus NCFM[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(11):3906-3912. ( 1) 1)
|
| [24] | VAN DER WAAIJ D, BERGHUIS-DE VRIES J M, LEKKERKERK-VAN DER WEES J E C.Colonization resistance of the digestive tract in conventional and antibiotic-treated mice[J]. Journal of Hygiene, 1971, 69(3):405-411. ( 1) 1)
|
| [25] | LIDBECK A, GUSTAFSSON J, NORD C E.Impact of Lactobacillus acidophilus supplements on the human oropharyngeal and intestinal microflora[J]. Scandinavian Journal of Infectious Diseases, 1987, 19(5):531-537. ( 1) 1)
|
| [26] | 周其家, 朱翔宇.仔猪消化环境与营养代谢调节剂的应用[J]. 畜牧兽医科技信息, 2011(5):56-57. ( 1) 1)
|
| [27] | 容庭, 何前, 陈庄, 等.屎肠球菌及其在仔猪生产上的研究现状[J]. 饲料工业, 2008, 29(22):55-57. ( 1) 1)
|
| [28] | 赵晓明, 李世丁, 郭凤英.早期断奶仔猪消化道环境变化与营养调控[J]. 饲料工业, 2003, 24(4):45-46. ( 1) 1)
|
| [29] | 吴惠芬, 毛勇胜, 姚文, 等.2株猪源乳酸菌对低pH值和胆盐耐受性及热稳定性研究[J]. 华中农业大学学报, 2005, 24(3):265-268. ( 1) 1)
|
| [30] | 杨桂梅, 朱永红, 苏娜, 等.2株猪源益生性肠球菌对酸和胆盐及热的耐受性研究[J]. 北京农学院学报, 2008, 23(4):29-32. ( 1) 1)
|
| [31] | FOSTER J W, HALL H K.Inducible pH homeostasis and the acid tolerance response of Salmonella typhimurium[J]. Journal of Bacteriology, 1991, 173(16):5129-5135. ( 1) 1)
|
| [32] | HECKER M, SCHUMANN W, VÖLKER U.Heat-shock and general stress response in Bacillus subtilis[J]. Molecular Microbiology, 1996, 19(3):417-428. ( 1) 1)
|
| [33] | COTTER P D, HILL C.Surviving the acid test:responses of gram-positive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3):429-453. ( 1) 1)
|
| [34] | VAN DE GUCHTE M, SERROR P, CHERVAUX C, et al.Stress responses in lactic acid bacteria[J]. Antonie Van Leeuwenhoek, 2002, 82(1/4):187-216. ( 2) 2)
|
| [35] | WU C D, ZHANG J, DU G C, et al.Aspartate protects Lactobacillus casei against acid stress[J]. Applied Microbiology and Biotechnology, 2013, 97(9):4083-4093. ( 1) 1)
|
| [36] | 刘伟, 崔艳华, 曲晓军.乳酸菌双组分信号转导系统研究进展[J]. 生物技术通报, 2011(5):38-42. ( 1) 1)
|
| [37] | CUI Y H, LIU W, QU X J, et al.A two component system is involved in acid adaptation of Lactobacillus delbrueckii subsp.Bulgaricus[J]. Microbiological Research, 2012, 167(5):253-261. ( 1) 1)
|
| [38] | LEE K B, LEE H G, CHOIC Y J.Proteomic analysis of the effect of bile salts on the intestinal and probiotic bacterium Lactobacillus reuteri[J]. Journal of Biotechnology, 2008, 137(1/2/3/4):14-19. ( 1) 1)
|
| [39] | TARANTO M P, PEREZ-MARTINEZ G, FONT DE VALDEZ G.Effect of bile acid on the cell membrane functionality of lactic acid bacteria for oral administration[J]. Research in Microbiology, 2006, 157(8):720-725. ( 1) 1)
|
| [40] | BURNS P, SÁNCHEZ B, VINDEROLA G, et al.Inside the adaptation process of Lactobacillus delbrueckii subsp lactis to bile[J]. International Journal of Food Microbiology, 2010, 142(1/2):132-141. ( 1) 1)
|
| [41] | SICILIANO R A, CACACE G, MAZZEO M F, et al.Proteomic investigation of the aggregation phenomenon in Lactobacillus crispatus[J]. Biochimica et Biophysica Acta (BBA):Proteins and Proteomics, 2008, 1784(2):335-342. ( 1) 1)
|




