2. 曼彻斯特大学炎症与修复研究所, 曼彻斯特 M13 9PT
2. Institute of Inflammation and Repair, The University of Manchester, Manchester M13 9PT, United Kingdom
磷壁酸(teichoic acid)和肽聚糖(peptidoglycan)共同构成革兰氏阳性细菌细胞壁的结构成分,二者构成的细胞壁约占细胞干重的50%[1]。细菌磷壁酸和肽聚糖的研究一直都是研究治疗革兰氏阳性细菌感染疾病的重点。目前已有很多针对肽聚糖结构进行的有关抑菌物质(如溶菌酶、青霉素)及抑菌机制的研究[2, 3],但有关它的磷壁酸降解及抗生素作用的研究却非常少。磷壁酸是一种富含磷酸基团的线性多聚体,其骨架由磷酸甘油或者磷酸核糖醇构成[4]。Kusse等[5, 6]首次从枯草芽孢杆菌(Bacillus subtilis)Marburg中分离到了一种可以特异性降解磷壁酸的酶,将其命名为磷壁酸酶(teichoicase)。然而,有关磷壁酸酶的后续研究报道较少,在NCBI、KEGG、BRENDA等数据库中至今未有磷壁酸酶基因和蛋白的任何记录。因此,本文将主要介绍磷壁酸酶的发现及命名、可能的同工酶、功能以及潜在的应用价值。
1 磷壁酸酶简介 1.1 发现及命名1972年,Wise等[7]首次以32P标记的Bacillus subtilis ATCC6051的磷壁酸作为底物,筛选到了具有分解磷壁酸能力的细菌,并且将其命名为磷壁酸分解(teichoic-acid eater,TAE)菌株。Wise等[7]虽然测到了TAE菌株的粗酶液具有分解磷壁酸的能力,但是他们并没有对粗酶液中的各个组分进行分离,没有得到纯的具有分解磷壁酸能力的酶。因此,他们并不能够确定TAE菌株的粗酶液中到底有多少种酶与磷壁酸的降解有关,也没办法排除是一些核酸酶的作用。随后,1982年,Kusse等[5]以带有14C标记的葡萄糖的磷壁酸(来自于Bacillus subtilis DSM 10)作为底物,从Bacillus subtilis Marburg的发酵液中分离并且纯化到了可以特异性地降解磷壁酸的酶,并将其命名为磷壁酸酶。他们将磷壁酸酶定义为这样一类酶:能够特异性地作用于磷壁酸,但是不能作用于核酸类物质;具有磷酸二酯酶活性,但是不具有磷酸单酯酶活性的酶。磷壁酸酶可以作用于磷壁酸产生α-D-葡萄糖-1,2甘油-3-磷酸(α-D-glucose 1→2(sn)glycero-3-phosphate)。它在Bacillus subtilis Marburg的产孢时期,活性达到最高。Kusse等[5]还测得了此Bacillus subtilis Marburg来源的磷壁酸酶的相对分子质量,大约为310×103,由4个亚基组成,每个亚基大约为78×103。
1.2 可能的同工酶磷壁酸酶虽在1982年已经被提取和纯化,并且测定了相对分子质量,但是,他们并没有获得此酶的基因和晶体结构信息。而且,此后也没有人在相关领域发表任何有关磷壁酸酶的文章,NCBI、KEGG、BRENDA等数据库中至今也没有关于磷壁酸酶基因(teichoicase)和蛋白的相关信息。然而,根据磷壁酸酶作用的底物、作用特点以及产物在NCBI上进行搜索,发现其与甘油磷酸二酯磷酸 二酯酶(glycerophosphodiester phosphodiesterase,GDPD)家族的一些作用底物、作用特点、产物都十分相似,尤其是GDPD(EC:3.1.4.46)。因此,磷壁酸酶极有可能属于GDPD家族。
GDPD家族是一类专门水解甘油磷酸二酯类底物,产生甘油-3-磷酸和相应的醇类(如:胆碱、乙醇胺、肌醇、丝氨酸)的水解酶[8, 9, 10, 11, 12, 13, 14],催化的反应如下:
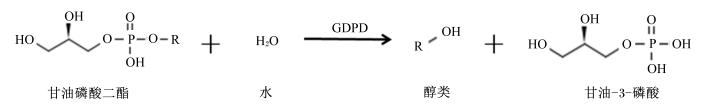
GDPD家族中一些酶的晶体结构已经得到[11, 13, 15],它们是类似于磷酸丙糖异构酶晶体结构的α/β折叠桶结构,由8个β折叠片和8个α螺旋组成。镁离子(Mg2+)、钙离子(Ca2+)是甘油磷酸二酯酶的激活剂[11, 16, 17, 18]。甘油磷酸二酯酶广泛存在于原核生物、真核生物中,并且对许多甘油磷酸二酯都具有特异性的水解能力,例如:甘油磷酸胆碱(glycerophosphocholine)、甘油磷酸乙醇胺(glycerophosphoethanolamine)、甘油磷酸甘油(glycerophosphoglycerol)、双甘油磷酸甘油[bis(glycerophosphoglycerol)]。而这些底物在结构上与甘油型磷壁酸十分相似,都是以磷酸和甘油形成的磷酸二酯键作为骨架。而且,据Santos-Beneit等[19]和Mcoughlin等[20]的报道,甘油磷酸二酯酶在细菌对磷和碳源的利用上也发挥着重要作用。因此,甘油磷酸二酯酶极有可能是磷壁酸酶的同工酶。
2 磷壁酸酶的功能 2.1 降解细菌磷壁酸磷壁酸酶是Kusse等[5, 6]依据其可以特异性地降解磷壁酸而命名的,因此,降解磷壁酸应该就是磷壁酸酶的功能之一。根据报道,他们以Bacillus subtilis DSM 10的磷壁酸作为底物,以14C标记葡萄糖,与Bacillus subtilis Marburg来源的磷壁酸酶作用后,生成了α-D-葡萄糖-1,2甘油-3-磷酸。因此,磷壁酸酶降解磷壁酸的方式应该就是:作用于磷壁酸中的甘油-磷酸骨架,从而产生甘油-3-磷酸和甘油。
2.2 参与磷脂和磷元素代谢根据Kusse等[5, 6]的研究,磷壁酸酶作用于磷壁酸中的甘油-磷酸骨架,产生甘油-3-磷酸和甘油,而甘油-3-磷酸对于原核和真核生物都有着非常重要的作用。在原核生物中,如大肠杆菌(Escherichia coli),据Larson等[21]报道,在GDPD的作用下,甘油磷酸二酯类物质可以被降解,生成甘油-3-磷酸和醇类。而甘油-3-磷酸在ABC转运蛋白的运输下到达胞质,参与到磷脂的合成途径中[16, 22, 23],为磷脂的合成提供原料。在真核生物中,GDPD也发挥着相同的作用。Cheng等[10]报道了拟南芥在培养基磷饥饿的情况下,在GDPD的作用下,不仅可以从磷脂上获得甘油-3-磷酸用以合成新的脂类,同时还可以获得磷元素用以机体的磷代谢。另外,Santos-Beneit等[19]发现天蓝链霉菌(Streptomyces coelicolor)中甘油磷酸二酯酶在磷源和碳源的调节中也发挥着重要的作用。由于甘油磷酸二酯酶是磷壁酸酶可能的同工酶,而且磷壁酸酶作用于磷壁酸后的产物也为甘油-3-磷酸,因此,磷壁酸酶也极有可能在原核生物和真核生物的磷脂以及磷元素代谢过程中发挥着不可或缺的作用。
2.3 阻止革兰氏阳性致病菌对宿主细胞的黏附、定植磷壁酸是一类由多聚甘油磷酸酯或多聚磷酸核糖醇构成的阴离子聚合物,其侧链上羟基往往带有丙氨酸(Ala)或者N-乙酰葡糖胺(N-acctylglucosamine,GlcNAc),故通常带有一定量的正电荷,形成正负电荷交替出现的链状聚合物结构[24]。近年来,越来越多的研究表明,磷壁酸在革兰氏阳性细菌与宿主细胞的互作中发挥着十分重要的作用[25, 26, 27, 28]。据Weidenmaier等[29]报道,磷壁酸在金黄色葡萄球菌对大鼠鼻腔黏膜上皮细胞的黏附中发挥着重要作用。Gao等[30]利用排斥试验和竞争试验也证明了磷壁酸在丁酸梭菌的黏附、定植过程中发挥着主要作用。因此,磷壁酸酶对磷壁酸的降解可能导致革兰氏阳性细菌对宿主细胞黏附率的降低,进而阻止诸如金黄色葡萄球菌等一些革兰氏阳性细菌对宿主细胞的黏附、定植。
3 磷壁酸酶潜在的应用价值磷壁酸酶作为一种可以特异性地降解甘油型磷壁酸的磷酸二酯酶,在细菌生理学研究和动物疾病预防方面都具有潜在的价值。
3.1 细菌生理学研究磷壁酸酶的发现是非常重要的,它对进一步地了解革兰氏阳性细菌磷壁酸的合成与降解以及磷脂、磷元素的代谢机制有着非常重大的意义。
在磷壁酸合成机制研究方面,黄健[31]报道了在肺炎链球菌体中存在的基因spd1672是影响磷壁酸合成的关键基因,该基因缺失后,会导致细菌磷壁酸合成显著减少,并且对宿主定植、侵袭能力减弱。在磷壁酸降解方面,也仅有Kusse等[5]从枯草芽孢杆菌中发现并纯化到了可以降解磷壁酸的磷壁酸酶,揭示磷壁酸酶在其他细菌和真菌中的存在状况及其特性对于研究磷壁酸的降解机制具有重要的作用。
根据Kusse等[5, 6]的研究,磷壁酸酶作用于甘油型磷壁酸后会形成α-D-葡萄糖-1,2甘油-3-磷酸。而甘油-3-磷酸往往被细菌用来合成脂类物质[16],如磷脂。另外,据Schwan等[23]报道螺旋原虫(Spirochetes)在生长环境中缺乏磷源和碳源时,会降解磷脂类物质生成甘油-3-磷酸,用来当作碳源和磷源,保证细胞能够进行正常的磷代谢以及达到较高的细胞浓度。因此,磷壁酸酶在细胞磷脂和磷代谢的过程中发挥着很大的作用。研究磷壁酸酶也将有助于更加深入地了解细胞对磷脂和磷元素的代谢过程。
3.2 动物细菌性疾病预防根据Weidenmaier等[29]和Gao等[30]的报道,磷壁酸在金黄色葡萄球菌对宿主细胞的黏附、定植中发挥着重要作用。因此,磷壁酸酶可望在以下方面对预防细菌性疾病发挥作用。
3.2.1 外伤感染治疗长期以来,动物疫病多,疫情复杂始终是制约我国畜牧业健康发展的一个重要因素[32]。造成动物患病的因素是多方面的,外伤感染则是较为常见的因素之一。在造成动物外伤感染的细菌中,革兰氏阳性细菌占有很大的比例。例如,金黄色葡萄球菌(Staphylococcus aureus)、肠球菌(Enterococcus)、链球菌(Streptococcus)等。这些革兰氏阳性细菌的感染极易引起诸如肺炎、化脓性感染、败血症、脐带炎等,很容易引起幼畜的死亡。目前,防治这些疾病的发生,人们主要采用注射疫苗以及饲喂抗生素类药物的方法。但是,疫苗和抗生素类药物的使用极易造成在动物肉类制品中残留量超标。而且,抗生素类药物的频繁使用也极易使一些革兰氏阳性致病菌产生抗性。而磷壁酸酶的使用则可以避开这些问题。磷壁酸酶用于动物外伤感染的治疗主要依靠其可以降解磷壁酸,阻止革兰氏阳性细菌对宿主细胞的定植、黏附[33],继而阻止其在外伤处繁殖以及产生毒素,从而达到保护动物免受外伤感染。
3.2.2 在饲料中的应用磷壁酸酶还可以添加到动物饲料中,尤其是幼畜饲料,作为一些由革兰氏阳性细菌造成的食入性疾病的阻断剂。幼畜较成年动物,免疫力低,对环境的适应能力差,其机体的免疫力主要来自母体[34]。因此,向幼畜饲料中添加磷壁酸酶制剂,与溶菌酶等抑菌物质共同使用,不仅可以抑制一些致病菌的繁殖,同时也可以抑制一些革兰氏阳性细菌磷壁酸的合成,从而达到保护幼畜的效果。磷壁酸酶制剂作为革兰氏阳性细菌阻断剂加入到饲料中,除了可以达到保护幼畜的效果外,还可以减少抗生素类药物的使用,从而减少甚至避免动物肉制品中抗生素的残留,对于无抗化养殖具有积极的意义。
磷壁酸酶用作饲用酶制剂,除了和其他饲用酶制剂一样存在易变性失活的不足之外,还会在其作用特异性方面存在一些不理想的性质。由于磷壁酸酶是作为革兰氏阳性致病菌的阻断剂而发挥作用,它降解细胞壁中的磷壁酸从而阻止革兰氏阳性病原菌对宿主细胞的定植、黏附[33],达到抑制病原菌繁殖的目的,在这个过程中磷壁酸酶也可能会不加选择地对一些有益的革兰氏阳性细菌如双歧杆菌等产生抑制作用,从而对动物尤其是幼畜生长产生不利影响,因此,在磷壁酸酶饲用时需要对其进行更深入的功效研究。
4 小 结磷壁酸酶自1982年由Kusse等[5]提出并命名后,至今并没有得到其基因信息,在NCBI、KEGG、BRENDA等数据库中也没有关于磷壁酸酶基因和蛋白的相关信息。即便如此,我们也相信自然界肯定存在着可以特异性地降解磷壁酸的磷壁酸酶。虽然,磷壁酸酶作为酶制剂在动物饲料应用方面存在着不足,但其在动物细菌性疾病预防方面有着极大的应用潜力。而且,磷壁酸酶的发现不仅将会对细菌学研究产生重大的推动作用,对动物,尤其是幼畜动物的一些由革兰氏阳性细菌引起的外伤感染的治疗和食入性疾病的防范也有着十分重要的意义。同时,对减少动物养殖过程中抗生素类药物的使用和降低动物肉制品中抗生素的残留也有着一定的积极作用。因此,磷壁酸酶的发现,无论是在理论研究方面,还是实际应用方面,都有着非常重大的意义。
| [1] | 王静华,赵洪涛,汪以真.细菌细胞壁肽聚糖的研究进展[J]. 中国兽药杂志,2004,38(1):38-40. ( 1) 1)
|
| [2] | 陈艳,江明锋,叶煜辉,等.溶菌酶的研究进展[J]. 生物学杂志,2009,26(2):64-66. ( 1) 1)
|
| [3] | FLEMING A.On a remarkable bacteriolytic element found in tissues and secretions[J]. Proceedings of the Royal society of London.Series B,1922,93:306-317. ( 1) 1)
|
| [4] | 李莹,付艳茹,刘彦民,等.磷壁酸提取方法的研究[J]. 天然产物研究与开发,2009,21(10):499-501. ( 1) 1)
|
| [5] | KUSSER W,FIEDLER F.Purification,Mr-value and subunit structure of a teichoic acid hydrolase from Bacillus subtilis[J]. Febs Letters,1982,149(1):67-70. ( 8) 8)
|
| [6] | KUSSE W,FIEDLER F.Teichoicase from Bacillus subtilis marburg[J]. Jouranal of Bacteriology,1983,155(1):302-310. ( 4) 4)
|
| [7] | WISE E M,WISE J R,GLICKMAN R S,et al.Teichoic acid hydrolase activity in soil bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America,1972,69(1):233-237. ( 2) 2)
|
| [8] | CORDA D,MOSCA M G,OHSHIMA N,et al.The emerging physiological roles of the glycerophosphodiesterase family[J]. The FEBS Journal,2014,281(4):998-1016. ( 1) 1)
|
| [9] | JACKSON C J,CARR P D,LIU J W,et al.The structure and function of a novel glycerophosphodiesterase from Enterobacter aerogenes[J]. Journal of Molecular Biology,2007,367(4):1047-1062. ( 1) 1)
|
| [10] | CHENG Y X,ZHOU W B,SHEERY N I E,et al.Characterization of the arabidopsis glycerophosphodiester phosphodiesterase (GDPD) family reveals a role of the plastid-localized AtGDPD1 in maintaining cellular phosphate homeostasis under phosphate starvation[J]. The Plant Journal,2011,66(5):781-795. ( 2) 2)
|
| [11] | SHI L,LIU J F,AN X M,et al.Crystal structure of glycerophosphodiester phosphodiesterase (GDPD) from Thermoanaerobacter tengcongensis,a metal ion-dependent enzyme:insight into the catalytic mechanism[J]. Proteins:Structure,Function,and Bioinformatics,2008,72(1):280-288. ( 2) 2)
|
| [12] | DENLOYE T,DALAL S,KLEMBA M.Characterization of a glycerophosphodiesterase with an unusual tripartite distribution and an important role in the asexual blood stages of Plasmodium falaciparum[J]. Molecular & Biochemical Parasitology,2012,186(1):29-37. ( 1) 1)
|
| [13] | RAO K N,BONANNO J B,BURLEY S K,et al.Crystal structure of glycerophosphodiester phosphodiesterase from Agrobacterium tumefaciens by SAD with a large Asymmetric Unit[J]. Proteins:Structure,Function,and Bioinformatics,2006,65(2):514-518. ( 1) 1)
|
| [14] | VAN DER REST B,ROLLAND N,BOISSON A M,et al.Identification and characterization of plant glycerophosphodiester phosphodiesterase[J]. Biochemical Journal,2004,379(3):601-607. ( 1) 1)
|
| [15] | SANTELLI E,SCHWARZENBACHER R,MCMULLAN D,et al.Crystal structure of a glycerophosphodiester phosphodiesterase (GDPD) from Thermotoga maritima (TM1621) at 1.60 Å resolution[J]. Proteins:Structure,Function,and Bioinformatics,2004,56(1):167-170. ( 1) 1)
|
| [16] | LARSON T J,EHRMANN M,BOOS W.Periplasmic glycerophosphodiester phosphodiesterase of Escherichia coli,a new enzyme of the glp regulon[J]. The Journal of Biological Chemistry,1983,258(9):5428-5432. ( 3) 3)
|
| [17] | LARSON T J,VAN LOO-BHATTACHARYA A T.Purification and characterization of glpQ-encoded glycerophosphodiester phosphodiesterase from Escherichia coli k-12[J]. Archives of Biochemistry and Biophysics,1988,260(2):577-584. ( 1) 1)
|
| [18] | OHSHIMA N,YAMASHITA S,TAKAHASHI N,et al.Escherichia coli cytosolic glycerophosphodiester phosphodiesterase (UgpQ) requires Mg2+,Co2+,or Mn2+ for its enzyme activity[J]. Journal of Bacteriology,2008,190(4):1219-1223. ( 1) 1)
|
| [19] | SANTOS-BENEIT F,RODRÍGUEZ-GARCÍA A,APEL A K,et al.Phosphate and carbon source regulation of two PhoP-dependent glycerophosphodiester phosphodiesterase genes of Streptomyces coelicolor[J]. Microbiology,2009,155(6):1800-1811. ( 2) 2)
|
| [20] | MCLOUGHLIN S Y,JACKSON C,LIU J W,et al.Growth of Escherichia coli coexpressing phosphotriesterase and glycerophosphodiester phosphodiesterase,using Paraoxon as the sole phosphorus source[J]. Applied and Environmental Microbiology,2004,70(1):404-412. ( 1) 1)
|
| [21] | SCHMIDL S R,OTTO A,LLUCH-SENAR M,et al.A trigger enzyme in Mycoplasma pneumoniae:impact of the glycerophosphodiesterase GlpQ on virulence and gene expression[J]. PLoS Pathogens,2011,7(9):e1002263. ( 1) 1)
|
| [22] | LIN E E C.Glycerol dissimilation and its regulation in bacteria[J]. Annual Review of Microbiology,1976,30:535-578. ( 1) 1)
|
| [23] | SCHWAN T G,BATTISTI J M,PORCELLA S F,et al.Glycerol-3-phosphate acquisition in Spirochetes:distribution and biological activity of glycerophosphodiester phosphodiesterase (GlpQ) among Borrelia species[J]. Journal of Bacteriology,2003,185(4):1346-1356. ( 2) 2)
|
| [24] | LOVERING A L,LIN L Y C,SEWELL E W,et a1.Structure of the bacterial teichoic acid polymerase TagF provides insights into membrane association and catalysis[J]. Nature Structural & Molecular Biology,2010,17(5):582-589. ( 1) 1)
|
| [25] | XIA G Q,KOHLER T,PESCHEL A.The wall teichoic acid and lipoteichoic acid polymers of Staphylococcus aureus[J]. International Journal of Medical Microbiology,2010,300(2/3):148-154. ( 1) 1)
|
| [26] | WEIDENMAIER C,PESCHEL A.Teichoic acids and related cell-wall glycopolymers in Gram-positive physiology and host interactions[J]. Nature Reviews Microbiology,2008,6(4):276-287. ( 1) 1)
|
| [27] | OKU Y,KUROKAWA K,MATSUO M,et al.Pleiotropic roles of polyglycerolphosphate synthase of lipoteichoic acid in growth of Staphylococcus aureus cells[J]. Journal of Bacteriology,2009,191(1):141-151. ( 1) 1)
|
| [28] | COT M,RAY A,GILLERON M,et al.Lipoteichoic acid in Streptomyces hygroscopicus:structural model and immunomodulatory activities[J]. PLoS One,2011,6(10):e26316. ( 1) 1)
|
| [29] | WEIDENMAIER C,KOKAI-KUN J F,KRISTIAN S A,et al.Role of teichoic acids in Staphylococcus aureus nasal colonization,a major risk factor in nosocomial infections[J]. Nature Medicine,2004,10(3):243-245. ( 2) 2)
|
| [30] | GAO Q X,WU T X,WANG J B,et al.Inhibition of bacterial adhesion to HT-29 cells by lipoteichoic acid extracted from Clostridium butyricum[J]. African Journal of Biotechnology,2011,10(39):7633-7639. ( 2) 2)
|
| [31] | 黄健.一种肺炎链球菌体磷壁酸合成相关蛋白SPD1672功能研究[D]. 硕士学位论文.重庆:重庆医科大学,2011:5. ( 1) 1)
|
| [32] | 于维军.我国动物疫病发生现状及防治中存在的问题[J]. 动物科学与动物医学,2003,20(7):1-3. ( 1) 1)
|
| [33] | 王进波,倪江,高权新,等.磷壁酸在细菌黏附、定植及免疫调节过程中的作用[J]. 动物营养学报,2013,25(9):1916-1920. ( 2) 2)
|
| [34] | BERGER-BÄCHIA B.Resistance mechanisms of gram-positive bacteria[J]. International Journal of Medical Microbiology,2002,292(1):27-35. ( 1) 1)
|




