黄芪多糖(astragalus polysaccharides,APS)是从天然中草药黄芪中提取的一种多糖,APS作为饲料添加剂能增强机体免疫功能[1],被认为是一种新型的饲料添加剂。已有研究表明,APS能够增强机体免疫细胞因子白细胞介素-1(interleukin-1,IL-1)、白细胞介素-2(IL-2)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的分泌[2, 3],进而提高机体的免疫功能。
肠黏膜是机体抵抗外源物质及微生物的重要免疫屏障[4],同时也是全身器官的“受损门户”,肠源性感染可能会导致机体多脏器功能衰竭[5]。小肠不仅是营养物质消化、吸收的场所,而且具有重要的免疫功能。十二指肠是鸡最初接触食物的肠段,其“U”形结构可以使食物在小肠停留较长时间,从而对食物进行较充分的消化吸收,同时十二指肠的这种特征也要求十二指肠要有一定的免疫结构来防御夹杂于食物中的病原菌。肠黏膜免疫是免疫系统中重要的组成部分。本试验通过对雏鸡口腔注入APS,观察其对鸡新城疫-传染性支气管炎(LaSota株+H120株)二联活疫苗免疫雏鸡十二指肠黏膜免疫球蛋白含量、黏膜免疫相关细胞数量和IL-2含量的影响,分析APS对新支二联苗免疫肉仔鸡十二指肠黏膜免疫的调节作用,为黄芪多糖作为功能性添加剂以及新药的创制提供可靠的试验依据。
1 材料与方法 1.1 试验材料1日龄爱拔益加(AA)肉仔鸡,购自下花园鸡场。APS(纯度72%),河北北方学院动物科技学院中兽医教研室制备,用去离子水稀释成不同浓度(6、4、2 mg/mL),置4 ℃冰箱中备用。鸡新城疫-传染性支气管炎(LaSota株+H120株)二联活疫苗(批号:1006004-2),山东齐鲁动物保健品有限公司生产。鸡免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)含量测定试剂盒,购自上海邦奕生物科技有限公司。鸡IL-2含量测定试剂盒,购自尚柏生物技术(北京)有限公司。
1.2 试验动物分组及处理200只1日龄AA肉仔鸡随机分为4组,每组50只,常规饲养。Ⅰ组为仅用新支二联苗免疫组,Ⅱ、Ⅲ、Ⅳ组分别为APS高、中、低剂量组。5~7日龄,Ⅱ、Ⅲ、Ⅳ组分别用钝头注射器经口注入3种不同浓度(6、4、2 mg/mL)APS,0.5 mL/只,每天1次,连用3 d,Ⅰ组灌服等量生理盐水。7日龄,每只采用鸡新支二联苗2倍量点眼滴鼻免疫,两侧眼睛和鼻孔各滴1滴。各组鸡在免疫后8、15、22日龄,随机选取10只鸡,剖杀,分离出十二指肠,挤出肠道食糜,剖开肠腔,用0.9%生理盐水轻轻冲洗除去肠壁上的内容物,滤纸吸干水分,用载玻片刮取十二指肠黏膜1.0 g左右,装入2 mL塑料安培管中,-20 ℃冷冻保存。同时,迅速剪取2段十二指肠,1段放入10%中性福尔马林溶液中固定,常规石蜡切片,厚度6 μm。另1段低温保存备检。
1.3 IgA、IgG、IgM含量测定取0.5 g(精确至0.000 1 g)肠黏膜,加入1 mL磷酸盐缓冲液(PBS,pH=7.4),冰浴条件下组织匀浆,4 000×g 4 ℃离心20 min,取上清液,按试剂盒说明书操作步骤用双抗原夹心法用酶标仪在450 nm波长处读取吸光度(OD)值,通过标准曲线计算样品中鸡IgA、IgG、IgM含量。
1.4 IL-2含量测定根据抗原抗体特异性结合的性质,选用种属特异性的IL-2酶联免疫分析试剂盒测定肠黏膜组织匀浆中细胞因子的含量:按照试剂盒说明书操作,试剂盒反应终止后,在酶标仪450 nm波长处读取OD值,利用已知浓度的标准样品OD值绘制标准曲线,据此标准曲线计算各细胞因子含量。
1.5 肠黏膜上皮内淋巴细胞(intraepithelial lymphocyte,IEL)、杯状细胞(goblet cell,GC)和肥大细胞(mast cell,MC)数量测定上皮内淋巴细胞和杯状细胞数量测定分别采用常规伊红-美蓝(HE)染色和过碘酸雪夫(PAS)染色切片,光镜下取每根肠管横断面,选5根最长且排列整齐的绒毛,计数每100个黏膜上皮柱状细胞间上皮内淋巴细胞和杯状细胞的数量;肥大细胞数量测定采用甲苯胺蓝(MTB)染色切片,光镜下计数每根肠管横断面的肠壁全层(包括黏膜及黏膜下层、肌层及浆膜层)的肥大细胞数量。
1.6 重复试验在本试验结束后,又用同样方法做了研究,检验本试验的效果,但限于文章篇幅,重复试验有关数据本文未予列出。
1.7 数据处理数据通过SPSS 13.0软件进行处理,以单因素方差分析(one-way ANOVA)进行统计学分析,数据以平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果 2.1 十二指肠黏膜免疫球蛋白含量的测定图1~图3显示,根据标准品已知系列浓度溶液的OD测定值作标准曲线,IgA、IgG、IgM曲线几乎为直线,R2均大于0.990 0,符合线性关系,可以由标准曲线计算各样品的IgA、IgG、IgM含量。
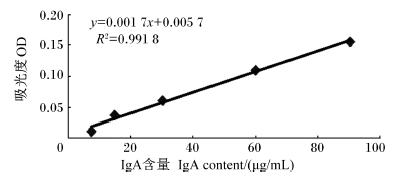 | 图1 免疫球蛋白IgA标准曲线图
Fig. 1 Standard graph of IgA |
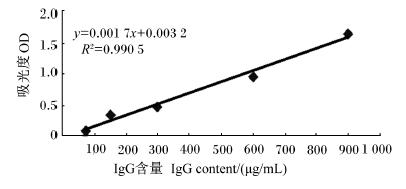 | 图2 免疫球蛋白IgG标准曲线图
Fig. 2 Standard graph of IgG |
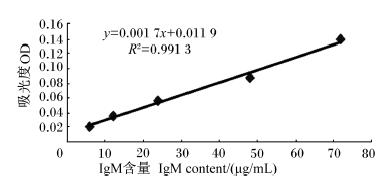 | 图3 免疫球蛋白IgM标准曲线图
Fig. 3 Standard graph of IgM |
由表1可知,8日龄时,APS各组肉仔鸡十二指肠黏膜IgA、IgG、IgM含量与对照组相比有不同程度升高,但差异不显著(P>0.05);15日龄时,高、中剂量组肉仔鸡十二指肠黏膜IgA、IgG、IgM含量均显著高于对照组(P<0.05);22日龄时,中剂量组肉仔鸡十二指肠黏膜IgG和IgM含量、高剂量组雏鸡肠黏膜IgA和IgM含量显著高于对照组(P<0.05)。
| 表1 十二指肠黏膜IgA、IgG、IgM含量
Table 1 Contents of IgA,IgG and IgM in duodenum mucosa (n=6)
|
由表2可知,各APS添加组肉仔鸡十二指肠黏膜IL-2含量相对于对照组均有不同程度的升高,且APS对肉仔鸡十二指肠黏膜IL-2含量的影响呈剂量依赖关系。8日龄时,各组肉仔鸡十二指肠黏膜IL-2含量差异不显著(P>0.05),但添加APS肉仔鸡十二指肠黏膜IL-2含量明显增加;15日龄时,在免疫后第1周,高、中剂量组与其他各组之间十二指肠黏膜中IL-2含量差异均极显著(P<0.01),且IL-2含量依给药剂量增加呈增加趋势;22日龄时,高、中剂量组与其他组比较仍保持显著差异(P<0.05)。
| 表2 十二指肠黏膜IL-2含量 Table 2 Content of IL-2 in duodenum mucosa (n=6) |
从表3可看出,8日龄时,APS使肉仔鸡十二指肠上皮内淋巴细胞、肥大细胞和杯状细胞的数量呈增加趋势,但各组间差异不显著(P>0.05);15日龄时,高、中剂量组肉仔鸡十二指肠上皮内淋巴细胞、肥大细胞和杯状细胞的数量显著或极显著高于对照组(P<0.05或P<0.01),而且高剂量组肉仔鸡十二指肠上皮内淋巴细胞和肥大细胞数量较对照组分别提高了44.18%和43.70%,差异极显著(P<0.01)。22日龄时,高、中剂量组肉仔鸡十二指肠上皮内淋巴细胞、肥大细胞和杯状细胞的数量与对照组比较仍保持显著差异(P<0.05)。
| 表3 十二指肠黏膜免疫相关细胞数量
Table 3 Numbers of mucosal immunity-associated cells in duodenum mucosa (n=6)
|
家禽肠道存在大量的淋巴样组织,构成完整而普遍的黏膜免疫系统,是机体防止感染的第1道防线[6]。十二指肠黏膜表面富含大量功能不同的免疫活性细胞,当细菌与之接触后,使肠道派伊尔结识别抗原的能力增强,同时活化了肠道相关淋巴组织和B淋巴细胞,使其转化为浆细胞。致敏的免疫细胞进入淋巴系统,经胸导管进入血液循环,逐步分化成熟,在全身免疫系统中发挥作用。成熟的免疫细胞在特异的归巢受体介导下,归巢到致敏部位的肠黏膜内,形成肠黏膜内的抗体生成细胞并分泌免疫球蛋白,从而发挥免疫效应功能[7]。免疫球蛋白是体液免疫应答中主要的免疫效应分子。家禽体内的免疫球蛋白主要IgA、IgG和IgM。本试验发现,口腔注入APS可以显著提高新支二联苗免疫肉仔鸡十二指肠黏膜IgA、IgG、IgM含量,表明APS可增强肉仔鸡肠黏膜的体液免疫反应。肠道黏膜免疫是全身免疫的重要组成部分。APS能提高肉仔鸡的免疫机能早有报道[8, 9],本试验结果进一步表明,APS能提高肉仔鸡的肠道免疫力。本试验还发现,APS高剂量组肉仔鸡肠黏膜IgG及APS中剂量组肉仔鸡十二指肠黏膜IgA和IgM含量明显高于对照组。
3.2 APS对肉仔鸡十二指肠黏膜免疫相关细胞数的影响通常情况下,肠道发挥免疫功能是通过定居在肠道内的上皮内淋巴细胞、肥大细胞和杯状细胞等免疫活性细胞的活动来完成的。
位于十二指肠黏膜上皮细胞层中的上皮内淋巴细胞,主要由T淋巴细胞构成,是肠黏膜免疫系统中最先接触抗原的免疫活性细胞,是机体黏膜免疫反应过程中极为重要的抗原呈递细胞(APCs)[10],其数量增加表明机体黏膜免疫力提高。黏膜上皮中杯状细胞主要分布于肠绒毛柱状细胞之间,杯状细胞内的黏液颗粒相互融合分泌黏蛋白,附于小肠上皮表面,有润滑和保护作用。分泌物排出后与水混合形成黏液,附着在肠黏膜表面形成“胶状屏障(gel barrier)”,与细胞膜的蛋白质和脂质牢固结合,作为肠黏膜屏障,捕获微生物,防止其他细菌入侵[11]。十二指肠上皮内淋巴细胞和杯状细胞是肠黏膜免疫细胞的重要组成部分,构成肠黏膜免疫系统的第1道防线。他们数量的变化在一定程度上可以反映消化道的免疫状况。本试验中APS显著增加新支二联苗免疫肉仔鸡十二指肠上皮内淋巴细胞和杯状细胞的数量,说明APS通过对这2种细胞的影响加强了肉仔鸡十二指肠对病原入侵的防御能力。
肥大细胞是天然免疫效应细胞之一,能够参与肠黏膜免疫调节,受到刺激活化后分泌组胺、白细胞介素等介质,引起血管反应,产生相应的免疫效应[12]。机体没有接受刺激时肥大细胞不被激活。正常组织的肥大细胞在免疫系统和神经系统之间的直接双向交流中起信息传递作用。从感觉神经末梢释放的神经肽与肥大细胞表面的特异性受体结合,激活肥大细胞,使其脱颗粒,肥大细胞释放的组胺能进一步刺激感觉神经释放更多的神经肽,从而使更多的肥大细胞脱颗粒,造成恶性循环[13]。本试验结果中,肥大细胞数量增多使神经系统和免疫系统之间的联系通路拓宽了。
此外,肥大细胞通过释放细胞因子,召集树突状细胞,并促进其成熟,加强对抗原的递呈作用。肥大细胞发挥最佳的防御效果需要依Toll样受体4(TLR4)的功能,通过释放炎症预激因子,尤其是TNF-α来介导。TLR4活化肥大细胞导致先天性免疫和获得性免疫反应[13]。本试验中,APS使肥大细胞数量增多,为肥大细胞更迅速的发挥其免疫调节功能提供物质基础。
3.3 APS对肉仔鸡十二指肠IL-2含量的影响IL-2主要由活化的T淋巴细胞和部分B淋巴细胞分泌产生,是动物体内重要的免疫活性因子之一,能诱导T淋巴细胞和B淋巴细胞分化增殖并维持T淋巴细胞在体外持续生长。IL-2在机体免疫应答、免疫调节和抗肿瘤免疫中具有重要作用。肠黏膜上皮内淋巴细胞主要为T淋巴细胞,T淋巴细胞受到抗原或有丝分裂素[如刀豆蛋白A(ConA)等]刺激后开始分泌IL-2,而IL-2又进一步促进T淋巴细胞的增殖分化,增强杀伤性T淋巴细胞的细胞毒性,诱导黏膜上皮自然杀伤细胞(NK)的增殖,参与黏膜免疫应答。IL-2的分泌水平高低可以反映机体的免疫机能,特别是细胞免疫水平[14]。本试验中APS使肉仔鸡十二指肠黏膜IL-2含量增加,提示肉仔鸡十二指肠黏膜中T淋巴细胞数量可能增加,APS对肉仔鸡十二指肠黏膜细胞免疫和体液免疫具有促进作用。这一结果与本试验发现的APS增加肉仔鸡十二指肠上皮内淋巴细胞、肥大细胞、杯状细胞等黏膜免疫相关细胞数量和IgA、IgG、IgM等免疫球蛋白含量的结果相一致。
4 总 结由此可见,APS可增强肉仔鸡十二指肠黏膜免疫功能,以6、4 mg/mL剂量最佳。
| [1] | 吕晓静,孟小宾,王小武,等.黄芪多糖的免疫作用机制研究进展[J]. 中国兽药杂志,2014(5):66-69. ( 1) 1)
|
| [2] | 孙波,陈静,吴娟,等.黄芪多糖对免疫抑制肉鸡生长性能、肠道菌群及免疫功能的影响[J]. 中国畜牧兽医,2014,41(8):101-106. ( 1) 1)
|
| [3] | 赵天章,李慧英,王志刚,等.黄芪多糖对肉仔鸡血清免疫细胞因子含量及小肠诱导型一氧化氮合成酶mRNA表达的影响[J]. 动物营养学报,2014,26(4):1011-1018. ( 1) 1)
|
| [4] | 常兰,张鹏飞,陈付菊,等.藏羚羊和藏绵羊小肠黏膜结构和黏膜免疫相关细胞的比较[J]. 中国病理生理杂志,2012,28(9):1658-1664. ( 1) 1)
|
| [5] | 朱惠玲,谢小利,刘玉兰,等.脂多糖应激对断奶仔猪肠黏膜免疫屏障的影响[J]. 中国畜牧杂志,2009,45(5):14-17. ( 1) 1)
|
| [6] | 黄其春,陈彤,郑新添,等.银杏叶提取物对肉仔鸡十二指肠黏膜免疫的调节作用[J]. 西北农林科技大学学报:自然科学版,2011,39(11):25-30. ( 1) 1)
|
| [7] | 余树民,甘梦,左之才,等.中药复方对免疫抑制模型小鼠细胞因子、免疫球蛋白及红细胞免疫黏附功能的影响[J]. 西北农林科技大学学报:自然科学版,2014,42(4):27-32. ( 1) 1)
|
| [8] | 王俊丽,章世元,徐春燕,等.黄芪多糖对肉仔鸡生产性能和部分免疫指标的影响[J]. 中国饲料,2010(7):18-21. ( 1) 1)
|
| [9] | 赵天章,李慧英.黄芪多糖对肉仔鸡生长性能和免疫功能的影响[J]. 饲料工业,2014,35(2):19-24. ( 1) 1)
|
| [10] | 吕健,李孟军.肠上皮内淋巴细胞研究进展[J]. 胃肠病学,2011,16(5):310-313. ( 1) 1)
|
| [11] | 胡艳艳,刘小伟.肠道杯状细胞结构和功能的研究进展[J]. 国际病理科学与临床杂志,2013,33(5):424-430. ( 1) 1)
|
| [12] | KALESNIKOFF J,GALLI S J.New developments in mast cell biology[J]. Nature Immunology,2008,9(11):1215-1223. ( 1) 1)
|
| [13] | 姜楠,胡易,陈耀星,等.肥大细胞在动物肠道黏膜免疫屏障中的作用[J]. 中国畜牧兽医,2011,38(8):167-170. ( 2) 2)
|
| [14] | 栾维民,杨树宝,顾玉宝,等.鸡肠相关性淋巴组织中IFN-γ和IL-2 mRNA表达的动态变化[J]. 中国兽医科学,2011,41(3):292-297. ( 1) 1)
|



