2. 上海海洋大学水产与生命学院, 上海 201306
2. College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China
云纹石斑鱼(Epinehelus moara)隶属硬骨鱼纲(Osteichthyes),辐鳍亚纲(Actinopterygii),鲈形目(Perciformes), 科(Serranidae),石斑鱼属(Epinephelus),俗称真油斑,为暖温性恋礁鱼类,广泛分布于东海、南海以及台湾沿海[1, 2]。由于其生长快,肉质鲜美,养殖前景看好,当前除福建、广东、海南等地把云纹石斑鱼被列为重点发展的养殖种类外,许多大型的工厂化循环水养殖企业也把此鱼纳入重要的养殖品种。但在高密度工厂化养殖的水体中,因残饵和鱼体排泄物的氨化作用会产生大量的氨氮[3],一定浓度的氨氮可以对鱼类产生胁迫,导致鱼体的应激反应,出现摄食量减小、生长缓慢、免疫力降低等,胁迫时间过长甚至死亡。大多数硬骨鱼类对氨氮都非常敏感,水体中氨氮浓度会导致血清皮质醇(COR)含量的激增[4],血液中葡萄糖(GLU)和乳酸(LD) 含量的升高[5, 6, 7]。氨氮也影响鱼类的机体抗氧化系统,使部分酶活力降低[8, 9],抗氧化物质含量减少。有研究表明氨氮也是诱发养殖鱼类患病的主要环境因子[10]。因此,研究血液中COR、GLU、LD含量以及各抗氧化指标对鱼类氨氮胁迫时的响应具有理论意义。
维生素E是非酶抗氧化物质中的重要组成成分,具有抗氧化作用,可以保护细胞膜、亚细胞膜不被氧化[11];在生理方面,维生素E与甲状腺机能、血红素合成以及组织内核酸代谢、抗坏血酸合成和氧化磷酸化等代谢过程都存在一定的关系[11],还可有效地增强水产动物抗拥挤胁迫[12]、抗亚硝酸盐和酸应激能力[13, 14],近年来通过在饲料中添加维生素E水平来提高水产动物的抗氧化和抗应激能力正成为研究热点。本试验通过在饲料中添加维生素E来补充非酶类的抗氧化物质,以提高云纹石斑鱼幼鱼的抗氧化和抗应激能力;并在养殖试验结束后用氨氮胁迫来验证饲料中维生素E水平对抗氧化和抗应激能力的影响,以期为云纹石斑鱼幼鱼养殖过程中饲料中维生素E的添加量提供参考依据。
1 材料与方法 1.1 试验用鱼及饲料制备云纹石斑鱼幼鱼在福建东山岛培育,幼鱼长到(15.6±0.2) g时开始试验。试验开始前在养殖池中挑选体表无伤、体色正常的云纹石斑鱼作为试验对象。
以维生素E醋酸酯(罗氏公司提供)作为维生素E添加源,以微晶纤维素为填充剂,使各试验饲料其他营养水平保持一致,其中复合维生素、复合矿物质、诱食剂参照文献[15]推荐的石斑鱼营养需求添加,略作修改。所有饲料经过60目筛,且充分混匀后用OMAS的TS-12型颗粒饲料机制成直径为2 mm的颗粒饲料,置于-20 ℃冰箱保存备用。试验饲料中的粗蛋白质、 粗脂肪、粗灰分、水分含量分别采用GB/T 6432—1994、GB/T 643—1994、GB/T 6438—1992、GB/T 6435—1986中方法进行测定,试验饲料组成及营养水平见表1。
| 表1 试验饲料组成及营养水平 Table 1 Composition and nutrient levels of experimental diets |
设5个饲料维生素E水平,即0、35、80、125和170 mg/kg,分别用A、B、C、D和E组表示。采用高效液相色谱法实测饲料中维生素E有效水平依次为11.09、47.52、91.38、134.57、178.92 mg/kg,每个维生素E水平设3个重复(网箱)。按20尾/网箱的密度将幼鱼随机放入直径1.0 m、深度0.8 m的塑料网箱中,网箱置于30 m3的圆形水泥池中。养殖试验开始前先进行14 d的适应性饲养,适应期间所有网箱中的云纹石斑鱼统一饲喂农好饲料有限公司生产的石斑鱼饲料。适应期后仍在塑料网箱中开始的正式试验。试验期间对云纹石斑鱼经行饱食投喂,具体方法为饲养试验前4周每天按照鱼体总重的3.0%投喂,后4周按鱼体总重的2.0%投喂。每天投喂2次(09:30、16:30)。试验用水经暗沉淀、砂滤处理,24 h不间断充气,水温为(27.8±0.5) ℃,pH为7.8±0.3,溶氧量7~8 mg/L,适应期和正式试验期换水量为50%/d,养殖周期为56 d。
养殖试验结束后,停止投喂饲料24 h后进行氨氮胁迫试验。参照郑乐云[16]试验中所得到的氨氮对平均体长10.5 cm斜带石斑鱼苗的24 h半致死浓度(LC50) 58.6 mg/L,设置本试验氨氮胁迫浓度为58.6 mg/L。从每个网箱中随机捞取5尾云纹石斑鱼,分别放入装有157 L清洁海水的水桶中适应1 h,然后向每个水桶中缓慢倒入用氯化铵(NH4Cl)配制好的117.2 mg/L氨氮溶液157 L,总水体达到314 L,使水体氨氮浓度达到设置浓度,6 h后胁迫结束。
1.3 样品采集在养殖试验前及氨氮胁迫前后均停食24 h,从每个网箱中随机捞取5尾鱼放入盛有0.15 mL/L丁香油溶液中短暂麻醉;氨氮胁迫结束后为避免捞取应激,直接滴入丁香油至水桶中进行短暂麻醉。将养殖试验前及氨氮胁迫前后取样的鱼麻醉后随即在准备好的冰盘上用1 mL无菌注射器尾静脉采血至无菌离心管中,4 ℃静止12 h,4 000 r/min离心15 min,取其上清液,-70 ℃保存备用,用于测定抗应激反应和抗氧化的各项指标。取血后的鱼在冰盘上解剖取肝脏,剔除其表面的结缔组织附着物,捣碎、匀浆、离心,制备上清液,置于-70 ℃保存备用。
1.4 指标测定GLU、LD和COR含量均采用南京建成生物工程研究所生产的试剂盒测定,测定方法参见说明书。
超氧化物歧化酶(SOD)、过氧化氢酶活力(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活力,总抗氧化能力(T-AOC)以及丙二醛(MDA)含量均采用南京建成生物工程研究所生产的试剂盒测定,测定方法参见说明书。
1.5 数据处理所得数据用SPSS 19软件处理。对不同维生素E水平饲喂过的幼鱼和氨氮胁迫后的幼鱼各检测指标进行单因素方差分析。当显著差异(P<0.05)时采用Duncan氏法进行多重比较;用t检测检验氨氮胁迫前后的变化;用Excel进行图形处理。数据以平均值±标准差表示。
2 结果与分析 2.1 氨氮胁迫下血清GLU含量的变化由图1可知,不同维生素E水平的饲料饲喂云纹石斑鱼幼鱼56 d后,血清中GLU含量在饲喂前后均无显著差异(P>0.05)。但氨氮胁迫6 h后,除E组外其他各组血清中GLU含量在胁迫前后均有显著差异(P<0.05),且各组中胁迫前后的差异程度差异较大,A组从胁迫前的(8.792±0.781) mmol/L上升至胁迫后的(51.390±1.358) mmol/L,B组也从胁迫前的(8.699±0.675) mmol/L上升至胁迫后的(19.110±1.285) mmol/L;而C~E组胁迫前平均为8.58 mmol/L,胁迫后平均为11.44 mmol/L。氨氮胁迫后A组血清中GLU含量达到了C~E组的4.6倍之多,B组血清中GLU含量也超过了C~E组的2.7倍,差异显著(P<0.05);而C、D和E组之间则无显著差异(P>0.05)。
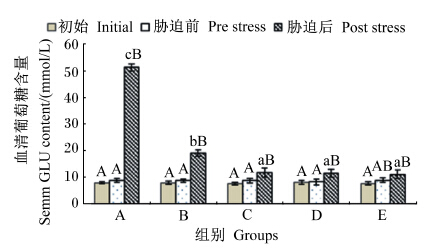 |
数据柱上方标注不同大写字母表示同组在不同时间点之间差异显著(P<0.05),不同小写字母表示同一时间点不同组之间差异显著(P<0.05)。下图同。 Above the date columns, different capital letters showed that the same group had significant difference in different time (P<0.05),while different small letters indicated that significant difference was found in different groups at the same time (P<0.05). The same as below. 图1 不同维生素E水平饲料饲喂的云纹石斑鱼 幼鱼氨氮胁迫前后血清GLU含量的变化 Fig. 1 Serum GLU content change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
由图2可知,不同维生素E水平的饲料饲喂云纹石斑鱼幼鱼56 d后,血清中LD含量在饲喂前后除C组之外均无显著差异(P>0.05)。在氨氮胁迫6 h后,A和B组血清中LD含量在胁迫前后有显著差异(P<0.05)。胁迫后血清中LD含量与饲料中维生素E水平呈反比,并在饲料中维生素E水平达到47.52 mg/kg之后血清中LD含量维持稳定。
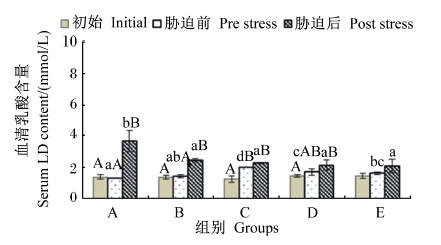 | 图2 不同维生素E水平饲料饲喂的云纹石斑鱼幼鱼氨氮胁迫前后血清LD含量的变化 Fig. 2 Serum LD content change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
由图3可知,不同维生素E水平的饲料饲喂云纹石斑鱼幼鱼56 d后,血清中COR含量比饲喂前均有升高,且都达到了显著水平(P<0.05),并随饲料中维生素E水平的升高而降低。氨氮胁迫之后,各组血清中COR含量都有升高的趋势,与胁迫前血清中COR含量的差异都达到了显著水平;氨氮胁迫之后,血清中COR含量表现为A组显著高于B~E组(P<0.05),B~E组之间无显著差异(P>0.05)。
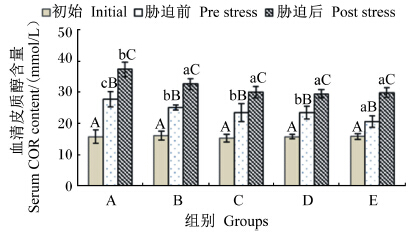 | 图3 不同维生素E水平饲料饲喂的云纹石斑鱼幼鱼氨氮胁迫前后血清COR含量的变化 Fig. 3 Serum COR content change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
由图4可知,不同维生素E水平饲料饲喂云纹石斑鱼幼鱼56 d,肝脏和血清中SOD活力除B组外均有显著差异(P<0.05),其中饲料中维生素E水平在11.09 mg/kg时肝脏和血清中SOD活力显著下降(P<0.05),而饲料中维生素E水平等于或超过91.38 mg/kg时肝脏和血清中SOD活力显著上升(P<0.05)。氨氮胁迫后除A组肝脏和血清中SOD活力均显著下降(P<0.05)外,其他各组差异均不显著(P>0.05)。结果表明,在本试验条件下,只有当饲料中维生素E水平在11.09 mg/kg时,饲喂56 d后再经氨氮胁迫,体内的SOD活力会显著下降;而当饲料中维生素E水平达到47.52 mg/kg后,饲喂56 d后再氨氮胁迫对体内的SOD活力不产生显著影响。
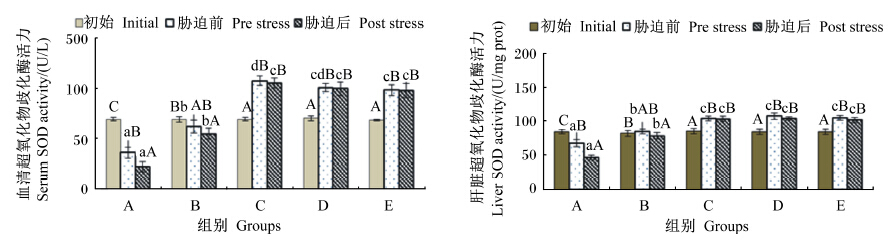 | 图4 不同维生素E水平饲料饲喂的云纹石斑鱼幼鱼氨氮胁迫前后血清和肝脏中SOD活力的变化 Fig. 4 Serum and liver SOD activity change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
由图5可知,不同维生素E水平饲料饲喂56 d后,A和B组血清中CAT活力呈显著下降(P<0.05),C~E组血清中CAT活力差异不显著(P>0.05);A组肝脏中CAT活力也显著下降(P<0.05),但C~E组则呈显著上升(P<0.05)。氨氮胁迫后A、B组血清中CAT活力变化趋势与饲喂前后的变化趋势相似,且与胁迫前差异显著(P<0.05);C~E组肝脏中CAT活力都出现下降,但无规律性变化。结果表明,低维生素E水平饲料饲喂的云纹石斑鱼幼鱼,在饲喂后和胁迫后血清中CAT活力均有下降的趋势,当饲料中维生素E水平达到91.38 mg/kg后,不论饲喂后还是胁迫后,血清中CAT活力变化都不显著。肝脏中CAT活力在低维生素E水平饲料饲喂时与血清中的结果相似,但在高维生素E水平饲料饲喂时则呈显著性上升,胁迫后出现下降。
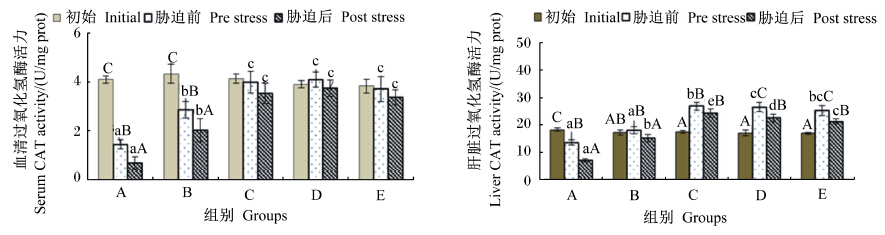 | 图5 不同维生素E水平饲料饲喂的云纹石斑鱼幼鱼氨氮胁迫前后血清和肝脏中CAT活力的变化 Fig. 5 Serum and liver CAT activity change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
由图6可知,MDA含量在血清和肝脏中都表现出相似的规律性,即饲料中维生素E水平为11.09和47.52 mg/kg时,饲喂后以及氨氮胁迫后均呈显著上升(P<0.05);饲料中维生素E水平达到91.38 mg/kg后,血清和肝脏中MDA含量在氨氮胁迫后没有产生显著变化(P>0.05)。
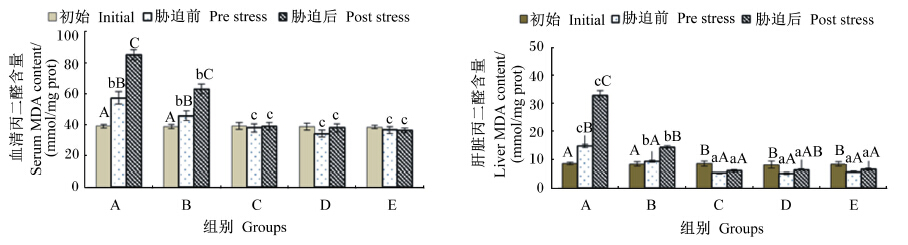 | 图6 不同维生素E水平饲料饲喂的云纹石斑鱼幼鱼氨氮胁迫前后血清和肝脏中MDA含量的变化 Fig. 6 Serum and liver MDA content change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
由图7可知,饲喂后血清中GSH-Px活力与饲料中维生素E水平为同向递增,但在饲料维生素E水平为47.52 mg/kg时出现拐点,GSH-Px活力虽然仍随饲料维生素E水平递增而增加,但各组间差异不显著(P<0.05)。在饲料维生素E水平为11.09和47.52 mg/kg时,饲喂后和氨氮胁迫后血清中GSH-Px活力均显著下降(P<0.05);而在饲料维生素E水平等于或超过91.38 mg/kg时,饲喂后血清中GSH-Px活力均有大幅度上升(P<0.05),氨氮胁迫后血清中GSH-Px活力则无显著变化(P>0.05)。
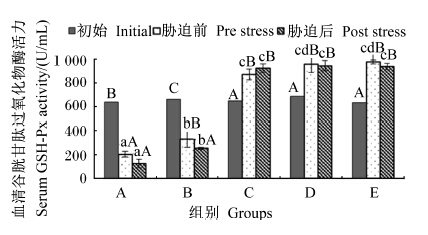 | 图7 不同维生素E水平饲料饲喂的云纹石斑鱼幼鱼氨氮胁迫前后血清GSH-Px活力的变化 Fig. 7 Serum GSH-Px activity change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
由图8可知,在饲料维生素E水平为11.09 mg/kg时,血清T-AOC在饲喂后和胁迫后均呈显著下降(P<0.05);但在饲料维生素E水平等于或超过47.52 mg/kg时,血清T-AOC在饲喂后则呈现出增高的态势,并且各组都达到显著差异(P<0.05),而氨氮胁迫后又都出现下降的趋势,其中C、D组的差异还达到显著水平(P<0.05)。
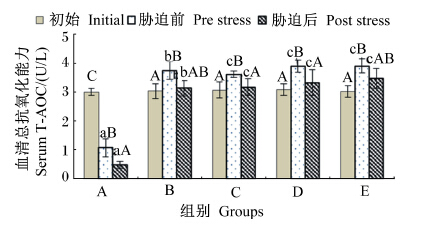 | 图8 不同维生素E水平饲料饲喂的云纹石斑鱼幼鱼氨氮胁迫前后血清T-AOC的变化 Fig. 8 Serum T-AOC change of juvenile Epinehelus moara fed diets with different vitamin E levels before and after ammonia nitrogen stress |
氨氮是指水中以游离氨(NH3)和铵离子(NH+4)形式存在的氮,其中对鱼类起危害作用主要是游离氨(非离子铵)。关于游离氨对鱼类的致毒浓度[17, 18, 19]以及毒害机理[20, 21]方面的研究已有很多报道。已有的研究认为,游离氨为亲脂性分子,能够穿透脂质性生物膜的疏水性微孔进入生物体内,从而对水生生物的鳃表皮细胞造成损伤,降低鱼的免疫力[22]。本试验中,不论在饲喂何种饲料维生素E水平饲料,受氨氮胁迫后血清COR含量与胁迫前相比均显著升高,这一现象可能说明了氨氮胁迫过程中水体中的游离氨进入机体内,使鱼产生应激反应。COR是一种由肾上腺产生的类激素,在应激反应时会大量产生,COR一般直接进入血液不被贮存,因此血液中COR含量常可作为衡量鱼所受应激强度的指标[23]。COR分泌能释放来自肝脏的GLU,在应激反应中被输送到血液里充当能量使用,由于GLU是多种组织代谢的重要能源物质,稳定的血糖浓度对维持鱼类正常生命活动有着重要的作用。研究表明,应激反应可导致鱼类血糖含量明显升高[4, 24]。从医学上说,LD是一种肌肉在供氧不足的情况下通过糖酵解产生的疲劳物质。Iversen等[5]在对大西洋鲑(Salmo salar)以及Sckreek等[24]在对大鳞大麻哈鱼(Oncorhynchus tshawytscha)的研究中都发现,环境胁迫均会导致鱼体内LD含量的升高。检测血液中的GLU、LD和COR含量可提示机体受胁迫的程度[4, 25]。本试验中,血清GLU和LD含量在胁迫前后随饲料中维生素E水平的提高差异减小,在低维生素E水平(11.09 mg/kg)饲喂条件下胁迫后的血清GLU和LD含量分别达到了胁迫前的464%和277%;而当饲料中维生素E水平达到91.38 mg/kg后,胁迫前后血清LD含量没有显著差异;血清GLU含量在维生素E水平达到178.92 mg/kg后胁迫前后才没有显著差异。这可以得出2个结论:一是不论饲料中维生素E水平多还是少,氨氮均可以引导鱼体产生应激反应;二是在本试验条件下,饲料中维生素E水平低于47.52 mg/kg时饲喂56 d后云纹石斑鱼幼鱼不能适应氨氮胁迫,而当饲料中维生素E水平大于91.38 mg/kg时,云纹石斑鱼幼鱼遭受氨氮胁迫后虽然也出现应激反应,但其程度明显低于饲料中维生素E水平低时。这可能说明了饲料中高水平的维生素E对提高云纹石斑鱼幼鱼的抗应激能力起到了一定的作用。
3.2 饲料维生素E水平对氨氮胁迫后云纹石斑鱼幼鱼抗氧化指标的影响鱼体内的抗氧化酶包括SOD、CAT和GSH-Px等,另有一类非酶类抗氧化物如维生素E、维生素C、谷胱甘肽和有机晒等,由抗氧化酶和非酶类抗氧化物共同构成抗氧化防御体系,对鱼体进行保护免受氧化伤害,同时与体内产生的活性氧物质之间达到一种平衡的状态[26]。然而,此种状态会因环境条件的改变而失去平衡,在体内形成氧化胁迫对细胞造成伤害。本试验中,当饲料中维生素E水平达到91.38 mg/kg后,饲喂56 d后可以显著提高云纹石斑鱼幼鱼血清中SOD、CAT和GSH-Px的活力,并且在氨氮胁迫后这3种抗氧化酶活力与胁迫前差异并不显著或下降幅度低于饲喂低维生素E水平饲料的A和B组。这说明了饲料中维生素E水平达到或超过91.38 mg/kg时对提高云纹石斑鱼幼鱼的抗氧化能力具有显著作用,并在本试验条件下有效地提高其抗应激能力。MDA是脂质被氧化后的终产物,机体内MDA的含量显示机体脂质受活性氧、自由基氧化损害的程度。在青鱼(Mylopharyngodon piceus)[3]、大菱鲆(Scophthalmus maximus)[27]和黄颡鱼(Pelteobagrus fulvidraco)[28]等品种的研究中均表明维生素E可以有效降低鱼体内的MDA含量,本试验的结果与上述报道相似。在饲料中维生素E水平达到或超过91.38 mg/kg时,饲喂56 d后云纹石斑鱼幼鱼血清MDA含量与饲喂前没有显著差异,而肝脏中MDA含量则显著下降。由于MDA是组织中脂质过氧化的最终产物,具有很强的细胞毒性[29],而本试验氨氮胁迫前后的血清和肝脏中MDA含量并无显著差异,可以说明饲料中维生素E水平达到或超过91.38 mg/kg能有效提高云纹石斑鱼幼鱼的抗氧化能力。
4 结 论根据应激反应和抗氧化指标对氨氮胁迫响应的综合分析,云纹石斑鱼幼鱼饲料中维生素E水平达到或超过91.38 mg/kg能有效地提高抗应激和抗氧化能力。
| [1] | 朱元鼎.东海鱼类志[M].北京:科学出版社,1963:642. ( 1) 1)
|
| [2] | 张永嘉.云纹石斑鱼淋巴囊肿病的光镜和电镜研究[J]. 海洋学报,1992,14(6):97-102. ( 1) 1)
|
| [3] | 黄云,胡毅,文华,等.维生素E对青鱼幼鱼生长、免疫及抗氨氮胁迫能力的影响[J]. 水生生物学报,2013,37(3):507-514. ( 2) 2)
|
| [4] | 彭士明,施兆鸿,李杰,等.运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J]. 水产学报,2011,35(6):831-837. ( 3) 3)
|
| [5] | IVERSEN M,FINSTAD B,MCKINLEY R S,et al.Stress responses in Atlantic salmon (Salmo salar L.) smolts during commercial well boat transports,and effects on survival after transfer to sea[J]. Aquaculture,2005,243(1/2/3/4) :373-382. ( 2) 2)
|
| [6] | OLSEN Y A,EINARSDOTTIR I E,NILSSEN K J.Metomidate anaesthesia in Atlantic salmon,Salmo salar,prevents plasma cortisol increase during stress[J]. Aquaculture,1995,134(1/2):155-168. ( 1) 1)
|
| [7] | 李爱华.拥挤胁迫对草鱼血浆皮质醇、血糖及肝脏中抗坏血酸含量的影响[J]. 水生生物学报,1997,21(4):384-386. ( 1) 1)
|
| [8] | ROMANO N,ZENG C S.Ontogenetic changes in tolerance to acute ammonia exposure and associated gill histological alterations during early juvenile development of the blue swimmer crab,Portunus pelagicus[J]. Aquaculture,2007,266(1/2/3/4):246-254. ( 1) 1)
|
| [9] | CHING B,CHEW S F,WONG W P,et al.Environmental ammonia exposure induces oxidative stress in gills and brain of Boleophthalmus boddarti (mudskipper)[J]. Aquatic Toxicology,2009,95(3):203-212. ( 1) 1)
|
| [10] | CHEN J C,CÁRDENAS E C,KOU C T.Nitrogenous excretion in Macrobrachium rosenbergii at different pH levels[J]. Aquaculture,1996,144(1/2/3):155-164. ( 1) 1)
|
| [11] | CARBALLO E C,TUAN P M,JANSSEN M,et al.Vitamin E (α-toeopherol) production by the marine microalgae Dunaliella tertiolecta and Tetraselmis suecica in batch cultivation[J]. Biomolecular Engineering,2003,20(4/5/6):139-147. ( 1) 1)
|
| [12] | 王桂芹,牛小天,卢洪梅,等.饲料中添加VE和DHA对不同养殖密度建鲤生长、摄食和分化的影响[J]. 吉林农业大学学报,2010,32(5):548-554. ( 1) 1)
|
| [13] | 高明辉.VC、VE对亚硝酸盐胁迫下异育银鲫血液指标及抗氧化能力的影响[D]. 硕士学位论文.武汉:华中农业大学,2008. ( 1) 1)
|
| [14] | 周显青,谢孟峡,牛翠娟,等.维生素C和E合用对应激和非应激中华鳖幼鳖生长、肝脏维生素C和E以及血清皮质醇含量的影响[J]. 动物学报,2004,50(2):158-164. ( 1) 1)
|
| [15] | 徐立红,陈专,徐盈,等.用高效液相色谱法测定鱼样中的维生素D3和E[J]. 水生生物学报,1994,18(2):192-193. ( 1) 1)
|
| [16] | 郑乐云.氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J]. 海洋科学,2012,36(5):81-86. ( 1) 1)
|
| [17] | 王侃,刘荭.非离子态氨及亚硝酸盐对鳜鱼苗的急性毒性试验[J]. 淡水渔业,1996,26(3):7-10. ( 1) 1)
|
| [18] | 陈瑞明.铵态氮和亚硝酸盐氮对鳜鱼苗的急性毒性试验[J]. 水利渔业,1998(1):17-20. ( 1) 1)
|
| [19] | RUYET J P L,GALLAND R,ROUX A L,et al.Chronic ammonia toxicity in juvenile turbot (Scophthalmus maximus)[J]. Aquaculture,1997,154(2):155-171. ( 1) 1)
|
| [20] | 余瑞兰,聂湘平,魏泰莉.分子氨和亚硝酸盐对鱼类的危害及其对策[J]. 中国水产科学,1999,6(3):73-77. ( 1) 1)
|
| [21] | SAMPAIO L A,WASIELESKY W,MIRAND-FILHO K C.Effect of salinity on acute toxicity of ammonia and nitrite to juvenile Mugil platanus[J]. Bulletin of Environmental Contamination and Toxicology,2002,68(5):668-674. ( 1) 1)
|
| [22] | ARMSTRONG D A,CHIPPENDALE D,KNIGHT A.W.Interaction of ionized and unionized ammonia on short-term survival and growth of prawn larvae,Macrobrachium rosenbergii[J]. Biological Bulletin,1978,154(1):15-31. ( 1) 1)
|
| [23] | HSIEH S L,CHEN Y N,KUO C M.Physiological responses,desaturase activity,and fatty acid composition in milkfish (Chanos chanos) under cold acclimation[J]. Aquaculture,2003,220(1/2/3/4):903-918. ( 1) 1)
|
| [24] | SCKREEK C B,JONSSON L,FEIST G,et al.Conditioning improves performance of juvenile chinook salmon,Oncorhynchus tshawytscha,to transportation stress[J]. Aquaculture,1995,135(1/2/3):99-110. ( 2) 2)
|
| [25] | SULIKOWSKI J A,FAIRCHILD E A,RENNELS N,et al.The effects of transport density on cortisol levels in juvenile winter flounder,Pseudopleuronectes americanus[J]. Journal of the World Aquaculture Society,2006,37(1):107-112. ( 1) 1)
|
| [26] | 亢玉静,郎明远,赵文.水生生物体内抗氧化酶及其影响因素研究进展[J]. 微生物学杂志,2013,33(3):75-80. ( 1) 1)
|
| [27] | 魏玉婷,王小洁,麦康森,等.饲料中的维生素E对大菱鲆幼鱼生长、脂肪过氧化及抗氧化能力的影响[J]. 中国海洋大学学报:自然科学版,2011,41(6):45-50. ( 1) 1)
|
| [28] | 陈骋,熊晶,左永松,等.饲料中不同维生素E添加量对黄颡鱼幼鱼生长性能及免疫功能的影响[J]. 中国水产科学,2010,17(3):521-526. ( 1) 1)
|
| [29] | PENG S,CHEN L,QIN J G,et al.Effects of dietary vitamin E supplementation on growth performance,lipid peroxidation and tissue fatty acid composition of black sea bream (Acanthopagrus schlegeli) fed oxidized fish oil[J]. Aquaculture Nutrition,2009,15(3):329-337. ( 1) 1)
|



