2. 扬州市扬大康源乳业有限公司, 扬州 225004
2. Yang Da Kang Yuan Dairy Co., Ltd., Yangzhou 225004, China
牛奶能够提供人体所需的多种氨基酸,是目前人类主要的蛋白质营养源之一[1],其产量、品质以及质量安全的研究已经成为营养学家们关注的热点[2, 3, 4]。乳汁通过奶牛的乳腺合成分泌,而合成乳汁营养的前体物质是由进入乳腺的血液提供的[5, 6]。因此,在研究产奶牛泌乳过程时,乳腺血流量的测定是必不可少的环节。产奶牛乳腺血流量的测定是原料乳合成速率、乳腺对原料乳前体物吸收速率等相关研究的前提与基础。目前,反刍动物乳腺血流量测定方法和技术虽然有电磁血流量计法、菲克原理、染料稀释法和热稀释法等多种,但迄今为止,并没有相对统一的测定技术,而且已知的研究多是以奶山羊为研究对象进行试验,比如宋移福等通过Transit-time超声血流计对奶山羊不同条件下乳腺血流量的测定及其准确性进行了评估。这在一定程度上影响了其研究结果的可比性和参考价值。为此,本文拟针对奶牛乳腺泌乳相关血管构造和血流量的测量方法作以综述,旨在为此研究方向的后续相关试验研究提供一些参考。
1 奶牛乳腺血流量与泌乳的关系血流量即血流的容积速度,是指单位时间内流经血管某一截面的血量,常以每分钟毫升数或升数表示。血流量的大小与血管两端的压力差成正比,与血管对血流的阻力成反比。血流量的测定一般分为速度流量和体积(或容积)流量2种,速度流量比较直观地表现血液的移动速度,体积流量则表示某段时间内流过血液的体积。心血管系统为密闭的管道系统,流经动脉、毛细血管和静脉各段的总截面积的血流量相等,均等于心输出量,但在并联血管的各分路,即各器官的血流量是不同的。
奶牛乳腺内的动脉由乳腺两侧的阴外动脉通入,阴外动脉位于髋关节和股关节之间的三角低洼处的中间,也就是臀中肌、股四头肌和骨阔肌膜张肌的交叉点处[7]。2条阴外动脉经由腹股沟管向下从腹腔进入乳腺区域,并分为前侧乳腺动脉和近尾乳动脉。前侧乳腺动脉通入前四分之一乳区,尾乳动脉通入后四分之一乳区。而乳房单侧的静脉血管又分为阴外静脉和腹部皮下静脉即所谓的乳静脉,其位置与乳区的动脉大致平行,而后分别延伸至后腔静脉和前腔静脉并通入右心房(图1)[8]。
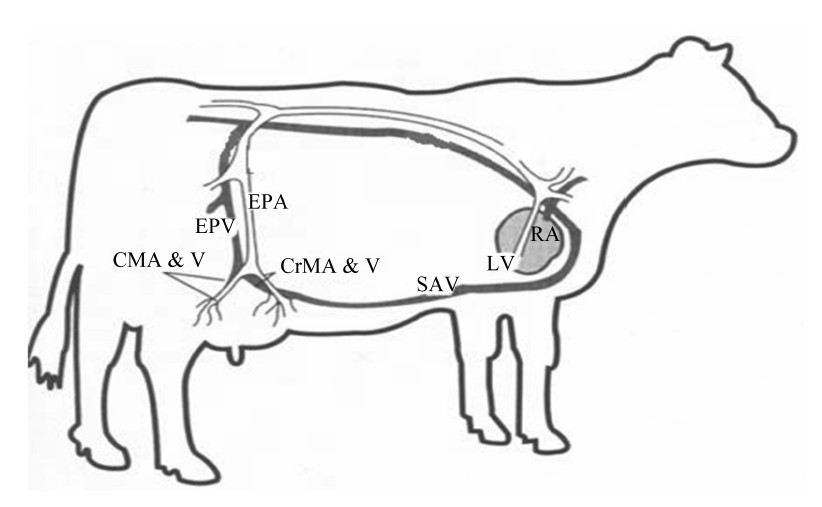 | 图1 奶牛乳腺血液循环系统
Fig. 1 Blood circulation system of the mammary gland in dairy cows |
供给乳腺的动脉血液大部分是经由乳房两侧的阴外动脉流入的,2条阴外动脉分别通入左右2个乳区,对于反刍动物尤其是泌乳期奶牛和奶山羊,乳汁中的营养物质主要是由阴外动脉中的血液供给的(图2)。然而,乳腺内的静脉血流出主要有3个方向:第1个是沿阴外静脉穿过腹股沟而上行,第2个是沿皮下腹壁静脉(乳静脉)而出,此外还有个方向是经会阴静脉,由乳房后部通入会阴部,此静脉明显小于另外2条静脉[9]。由于乳腺内的静脉有瓣膜(起阀门作用)的引导,阴外静脉是幼龄反刍动物乳腺血流唯一流出渠道,而随着动物年龄增长,瓣膜的阀门功能逐渐丧失,所以当牛羊站立时,静脉血只能向下沿乳静脉流出,其中甚至混有从阴外静脉回流的非乳腺血液。与此相似,在动物俯卧时,乳静脉闭合,血液经阴外静脉而出,其中同样可能混有非乳腺血液[10]。因此,在测定反刍动物乳腺血流量时,通常采集动物站立时阴外动脉和乳静脉的各种血液指标作为依据,获得直接或间接的结果。进行乳静脉采血时,为防止非乳腺血液从阴外静脉回流,可用手夹紧阴外静脉,但此法难以对牛操作,于是Kronfeld[11]发明以充气气球来阻塞阴外静脉的方法。
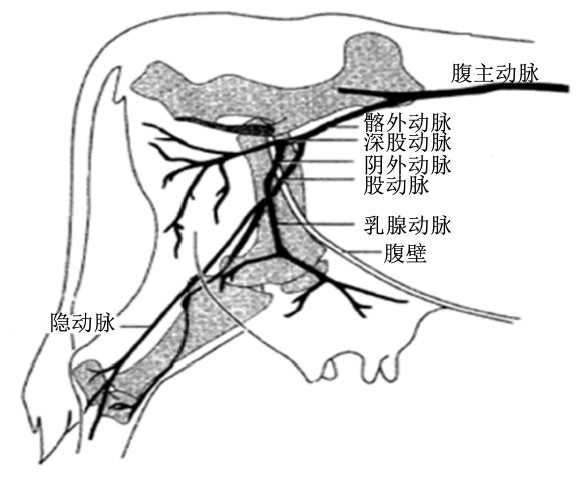 | 图2 奶牛乳腺动脉分布图 Fig. 2 Arterial supply to the mammary gland of the cow[12] |
电磁血流量计是根据法拉第电磁感应定律制造的血管内导电介质(血液)体积流量的感应式仪表。原理即是电磁感应定律,将血管暴露与磁场下,血液作为导体,切割磁感线引起磁通量的变化从而产生电动势(电压)。在磁场强度,血管直径,血液浓度不变时,此电动势与血流速度成正比。
电磁血流量计的探头分为2种:管型探头和钩形探头。其中,管型探头在使用时需切开血管以连接探头,而钩形探头可直接勾住血管,避免了血管的切割性创伤,但所选择探头的直径必须与所测血管直径相适,且接触紧密,要留出10%的间隙和气泡[13]。
Dhondt等[14]曾用电磁法对奶牛阴外动脉进行急性试验来研究乳腺血流量。而流量的校正又使电磁流量计用于长期性试验成为可能,探头每次使用前以量筒收集法进行校正,经校正后的误差可缩小至6%[15],而多次重复校正可使误差仅为2%[16]。Petters等[13]成功地用电磁流量计进行长期血流量测定试验,以此来研究产奶牛乳房内营养物质的平衡。
使用电磁血流量计能够直接读取数据,可实时测得血液的瞬时流量,适用于血液流动变化的瞬间计时,这是它的优点。其不足之处主要表现在使用前对探头需要先进行校对,施加的磁场要均匀,使用过程中要保证探头与血管的垂直,更要避免血管的扭曲、牵拉和变形。比如探头插在阴外动脉,动脉的收缩亦可产生误差影响试验结果。
2.2 多普勒超声血流计多普勒超声血流计是通过多普勒效应测量血液的流速的。利用压电晶体的压电效应产生超声波,超声发射装置为声源,血管中的红细胞为接收者,利用多普勒效应,流动中的红细胞接收到超声波时频率将发生变化,而将超声波反射后,利用压电晶体的逆压电效应,超声接收装置会接收反射回的信号,基于多普勒效应从而再测得回波的频率。一般将发射的超声波频率和接收到的回波频率之频率差称为频率偏移或频移[17]。而超声波的速率远大于血管中血细胞的流速,其频移与血流速率亦成正比。即:
△f=2·f0·v/c·cosα。
其中,△f为频移值,f0为超声波的发射频率,v为血细胞的移动速度,c为声波在介质中的速度,α为发射角[18]。
超声波的发射亦可以分为连续多普勒(连续波)和脉冲多普勒(脉冲波)2大类,常用连续和脉冲2种多普勒系统来互补性能。Dauzat等[19]通过比较脉冲多普勒和电磁血流量计2种方法测定门静脉血流量,结果表明,在用多普勒技术获取数据时需十分谨慎,且由于仪器精密,对操作技术要求甚高,其结果极易受偶然因素影响,故此方法在使用上受操作误差大和高成本的限制。
2.3 Transit-time超声血流量计Transit-time超声血流量计又称超声瞬时血流计,其原理是应用超声波压电晶体能够监测血流及血流的传播信号之时间差。Transit-time超声血流量计的探头由1个探体和1个反射镜组成,探体上有2个超声传感器呈一定角度固定于血管的一侧,而反射器则位于另一侧。
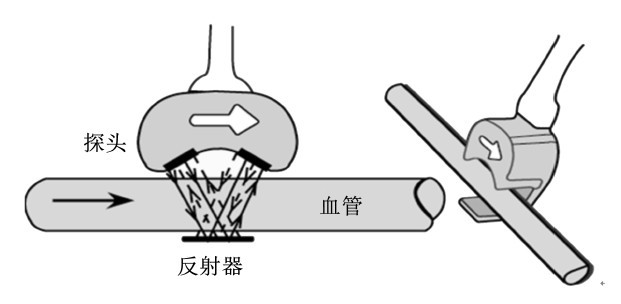 | 图3 探头安置血管示意图
Fig. 3 Blood flow probe placed in a vessel[20] |
上游的传感器发出的超声通过血管另一侧的反射镜反射并由下游的传感器接收之后再由下游的传感器发射超声由上游传感器接收,如此重复,2个传感器交替轮作。当超声波自上游发射下游接收时,声波与血流同向而行,自发射至接收的时间会因顺流而缩短,反之,逆血流的超声波传递的时间会增长。根据接收到的2次超声波时间,计算其时间差值就是体积(容量)流量的测量值即血流量。
优点:血管均匀地位于宽面超声束中,经过血管的超声波束进行积分,而之外的超声束面则不在积分范围之内,所以此方法不受血管横截面大小的影响。此外,由于发射2次超声并测其时间差,所以即使探头与血管未能相互垂直,测定结果亦不受影响。Transit-time超声血流量计具有对血管尺寸的不依赖性和探头角度的不敏感性的优点,使其可用于正在生长的血管、收缩的血管和静脉束;其缺点是此法仍带有一定的创伤性,另外,早期的Transit-time超声血流量计在测量低流量时误差较大。Forsberg等[21]和Westra等[22]分别有研究表明,在测量低流量(<150 mL/min)时误差可达21%~25%,然而此误差在后来的仪器改进中已被逐渐减小。
Transit-time超声血流量计目前已得到了学者的普遍使用。例如,Rigout等[23]研究了以草料和青贮料为基础饲粮的奶牛十二指肠灌注葡萄糖对整个机体和乳腺利用血糖的影响,以超声血流量计检测乳腺血流量发现灌注后比正常值提升了45%。随后Rulquin等[24]在研究灌注葡萄糖对奶牛乳腺中氨基酸循环的影响时,也使用同样的方法对乳腺血流量进行测定。Delamaire等[25]对挤奶间隔的延长降低乳腺血流量与乳腺对营养物质的摄取的研究中更直观地显示了对乳腺血流量的需要,通过超声血流量计检测,表明挤乳间隔时间越长,与将会导致乳腺营养吸收下降的关系越密切,而不是与乳腺将这些养分转化为牛奶成份的效率降低有关。乳腺对营养物质吸收的降低,是由于乳腺血流量减少而产生的。
2.4 菲克原理法菲克原理可描述为在单位时间内通过垂直于扩散方向的单位截面积的扩散物质流量与该截面积处浓度梯度成正比。将此原理应用于乳腺血流量的测定时,以血液中某物质的动静脉浓度差作为开始扩散的前体物质浓度,该物质在乳汁中的浓度则被视为沿扩散方向扩散后的浓度。故以乳汁中某物质的浓度除以血液中该物质的动静脉浓度差的方法常用来估测乳腺血流量,因此,此法需要分别采集阴外动脉血和乳腺静脉血为样本。
Mepham[26]以苯丙氨酸(Phe)和酪氨酸(Tyr)为内标分别测出2种氨基酸在动静脉血和乳汁中的浓度并以此估算乳腺血流量。Cant等[27]将此方法进行了修正后得出以下公式:
乳腺血流量(L/d)=0.965×FYB/FYA-V。
其中,FYB(mol/d)=乳中(Phe+Tyr)浓度(mol/L)×产奶量(L/d);FYA-V(mol/d)=动脉血中(Phe+Tyr)浓度(mol/L)-静脉血中(Phe+Tyr)浓度(mol/L)。
这种方法一般被称为氨基酸动静脉浓度差法。
除此之外,以一定量的指示剂注入血管中再测其稀释后的浓度从而测得血流量均是以菲克原理为基础的方法。常用的有染料稀释法、乳房甲硫氨酸吸收法和同位素扩散法等。染料稀释法近年来普遍选用对氨基马尿酸(PAH)作为指示剂。一般是将PAH注入动脉(或静脉)后,以恒定的速度连续静脉(或动脉)采血,再用分光光度计测出染料浓度,绘制浓度稀释曲线。Katz等[28]研究发现,PAH完全不被肝清除,而在循环至肾时由肾清除,部分PAH由动脉再循环至肝,因此在测量奶牛乳腺血流量时,有3种灌注PAH和采血的方法:颈静脉灌注,颈动脉和乳静脉采血;乳静脉灌注,乳静脉下游和颈动脉采血;阴外动脉灌注,阴外动脉下游和乳静脉采血。孙满吉对此3种方法进行比较试验,研究发现使用颈静脉灌注PAH测得的血流量偏低,而由阴外动脉灌注,阴外动脉下游和乳静脉采血的方法较为科学。
以菲克原理测定奶牛的乳腺血流量,避免了其他血流量计的成本问题以及使用时需要对奶牛进行手术植入仪器的限制,因此在操作非常方便,应用广泛,但其准确性却并未得到公认的赞同[29]。Pacheco-Rios等[30]比较了氨基酸动静脉浓度差法和同位素(氚化水)扩散法,发现以氚化水为指示剂估测出的血流量与产乳量的比值为395,而Phe+Tyr动静脉浓度差估测得出的血流量与产乳量比值为602,属正常范围450~900之内。因此氨基酸动静脉浓度差法估测乳腺血流量较氚化水法更近似于真实值。
2.5 热稀释法Fegler[31, 32]热稀释法也叫温差稀释法或温度稀释法,将低温的溶液(生理盐水或等渗葡萄糖)注入血液中,测定温度的局部变化:将带有热敏电阻的导管插入乳腺静脉下游,向导管内注入低温溶液后,热敏电阻测量溶液入血后温度的变化情况,即可记录下温度稀释曲线。热稀释法注射的指示剂完全属于生理溶液,无再循环,对生理机能几乎没有影响,不会有染料在体内蓄积之顾虑,故而短时间可重复测定。但此方法仍具有创伤性,另外热敏电阻对低温的敏感性要求注入的溶液温度越低电阻越敏感,但低温又会受室温的影响使得误差较大。所以现在一般的建议是指示剂采用室温的生理盐水且同时加大用量。然而,由于清醒动物的中心静脉压可能受到外来因素影响的缘故,此法测得数据准确性不高,且过程冗长耗时,为此经过改进的连续热稀释法已克服了这些缺点。
Linzell等[10]以连续热稀释法对奶山羊进行试验,将乳静脉环状剥离出体内,以便安置热敏电阻和阻断血管与组织的热交换,用室温下生理盐水在20~60 s内匀速连续地注入乳静脉,同时血液的温度变化被热敏电阻测得并连续地记录在纸上。如此,即时测量血液温度的降低可使血流量计算更迅速,而连续的记录则更加便于估测平均血流量。试验所得数据分别与单独注射热稀释、菲克原理估测法和量筒收集法的结果进行比较,证明了其精确性与上述3种方法均一致。
值得注意的是,由于前面提到的关于乳腺内静脉血的流向问题——反刍动物从出生到首次泌乳,血液只由阴外静脉流出而不通过乳静脉,故热稀释法在此无法使用。但针对母畜生育后的非哺乳期,以连续热稀释法测定此时较低的乳腺血流量却具有较高的准确性。
2.6 其他方法除上述方法之外,还有放射性微球法、核磁共振法、彩色多普勒流量测定法和彩色血流流速流量测定法等可用于测量血流量。
用放射性微球来测量血流量优点是快速且结果误差小,但其明显缺陷就是具有创伤性,若测器官血流量则需要处死并解剖动物,只能一次性试验,无法对动物进行后续的研究。因此,放射性微球法对于奶牛乳腺泌乳量以及营养调控等研究缺乏实际意义。
核磁共振法的原理是血液流过正负梯度变化的磁场时产生累加的相位位移,此位移与血液流动的速度成正比,相位位移在图像上显示为像素信号强度的变化而被记录下来[33];彩色多普勒法需使用安装有VP软件的彩色多普勒超声诊断仪[34],而彩色血流流速流量测定法则需依靠安装有CVIQ软件的彩色超声仪和线阵探头[35],这3种仪器测量血流量的准确性较高,且都属于无创性方法;但都由于设备成本的原因,加上操作过程要求复杂、精细,存在诸多局限性,目前较多是在临床医学诊断上使用而非用于动物生产性试验,所以在此亦不多作赘述。
3 小 结随着国内外先进技术的发展和测量仪器设备的不断升级,早期曾一度较多使用的一些测血流量的方法比如量筒收集法和气泡血流计等已不再适用于目前的科学研究之中;现在电磁血流量计和多普勒超声波血流量计现应用比较广,使用这2种仪器可测得奶牛乳腺血流的速度流量,即通过读数能直接观测到血流速度的瞬时变化;而Transit-time超声血流量计则是测定血液的体积流量,由于其容易校准且是目前最为精确的血流量测定设备,被公认为当今血流量计的“黄金标准”。但是一些地区由于经济条件的影响,以上各种设备的使用和普及受到很大程度的限制,所以基于菲克原理的各种方法在奶牛乳腺血流量的研究中使用仍较为普遍。然而菲克原理法又因为具体操作方法多种多样,人工操作随机性大,且受奶牛的生理习性和应激的影响,具有一定的局限性。因此,奶牛乳腺血流量测定时可根据具体的研究方向、研究目的、试验设计来选取合适的测定方法。
| [1] | JACHNIK P.Regionalization vs.globalization of the world dairy economy:conflict or complementarity?[J]. Advances in Dairy Technology,2004,16:93-99. ( 1) 1)
|
| [2] | HARVATINE K J,ALLEN M S.The effect of production level on feed intake,milk yield,and endocrine responses to two fatty acid supplements in lactating cows[J]. Journal of Dairy Science,2005,88(11):4018-4027. ( 1) 1)
|
| [3] | PURDIE N G,TROUT D R,CIESLAR S R L,et al.The effect of short-term hyperammonaemia on milk synthesis in dairy cows[J]. Journal of Dairy Research,2009,76(1):49-58. ( 1) 1)
|
| [4] | WANG M Z,XU B L,WANG H R,et al.Effects of arginine concentration on the in vitro expression of casein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J]. PLoS One,2014,9(5):e95985. ( 1) 1)
|
| [5] | BAUMAN D E,MATHER I H,WALL R J,et al.Major advances associated with the biosynthesis of milk[J]. Journal of Dairy Science,2006,89(4):1235-1243. ( 1) 1)
|
| [6] | HURLEY W L.Lactation biology[J/OL].University of Illinois,Urbana-Champaign,2007.http://classes.ansci.uniuc.edu/ansc438/. ( 1) 1)
|
| [7] | 周子明,周立欣.阴部外动脉注药治疗奶牛急性乳房炎的体会[J]. 畜牧兽医科技信息,2009(2):47. ( 1) 1)
|
| [8] | 张兴夫.不同日粮模式对泌乳奶牛乳腺乳蛋白合成影响的研究[D]. 博士学位论文.呼和浩特:内蒙古农业大学,2013. ( 1) 1)
|
| [9] | LINZELL J L.Valvular incompetence in the venous drainage of the udder[J]. The Journal of Physiology,1960,153(3):481-491. ( 1) 1)
|
| [10] | LINZELL J L,FLEET I R.Measurement of venous flow by continuous thermodilution and its application to measurement of mammary blood flow in the goat[J]. Circulation Research,1966,18(6):745-754. ( 2) 2)
|
| [11] | KRONFELD D S.Biosynthesis of milk constituents at lactogenesis[M]//REYNOLDS M,FOLLEY S J,eds.Lactogenesis:the Initiation of Milk Secretion at Parturition. Philadelphia:University of Pennsylvania Press,1969:109-120. ( 1) 1)
|
| [12] | MAAS J A,CANT J P,MCBRIDE B W,et al.Method for close arterial infusion of the lactating mammary gland[J]. Canadian Journal of Animal Science,1995,75(3):345-349. ( 1) 1)
|
| [13] | PEETERS G,HOUVENAGHEL A,ROETS E,et al.Electromagnetic blood flow recording and balance of nutrients in the udder of lactating cows[J]. Journal of Animal Science,1979,48(5):1143-1153. ( 2) 2)
|
| [14] | DHONDT G,HOUVENAGHEL A,PEETERS G,et al.Influence of vasoactive hormones on blood flow through the mammary artery in lactating cows[J]. Archives Internationales de Pharmacodynamie et de Thérapie,1973,204(1):89-104. ( 1) 1)
|
| [15] | HUET P M,LAVOIE P,VIALLET A.Simultaneous estimation of hepatic and portal blood flows by an indicator dilution technique[J]. Journal of Laboratory and Clinical Medicine,1973,82(5):836-846. ( 1) 1)
|
| [16] | TERANAKA M,SCHENK W G.Hepatic blood flow measurement.A comparison of the indocyanine green and electromagnetic techniques normal and abnormal flow states in the dog[J]. Annals of Surgery,1977,185(1):58-63. ( 1) 1)
|
| [17] | 盖立平,王桂莲.多普勒超声血流仪测量血流速机理的模拟设计[J]. 医疗卫生装备,2006,27(9):80-81. ( 1) 1)
|
| [18] | 包玉生.冠状动脉血流的测量方法[J]. 国外医学:生物医学工程分册,1997,20(4):219-222. ( 1) 1)
|
| [19] | DAUZAT M,LAYRARGUES G P.Portal vein blood flow measurements using pulsed Doppler and electromagnetic flowmetry in dogs:a comparative study[J]. Gastroenterology,1989,96(3):913-919. ( 1) 1)
|
| [20] | 傅莹.限制性必需氨基酸对奶山羊泌乳性能及其乳腺氨基酸代谢的影响[D]. 硕士学位论文.泰安:山东农业大学,2011. ( 1) 1)
|
| [21] | FORSBERG F,LIU J B,RUSSELL K M,et al.Volume flow estimation using time domain correlation and ultrasonic flowmetry[J]. Ultrasound in Medicine & Biology,1995,21(8):1037-1045. ( 1) 1)
|
| [22] | WESTRA S J,LEVY D J,CHALOUPKA J C,et al.Carotid artery volume flow:in vivo measurement with time-domain-processing US[J]. Radiology,1997,202(3):725-729. ( 1) 1)
|
| [23] | RIGOUT S,LEMOSQUET S,VAN EYS J E,et al.Duodenal glucose increases glucose fluxes and lactose synthesis in grass silage-fed dairy cows[J]. Journal of Dairy Science,2002,85(3):595-606. ( 1) 1)
|
| [24] | RULQUIN H,RIGOUT S,LEMOSQUET S,et al.Infusion of glucose directs circulating amino acids to the mammary gland in well-fed dairy cows[J]. Journal of Dairy Science,2004,87(2):340-349. ( 1) 1)
|
| [25] | DELAMAIRE E,GUINARD-FLAMENT J.Increasing milking intervals decreases the mammary blood flow and mammary uptake of nutrients in dairy cows[J]. Journal of Dairy Science,2006,89(9):3439-3446. ( 1) 1)
|
| [26] | MEPHAM T B.Amino acid utilization by lactating mammary gland[J]. Journal of Dairy Science,1982,65(2):287-298. ( 1) 1)
|
| [27] | CANT J P,DEPETERS E J,Baldwin R L.Mammary amino acid utilization in dairy cows fed fat and its relationship to milk protein depression[J]. Journal of Dairy Science,1993,76(3):762-774. ( 1) 1)
|
| [28] | KATZ M L,BERGMAN E N.Simultaneous measurements of hepatic and portal venous blood flow in the sheep and dog[J]. American Journal of Physiology,1969,216(4):946-952. ( 1) 1)
|
| [29] | HANIGAN M D,CALVERT C C,DEPETERE E J,et al.Whole blood and plasma amino acid uptakes by lactating bovine mammary glands[J]. Journal of Dairy Science,1991,74(8):2484-2490. ( 1) 1)
|
| [30] | PACHECO-RIOS D,MACKENZIE D D S,MCNABB W C.Comparison of two variants of the Fick principle for estimation of mammary blood flow in dairy cows fed two levels of dry matter intake[J]. Canadian Journal of Animal Science,2001,81(1):57-63. ( 1) 1)
|
| [31] | FEGLER G.Measurement of cardiac output in anaesthetized animals by a thermo-dilution method[J]. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences,1954,39(3):153-164. ( 1) 1)
|
| [32] | FEGLER G.The reliability of the thermodilution method for determination of the cardiac output and the blood flow in central veins[J]. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences,1957,42(3):254-266. ( 1) 1)
|
| [33] | 汪君红,丁祖荣.无创伤性血流测量[J]. 医用生物力学,2003,18(4):244-249. ( 1) 1)
|
| [34] | 殷晓煜,黄洁夫.运用彩色多普勒流速剖面图测定血流量的实验研究[J]. 中国超声医学杂志,1997,13(12):4-6. ( 1) 1)
|
| [35] | 徐智章.超声流速及流量测定[J]. 上海医学影像,1996(2):84. ( 1) 1)
|




