2. 北京市营养源研究所, 水产动物系统营养研究开放实验室, 北京 100000
2. Laboratory of Aquatic Animal Nutrition Research System, Beijing Research Institute for Nutritional resources, Beijing 100000, China
油脂作为重要的能量来源而广泛应用于水产动物配合饲料中,其丰富的不饱和脂肪酸是鱼类生长发育所必需的[1]。研究发现,脂类对淡水鱼的营养价值很大程度上取决于多不饱和脂肪酸(PUFA)的种类和数量,尤其是亚麻酸、亚油酸、二十二碳四烯酸(EPA)和二十二碳六烯酸(DHA)等,饲料中少量添加就可以明显提高鱼类生长速度[2, 3, 4],而鱼油则富含这些多不饱和脂肪酸。但大量不饱和脂肪酸,在光照、温度和氧等因素的影响下会被氧化酸败,进而产生大量氢过氧化物、醛、醇、酮以及酯类和多聚体等物质损害动物的生产性能及健康[5]。洪平等[6]饲喂鲤(Cyprinus carpio)氧化酸败的饲料后发现其生长速度下降,肌肉营养不良,死亡率上升。 鱼(Seriola quinqueradiata)摄食氧化的饲料后,其肝脏中维生素E含量下降[7]。饲喂氧化油脂会导致罗非鱼(Oreochromis niloticus)生长速度显著下降,肝胰脏出现明显病变[8]。因此,饲料油脂显示出营养作用和氧化产物的副作用2个方面的作用。
草鱼(Ctenopharyngodon idellus)作为我国四大家鱼之一,深受广大消费者喜爱。近年来随着草鱼养殖业的迅速发展,其疾病多、难控制、易造成大量死亡的问题也越来越突出[9],饲料营养、安全与鱼体健康的关系是值得研究的重要课题。而饲料质量的重点之一便是对油脂营养质量和安全质量的控制。本试验以豆油为对照,主要研究氧化鱼油对草鱼生长速度、饲料效率的营养作用与氧化产物的副作用,及对肌肉脂肪酸组成的影响,为饲料中油脂营养作用研究、饲料油脂质量的控制提供参考。
1 材料与方法 1.1 试验动物试验用草鱼来源于浙江一星饲料有限公司养殖基地,为池塘培育的1冬龄鱼种共350尾,平均体重为(74.82±1.49) g。草鱼随机分为5组,每组 设3个重复,每个重复20尾,分组后剩余草鱼用于养殖前期取样分析。
1.2 试验饲料以酪蛋白和秘鲁蒸汽鱼粉为主要蛋白质源,采用等氮等能方案设计试验饲料,共配制含6%豆油(6S组)、6%鱼油(6F组)、2%氧化鱼油+4%豆油(2OF组)、4%氧化鱼油+2%豆油(4OF组)、6%氧化鱼油(6OF组)的5种半纯化饲料,其组成及营养水平见表1。各组试验饲料粗蛋白质含量为29.52%~30.55%,组间无显著差异(P>0.05);各组试验饲料总能值为19.94~20.86 MJ/kg,组间无显著差异(P>0.05)。
饲料原料粉碎过60目筛,用绞肉机制成直径1.5 mm的长条状,切成1.5 mm×2.0 mm的颗粒状,风干。饲料置于-20 ℃冰柜保存备用。
| 表1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验用豆油为“福临门”牌一级大豆油,鱼油来源于广东省良种引进服务公司生产的“高美牌”精炼海水鱼油,氧化鱼油参考文献[10]的方法制备,分别测定了3种油脂的过氧化值(POV)、酸价(AV)、丙二醛(MDA)含量,并计算试验饲料中POV、AV、MDA含量(饲料中AV、POV、MDA含量测定尚无有效方法,故采用油脂测定结果的计算值),结果见表2。
| 表2 试验饲料中POV、AV及MDA含量分析结果 Table 2 Analytical results for POV,AV and MDA content in experimental diets |
由表2可知,本试验中使用的鱼油有一定程度的氧化,由于其在饲料中比例为6%,而氧化鱼油组是由氧化鱼油和豆油按比例混合作为脂肪源,所以6F组的实际POV比2OF组高12.25%, 而AV则比2OF和4OF组分别高出100.0%和3.90%。
各组试验饲料中脂肪酸组成见表3。
| 表3 试验饲料中脂肪酸组成(干物质基础) Table 3 Fatty acid composition of experimental diets (DM basis) |
由表3可知,各试验饲料中,与6S组相比,6F组饱和脂肪酸(SFA)含量高118.8%,单不饱和脂肪酸(MUFA)含量高47.5%,PUFA含量低45.7%,但PUFA中EPA和DHA含量6F组分别比6S组高146.5%、329%;而2OF、4OF及6OF组中随着氧化鱼油含量的增加,SFA及MUFA含量也增加,PUFA含量下降。
1.3 饲养管理养殖试验在浙江一星饲料有限公司试验基地进行。在5个面积为667 m2(平均水深1.8 m)的池塘中设置网箱,网箱规格为1.0 m×1.5 m×2.0 m。将各组试验草鱼以重复为单位随机分配到15个网箱中。
分别用试验饲料驯化1周后,开始正式投喂,每天07:00、16:00定时投喂,投饲率为4%,每10 d依据投饲量估算鱼体增重并调整投饲率,记录每天投饲量。正式试验共养殖72 d。
每周测定水质1次,试验期间溶解氧浓度>8.0 mg/L,pH 7.8~8.4,氨氮浓度<0.2 mg/L,亚硝酸盐浓度<0.01 mg/L,硫化物浓度<0.05 mg/L。
养殖期间水温25~33 ℃,水温日变化见图1。
 | 图1 养殖期间水温日变化趋势
Fig. 1 Diurnal variation trend of water temperature during culture period |
养殖72 d后,禁食24 h,分别捞取各网箱草鱼虑水后称重,并记录尾数,用于生长速度计算;统计各组草鱼增重量和投喂饲料量,计算饲料系数。相关计算公式如下:
特定生长率(specific growth rate,SGR,%/d)=
100×(ln终末体重-ln初始体重)/饲养天数;
饲料系数(feed conversion ratio,FCR)=饲料
摄入量/(终末体重-初始体重);
蛋白质沉积率(protein retention rate,PRR,%)=
100×全鱼增重×鱼体粗蛋白质含量/(摄入饲料
总重×饲料粗蛋白质含量);
脂肪沉积率(lipid retention rate,LRR,%)=100×
全鱼增重×鱼体粗脂肪含量/(摄入饲料总重×
饲料粗脂肪含量)。
随机从每个网箱内取2尾鱼作为全鱼样品。采集鱼体侧线鳞以上肌肉(不含红色肉)于-20 ℃冰箱保存,用于肌肉脂肪酸组成测定。
1.5 指标分析方法饲料原料及所有试验鱼样品均在冷冻干燥机(北京四环科学仪器厂LGJ-18B型)中干燥至恒 重,然后进行营养成分测定。采用凯氏定氮法测 定粗蛋白质含量,索氏抽提法测定粗脂肪含量;总能值使用上海吉昌公司XRY-1型氧弹仪,采用燃烧能测定方法测定。
饲料及肌肉脂肪酸组成的测定采用氯仿-甲醇方法,样品在4 ℃冰箱浸提24 h后,离心、蒸发溶剂得到肌肉脂肪后参照GB 9695.2—88,采用GC-14C型气相色谱仪(日本岛津公司)测定各脂肪酸含量,脂肪酸组成采用归一法定量,以百分比(%)表示。气相色谱条件:色谱柱为J&W气相色谱柱(30 m×0.25 mm×0.25 μm);氢火焰离子检测器(FID);FID 270 ℃;柱温采用程序升温,80(3 min)~240 ℃(5 ℃/min);载气为高纯氮气;分流比为60 ∶ 1;进样量为3 μL。
POV测定参照GB/T 5538—2005;AV测定参照GB/T 5530—2005;MDA含量采用南京建成生物工程研究所生产的试剂盒测定。
1.6 数据处理试验结果用SPSS 21.0软件进行统计分析,采用平均值±标准差(mean±SD)表示,在单因素方差分析的基础上,采用Duncan氏法多重比较检验组间差异显著性,以P<0.05表示差异显著。
2 结果与分析 2.1 饲料中氧化鱼油对草鱼生长性能的影响由表4可知,相对于6S组,无论添加鱼油还 是氧化鱼油,草鱼的SGR都出现了不同程度的下 降,下降率为5.81%~11.50%,且差异均达显著水平(P<0.05)。在添加鱼油和氧化鱼油的各组间,除6OF组的SGR较其他组显著下降(P<0.05)外,6F、2OF及4OF组之间差异不显著(P>0.05)。
| 表4 饲料氧化鱼油对草鱼SGR的影响 Table 4 Effects of oxidized fish oil on SGR of grass carp |
由表5可知,相对于6S组,添加鱼油或氧化鱼油后草鱼的FCR都出现不同程度的上升,上升率为8.64%~17.28%,且差异均达显著水平(P<0.05)。在添加鱼油和氧化鱼油的各组间,除6OF组FCR较其他组显著下降(P<0.05)外,6F、2OF及4OF组之间差异不显著(P>0.05)。PRR以6S组最大,6OF组最小,且2组与其他组的差异均达显著水平(P<0.05)。6F、2OF及4OF组的LRR较6S组显著下降(P<0.05),但6OF组较其他4组显著升高(P<0.05)。
| 表5 氧化鱼油对草鱼饲料效率的影响 Table 5 Effects of oxidized fish oil on feed efficiency of grass carp |
不同组草鱼的SGR、FCR与饲料PUFA含量进行回归分析,以幂函数回归方程相关性最强,结果见图2、图3。
由图2可知,草鱼SGR(y)与饲料PUFA含量(x)呈幂函数正相关关系,其回归方程为y=0.973 9x0.135 1,R2=0.741 9。结果显示,随着饲料中PUFA含量的增加,草鱼的SGR增加,表明饲料中PUFA对促进草鱼的生长具有正向作用。
由图3可知,FCR(y)饲料PUFA含量(x)呈幂函数负相关关系,其回归方程为y=3.487 3x-0.182,R2=0.711 4。结果显示,随着饲料中PUFA含量的增加,草鱼的FCR减少,表明饲料中PUFA对降低草鱼FCR具有很好的促进作用。
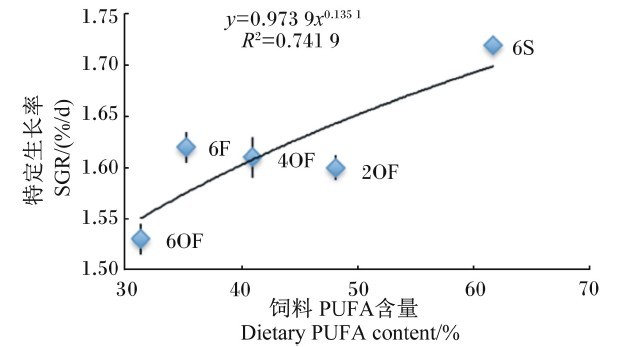 | 图2 SGR与饲料PUFA含量的关系 Fig. 2 Relationship between SGR and dietary PUFA content |
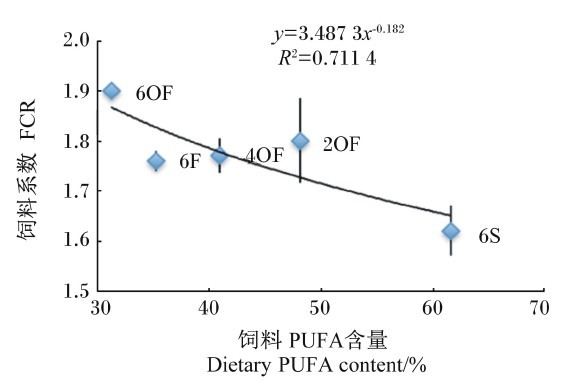 | 图3 FCR与饲料PUFA含量的关系 Fig. 3 Relationship between FCR and dietary PUFA content |
将不同组草鱼的SGR、FCR与饲料POV、AV及MDA含量进行回归分析,以幂函数回归方程相关性最强,结果见图4至图9。
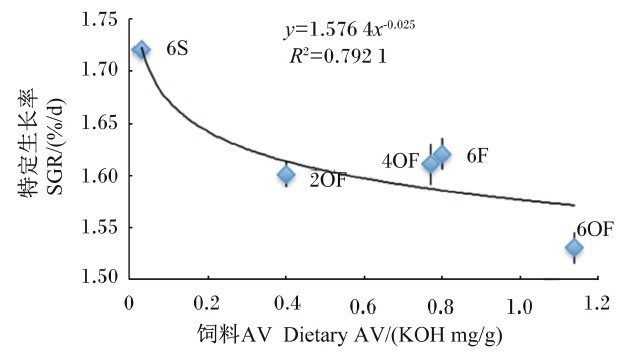 | 图4 SGR与饲料AV的关系 Fig. 4 Relationship between SGR and dietary AV |
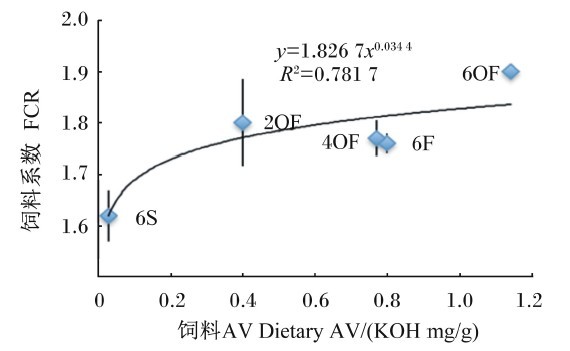 | 图5 FCR与饲料AV的关系 Fig. 5 Relationship between FCR and dietary AV |
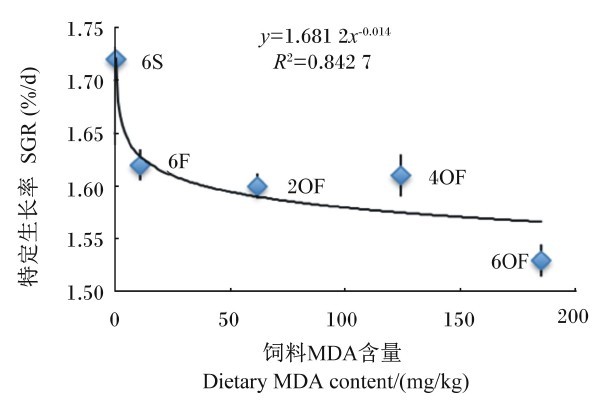 | 图6 SGR与饲料MDA含量的关系 Fig. 6 Relationship between SGR and dietary MDA content |
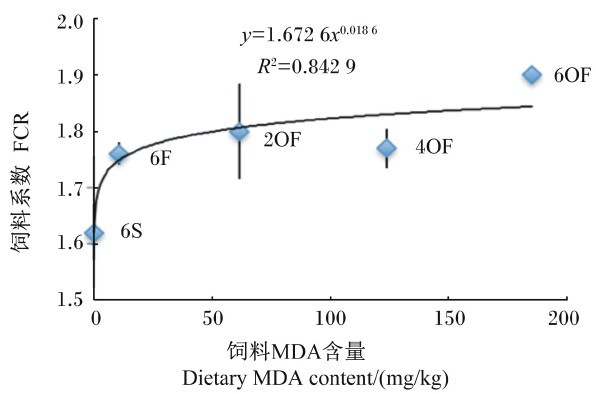 | 图7 FCR与饲料MDA含量的关系 Fig. 7 Relationship between FCR and dietary MDA content |
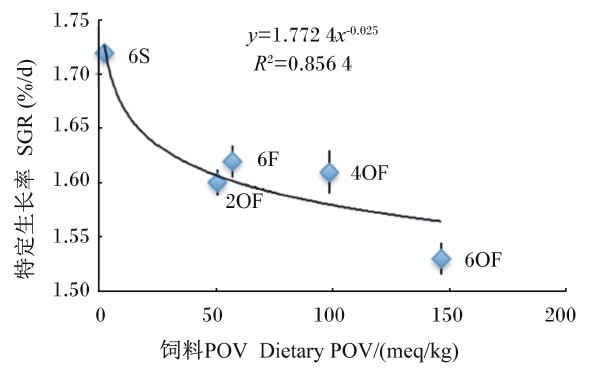 | 图8 SGR与饲料POV的关系 Fig. 8 Relationship between SGR and dietary POV |
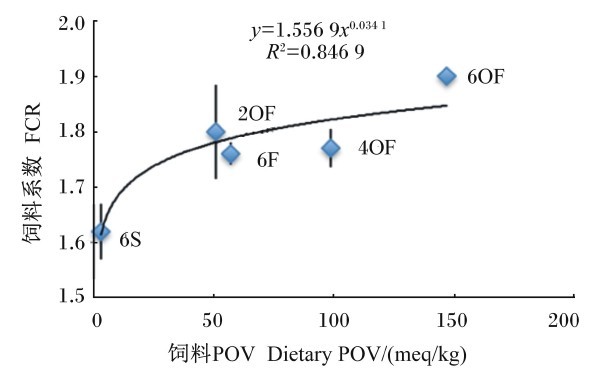 | 图9 FCR与饲料POV的关系 Fig. 9 Relationship between FCR and dietary POV |
由图4可知,SGR(y)与饲料AV(x)呈幂函数负相关关系,其回归方程为y=1.576 4x-0.025,R2=0.792 1。由图6可知,SGR(y)与饲料MDA含量(x)呈幂函数负相关关系,其回归方程为y=1.681 2x-0.014,R2=0.842 7。由图8可知,SGR(y)与饲料POV(x)呈幂函数负相关关系,其回归方程为y=1.783x-0.025,R2=0.856 4。结果显示,随着饲料POV、AV及MDA含量的上升,草鱼SGR减少,表明饲料POV、AV及MDA含量对草鱼的生长具有减缓作用,其中饲料POV及MDA含量的影响较AV大。
由图5可知,FCR(y)与饲料AV(x)呈幂函数正相关关系,其回归方程为y=1.826 7x0.034 4,R2=0.781 7。由图7可知,FCR(y)与饲料MDA含量(x)呈幂函数正相关关系,其回归方程为y=1.672 6x0.018 6,R2=0.842 9。由图9可知,FCR(y)与饲料POV(x)呈幂函数正相关关系,其回归方程为y=1.544 3x0.034 1,R2=0.846 9。结果显示,随着饲料POV、AV及MDA含量的上升,草鱼FCR增加,表明饲料POV、AV及MDA含量会降低草鱼的饲料效率,其中饲料POV及MDA含量的影响较AV值大。
2.3 饲料中氧化鱼油对草鱼肌肉脂肪酸组成的影响由表6可知,与6S组相比,添加鱼油或氧化鱼油后,草鱼肌肉中SFA和MUFA含量均增加,而PUFA含量则下降。由表7可知,各组草鱼肌肉中SFA、MUFA、PUFA及n-6脂肪酸含量均与饲料中相应脂肪酸含量表现出较大的相关性,相关系数为0.97~1.00;除6S组肌肉中n-3 脂肪酸含量与饲料中n-3脂肪酸含量为正相关(相关系数为0.53)外,其余各组均为负相关,相关系数为-0.81~-0.28。这说明添加鱼油或氧化鱼油后肌肉中n-3脂肪酸含量与饲料中n-3脂肪酸含量呈负相关关系,n-3脂肪酸的代谢受到了很大的影响。
| 表6 各组草鱼肌肉脂肪酸组成(干物质基础) Table 6 Fatty acid composition in muscle of grass carp in different groups (DM basis) |
| 表7 各组草鱼肌肉中SFA、MUFA、PUFA及n-3、n-6脂肪酸含量与饲料中相应脂肪酸含量的相关系数 Table 7 Correlation coefficients between SFA,MUFA,PUFA,n-3 and n-6 fatty acids contents in muscle of grass carp and dietary corresponding fatty acid contents |
饲料油脂的营养作用主要为提供饲料能量、必需脂肪酸等,而油脂氧化产物对动物具有毒副作用[1]。因此,饲料油脂对于养殖动物显示出营养与毒副作用的两面性。对于一种具体油脂而言,其营养作用与其能值大小、不饱和脂肪酸组成和含量相关,
而其毒副作用则与其氧化程度如POV、AV、MDA含量等相关[11]。鱼油与豆油相比较,其不饱和脂肪酸含量,尤其是PUFA如EPA、DHA等含量较高,但也更容易氧化酸败,其氧化产物对养殖动物的毒副作用也更大[12]。本试验结果很好地显示了鱼油的营养作用和氧化产物毒副作用的两面性,且氧化产物的毒副作用显著影响了草鱼的生长速度和饲料效率。
高淳仁等[13]在用添加不同氧化程度的氧化鱼油的饲料饲喂真鲷后发现其增重率随饲料中POV的升高而呈线性下降。刘伟[14]在鲤鱼上也发现了同样的规律,但任泽林等[15]在鲤鱼上得到的结果是,氧化鱼油降低鲤鱼生产性能,但这一降低趋势与鱼油氧化程度升高无相关性,并认为这可能是由于氧化鱼油中氧化产物在试验期间发生降解从而引起试验各组间实际的氧化程度差距减少所致。虽然POV常用来反映油脂氧化程度,但其随着油脂氧化程度的加深是呈现先上升后下降的变化趋势,因此单一考虑POV这一指标来评价氧化油脂对动物的影响是不科学的,氧化油脂对动物的影响应该是众多有效成分共同作用的结果。
AV作为评价油脂氧化程度的重要指标之一,其主要反映油脂中游离脂肪酸及其他酸性物质的含量。MDA含量作为油脂氧化终产物之一,其常作为评价氧化油脂毒性的指标。而PUFA作为油脂中重要营养成分,其含量高低常作为油脂营养价值的评价指标。本试验结果显示,饲料中POV、AV、MDA含量及PUFA含量与草鱼SGR和FCR均呈幂函数相关关系。6F组相比2OF组,其饲料中PUFA含量降低26.7%,AV、POV分别提高100%、12.25%,MDA含量减少82.4%,但2OF组草鱼的SGR与6F组没有显著差异,还有一定下降,这可能是因为2OF组饲料中高MDA含量对草鱼机体造成的损害大于其他因素的影响造成的。根据幂函数的特性,当POV和MDA含量从较少的2.89 meq/kg、0.18 mg/kg升高到较高的57.09 meq/kg、10.82 mg/kg时,它们对草鱼生长的影响比较显著,而再升高到98.84 meq/kg、123.92 mg/kg时其影响就相对不显著,这可能是为什么6F、2OF和4OF组之间SGR没有显著差异的原因,也有可能是因为饲料中POV、AV、MDA含量对草鱼造成的负面影响与PUFA造成的正面影响相抵消,其具体原因有待进一步研究。
上述结果显示,氧化油脂对动物生长的影响应该综合饲料中 氧化产物和营养物质,并且过氧化物及MDA对草鱼生长性能的影响随着它们含量的上升而下降,两者对草鱼的损伤有待进一步研究。
3.2 草鱼饲料效率与饲料油脂质量的相关性本试验中,添加氧化鱼油后草鱼生长性能下降,这与大西洋鳕鱼(Gadus morhua)[16]、鲤鱼(Cyprinus carpio)[17]、大西洋比目鱼(Hippoglossus hippoglossus)[18]、真鲷(Pagrus major)[19]、非洲鲶鱼(Clarias gariepinus)[20]、金头鲷(Sparus aurata)[21]等在摄食氧化油脂后的结果相一致。在添加鱼油或氧化鱼油后草鱼PRR出现不同程度的下降,说明油脂中的有害物质对鱼体蛋白质的合成造成了干扰,从而降低其生长性能。研究表明氧化油脂对动物生长性能的影响可能是油脂氧化产物使肌肉蛋白质发生交联造成的[22, 23]。6F、2OF、4OF组的LRR较6S组显著下降,但6OF组的LRR显著高于其他组。黄凯等[8]用氧化油脂饲喂奥尼罗非鱼后发现其肝胰脏脂肪含量随氧化油脂含量的上升而先上升后下降,他认为下降的原因是大剂量的氧化产物使肝胰脏受损从而影响脂肪在体内的正常代谢,而导致脂肪大量沉积。这说明油脂氧化产物会干扰草鱼脂肪正常代谢,但低氧化程度的油脂会引起草鱼应激,从而使其肝胰脏代偿性增生而代谢一定量的氧化产物,而高氧化程度的油脂其氧化产物含量超出草鱼耐受范围后,会对肝胰脏造成损伤,使肝胰脏代谢脂肪能力下降,从而导致脂肪在草鱼体内大量沉积。Gao等[24]用氧化鱼油和维生素E饲喂真鲷后发现,无维生素E组全鱼脂肪含量显著上升,而添加维生素E组下则降,说明氧化鱼油会影响鱼体的脂肪代谢;同时,他认为维生素E增强了真鲷的抵抗力且在一定程度上降低了氧化油脂的毒性,从而减少了油脂氧化产物对肝胰脏脂肪代谢功能的影响。
上述结果显示,鱼油的氧化产物会使草鱼的生长速度下降,使鱼体内蛋白质沉积下降,且饲料中含较低氧化程度鱼油会使草鱼代谢脂肪能力增加,而含高氧化程度鱼油则会扰乱鱼体脂肪代谢导致脂肪在体内大量沉积。
3.3 饲料中氧化鱼油对草鱼肌肉脂肪酸组成的影响一般认为鱼类组织中脂肪酸的组成很大程度上决定于饲料中脂肪酸的组成[25, 26]。本试验结果显示,与6S组相比,添加鱼油或氧化鱼油后会增加了草鱼肌肉中SFA和MUFA的含量,降低了PUFA含量。但4OF、6OF组肌肉中EPA、DHA的含量高于6F、2OF组,这与高淳仁等[13]、Gao等[24]、Baker等[20, 27]的结果不一致。一般认为,PUFA尤其是EPA、DHA容易被脂质过氧化物所氧化从而降低其在肌肉中的含量。然而,一些研究得出和本试验相一致的结果,Kestemont等[28]在饲喂鲈鱼(Perca fluviatilis)含氧化油脂的饲料后发现其肌肉中DHA含量上升,他认为相对较高的DHA含量可能是短链和中链脂肪酸作为维护机体的原料被优先利用的结果,而不是在不饱和脂肪酸中的绝对含量的增加,并且发现DHA含量相对较高的组的鱼体重相对较低。
这也有可能是与鱼类肌肉细胞膜上含有丰富的PUFA有关,并且DHA的含量高于EPA的含量[29, 30],这与本试验结果相一致。而DHA在肌肉中拥有更高的比例说明它具有重要的功能,肌肉对其表现出更多的选择性保留。Zhong等[30]在大西洋鳕鱼上已经证明,肌肉中高含量的DHA与其抵御氧化油脂中氧化产物的能力有关。
相关性分析结果显示,添加鱼油或氧化鱼油组的草鱼肌肉中n-3脂肪酸含量与饲料中n-3脂肪酸含量呈负相关。这可能是由于氧化鱼油增加了草鱼对了n-3脂肪酸的需求来抵御氧化产物对机体造成的损伤,并且和大部分淡水鱼一样,草鱼可以利用饲料中的α-C18 ∶ 3n-3来合成自身所必需的PUFA[31, 32]。此外,结果显示,氧化鱼油会增加草鱼肌肉中PUFA的含量,这可能与PUFA能增强机体抗氧化和直接抵御氧化物质的能力有关。
4 结 论① 鱼油在提供饲料不饱和脂肪酸的同时,其氧化产物对草鱼生长的副作用也较为显著,饲料中适宜的油脂含量、脂肪酸组成以及无或很低含量的氧化产物对草鱼生长速度、饲料效率具有很好的促进作用。
② 鱼油的氧化产物会导致草鱼生长速度、饲料效率、蛋白质利用率的下降,但会增加草鱼肌肉中PUFA的含量。
③ 综合考虑饲料中油脂氧化产物及其营养物质对草鱼的影响,在实际生产中可以配合使用豆油和鱼油来减少因鱼油氧化产生的氧化产物对水产动物生长性能的影响。
| [1] | 张红娟,刘玉梅,刘海燕,等.油脂氧化对水产动物的危害及其预防对策[J]. 饲料研究,2013(7):68-71. ( 2) 2)
|
| [2] | 王裕玉,杨雨虹.水生生物对高不饱和脂肪酸的营养需求[J]. 中国饲料,2008(18):31-33. ( 1) 1)
|
| [3] | 刘镜恪,雷霁霖.人工调节轮虫n-3 HUFA对黑鲷仔鱼生长、存活的影响[J]. 科学通报,1997,42(12):1330-1333. ( 1) 1)
|
| [4] | WATANABE T,OHTA M,KITAJIMA C,et al.Improvement of dietary value of brine shrimp Artemia salina for fish larvae by feeding them on omega 3 highly unsaturated fatty acids[J]. Bulletin of the Japanese Society of Scientific Fisheries,1982,48(12):1775-1782. ( 1) 1)
|
| [5] | 姚仕彬,叶元土,李洁,等.鱼油在氧化过程中氧化指标及其脂肪酸组成的变化[J]. 饲料研究,2012(6):74-76. ( 1) 1)
|
| [6] | 洪平.影响水产饲料品质之非配方因素-鱼虾营养研究进展[J]. 中山大学出版社,1995:397-399. ( 1) 1)
|
| [7] | PARK S I.Nutritional liver disease of cultured yellowtail,Seriola quinqueradiata,caused by feed deficiency[J]. Bulletin of the Korean Fisheries Society,1978,11(1):1-4. ( 1) 1)
|
| [8] | 黄凯,阮栋俭,战歌,等.氧化油脂对奥尼罗非鱼生长和抗氧化性能的影响[J]. 淡水渔业,2006,36(6):21-24. ( 2) 2)
|
| [9] | 张春雨.池塘草鱼病害的发生与防治[J]. 现代农业科技,2008(22):240,242. ( 1) 1)
|
| [10] | 殷永风,叶元土,蔡春芳,等.在自制氧化装置中氧化时间对豆油氧化指标的影响[J]. 安徽农业科学,2011,39(7):4052-4054. ( 1) 1)
|
| [11] | 王凤红.肉仔鸡饲用油脂营养价值的评定[D]. 硕士学位论文.北京:中国农业科学院,2009. ( 1) 1)
|
| [12] | 任泽林,范志影,霍启光,等.氧化鱼油营养价值评定[J]. 饲料广角,2003(13):33-36. ( 1) 1)
|
| [13] | 高淳仁,雷霁霖.饲料中氧化鱼油对真鲷幼鱼生长、存活及脂肪酸组成的影响[J]. 上海水产大学学报,1999,8(2):124-130. ( 2) 2)
|
| [14] | 刘伟.饲料添加氧化油脂对鲤体内脂质过氧化及血液指标的影响[J]. 中国水产科学,1997,4(1):94-96. ( 1) 1)
|
| [15] | 任泽林,霍启光,曾虹,等.氧化鱼油对鲤鱼生产性能和肌肉组织结构的影响[J]. 动物营养学报,2001,13(1):59-64. ( 1) 1)
|
| [16] | ZHONG Y,LALL S P,SHAHIDI F.Effects of oxidized dietary oil and vitamin E supplementation on lipid profile and oxidation of muscle and liver of juvenile Atlantic cod (Gadus morhua)[J]. Journal of Agricultural and Food Chemistry,2007,55(15):6379-6386. ( 1) 1)
|
| [17] | 叶仕根,汪开毓,何显荣.鲤摄食含氧化鱼油的饲料后其病理学的变化[J]. 大连水产学院学报,2006,21(1):1-6. ( 1) 1)
|
| [18] | LEWIS-MCCREA L M,LALL S P.Effects of phosphorus and vitamin C deficiency,vitamin A toxicity,and lipid peroxidation on skeletal abnormalities in Atlantic halibut (Hippoglossus hippoglossus)[J]. Journal of Applied Ichthyology,2010,26(2):334-343. ( 1) 1)
|
| [19] | GAO J,KOSHIO S,ISHIKAWA M,et al.Effect of dietary oxidized fish oil and vitamin C supplementation on growth performance and reduction of oxidative stress in red sea bream Pagrus major[J]. Aquaculture Nutrition,2013,19(1):35-44. ( 1) 1)
|
| [20] | BAKER R T M.The effects of dietary α-tocopherol and oxidised lipid on post-thaw drip from catfish muscle[J]. Animal Feed Science and Technology,1997,65(1/2/3/4):35-43. ( 2) 2)
|
| [21] | MOURENTE G,DÍAZ-SALVAGO E,BELL J G,et al.Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil:attenuation by dietary vitamin E[J]. Aquaculture,2002,214(1/2/3/4):343-361. ( 1) 1)
|
| [22] | CHIO K S,TAPPEL A L.Synthesis and characterization of the fluorescent products derived from malonaldehyde and amino acids[J]. Biochemistry,1969,8(7):2821-2827. ( 1) 1)
|
| [23] | CHIBA H,YOSHIKAWA M.Deterioration of casein components by malonaldehyde[J]. Agricultural and Biological Chemistry,1976,40:1001-1010. ( 1) 1)
|
| [24] | GAO J,KOSHIO S,ISHIKAWA M,et al.Effects of dietary oxidized fish oil with vitamin E supplementation on growth performance and reduction of lipid peroxidation in tissues and blood of red sea bream Pagrus major[J]. Aquaculture,2012,356/357:73-79. ( 2) 2)
|
| [25] | FRANCIS D S,TURCHINI G M,JONES P L,et al.Growth performance,feed efficiency and fatty acid composition of juvenile Murray cod,Maccullochella peelii peelii,fed graded levels of canola and linseed oil[J]. Aquaculture Nutrition,2007,13(5):335-350. ( 1) 1)
|
| [26] | SARGENT J R,TOCHER D R,BELL J G.Fish nutrition[M]. 3rd.New York:Academic Press,2003:181-257. ( 1) 1)
|
| [27] | BAKER R T M,DAVIES S J.Increased production of docosahexaenoic acid (22:6n-3,DHA) in catfish nutritionally stressed by the feeding of oxidized oils and the modulatory effect of dietary α-tocopheryl acetate[J]. Journal of Fish Biology,1996,49(4):748-752. ( 1) 1)
|
| [28] | KESTEMONT P,VANDELOISE E,MÉLARD C,et al.Growth and nutritional status of Eurasian perch Perca fluviatilis fed graded levels of dietary lipids with or without added ethoxyquin[J]. Aquaculture,2001,203(1):85-99. ( 1) 1)
|
| [29] | SHAHIDI F,CADWALLADER K R,CALDWALLADER K.Flavor and lipid chemistry of seafoods[J]. Washington,D.C.:American Chemical Society,1997. ( 1) 1)
|
| [30] | ZHONG Y,LALL S P,SHAHIDI F.Effects of dietary oxidized oil and vitamin E on the growth,blood parameters and body composition of juvenile Atlantic cod Gadus morhua (Linnaeus 1758)[J]. Aquaculture Research,2008,39(15):1647-1657. ( 2) 2)
|
| [31] | CAI Z,CURTIS L R.Effects of diet on consumption, growth and fatty acid composition in young grass carp[J]. Aquaculture,1989,81(1):47-60. ( 1) 1)
|
| [32] | CAO J M,LIU Y J,LAO C L,et al.Effect of dietary fatty acids on tissue lipid content and fatty acid composition of grass carp[J]. Acta Zoonurimenta Sinica,1997,9:36-44. ( 1) 1)
|




