2. 云南省畜牧兽医科学院, 昆明 650224
2. Yunnan Animal Science and Veterinary Institute, Kunming 650224, China
高黎贡山猪是我国云南省特有的山地放牧型小型猪种,主要分布在高黎贡山平均海拔2 300 m(987~3 980 m)的地区,具有耐粗饲、抗逆性强、贮脂能力强等特性,是我国珍稀的优良地方猪种[1]。而杜洛克猪生产性能优秀,主要表现为生长速度快、胴体瘦肉率及饲料转化率高,已成为主要生产猪种杂交组合的终端父本,因此本研究选用杜洛克猪与高黎贡山猪进行比较。已有研究表明,猪能消化粗纤维,粗纤维是猪饲粮中不可缺少的部分。优质适量的纤维具有提高猪的生产性能、增强猪的健康、维持胃肠道的微生态平衡、调控仔猪消化道的发育等作用。但关于粗纤维水平对金属硫蛋白1(metallothionein 1,MT1)、急性期蛋白(acute phase proteins,APPs)基因表达的影响还鲜见报道。APPs作为一项能反映动物健康状态及潜在病变的灵敏指标逐渐得到研究和发展。MT1具有抗氧化效应,是动物生理健康的重要标识之一。Varel等[2]报道纤维可以减少消化道溃疡的形成,有利于仔猪肠道健康;Urriola等[3]研究表明中国本地猪较培育猪对纤维有更高的消化能力;Hedemann等[4]研究报道可溶性纤维可抑制致病,更好的保护仔猪肠道;Hermes等[5]试验证明纤维有利于提高断奶仔猪的生产性能,对肠道微生物的定植也有重大意义。在不同饲粮纤维水平下高黎贡山猪、杜洛克猪是否能保持各自的生产特性?不同纤维水平饲粮在影响肠道健康的同时可能引起金属硫蛋白(MTs)和APPs的分泌量发生改变,这是否会对仔猪的健康产生影响?鉴于此,本试验通过研究不同纤维水平饲粮对高黎贡山仔猪、杜洛克仔猪小肠形态学的影响,探索不同纤维水平饲粮对仔猪小肠黏膜MT1和组织APPs mRNA表达的影响,旨在为开发利用高黎贡山猪种资源提供科学依据。
1 材料与方法 1.1 试验动物与试验设计选择35日龄健康的高黎贡山断奶仔猪、杜洛克断奶仔猪各24头(公母各占1/2)为研究对象,试验设对照组和试验组,饲粮纤维水平分别为3.53%和7.04%。每组12个重复,每个重复1头猪,饲养至60日龄,试验期为25 d。
1.2 饲粮配制和饲养管理参照NRC(2012)猪营养需要推荐量配制试验饲粮,试验饲粮组成及营养水平见表1。
试验猪饲喂时间在每天的08:00、12:00、16:00和20:00左右,每次喂料量以料槽中有少量余料为宜,自由饮水。猪舍温度控制在25~28 ℃,舍内相对湿度在65%~70%。
1.3 测定指标与方法1.3.1 生产性能测定
测定试验开始和结束时各组仔猪的体重和采食量,计算日增重、日采食量、料重比。
1.3.2 小肠形态学观察试验结束后,屠宰对照组和试验组仔猪各24头,迅速采集十二指肠、空肠和回肠,参照陈恒灿等[6]方法进行前处理后观察小肠形态学变化。
| 表1 试验饲粮组成及营养水平(风干基础)
Table 1 Composition and nutrient levels of experimental diets (air-dry basis)
|
对屠宰的48头断奶仔猪,迅速采集肝脏、胰脏、脾脏、肾脏、十二指肠、空肠、回肠7种组织,-80 ℃速冻,用于检测MT1、C-反应蛋白(C-reactive protein,CRP)、触珠蛋白(haptoglobin,HP)、α1-酸性糖蛋白(α1-acid glycoprotein,AGP)和血清淀粉样蛋白A(serum amyloid-A,SAA) mRNA相对表达量。6个基因引物设计采用Primer Express Software。各基因引物序列见表2。
| 表2 实时荧光定量PCR引物
Table 2 Primers for real-time qPCR
|
小肠组织的MT1以β-肌动蛋白(β-actin)为内参基因进行相对定量,APPs均是以18S rRNA、甘油醛-3-磷酸脱氢酶(GAPDH)和β-actin共同为内参基因进行相对定量,相对定量计算方法采用Pfaffl[7]的方法,结果以mRNA相对表达量表示。
1.4 数据处理与分析
所有数据均采用Excel 2003进行整理,采用SPSS 17.0统计软件进行统计处理,组间数据采用Duncan氏法进行多重比较,结果用平均值±标准差表示。
2 结 果 2.1 生产性能由表3可见,饲粮纤维水平为7.04%时,高黎贡山仔猪的日增重极显著高于杜洛克仔猪(P<0.01),日采食量显著高于杜洛克仔猪(P<0.05),料重比显著低于杜洛克仔猪(P<0.05)。饲粮纤维水平为3.53%时,高黎贡山仔猪的日增重极显著低于杜洛克仔猪(P<0.01),料重比显著高于杜洛克仔猪(P<0.05)。杜洛克仔猪饲粮纤维水平为3.53%时,日增重极显著高于其饲粮纤维水平为7.04%(P<0.01),料重比显著低于其饲粮纤维水平为7.04%(P<0.05),日采食量差异不显著(P>0.05)。高黎贡山仔猪饲粮纤维水平为3.53%时,日增重极显著低于其饲粮纤维水平为7.04%(P<0.01),日采食量显著低于其饲粮纤维水平为7.04%时(P<0.05),料重比显著高于其饲粮纤维水平为7.04%(P<0.05)。
| 表3 不同纤维水平饲粮对仔猪生产性能的影响 Table 3 Effects of different levels of dietary fiber on performance of piglets |
由表4可见,饲粮纤维水平为7.04%时,高黎贡山仔猪十二指肠、空肠、回肠的绒毛长度极显著大于杜洛克仔猪(P<0.01);十二指肠、空肠隐窝深度极显著低于杜洛克仔猪(P<0.01);十二指肠、空肠、回肠绒毛长度/隐窝深度极显著大于杜洛克仔猪(P<0.01)。饲粮纤维水平为3.53%时,高黎贡山仔猪十二指肠、空肠、回肠的绒毛长度极显著小于杜洛克仔猪(P<0.01);十二指肠、空肠隐窝深度极显著高于杜洛克仔猪(P<0.01);十二指肠、空肠、回肠绒毛长度/隐窝深度极显著小于杜洛克仔猪(P<0.01)。高黎贡山仔猪饲粮纤维水平为7.04%时,十二指肠、空肠、回肠的绒毛长度极显著大于其饲粮纤维水平为3.53%时(P<0.01);十二指肠、空肠、回肠隐窝深度极显著低于其饲粮纤维水平为3.53%时(P<0.01);十二指肠、空肠、回肠 绒毛长度/隐窝深度极显著大于其饲粮纤维水平 为3.53%时(P<0.01)。杜洛克仔猪饲粮纤维水平为7.04%时,十二指肠、空肠、回肠的绒毛长度极显著小于其饲粮纤维水平为3.53%时(P<0.01);十二指肠、空肠、回肠隐窝深度极显著高于其饲粮纤维水平为3.53%时(P<0.01);十二指肠、空肠、回肠绒毛长度/隐窝深度极显著小于其饲粮纤维水平为3.53%时(P<0.01)。
| 表4 不同纤维水平饲粮对仔猪小肠形态学的影响
Table 4 Effects of different levels of dietary fiber on intestinal morphology of piglets
|
不同纤维水平饲粮对仔猪小肠黏膜MT1 mRNA相对表达量的影响如图1所示。各组仔猪的MT1 mRNA相对表达量在十二指肠均极显著高于空肠和回肠(P<0.01)。在十二指肠中,高黎贡山仔猪饲粮纤维水平为7.04%时,MT1 mRNA相对表达量极显著高于其他3组(P<0.01);杜洛克仔猪在饲粮纤维水平为7.04%时MT1 mRNA相对表达量极显著高于饲粮纤维水平为3.53%时(P<0.01)。在空肠中,饲粮纤维水平为7.04%时,高黎贡山仔猪与杜洛克仔猪之间MT1 mRNA相对表达量差异不显著(P>0.05);饲粮纤维水平为3.53%时,高黎贡山仔猪MT1 mRNA相对表达量极显著高于杜洛克仔猪(P<0.01); 高黎贡山仔猪与杜洛克仔猪在饲粮纤维水平为7.04%时MT1 mRNA相对表达量极显著高于饲粮纤维水平为3.53%时(P<0.01);在回肠中,高黎贡山仔猪饲粮纤维水平为7.04%时,MT1 mRNA相对表达量极显著高于其他3组(P<0.01),其他3组间差异不显著(P>0.05)。
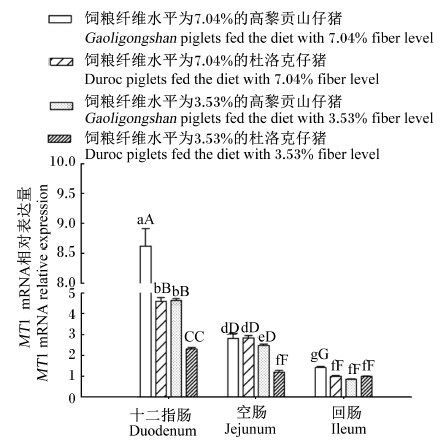 | 数据柱标注不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。下图同。 图1 仔猪小肠黏膜中MT1 mRNA表达趋势 Fig. 1xpression trend of MT1 mRNA in intestinal mucosa of piglets |
CRP mRNA表达差异(图2):CRP mRNA相对表达量在胰脏最高,极显著高于其他组织(P<0.01)。饲粮纤维水平为7.04%时,高黎贡山仔猪肝脏、脾脏、胰腺、空肠CRP mRNA相对表达量极显著高于同饲粮纤维水平时的杜洛克仔猪(P<0.01)。饲粮纤维水平为3.53%时,高黎贡山仔猪脾脏、肾脏、胰腺、空肠、回肠CRP mRNA相对表达量极显著高于饲粮纤维水平为7.04%及3.53%时的杜洛克仔猪(P<0.01),极显著低于饲粮纤维水平为7.04%时的高黎贡山仔猪(P<0.01)。在肾脏中,饲粮纤维水平为3.53%时的高黎贡山仔猪CRP mRNA相对表达量最高。在十二指肠中,饲粮纤维水平为7.04%的杜洛克仔猪CRP mRNA相对表达量最高。
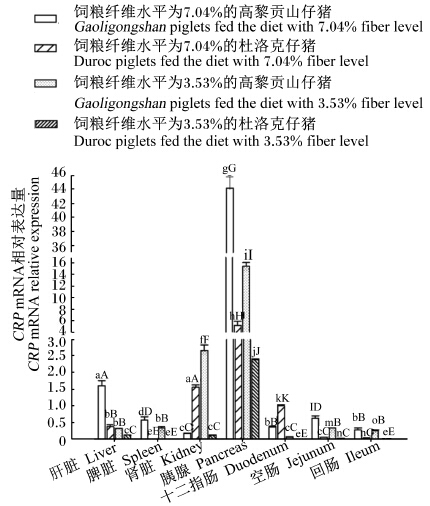 | 图2 仔猪组织中CRP mRNA表达趋势 Fig. 2 Expression trend of CRP mRNA in tissues of piglets |
HP mRNA表达差异(图3):饲粮纤维水平为7.04%时,高黎贡山仔猪肝脏、脾脏、肾脏、胰脏、十二指肠、空肠HP mRNA相对表达量极显著高于同饲粮纤维水平时的杜洛克仔猪、饲粮纤维水平为3.53%时的高黎贡山仔猪及杜洛克仔猪(P<0.01)。饲粮纤维水平为3.53%时,高黎贡山仔猪肝脏、脾脏、肾脏、十二指肠、空肠HP mRNA相对表达量极显著高于杜洛克仔猪(P<0.01),极显著低于饲粮纤维水平为7.04%时的高黎贡山仔猪(P<0.01)。
AGP mRNA表达差异(图4):肾脏和胰腺的AGP mRNA相对表达量极显著高于其他组织(P<0.01),十二指肠AGP mRNA微量表达。饲粮纤维水平为7.04%时,高黎贡山仔猪肝脏、脾脏、肾脏和胰腺AGP mRNA相对表达量极显著高于同饲粮纤维水平时的杜洛克仔猪及饲粮纤维水平为3.53%时的高黎贡山仔猪及杜洛克仔猪(P<0.01)。
SAA mRNA表达差异(图5):空肠SAA mRNA相对表达量极显著高于绝大部分组织(P<0.01),脾脏SAA mRNA相对表达量极显著低于其他组织(P<0.01)。饲粮纤维水平为7.04%时,高黎贡山仔猪肝脏、肾脏、十二指肠和空肠SAA mRNA相对表达量极显著高于同饲粮纤维水平时的杜洛克仔猪、饲粮纤维水平为3.53%时的高黎贡山仔猪和杜洛克仔猪(P<0.01)。饲粮纤维水平为3.53%时,高黎贡山仔猪肝脏、肾脏、空肠SAA mRNA相对表达量极显著高于同饲粮纤维水平时的杜洛克仔猪(P<0.01),极显著低于饲粮纤维水平为7.04%时的高黎贡山仔猪(P<0.01)。
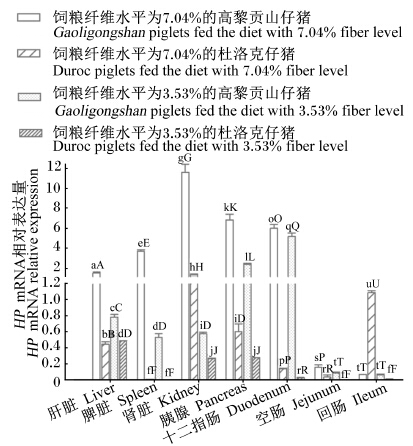 | 图3 仔猪组织中HP mRNA表达趋势 Fig. 3 Expression trend of HP mRNA in tissues of piglets |
仔猪组织CRP、HP、AGP、SAA基因表达谱:4个APPs基因的mRNA相对表达量由高到底依次是饲粮纤维水平为7.04%时的高黎贡山仔猪、饲粮纤维水平为3.53%时的高黎贡山仔猪、饲粮纤维水平为7.04%时的杜洛克仔猪和饲粮纤维水平为3.53%时的杜洛克仔猪。
3 讨 论 3.1 适宜纤维水平饲粮可改善仔猪生产性能本试验结果显示,相较于饲粮纤维水平为3.53%时,饲粮纤维水平为7.04%时杜洛克仔猪日采食量、日增重显著下降,料重比则显著升高。这可能是高纤维导致饲粮适口性下降,杜洛克仔猪肠道明显不能适应高纤维饲粮所致。同时,高黎贡山仔猪肠道则明显不适应纤维水平为3.53%的饲粮,其日采食量、日增重极显著低于、料重比显著高于同饲粮纤维水平时的杜洛克仔猪及饲粮纤维水平为7.04%时高黎贡山仔猪。本试验结果表明,饲粮纤维水平为7.04%时,显著提高高黎贡山仔猪日采食量,促进生长,提高料重比。Hermes等[5]报道,饲粮中的纤维可提高猪的生长性能,并能促进肠道微生物区系和发酵指标的完善。Castillo等[8]研究报道,适宜纤维水平饲粮可促进断奶仔猪生长和预防腹泻。高黎贡山仔猪是较适应恶劣自然环境的放养猪种,长期处于放养条件下适应了高纤维饲粮,对低纤维饲粮反而表现出不适应。本试验结果提示,在同样高纤维水平饲粮下,高黎贡山仔猪生产性能明显高于杜洛克仔猪;高纤维饲粮有利于高黎贡山仔猪生长潜力的充分发挥,利用其肠道耐粗饲特性可优化利用云南特有高黎贡山猪资源。
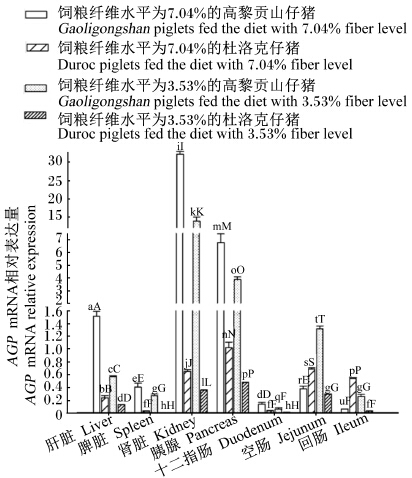 | 图4 仔猪组织中AGP mRNA表达趋势 Fig. 4 Expression trend of AGP mRNA in tissues of piglets |
表4结果显示,饲粮纤维水平为7.04%时,高黎贡山仔猪十二指肠、空肠、回肠绒毛长度均极显著高于杜洛克仔猪,隐窝深度均极显著低于杜洛克仔猪;饲粮纤维水平为3.53%时,结果则相反。Urriola等[9]等试验得出,饲喂相同玉米-豆粕型饲粮时梅山猪比约克夏猪的养分表观消化率更高。高黎贡山猪具有耐粗饲、抗逆性强、贮脂能力强等特性,是我国优良的地方猪种[1]。本结果显示,饲粮纤维水平为7.04%时,高黎贡山仔猪的肠道发育比杜洛克仔猪健康,消化吸收能力更强。从肠道结构的角度解释了高黎贡山仔猪耐粗饲特性。这一结果与高黎贡山仔猪在饲粮纤维水平为7.04%时生产性能高于杜洛克仔猪的试验结果相互映证。
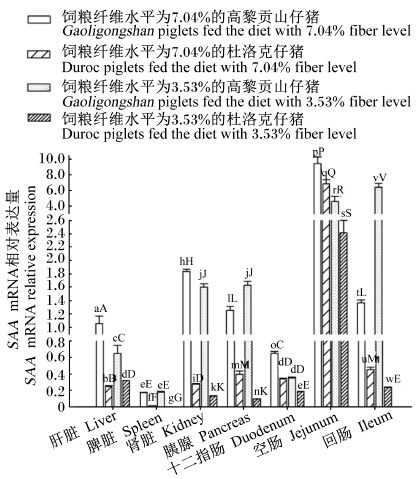 | 图5 仔猪组织中SAA mRNA表达趋势 Fig. 5 Expression trend of SAA mRNA in tissues of piglets |
在十二指肠、空肠、回肠中,高黎贡山仔猪在饲粮纤维水平为7.04%时,绒毛长度均比高黎贡山仔猪在饲粮纤维水平为3.53%时长,且差异均极显著。这一试验结果提示,较高纤维水平的饲粮可以促进高黎贡山仔猪肠道的发育,从而增强其对营养物质的消化吸收能力。
3.3 不同纤维水平饲粮对仔猪小肠黏膜MT1、组织APPs基因的诱导表达 3.3.1 小肠黏膜MT1基因的表达差异研究报道,MT1参与细胞的增殖与凋亡[10]。李振华等[11]研究报道,随着食管癌的发展和恶性程度的增高,MT1的表达量呈升高趋势,这种趋向性对判断肿瘤的恶性程度及进展有积极意义。
由图1可见,高黎贡山仔猪在饲粮纤维水平7.04%时其十二指肠中MT1 mRNA相对表达量极显著高于饲粮纤维水平3.53%时;杜洛克仔猪在饲粮纤维水平为7.04%时其胰腺中MT1 mRNA相对表达量极显著高于饲粮纤维水平为3.53%时。人类医学研究表明,如果提高化疗病人正常细胞中的MTs的含量就能减少化疗病人化疗毒副反应[12]。谢忆山等[13]报道,MTs在肠道的表达与大肠癌患者愈后恢复情况密切相关。上述研究表明MTs对肠道细胞具有一定的保护作用。本试验结果提示,高黎贡山仔猪饲喂高纤维的饲粮可诱导肠道MT1表达的上调,增强肠道对高纤维饲粮的适应性,这可能是MT1调节肠道健康的重要方式之一,对MT1与肠道保护的作用机理有待进一步研究。
3.3.2 组织APPs基因表达差异机体循环系统中APPs的含量与机体的潜在状态有关,在评价动物机体健康方面有较大的应用价值[14]。许美芳等[15]研究报道,健康猪与患病猪组织中APPs的表达呈现显著差异。
3.3.2.1 组织CRP基因表达差异图2显示,在仔猪的各个组织中均检测到CRP mRNA的存在,所有组织中以胰腺的相对表达量最高。这可能与仔猪断奶后胰脏迅速发育和消化酶分泌的诱导作用有关。高黎贡山仔猪饲粮纤维水平为7.04%时,高黎贡山仔猪胰腺和肝脏中CRP mRNA相对表达量极显著高于其他3组。杜洛克仔猪饲粮纤维水平为7.04%时其胰腺中CRP mRNA相对表达量极显著高于饲粮纤维水平为3.53%时。本试验结果显示,高纤维饲粮诱导组织中CRP基因表达的上调。Sasaki等[16]研究表明,儿童在细菌感染的急性期,血清中CRP含量显著升高。本试验中高黎贡山仔猪大部分组织中CRP mRNA相对表达量高于杜洛克仔猪,这可能与高黎贡山仔猪长期生长的粗放生态环境密切相关。Montagne等[17]研究报道,断奶仔猪饲喂高纤维饲粮会增加细菌感染的几率、影响日增重,尤其在恶劣条件下。本试验中,仔猪饲喂高纤维水平饲粮时,大部分组织中CRP mRNA相对表达量高于饲喂低纤维水平饲粮时。这一结果提示,高纤维饲粮诱导CRP表达上调是否与细菌的感染相关值得进一步研究。
3.3.2.2 组织HP基因表达差异图3显示,在仔猪的各个组织中均检测到HP mRNA的存在,以肾脏的相对表达量最高。高黎贡山仔猪在饲粮纤维水平为7.04%时,大部分组织中HP mRNA相对表达量极显著高于其他3组。HP具有结合游离血红蛋白、在红细胞破坏后减少血红蛋白及铁的流失并保护肾脏的功能。本试验结果提示,高纤维饲粮能诱导HP基因表达的上调,对相关组织可能起到更好的保护作用。在十二指肠中,高黎贡山仔猪HP mRNA相对表达量极显著高于杜洛克仔猪。鲁建云等[18]报道HP有结合血红蛋白、促进血管生成等作用。由此推测,HP mRNA的高表达可能与高黎贡山仔猪长期饲喂高纤维饲粮对肠道血管发育的刺激作用有关。在肝脏和脾脏中,高黎贡山仔猪HP mRNA相对表达量极显著高于杜洛克仔猪。Langlois等[19]研究表明,HP还具有重要的免疫调节功能。Quaye[20]报道,结合珠蛋白与炎症引起的疾病相关。饲粮纤维水平为7.04%时,高黎贡山仔猪和杜洛克仔猪大部分组织HP mRNA相对表达量高于饲粮纤维水平为3.53%时。结果提示,高纤维饲粮可以诱导HP在组织中的表达上调,从而提高仔猪的免疫调节能力。
3.3.2.3 组织AGP基因表达差异许美芳等[21]报道,AGP基因除肝脏外在其他组织也有表达。图4表明,在仔猪的各个组织中均检测到AGP mRNA的存在,所有组织中以肾脏和胰腺中AGP mRNA相对表达量最高。饲粮纤维水平为7.04%时,高黎贡山仔猪肝脏、肾脏、胰腺和十二指肠中AGP mRNA相对表达量极显著高于其他3组。本试验结果提示,肾脏中AGP基因的高表达可能对肾脏具有一定的保护作用。Gunnarsson等[22]报道指出,AGP能够通过增加胞质钙的浓度来影响嗜中性粒细胞,从而参与免疫的调节。AGP的主要生理功能是与药物结合及调节机体免疫反应。张建江等[23]报道,细菌感染者AGP表达量明显升高有利于提高机体的抗病力。由此推测,AGP表达量的升高有利于提高仔猪机体免疫的调节能力,从而提高对环境的适应能力。
3.3.2.4 组织SAA基因表达差异图5显示,在仔猪的各个组织中均检测到SAA mRNA的存在,所有组织中以空肠的相对表达量最高。高黎贡山仔猪在饲粮纤维水平为7.04%时,肝脏、肾脏、十二指肠和空肠中SAA mRNA相对表达量极显著高于其他3组。许美芳等[21]报道,SAA是灵敏的全身炎症标志物,能降低内毒素的毒性,在炎症时机体的保护性防御中发挥重要作用。本试验结果提示,SAA mRNA相对表达量在空肠中最高,这可能有利于高黎贡山猪空肠更好适应高纤维饲粮。在肝脏、肾脏、空肠中SAA mRNA相对表达量,高黎贡山仔猪极显著高于同饲粮纤维水平的杜洛克仔猪。在人类医学上,Urieli-Shoval等[24]报道卵巢癌症和卵巢肿瘤患者具有较高的血清SAA含量,SAA在卵巢癌的卵巢肿瘤发生中可能有一定的治疗作用。Mcdonald等[25]报道,在正常牛、马和绵羊的初乳中也可检测到SAA,其可能与新生幼畜对母体外环境的适应和哺乳动物的组织重塑有关。前人的研究结果说明SAA对机体具有保护性防御的作用。本试验结果提示,高纤维饲粮可诱导SAA基因在组织中表达上调,适应了高纤维饲粮的高黎贡山仔猪机体有更强的保护性防御能力。
综上,不同纤维水平饲粮对高黎贡山仔猪和杜洛克仔猪的生产性能、小肠黏膜形态以及小肠黏膜MT1、组织CRP、HP、AGP、SAA基因表达具有明显影响。高黎贡山仔猪在高饲粮纤维水平下的APPs基因表达的上调,可能不同于杜洛克仔猪,更不同于儿童感染疾病时的情况,很可能是长期适应后而形成的一种保护机制。饲喂高纤维饲粮的高黎贡山仔猪生产性能明显优于饲喂低纤维饲粮的高黎贡山仔猪,而与饲喂低纤维饲粮的杜洛克仔猪相当,这也是高黎贡山猪长期对粗纤维饲料和环境变化适应的结果,其机制有待进一步研究。
4 结 论① 高黎贡山仔猪适应高纤维水平(7.04%)的饲粮,而杜洛克仔猪适应低纤维水平(3.53%)饲粮。
② 7.04%的高纤维饲粮可提高高黎贡山仔猪的生产性能,有利于小肠黏膜的发育,上调小肠黏膜MT1及组织APPs mRNA的表达。
| [1] | 安清聪,张春勇,李美荃,等.谷氧还蛋白1和硫氧还蛋白1基因在高黎贡山猪不同组织中表达规律及维生素E对其在氧化应激细胞中表达的影响[J]. 动物营养学报,2013,25(8):1825-1835. ( 2) 2)
|
| [2] | VAREL V H,YEN J T.Microbial perspective on fiber utilization by swine[J]. Journal of Animal Science,1997,75(10):2715-2722. ( 1) 1)
|
| [3] | URRIOLA P E,STEIN H H.Comparative digestibility of energy and nutrients in fibrous feed ingredients fed to Meishan and Yorkshire pigs[J]. Journal of Animal Science,2012,90(3):802-812. ( 1) 1)
|
| [4] | HEDEMANN M S,ESKILDSEN M,LAERKE H N,et al.Intestinal morphology and enzymatic activity in newly weaned pigs fed contrasting fiber concentrations and fiber properties[J]. Journal of Animal Science,2006,84(6):1375-1386. ( 1) 1)
|
| [5] | HERMES R G,MOLIST F,YWAZAKI M,et al.Effect of dietary level of protein and fiber on the productive performance and health status of piglets[J]. Journal of Animal Science,2009,87(11):3569-3577. ( 2) 2)
|
| [6] | 陈恒灿,马黎,陈克嶙,等.丙氨酰谷氨酰胺二肽对早期断奶仔猪抗氧化能力及肠道保护的研究[J]. 畜牧兽医学报,2011,42(2):251-259. ( 1) 1)
|
| [7] | PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research,2001,29(9):e45 ( 1) 1)
|
| [8] | CASTILLO M,MARTÍN-ORÙE S M,TAYLOR-PICKARD J A,et al.Use of mannan-oligosaccharides and zinc chelate as growth promoters and diarrhea preventative in weaning pigs:Effects on microbiota and gut function[J]. Journal of Animal Science,2008,86(1):94-101. ( 1) 1)
|
| [9] | URRIOLA P E,STEIN H H.Effects of distillers dried grains with solubles on amino acid,energy,and fiber digestibility and on hindgut fermentation of dietary fiber in a corn-soybean meal diet fed to growing pigs[J]. Journal of Animal Science,2010,88(4):1454-1462. ( 1) 1)
|
| [10] | JAYASURYA A,BAY B H,YAP W M,et al.Proliferative potential in nasopharyngeal carcinoma:correlations with metallothionein expression and tissue zinc levels[J]. Carcinogenesis,2000,21(10):1809-1812. ( 1) 1)
|
| [11] | 李振华,田子强,丛斌,等.食管癌组织中MT-1、-2与-3的表达差异及临床意义[J]. 中国肿瘤临床,2012,39(15):1091-1095. ( 1) 1)
|
| [12] | 林林.MT和Bag-1在胃癌中的表达[D]. 硕士学位论文.石家庄:河北医科大学,2003. ( 1) 1)
|
| [13] | 谢忆山,王蕊,陶卫平.金属硫蛋白在大肠癌及正常黏膜组织中阳性表达的临床意义[J]. 肿瘤防治研究,2009,36(10):886-891. ( 1) 1)
|
| [14] | PIEIRO C,PIEIRO M,MORALES J,et al.Pig-MAP and haptoglobin concentration reference values in swine from commercial farms[J]. The Veterinary Journal,2009,179(1):78-84. ( 1) 1)
|
| [15] | 许美芳,李永明,齐珂珂,等.3种评价猪群健康的急性期蛋白相关性的研究[J]. 中国畜牧杂志,2013,49(1):57-60. ( 1) 1)
|
| [16] | SASAKI K,FUJITA I,HAMASAKI Y,et al.Differentiating between bacterial and viral infection by measuring both C-reactive protein and 2'-5'-oligoadenylate synthetase as inflammatory markers[J]. Journal of Infection and Chemotherapy,2002,8(1):76-80. ( 1) 1)
|
| [17] | MONTAGNE L, LE FLOC'H N,ARTURO-SCHAAN M,et al.Comparative effects of level of dietary fiber and sanitary conditions on the growth and health of weanling pigs[J]. Journal of Animal Science,2012,90(8):2556-2569. ( 1) 1)
|
| [18] | 鲁建云,吴志强,谭丽娜,等.结合珠蛋白mRNA及其蛋白在尖锐湿疣皮损中的表达[J]. 中南大学学报:医学版,2007,32(6):1020-1025. ( 1) 1)
|
| [19] | LANGLOIS M R,DELANGHE J R.Biological and clinical significance of haptoglobin polymorphism in humans[J]. Clinical Chemistry,1996,42(10):1589-1600. ( 1) 1)
|
| [20] | QUAYE I K.Haptoglobin,inflammation and disease[J]. Transactions of the Royal Society of Tropical Medicine and Hygiene,2008,102(8):735-742. ( 1) 1)
|
| [21] | 许美芳,李永明,徐子伟.急性期蛋白及其用于动物健康状态的评价[J]. 家畜生态学报,2010,31(3):76-80. ( 2) 2)
|
| [22] | GUNNARSSON P,LEVANDER L,PHLSSON P,et al.The acute-phase protein α1-acid glycoprotein (AGP) induces rises in cytosolic Ca2+ in neutrophil granulocytes via sialic acid binding immunoglobulin-like lectins (Siglecs)[J]. The FASEB Journal,2007,21(14):4059-4069. ( 1) 1)
|
| [23] | 张建江,易著文,罗雪梅,等.血清C-反应蛋白、α1-酸性糖蛋白和前白蛋白的检测在儿童感染性疾病中的应用[J]. 中国综合临床,2006,22(5):470-472. ( 1) 1)
|
| [24] | URIELI-SHOVAL S,FINCI-YEHESKEL Z,DISHON S,et al.Expression of serum amyloid a in human ovarian epithelial tumors:implication for a role in ovarian tumorigenesis[J]. Journal of Histochemistry and Cytochemistry,2010,58(11):1015-1023. ( 1) 1)
|
| [25] | MCDONALD T L,LARSON M A,MACK D R,et al.Elevated extrahepatic expression and secretion of mammary-associated serum amyloid A 3 (M-SAA3) into colostrum[J]. Veterinary Immunology and Immunopathology,2002,83(3/4):203-211. ( 1) 1)
|




