2. 无锡几丁生物新材料科技发展有限公司, 无锡 2014026;
3. 江苏德仁生物科技发展有限公司, 金坛 213200
2. Wuxi Jiding Biological New-Type Material Technology Development Co., Ltd., Wuxi 214026, China;
3. Jiangsu Deren Biological Technology Development Co., Ltd., Jintan 213200, China
当前中国,鱼类疾病的预防与治疗主要通过有限的抗生素与化学药物,然而,长期使用抗生素会引起病原菌产生抗性,降低药用效果[1]。伴随着抗生素在水产养殖中的严格限制,大量免疫增强剂和免疫调控剂得以迅速发展与推广,这其中主要包括一些天然物质与合成物质,如:左旋咪唑、β-葡聚糖、肽聚糖、壳多糖、几丁聚糖、维生素混合物以及各种中草药制剂等。这些物质可以有效地通过增强细胞与体液的免疫防御来预防疾病[2]。
甲壳素作为一种天然高分子物质,广泛存在于甲壳类动物、昆虫与真菌中。在医药、农业和水产行业的应用中,虾壳与蟹壳是甲壳素及其脱乙酰产物几丁聚糖(壳聚糖)的重要商业用料来源[3]。甲壳素与几丁聚糖可以有效地抑制多种真菌与细菌生长,其调控原理是几丁聚糖与细胞表面的负电荷残基之间的质子化氨基(NH2)基团通过静电力相互作用,从而增强细胞表面的抗菌活性[4]。同时,几丁聚糖是天然的可生物降解的多糖,也是自然界中唯一带正电荷的生物活性多糖[5],通过口服几丁聚糖来提高免疫力已呈现出良好的发展前景。几丁聚糖在水产动物上的研究已有一些报道,如饲料中添加几丁聚糖可以在一定程度上提高褐石斑鱼(Epinephelus bruneus)[2]、鲤鱼(Cyprinus carpio)[6]、军曹鱼(Rachycentron canadum)[1]、草鱼(Ctenopharyngodon idellus)[7]、香鱼(Plecoglbssus altivelis)[8]、星斑川鲽(Platichthys stellatus)[9]和异育银鲫(Carassius auratus gibelio)[10, 11]的免疫力。然而,近年来,随着几丁聚糖研发工艺的发展,传统工艺获取的几丁聚糖因分子质量巨大、聚合度高、吸收率低以及提取工艺成本较高等原因制约了其推广应用。相比之下,通过无拮抗作用的微生物发酵与酶解产生的新型几丁聚糖,分子质量小[化学式为(C6H11NO4)n,相对分子质量为(161.9)n],易于吸收。同时,其提取工艺较为简单,成本较低,安全性已经通过日本政府600项农药残留检测,毒性低于食盐[半数致死量(LD50)>20 000 mg/kg][12]。
罗非鱼(Oreochromis niloticus)是世界主要养殖鱼类之一,近年来,由于高密度养殖、养殖水体污染以及配合饲料营养不均衡等问题,罗非鱼感染疾病的几率大大升高。其中,无乳链球菌和海豚链球菌引起的罗非鱼链球菌病,是罗非鱼病害中最为棘手的,该病不仅死亡率高,而且死亡速度极快,治疗起来极其困难,该疾病给养殖从业者带来了严重的经济损失,已经成为严重制约罗非鱼产业健康发展的枷锁[13, 14, 15]。本研究拟以此新型几丁聚糖为饲料添加剂,通过对照组与不同添加量间的比较,分析饲料中添加几丁聚糖对吉富罗非鱼生长性能、血常规与血清生化参数、头肾中免疫相关基因表达的影响;同时,比较海豚链球菌感染后的累计死亡率,从而筛选出几丁聚糖的最适添加量。本研究结果可以为新型几丁聚糖在罗非鱼饲料中的应用与推广提供理论依据。
1 材料与方法 1.1 试验用鱼试验鱼取自中国水产科学研究院淡水渔业研究中心宜兴基地自繁的“吉富”品系尼罗罗非鱼幼鱼,选择无病无伤、活力强的个体作为试验用鱼。试验前在室内水泥池[水温(29±1) ℃,pH 7.4±0.2]中暂养10 d,自然光周期。暂养期间使用循环水连续充气,每天08:00和15:00各投喂沉水性饲料(粗蛋白质含量为29.0%、粗脂肪含量为8.0%)1次,投喂量为体重的8%。
1.2 试验设计与分组首先配制基础饲料,然后在每千克基础饲料中分别添加10、20、30和40 mL的几丁聚糖溶液(购于江苏德仁生物科技有限公司,几丁聚糖的有效浓度为0.6%),另配制成4种试验饲料,分别用1、2、3和4组表示。几丁聚糖溶液的具体添加方法为:每种饲料按照基础饲料配方(表1)分别配制10 kg的饲料后,采用移液枪分别准确地吸取100、200、300和400 mL的几丁聚糖液体溶液,先将几丁聚糖溶液添加至水中,混匀后,然后用喷壶均匀喷洒到饲料中。同时设置不添加几丁聚糖的基础饲料为对照组。将各饲料使用饲料制粒机制成颗粒,阴凉处风干,-20 ℃保存备用。
| 表1 基础饲料组成及营养水平(风干基础)
Table 1 Composition and nutrient levels of the basal diet (air-dry basis)
|
试验在封闭的水循环系统中进行,选取15个容积800 L的塑料桶,每个塑料桶添加曝气3 d后的自来水700 L。利用控温系统将温度保持在(29.0±0.3) ℃,试验开始前对幼鱼的体重进行测量,试验用鱼平均体重为(2.97±0.02) g,随机分为5组,每组3个重复(塑料桶),每个重复放养25尾鱼。各组试验鱼初始体重没有显著差异(P>0.05)。每组试验鱼随机饲喂1种饲料,每次投喂量为体重的5%~8%,每周投喂6 d,停饲1 d,试验周期共计63 d。试验期间连续充气,采用虹吸法清除桶底粪便,每隔3 d换水1/3,保持换水前后温差不超过±0.5 ℃,溶氧保持在5 mg/L以上,pH 7.6±0.2,氨氮和亚硝酸盐浓度分别不高于0.003和0.004 mg/L,自然光周期。
1.4 生长性能指标测定饲养试验结束后,统计各养殖桶的鱼尾数,称取每桶鱼的总重后,随机选取5尾鱼,用浓度为200 mg/L的MS-222进行快速深度麻醉,分别称体重后,立即剖开腹腔,剥离出内脏和肝脏并称重。
分别按下式计算特定生长率(specific growth rate,SGR)、饲料效率(feed efficiency,FE)、成活率(survival ratio,SR)、肝体比(hepatosomatic index,HSI)、内脏比(viscerasomatic index,VSI):
SGR(%/d)=100×(lnWt-lnW0)/t;
FE(%)=100×(Wt-W0)/F;
SR(%)=100×(N0-Nt)/N0;
HSI(%)=100×Wh/Wb;
VSI(%)=100×Wv/Wb。
式中:W0为鱼的初始均体重(g);Wt为鱼的终末均体重(g);t为饲养天数(d);F为每尾鱼的平均总摄食量(湿重,g);N0为初始鱼尾数;Nt为终末鱼尾数;Wh为每尾鱼终末肝脏重(g);Wv为每尾鱼终末内脏重(g);Wb为每尾鱼终末体重(g)。
1.5 采样与处理每个养殖桶随机再选取4尾鱼,为了降低取样应激,利用过量的MS-222(2%)深度麻醉后,取头肾与血液样品检测相关指标的变化。一部分血样用于血常规指标的检测,一部分血样于4 ℃冰箱中静置2 h,在4 ℃、3 500 r/min下离心10 min制备血清,上清液移置-70 ℃冰箱中保存备用;头肾样品用液氮速冻后,于-70 ℃保存,用于分子生物学分析。
1.5.1 血常规指标的测定血常规中红细胞(red blood cells,RBC)、白细胞(white blood cells,WBC)数目,血红蛋白(haemoglobin,Hb)浓度与红细胞压积(haematocrit,Hct)在迈瑞BC-5300Vet全自动五分类动物血液细胞分析仪上测定,试剂盒均购自无锡中润医药有限公司。
1.5.2 血清生化指标的测定血清皮质醇(cortisol,COR)含量及溶菌酶(lysozyme,LZM)、超氧化物歧化酶(superoxide dismutase,SOD)活性采用酶联免疫吸附法测定,通过BioTek EonTM微孔板分光光度计进行读数,试剂盒购自上海朗顿生物有限公司。血清总蛋白(total protein,TP)、葡萄糖(glucose,GLU)、甘油三酯(triglyceride,TC)、胆固醇(cholesterol,TG)、高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)含量及谷丙转氨酶(alanine aminotransferase,ALP)、谷草转氨酶(aspertate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,AKP)活性在迈瑞全自动生化分析仪(BS-400)上测定,试剂盒均购自无锡中润医药有限公司。
1.5.3 头肾免疫相关基因定量表达根据GenBank中罗非鱼白细胞介素1β(interleukin 1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和干扰素γ(interferon γ,IFN-γ)的序列,设计3个基因的特异性引物,引物序列见表2。用罗非鱼的β-肌动蛋白(β-actin)(EU887951.1)作为内参基因,设计β-actin引物,引物序列见表2。所有引物由上海基康生物技术有限公司合成,取罗非鱼头肾20 mg左右,参照RNeasy Mini Handbook(QIAGEN公司)说明书用试剂盒提取总RNA,所得总RNA的OD260/OD280为1.90左右。荧光定量PCR反应液的制备与反应条件参照Qiang等[13]的方法。
| 表2 引物序列
Table 2 Primer sequences
|
在基因表达与β-actin的定量PCR扩增效率基本一致的前提下,计算目的基因mRNA相对表达量。以罗非鱼β-actin为内参,对得到的各样品Ct值进行均一化处理,以对照组的相对表达量为基准,应用2-ΔΔCt法[16]确定不同几丁聚糖添加水平下各基因mRNA的相对表达量。
1.6 感染试验为了减少取样应激,试验结束继续饲养10 d后,每个养殖桶选取10尾鱼进行海豚链球菌感染试验,海豚链球菌的培养与计数、菌液注射感染等方法参照Qiang等[13]的方法。正式感染试验前,随机选取30尾备用吉富罗非鱼(摄食对照组饲料),通过感染不同浓度梯度的菌液进行预试验,确定感染菌液的半数致死量。本试验注射感染所用的海豚链球菌菌液浓度为6.15×106 CFU/mL,注射剂量为每100 g体重300 μL,计算感染192 h时各组的累计死亡率。
1.7 数据处理试验数据用SPSS 17.0统计软件进行方差分析及Duncan氏法多重比较,显著水平为P<0.05。结果用平均值±标准差(mean±SD)表示。
2 结果与分析 2.1 饲料中添加几丁聚糖对吉富罗非鱼幼鱼生长性能的影响饲料中添加几丁聚糖对吉富罗非鱼幼鱼生长性能的影响见表3。2组的终末体重和FE均显著高于对照组与3和4组(P<0.05)。各组SGR无显著差异(P>0.05)。各组63 d的SR介于93.3%~97.3%,组间无显著差异(P>0.05)。与对照组相比,饲料中几丁聚糖溶液添加量为10和20 mL/kg时能显著降低HSI(P<0.05),几丁聚糖溶液添加量为20和40 mL/kg时能显著降低VSI(P<0.05)。
| 表3 饲料中添加几丁聚糖对吉富罗非鱼幼鱼生长性能的影响 Table 3 Effects of chitosan supplementation on growth performance of juvenile GIFT tilapia |
饲料中添加几丁聚糖对吉富罗非鱼幼鱼血常规指标的影响见表4。与对照组相比,饲料中几丁聚糖溶液添加量为10和20 mL/kg时能显著增加血液中RBC和WBC数目以及Hb浓度和Hct(P<0.05);继续增加几丁聚糖溶液的添加量后各血常规指标均有所下降。4组中血液中RBC数目、Hb浓度和Hct与对照组相比无显著差异(P>0.05),但其血液中WBC数目显著低于其他各组(P<0.05)。
| 表4 饲料中添加几丁聚糖对吉富罗非鱼幼鱼血常规指标的影响 Table 4 Effects of chitosan supplementation on hematological parameters of juvenile GIFT tilapia |
饲料中添加几丁聚糖对吉富罗非鱼幼鱼血清生化指标的影响见表5。1、2组血清COR含量显著低于对照组和4组(P<0.05)。1组血清LZM活性显著高于对照组及2、3、4组(P<0.05)。1、2、3和4组血清SOD活性均显著高于对照组(P<0.05)。2组血清ALT、AST活性及GLU和TG含量均较低,显著低于对照组及1组(P<0.05)。各组血清TP含量无显著差异(P>0.05)。3与4组血清TC含量显著低于对照组及1和2组(P<0.05)。1、2和4组血清AKP活性显著高于3组(P>0.05)。同时,2组血清LDL-C含量显著低于其他各组(P<0.05),而血清HDL-C含量则显著高于3和4组(P<0.05)。
| 表5 饲料中添加几丁聚糖对吉富罗非鱼幼鱼血清生化指标的影响 Table 5 Effects of chitosan supplementation on serum biochemical parameters of juvenile GIFT tilapia |
由图1可知,1和2组头肾IL-1β和TNF-α mRNA相对表达量均显著高于对照组和4组(P<0.05)。1组头肾IFN-γ mRNA相对表达量显著高于其他各组(P<0.05),随着几丁聚糖溶液添加量的增加,IFN-γ mRNA相对表达量呈下降趋势。
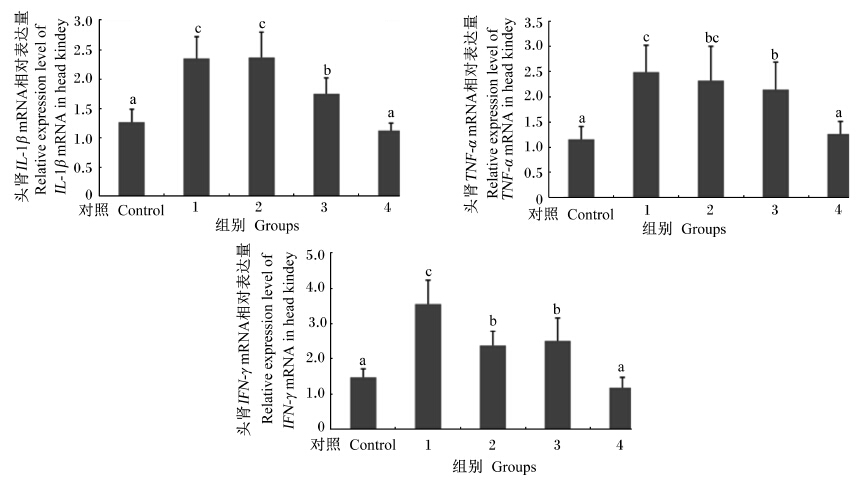 |
数据柱标注不同小写字母表示差异显著(P<0.05)。下图同。 Data columns with different small letters mean significant difference(P<0.05). The same as below. 图1 饲料中添加几丁聚糖对吉富罗非鱼幼鱼头肾IL-1β、TNF-α和 IFN-γ mRNA相对表达量的影响 Fig. 1 Effects of chitosan supplementation on IL-1β,TNF-α and IFN-γ mRNA relative expression levels in head kidney of juvenile GIFT tilapia |
饲喂63 d后,采用6.15×106 CFU/mL的海豚链球菌菌液进行腹腔注射感染,192 h后累计死亡率结果见图2。1、2和3组的累计死亡率介于30.06%~39.95%,显著低于对照组的51.19%与4组的77.55%(P<0.05)。
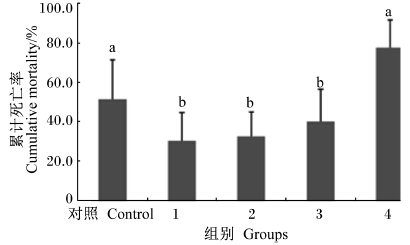 | 图2 饲料中添加几丁聚糖对吉富罗非鱼幼鱼感染海豚链球菌192 h后累计死亡率的影响 Fig. 2 Effects of chitosan supplementation on cumulative mortality of juvenile GIFT against Streptococcus iniae after 192 h |
饲料中添加几丁聚糖对水产动物生长的影响已见一些报道,不同鱼类之间存在较大差异。研究发现,饲料中添加几丁聚糖可以提高鲤鱼[6]与牙鲆(Paralichthys olivaceus)的生长速度[17]。然而,Kono等[18]发现,饲料中添加几丁聚糖对真鲷(Pagrosomus major)、日本鳗(Anguilla japonica)与 鱼(Seriola quinqueracliata)的生长无影响。关于罗非鱼方面的研究仅见Shiau等[19]的报道。Shiau等[19]发现饲料中添加2%~10%的几丁聚糖能够明显抑制奥尼罗非鱼(O. niloticus×O. aureus)的生长。这可能与从虾壳、蟹壳获取的几丁聚糖分子质量巨大、聚合度高、吸收率低,从而制约添加效果有关。本试验添加的无拮抗作用的微生物发酵产生的小分子质量几丁聚糖,具有较高的吸收与利用率。当饲料中几丁聚糖溶液添加量为20 mL/kg时,63 d后,吉富罗非鱼幼鱼的生长速度与FE显著高于对照组,可能是因为适量的几丁聚糖有助于增加微生物合成,提高酶的活力,促进营养物质消化与吸收[20],从而提高了生长与饲料利用。然而,饲料中几丁聚糖溶液添加量为40 mL/kg时明显抑制了吉富罗非鱼生长,说明过量的几丁聚糖可能会影响肠道对于饲料脂肪的消化与吸收,使脂肪通过粪便而排泄到体外[19]。 同时,本试验中发现,饲料中几丁聚糖溶液添加量为10和20 mL/kg时能显著降低吉富罗非鱼的HSI与VSI,这在水产健康养殖中具有重要的应用前景。
3.2 饲料中添加几丁聚糖对吉富罗非鱼幼鱼血常规指标的影响本试验中,饲料中几丁聚糖溶液添加量为10和20 mL/kg时能显著提高吉富罗非鱼幼鱼血液RBC数目。血液RBC数目的升高可能与鱼体的营养状态有关。适量的几丁聚糖有助于提高鱼体的消化与代谢反应速率,增加氧气需要量,从而导致RBC数目与Hb浓度的升高[13]。同时,10 mL/kg添加量下血液WBC数目显著高于其他组,这与Lin等[21]的研究结论相似,说明饲料中添加几丁聚糖有助于提高鱼体的非特异性免疫力。然而,几丁聚糖溶液添加量为40 mL/kg时血液RBC数目、Hb浓度和Hct与对照组相比无显著差异,同时,其血液WBC数目显著低于对照组。这说明过量的几丁聚糖可能会影响细胞代谢与免疫调控,从而影响了血液中RBC、WBC数目及Hb浓度与Hct。
3.3 饲料中添加几丁聚糖对吉富罗非鱼幼鱼血清生化指标的影响鱼类通过调节能量代谢水平来适应环境变化。应激状态下,为了生长与繁殖,鱼体往往需要通过加强代谢活动来维持生理平衡。急性与慢性应激均与代谢率的提高相关联[22]。本研究中发现,饲料中几丁聚糖溶液添加量为10和20 mL/kg时能显著降低血清COR含量,增加生长速度,这可能与鱼体的代谢率降低有关。然而,饲料中几丁聚糖溶液添加量为40 mL/kg时血清COR含量显著高于添加量为10 mL/kg时,说明过量的几丁聚糖可能会引起鱼体产生代谢压力,提高代谢率。
LZM具有杀菌活性,能够作为一种调理素激活机体的补体系统与吞噬细胞,从而防止病害入侵[6]。本研究中发现,饲料中几丁聚糖添加量为10 mL/kg时血清LZM活性显著高于对照组。Geng等[1]、Gopalakannan等[6]和常青等[23]也得出类似结论。血清SOD活性同样也是一个重要的非特异性免疫指标。本试验中,饲料中几丁聚糖溶液添加量为10和20 mL/kg时血清SOD活性显著高于对照组。Lin等[21]在鲤鱼研究中也发现了类似结论。因此,饲料中几丁聚糖溶液添加量为10~20 mL/kg时能够显著降低吉富罗非鱼幼鱼血清COR含量,提高血清LZM和SOD活性。
血清中ALT与AST活性可以作为肝脏损伤的重要指示物[24],本研究中发现饲料中几丁聚糖溶液添加量为20 mL/kg时血清ALT、AST活性显著低于对照组,说明饲料中几丁聚糖溶液添加量为20 mL/kg时能够起到保护肝脏的作用。血清中GLU含量是鱼类面对胁迫时代谢调控的重要指示物。拥挤与温度胁迫、病菌感染等均能增加吉富罗非鱼血清GLU含量[15, 22, 24]。本研究中,饲料中几丁聚糖溶液添加量为20 mL/kg时血清GLU含量显著低于对照组,这与其相应较低的血清COR含量相一致。血清中TG含量的变化反映了鱼体脂肪代谢水平,TG含量升高表明肝脏中脂肪沉积较多,容易引起脂肪肝。本研究中发现饲料中几丁聚糖溶液添加量为20 mL/kg时血清TG含量显著低于对照组,说明适量的几丁聚糖能提高饲料中脂肪的利用[25]。然而,随着饲料中几丁聚糖溶液添加量的增加,鱼体的脂肪代谢能力下降,血清TG与HSI均出现上升。
本研究中,各组血清TP指标未出现显著变化,可能是因为这个指标在血液中相对稳定,在本试验处理下不足以产生明显改变。AKP是一种溶酶体酶,广泛存在于各组织细胞中,参与水产动物骨骼矿化与细胞膜转运[24]。血清中AKP活性的增加与促进成骨细胞活性、胆汁郁积或慢性胁迫相关联[26]。饲料中几丁聚糖溶液添加量为10和20 mL/kg时有较高的血清AKP活性,可能归因于吉富罗非鱼较快的生长速度;然而,饲料中几丁聚糖溶液添加量为40 mL/kg时有较高的血清AKP活性则与鱼体在慢性胁迫下代谢紊乱有关。LDL-C和HDL-C属于血脂蛋白,血清LDL-C含量升高易引起TG在血管沉积,并与其他物质一起堵塞血管;而HDL-C能将肝脏外的TG运输到肝脏分解排出体外[27]。本研究中,饲料中几丁聚糖溶液添加量为40 mL/kg时,吉富罗非鱼幼鱼血清TG与LDL-C含量均显著高于添加量为20 mL/kg时,而血清HDL-C含量则显著低于添加量为20 mL/kg时,表明过量的几丁聚糖可能导致鱼体脂质代谢紊乱与血脂沉积。
3.4 饲料中添加几丁聚糖对吉富罗非鱼幼鱼头肾中免疫相关基因表达的影响随着病害发生与防治研究的进一步深入,许多细胞因子基因的功能研究已广泛开展。在鱼类中,IL-1β、TNF-α和IFN-γ作为重要的免疫调控细胞因子基因,在机体非特异性免疫方面发挥着重要作用[28]。关于几丁聚糖对鱼体细胞因子的研究尚未见到相关报道,仅在鸡[29]与小鼠[30, 31]上见到类似研究。壳聚糖是以几丁聚糖为原料,经生物技术降解而成的低分子质量产品。张小边[30]与纪莹[31]研究均发现,饲料中添加壳聚糖后,能够显著增强小鼠巨噬细胞IL-1β和TNF-α基因的表达,提高机体的非特异性免疫力。王红卫等[29]也报道,饲料中添加200 mg/kg分子质量为3 ku的壳聚糖能显著提高蛋鸡脾脏白细胞介素-2(IL-2)和TNF-α mRNA表达水平。本研究中发现,饲料中添加10 mL/kg含小分子质量几丁聚糖的几丁聚糖溶液能显著提高吉富罗非鱼头肾IL-1β、TNF-α和IFN-γ mRNA的相对表达量,这该组较高的WBC数目及血清LZM与SOD活性等相一致。
3.5 饲料中添加几丁聚糖对吉富罗非鱼幼鱼感染海豚链球菌192 h后累计死亡率的影响不同几丁聚糖添加量下,吉富罗非鱼幼鱼饲养63 d后,采用6.15×106 CFU/mL的海豚链球菌菌液进行腹腔注射感染。192 h后,添加量为10 mL/kg的组累计死亡率最低,其次是添加量为20 mL/kg的组。这与前面讨论中提及的几丁聚糖溶液添加量为10、20 mL/kg时具有较高的血清与头肾非特异性免疫活性相一致。本试验中添加的几丁聚糖是通过微生物发酵后提取的,具有分子质量小、溶解性与吸收性较好等优势,因此作用效果更明显。
4 结 论① 饲料中几丁聚糖溶液添加量为20 mL/kg时可以促进吉富罗非鱼幼鱼生长,提高FE,减少肝脏损伤与血清TG含量,有利于健康养殖。
② 饲料中几丁聚糖溶液添加量为10和20 mL/kg时有助于提高血液WBC数量、血清LZM和SOD活性,上调头肾细胞免疫因子的表达,降低海豚链球菌感染后的累计死亡率。
③ 本试验条件下,建议吉富罗非鱼幼鱼饲料中几丁聚糖溶液的添加量为10~20 mL/kg。
| [1] | GENG X,DONG X H,TAN B P,et al.Effects of dietary chitosan and Bacillus subtilis on the growth performance,non-specific immunity and disease resistance of cobia,Rachycentron canadum[J]. Fish & Shellfish Immunology,2011,31(3):400-406. ( 3) 3)
|
| [2] | HARIKRISHNAN R,KIM J S,BALASUNDARAM C,et al.Immunomodulatory effects of chitin and chitosan enriched diets in Epinephelus bruneus against Vibrio alginolyticus infection[J]. Aquaculture,2012,326-329:46-52. ( 2) 2)
|
| [3] | EL GHAOUTH A,ARUL J,GRENIER J,et al.Antifungal activity of chitosan on two postharvest pathogens of strawberry fruits[J]. Phytopathology,1992,82(4):398-402. ( 1) 1)
|
| [4] | GOODAY G W.Aggressive and defensive roles for chitinases[M]//JOLLÈS P,MUZZARELLI R A A.Chitin and chitinases.Basel:Birkhuser Verlag,1999,87:157-169. ( 1) 1)
|
| [5] | TSAI G J,SU W H.Antibacterial activity of shrimp chitosan against Escherichia coli[J]. of Food Protection,1999,62(3):239-243. ( 1) 1)
|
| [6] | GOPALAKANNAN A,ARUL V.Immunomodulatory effects of dietary intake of chitin,chitosan and levamisole on the immune system of Cyprinus carpio and control of Aeromonas hydrophila infection in ponds[J]. Aquaculture,2006,255(1/2/3/4):179-187. ( 4) 4)
|
| [7] | 王红权,赵玉蓉,余建波.壳聚糖对草鱼非特异性免疫功能的影响[J]. 湖南农业大学学报:自然科学版,2010,36(2):215-217. ( 1) 1)
|
| [8] | 金思,龚一富,章丽,等.壳聚糖对香鱼溶菌酶活性和hsp70基因表达的影响[J]. 生物学杂志,2012,25(9):11-14. ( 1) 1)
|
| [9] | 王际英,蒋锦坤,张利民,等.壳聚糖对星斑川鲽幼鱼生长、脂肪含量及抗氧化能力的影响[J]. 中国农学通报,2013,29(8):64-70. ( 1) 1)
|
| [10] | 曹志华,严书林,罗静波,等.壳聚糖对异育银鲫非特异性免疫功能的影响[J]. 长江大学学报:自然科学版,2010,7(2):29-31. ( 1) 1)
|
| [11] | 陈勇,华雪铭,周洪琪,等.壳聚糖和益生菌对异育银鲫非特异免疫功能及血清甲状腺激素、皮质醇水平的影响[J]. 水产学报,2010,34(5):711-718. ( 1) 1)
|
| [12] | 苟晨晨.创新生物农药太激的特性及使用[J]. 安徽农学通报,2012,18(11):115-116. ( 1) 1)
|
| [13] | QIANG J,YANG H,WANG H,et al.Interacting effects of water temperature and dietary protein level on hematological parameters in Nile tilapia juveniles,Oreochromis niloticus (L.) and mortality under Streptococcus iniae infection [J]. Fish & Shellfish Immunology,2013,34(1):8-16. ( 4) 4)
|
| [14] | 强俊,徐跑,何杰,等.氨氮与拥挤胁迫对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化指标的联合影响[J]. 水产学报,2011,35(12):1837-1848. ( 1) 1)
|
| [15] | 强俊,杨弘,王辉,等.海豚链球菌感染对不同品系罗非鱼血液生化指标和肝脏HSP70 mRNA 表达的影响[J]. 水产学报,2012,36(6):958-968. ( 2) 2)
|
| [16] | LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods,2001,25(4):402-408. ( 1) 1)
|
| [17] | CHA S H,LEE J S,SONG C B,et al.Effects of chitosan-coated diet on improving water quality and innate immunity in the olive flounder,Paralichthys olivaceus[J]. Aquaculture,2008,278(1/2/3/4):110-118. ( 1) 1)
|
| [18] | KONO M,MATSUI T,SHIMIZU C.Effect of chitin,chitosan and cellulose as diet supplements on the growth of cultured fish[J]. Nippon Suisan Gakkaishi,1987,53(1):125-129. ( 1) 1)
|
| [19] | SHIAU S Y,YU Y P.Dietary supplementation of chitin and chitosan depresses growth in tilapia,Oreochromis niloticus×O.aureus[J]. Aquaculture,1999,179(1/2/3/4):439-446. ( 2) 2)
|
| [20] | NIU J,LIU Y J,LIN H Z,et al.Effects of dietary chitosan on growth,survival and stress tolerance of postlarval shrimp,Litopenaeus vannamei[J]. Aquaculture Nutrition,2011,17(2):e406-e412. ( 1) 1)
|
| [21] | LIN S M,MAO S H,GUAN Y,et al.Effects of dietary chitosan oligosaccharides and Bacillus coagulans on the growth,innate immunity and resistance of koi (Cyprinus carpio koi)[J]. Aquaculture,2012,342/343:36-41. ( 2) 2)
|
| [22] | QIANG J,YANG H,WANG H,et al.Physiological responses and HSP70 mRNA expression in GIFT tilapia juveniles,Oreochromis niloticus under short-term crowding[J]. Aquaculture Research,2013,46(2):335-345,doi:10.1111/ are.12189. ( 2) 2)
|
| [23] | 常青,梁萌青,王家林,等.壳聚糖对花鲈生长和非特异性免疫力的影响[J]. 海洋水产研究,2006,27(5):17-22. ( 1) 1)
|
| [24] | 强俊,杨弘,王辉,等.急性温度应激对吉富品系尼罗罗非鱼(Oreochromis niloticus)幼鱼生化指标和肝脏HSP70 mRNA表达的影响[J]. 海洋与湖沼,2012,43(5):943-953. ( 3) 3)
|
| [25] | DEUCHI K,KANAUCHI O,IMASATO Y,et al.Decreasing effect of chitosan on the apparent fat digestibility by rats fed on a high-fat diet[J]. Bioscience,Biotechnology,and Biochemistry,1994,58(9):1613-1616. ( 1) 1)
|
| [26] | WOLF P L.Clinical significance of an increased or decreased serum alkaline phosphatase level[J]. Archives of Pathology & Laboratory Medicine,1978,102(10):497-501. ( 1) 1)
|
| [27] | 文远红,曹俊明,黄燕华,等.蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能、体组成和血浆生化指标的影响[J]. 动物营养学报,2013,25(1):171-181. ( 1) 1)
|
| [28] | ŠKUGOR S,ŠKUGOR A,TODORĈEVIĆ M,et al.Exposure to lipopolysaccharide induces immune genes in cultured preadipocytes of Atlantic salmon[J]. Fish & Shellfish Immunology,2010,29(5):817-824. ( 1) 1)
|
| [29] | 王红卫,孙敏敏,孟晓,等.不同分子质量壳寡糖对蛋鸡生产性能、肠道微生物及脾脏白细胞介素-2和肿瘤坏死因子-α基因表达的影响[J]. 动物营养学报,2013,25(11):2660-2667. ( 2) 2)
|
| [30] | 张小边.壳寡糖对巨噬细胞IL-1β、TNF-α基因表达的影响[D]. 硕士学位论文.杭州:浙江大学,2002. ( 2) 2)
|
| [31] | 纪莹.壳寡糖对经IFN-γ预刺激的巨噬细胞IL-1β、TNF-α基因表达的影响[D]. 硕士学位论文.杭州:浙江大学,2003. ( 2) 2)
|




