黄曲霉毒素主要由黄曲霉(Aspegillus flavus)和寄生曲霉(A. parasitius)产生的一类结构类似物,其中以黄曲霉毒素B1(aflatoxin B1,AFB1)毒性最强,检出率最高[1]。玉米赤霉烯酮(zearalenone,ZEN)是禾谷镰孢菌(Fusarium graminearum)等镰孢菌产生的一种有毒代谢产物。饲料被AFB1和ZEN污染带来的多种危害及其防治已被广泛研究[2]。截止目前,添加霉菌毒素吸附剂仍然是降低此类毒素危害常用的方法之一。吸附剂通过物理或化学方式吸附毒素,减少毒素在动物消化道的吸收,使之随粪便排出体外,从而达到减轻危害的目的[3, 4, 5, 6, 7]。由于用动物试验进行霉菌毒素吸附剂效能评价受到试验材料、时间和成本等多方面的限制,目前主要采用测定体外吸附率的方法进行快速筛选和评价。常用体外评价方法有纯水介质中的单一毒素浓度或梯度浓度等温吸附[6, 8]、缓冲液介质中的等温吸附[7, 9, 10]、模拟胃肠道条件下的吸附[9, 11, 12]等方法。霉菌毒素的吸附效率受吸附剂材料性质、吸附容量、毒素种类和吸附反应环境中其他成分等多种因素影响。饲料成分多样性及消化道中消化产物和动物内源分泌物的复杂性,进一步增加了建立适用于饲料和畜牧行业评价霉菌毒素吸附剂吸附效果方法的难度。
本文通过改进已有的AFB1和ZEN检测方法,建立适用于测定猪胃和小肠食糜上清液相应毒素的高效液相色谱(HPLC)法,并分别以纯水、猪胃和小肠食糜上清液为介质评价2种商用霉菌毒素吸附剂产品和本实验室自制的2个吸附剂样品对AFB1和ZEN的体外吸附效率,通过比较4种吸附剂在不同反应介质中对上述毒素吸附效率的差异,探讨影响霉菌毒素吸附的因素,为建立霉菌毒素吸附剂吸附效率评价的新方法奠定基础。
1 材料与方法 1.1 试验材料 1.1.1 仪器本试验所用仪器:HPLC仪(HITACHI D-2000,L-2485荧光检测器)、液相色谱柱(C18,150 mm×4.6 mm,5 μm,岛津)、荧光分光光度计(F-7000,日立)、紫外分光光度计(UV-2450,岛津)、振荡恒温金属浴(BG-100,杭州朗基)。
1.1.2 试剂本试验所用乙腈(Merk,南京荣华)为色谱纯,AFB1和ZEN标准品(Sigma公司)。其他试剂均为分析纯。
1.1.3 霉菌毒素吸附剂本实验室自制霉菌毒素吸附剂样品:以离子交换量不小于1 000 meq/kg的膨润土为基质,分别用长链脂肪酸铵盐和阳离子交换树脂对基质进行表面修饰制成,分别标记为P3和M3样品。市场采购的霉菌毒素吸附剂产品Y1和Y2,分别为经葡聚糖插层改性的膨润土和经甘露聚糖改性的沸石。
1.1.4 猪胃和小肠食糜上清液制备选用6头品种相同的育肥猪,出栏前10 d饲喂玉米-豆粕饲粮,屠宰后分别取胃和小肠食糜,3 000 r/min离心10 min,吸取上清液分装,-20 ℃保存。
1.1.5 AFB1和ZEN储备液和标准工作液标准储备液:将5.00 mg AFB1标准品溶于10 mL乙腈/苯(体积比为98 ∶ 2)溶液中,配制成500 μg/mL的AFB1储备液。取ZEN标准品10.00 mg溶于10 mL乙腈中,配制成1 000 μg/mL的ZEN储备液。
标准工作液:用纯水分别稀释AFB1和ZEN储备液为约20 μg/mL的标准工作液,紫外分光光度计测定AFB1[εAFB1=21 865 mol/(L·cm),λmax=362 nm]和ZEN[εZEN=13 909 mol/(L·cm),λmax=316 nm]标准工作液的准确含量。
混合标准工作液:分别用AFB1和ZEN标准工作液配制AFB1和ZEN浓度为0和0、2和100 ng/mL、4和400 ng/mL、6和800 ng/mL、10和1 000 ng/mL、20和1 500 ng/mL、50和5 000 ng/mL的混合标准液。
1.2 猪胃肠道液体介质中AFB1和ZEN含量的测定 1.2.1 检测条件优化检测波长筛选:采用荧光分光光度计分别对AFB1和ZEN标准溶液的激发光谱(200~600 nm)和发射光谱(200~600 nm)进行全波长扫描,选出AFB1和ZEN激发光谱和发射光谱中不重叠区的最大激发(Ex)和发射波长(Em)。
流动相优化:将乙腈/水流动相中乙腈比例分别设定为20%、30%、40%、50%、60%、70%和80%,根据上述毒素的分离效果和峰形选择适宜的乙腈比例。
提取条件:取0.5 mL猪胃食糜上清液,加入40 μg/mL的AFB1和ZEN各0.25 mL,2种毒素最终浓度均为10 μg/mL。依次用正己烷萃取1次,二氯甲烷萃取4次,分别收集每次的萃取液,氮气吹干,固形物用500 μL流动相溶解后用HPLC仪法测定AFB1和ZEN的含量,比较提取溶剂每次的毒素提取效率,计算毒素的总回收率。将二氯甲烷换成氯仿、乙酸乙酯或者石油醚,重复上述步骤,比较4种提取溶剂的提取效果。将猪胃食糜上清液换成猪小肠食糜上清液,重复以上步骤,比较猪小肠食糜上清液介质下4种提取溶剂对AFB1和ZEN的提取效果。
回收率:分别在猪胃和小肠食糜上清液中加入AFB1和ZEN标准液,使其浓度为0和0 ng/mL,20和500 ng/mL,1.0和2.5 μg/mL,5.0和10.0 μg/mL,按优化后的提取条件提取后,用HPLC测定AFB1和ZEN的回收量,计算其回收率。
1.2.2 检测方法考察指标线性和检测限:分别用AFB1和ZEN混合标准溶液的色谱峰面积(Y)和毒素浓度(X)绘制AFB1和ZEN的标准曲线;以信噪比的3倍所对应的毒素浓度作为最低检测限。
精密度:在上述色谱条件下测定同1天不同时间点(07:00、10:00、12:00、14:00、17:00)和连续5 d的AFB1和ZEN的浓度,分别计算日内精密度和日间精密度。
1.3 吸附剂在纯水中对AFB1和ZEN的吸附效果准确称取100.0 mg吸附剂于50 mL容量瓶中超纯水定容,混合均匀后,量取0.25 mL混合液于1.5 mL离心管中,加入20 μg/mL AFB1标准工作液0.25 mL,37 ℃金属浴振荡1 200 r/min吸附24 h。10 000 r/min离心10 min,HPLC法测定上清液中AFB1含量,计算体外吸附率。按照上述方法测定ZEN的体外吸附率。
1.4 吸附剂在猪胃和肠食糜上清液中对AFB1和ZEN的吸附效果准确称取100.0 mg吸附剂于50 mL容量瓶中,分别用猪胃和小肠食糜液上清液定容,混合均匀,取混合液200 μL于1.5 mL离心管中,加入40 μg/mL的AFB1标准溶液和ZEN溶液各100 μL,上述毒素浓度均为10 μg/mL,吸附剂浓度为1 mg/mL,37 ℃金属浴1 200 r/min吸附8 h,10 000 r/min离心10 min,根据1.2中方法测定上清液中AFB1和ZEN浓度,计算吸附剂对AFB1和ZEN的吸附率。
1.5 结果计算吸附剂对AFB1和ZEN吸附率计算公式:
R(%)=[(C0V0-X)/C0V0]×100。
式中:C0为吸附前溶液中毒素浓度(μg/mL);V0为加入毒素标准溶液的体积(mL);X为由标准曲线查出的样液中毒素含量(μg);R为吸附剂对毒素吸附率(%)。
1.6 统计方法试验结果用平均值±标准差表示,采用SPSS 18.0统计软件的one-way ANOVA对每种吸附剂在3种介质中的吸附率进行方差分析,差异显著性用Duncan氏法进行多重比较,以P<0.05作为各项差异显著的检验水平。
2 结果与分析 2.1 霉菌毒素检测方法条件的筛选检测波长:经过对AFB1和ZEN激发和发射波谱分析,同时参照欧盟的检测波长[13, 14]确定AFB1的最佳激发和发射波长分别为360和440 nm,ZEN的最佳激发和发射波长分别为235和418 nm。根据2种毒素的出峰时间,将0~9 min检测器的激发和发射波长分别设定为360和440 nm以测定AFB1浓度,9~14 min的激发和发射波长分别设定为235和418 nm,以测定ZEN浓度。
流动相:乙腈-水流动相中乙腈比例大于40%时,AFB1保留时间过短,不利于AFB1与样品中杂质的分离,小于60%时ZEN峰变宽且有拖尾现象,故采用乙腈比例0~4 min为40%,4~6 min为45%,9~14 min为60%的梯度洗脱。在此条件下可获得理想的分离效果,标准混合溶液(AFB1和ZEN浓度分别为10和1 000 ng/mL)和样品色谱图见图1。
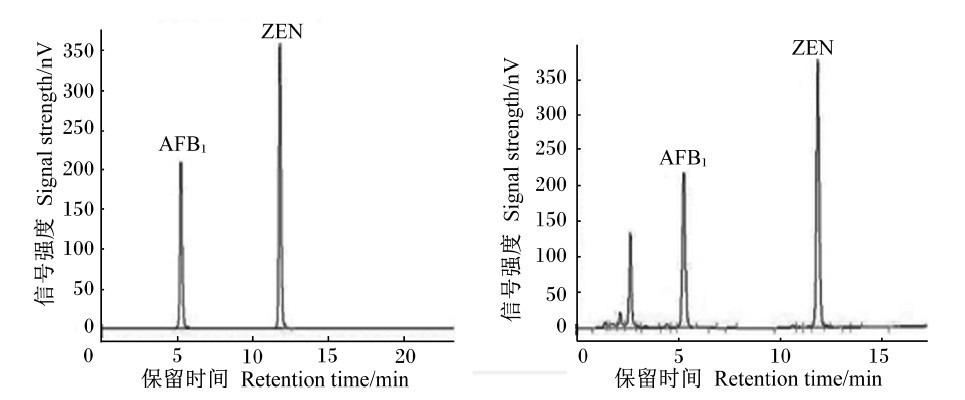 | 图1 混合标准溶液(左)和猪胃肠液中加入混合标准液后(右)AFB1和ZEN的HPLC法色谱图 Fig. 1 The HPLC chromatograms of AFB1 and ZEN in standard solution (left) and that after added in gastrointestinal supernatant of pigs (right) |
萃取条件:乙酸乙酯对ZEN、石油醚对AFB1的萃取效率低(数据未列出)。正己烷和二氯甲烷组合使用对AFB1和ZEN的提取效果较为理想,结果如表1,经正己烷萃取1次,二氯甲烷萃取2次可以完全提取样品中的AFB1,经1次正己烷和3次二氯甲烷萃取可以完全提取样品中的ZEN,故试验采取1次正己烷萃取和3次二氯甲烷萃取。
| 表1 正己烷和二氯甲烷萃取AFB1和ZEN的回收率 Table 1 The recoveries of AFB1 and ZEN extracted by n-hexane and dichloromethane |
回收率:在猪胃和小肠食糜上清液中加入已知浓度的2种毒素,经优化方案提取后,2种毒素的回收率如表2。猪胃食糜上清液中AFB1的回收率为89.8%~110.3%,ZEN为99.3%~102.5%;猪小肠食糜上清液中AFB1的回收率为90.9%~102.9%,ZEN为98.7%~104.0%。
| 表2 AFB1和ZEN在猪胃和小肠食糜上清液中回收率 Table 2 The recoveries of AFB1 and ZEN from gastric and intestinal chyme supernatant of pigs |
线性和检测限:在上述色谱条件下,AFB1浓度在0~50 ng/mL范围内的标准曲线回归方程为Y=0.000 3X+0.154 9,回归系数为1.000,检出限为0.16 ng/mL;ZEN的浓度在0~5 000 ng/mL之间的回归方程为Y=0.000 9X-7.005 6,回归系数为0.999,检出限为2.0 ng/mL。
精密度:HPLC法测定同一样品在同一天中5个时间点的AFB1和ZEN浓度,AFB1浓度的测定值分别为836.00、836.60、833.90、831.50和830.60 ng/mL,其日内精密度标准差为2.37%;ZEN浓度的测定值分别为514.20、516.40、523.20、524.90和524.80 ng/mL,其日内精密度标准差为4.50%。HPLC法连续5 d测定同一样品AFB1和ZEN浓度,AFB1浓度的测定值分别为836.00、835.70、832.40、831.40和828.70 ng/mL,日间精密度标准差为2.74%,ZEN浓度的测定值分别为514.20、490.70、493.20、496.00和490.70 ng/mL,其日间精密度标准差为8.84%。
2.3 不同介质中吸附剂对AFB1和ZEN的吸附效果纯水、猪胃和小肠食糜上清液介质中4种吸附剂对AFB1的吸附效果如表3所示,吸附率均在60.0%(吸附量6 μg/mL)以上,纯水环境中吸附剂对AFB1的吸附率与猪胃和小肠食糜上清液介质中差别较大。纯水环境中,吸附剂Y1和Y2的吸附率显著低于猪胃和小肠食糜上清液(P<0.05),吸附剂P3的吸附率显著高于猪胃和小肠食糜上清液(P<0.05),吸附剂M3在纯水介质中的吸附率与小肠食糜上清液无显著差异(P>0.05),但显著高于胃食糜上清液(P<0.05),这与胃肠道复杂的消化产物和动物内源分泌物有关。除Y2外,小肠食糜上清液介质中3种吸附剂对AFB1的吸附率显著高于胃食糜上清液(P<0.05),这可能是因为胃食糜上清液环境中高浓度的氢离子(H+)吸附在吸附剂有效吸附位点上,与AFB1形成了竞争效应。
| 表3 不同反应介质中吸附剂对AFB1的吸附率 Table 3 The binding efficacy of AFB1 absorption in different media |
4种吸附剂在纯水、猪胃和小肠食糜上清液介质中对ZEN的吸附效果如表4所示,猪胃和小肠食糜上清液介质下吸附剂M3和P3对ZEN的吸附率显著低于纯水介质(P<0.05),吸附效果受介质环境的影响较大。除吸附剂P3和Y2外,猪小肠食糜上清液介质中吸附剂的吸附率显著高于胃食糜上清液环境(P<0.05),这主要是因为酸性环境下ZEN只以疏水力结合在吸附剂的表面,中性或碱性环境下,ZEN阴离子增加了与土层边缘羟基以静电作用结合的吸附位点[10]。对于吸附剂M3和P3,纯水环境中的吸附率显著高于猪胃和小肠食糜上清液环境(P<0.05),这可能是复杂的消化产物或者消化道分泌物与ZEN产生了竞争性吸附作用。
| 表4 不同反应介质下吸附剂对ZEN的吸附率 Table 4 The binding efficacy of ZEN absorption in different media |
我国通常采用半定量薄层色谱法(GB/T 8381—2008)和HPLC法(NY/T 1286—2007)测定饲料及饲料原料中AFB1的浓度。其中前者用水和三氯甲烷提取AFB1,以正己烷、乙醚和硅藻土层析柱纯化样品;后者使用甲醇水溶液提取AFB1,以石油醚和三氯甲烷纯化样品。国家标准GB/T 5009.209—2008采用乙腈/水提取谷物中ZEN,再经免疫亲和柱净化。此法免疫亲和柱净化所需时间较长,成本较高。本试验提纯猪胃和小肠食糜上清液中AFB1和ZEN时借鉴国家标准测定AFB1的提取纯化溶剂,同时参考Krska等[15]提纯饲料和谷物中ZEN时采用的乙酸乙酯、乙腈、甲醇和氯仿等有机溶剂和Sprynskyy等[16]提纯人 工胃液中ZEN的正己烷和二氯甲烷,选取正己烷、氯仿、乙酸乙酯、石油醚和二氯甲烷5种有机溶剂对猪胃和小肠食糜上清液中AFB1和ZEN的提取纯化效果进行了探讨。结果显示,用1次正己烷和3次二氯甲烷萃取后,可完全提取猪胃和肠食糜上清液中的AFB1和ZEN,简化了国家标准的乙腈/水方法提取ZEN及免疫亲和柱纯化步骤,大大降低了测定成本。
本试验参照欧盟测定谷物中黄曲霉毒素和ZEN的方法[13, 14],通过荧光分光光度计分别对AFB1和ZEN标准溶液的激发光谱和发射光谱进行全波长扫描,优化了检测器的激发和发射波长;通过乙腈/水的梯度洗脱可同时测定猪胃和小肠食糜上清液中AFB1和ZEN浓度。本方法对ZEN的检出限为2.00 ng/mL,低于国家标准的方法中5 ng/mL的检出限和欧盟检测ZEN的3.00~6.00 ng/mL检出限,其回收率在89.1%~110.3%,符合欧盟对检测方法回收率在70.0%~110.0%的要求。上述改进后的方法可节省样品过免疫亲和柱时间,减少工作量和检测费用,同样优于美国公职分析化学师协会(AOAC)检测黄曲霉毒素和ZEN的方法[17, 18]。猪胃和小肠食糜上清液不仅含有饲料脂肪和蛋白质等的代谢产物,还有消化酶、胆汁酸及其盐类和脱落的消化道上皮细胞等内源物,因此本方法可能也适用于饲料中AFB1和ZEN的检测。本方法是目前为止较为快速经济的AFB1和ZEN的检测方法,可以满足本试验猪胃和小肠食糜上清液同时测定AFB1和ZEN浓度的需求。
3.2 霉菌毒素吸附剂的评价方法体内试验虽然可以真实地评价霉菌毒素吸附剂在动物体内的效果[19, 20],但受到试验动物的年龄、体重、饲喂阶段和饲粮的影响,以及试验周期长、成本高等的限制,因此体外试验仍然是评价吸附剂吸附效果的常用方法。纯水介质条件简单、易于操作,只适合对吸附剂进行快速的初步筛选。Lemke等[10]研究了不同pH的水溶液中有机蒙脱石对ZEN的吸附效果,结果表明在不同pH环境下蒙脱石具有不同的结合位点和吸附能力。Pimpukdee等[7]按照Lemke等[10]的方法评价不同pH水溶液中吸附剂NovaSil plus对AFB1的吸附效果,结果显示在不同pH环境下吸附剂对AFB1均有良好吸附效果,并且在动物试验中能减轻AFB1对肉鸡的伤害。由于纯水与胃和小肠食糜上清液真实环境在离子强度等干扰因素方面有明显差别,Dll等[21]用不同pH的磷酸盐-柠檬酸盐缓冲液模拟动物胃肠道环境,用于评价霉菌毒素吸附剂对ZEN和DON的吸附效果。缓冲盐溶液模拟胃肠道环境的评价方法可以固定温度和pH,易于控制试验条件,但其缺少动物消化道中消化酶等内源消化物。Magnoli等[22]比较了纯水、不同pH的缓冲液和奶牛瘤胃液环境下钠基膨润土对AFB1的吸附效果,发现pH相近的纯水、缓冲液和瘤胃液环境吸附剂对AFB1吸附效果呈正相关的L型等温吸附曲线。Moschini等[23]分别在纯水、低pH和高pH瘤胃液中评价了吸附剂Atox对AFB1的吸附效果并将吸附剂-毒素复合物投入奶牛瘤胃中,发现在低pH和高pH瘤胃液介质中具有高吸附率的吸附剂Atox同样可以减少牛奶中AFM1的排出量。本试验通过比较纯水、猪胃和小肠食糜上清液中4种吸附剂对AFB1和ZEN的吸附效率,发现小肠食糜上清液对ZEN的吸附率显著高于胃,这与Avantaggiato等[11]在消化酶、胰液和胆汁模拟胃肠道模型中评价消胆胺和活性炭对ZEN的结果一致;吸附剂P3和M3在猪胃肠道环境下对AFB1有较好的吸附效果,其添加到饲粮中可能会减轻AFB1对动物的伤害。猪胃肠道环境中评价吸附剂的吸附效果是一种测定霉菌毒素体外吸附率的可行方法,但该方法在其他动物胃肠道中的适用性还有待进一步研究。在猪胃肠液中吸附效果较好的吸附剂仍需要动物体内试验来验证真实的吸附效果。
4 结 论① 本试验建立了同时测定胃和小肠食糜上清液中AFB1和ZEN的HPLC法。
② 本方法可用于猪胃和小肠食糜上清液介质中评价吸附剂对AFB1和ZEN的体外吸附效率。
| [1] | Council for Agricultural Science and Technology.Mycotoxins:risks in plant,animal and human systems[M]. Wisconsin:Council for Agricultural Science and Technology,2003:1-191. ( 1) 1)
|
| [2] | ZAIN M E.Impact of mycotoxins on humans and animals[J]. Journal of Saudi Chemical Society,2011,15(2):129-144. ( 1) 1)
|
| [3] | DEVREESE M,DE BACKER P,CROUBEL S.Different methods to counteract mycotoxin production and its impact on animal health[J]. Vlaams Diergeneeskundig Tijdschrift,2013,82(4):181-190. ( 1) 1)
|
| [4] | 齐德生.蒙脱石改性前后对AFB1和营养成分的吸附及对AFB1的脱毒效果[D]. 博士学位论文.武汉:华中农业大学,2003:75-85. ( 1) 1)
|
| [5] | YIANNIKOURIS A,ANDRÉ G,BULÉON A,et al.Comprehensive conformational study of key interactions involved in zearalenone complexation with β-D-glucans[J]. Biomacromolecules,2004,5(6):2176-2185. ( 1) 1)
|
| [6] | MARROQUÍN-CARDONA A,DENG Y,TAYLOR J F,et al.In vitro and in vivo characterization of mycotoxin-binding additives used for animal feeds in Mexico[J]. Food Additives and Contaminants,2009,26(5):733-743. ( 2) 2)
|
| [7] | PIMPUKDEE K,KUBENA L F,BAILEY C A,et al.Aflatoxin-induced toxicity and depletion of hepatic vitamin a in young broiler chicks:protection of chicks in the presence of low levels of Novasil Plus in the diet[J]. Poultry Science,2004,83(5):737-744. ( 3) 3)
|
| [8] | PHILLIPS T D.Dietary clay in the chemoprevention of aflatoxin-induced disease[J]. Toxicological Sciences,1999,52(Suppl.1):118-126. ( 1) 1)
|
| [9] | LEMKE S L,OTTINGER S E,MAYURA K,et al.Development of a multi-tiered approach to the in-vitro prescreening of clay-based enterosorbents[J]. Animal Feed Science and Technology,2001,93(1):17-29. ( 1) 1)
|
| [10] | LEMKE S L,GRANT P G,PHILLIPS T D.Adsorption of zearalenone by organophilic montmorillonite clay[J]. Journal of Agricultural and Food Chemistry,1998,46(9):3789-3796. ( 4) 4)
|
| [11] | AVANTAGGIATO G,HAVENAAR R,VISCONTI A.Evaluation of the intestinal absorption of deoxynivalenol and nivalenol by an in vitro gastrointestinal model,and the binding efficacy of activated carbon and other adsorbent materials[J]. Food and Chemical Toxicology,2004,42(5):817-824. ( 2) 2)
|
| [12] | AVANTAGGIATO G,HAVENAAR R,VISCONTI A.Assessing the zearalenone-binding activity of adsorbent materials during passage through a dynamic in vitro gastrointestinal model[J]. Food and Chemical Toxicology,2003,41(10):1283-1290. ( 1) 1)
|
| [13] | KOLOSOVA A,STROKA J.Evaluation of the effect of mycotoxin binders in animal feed on the analytical performance of standardised methods for the determination of mycotoxins in feed[J]. Food Additives & Contaminants Part A:Chemistry Analysis Control Exposure & Risk Assessment,2009,29(12):1959-1971. ( 2) 2)
|
| [14] | ANKLAM E,STROKA J,BOENKE A.Acceptance of analytical methods for implementation of EU legislation with a focus on mycotoxins[J]. Food Control,2002,13(3):173-183. ( 2) 2)
|
| [15] | KRSKA R,JOSEPHS R.The state-of-the-art in the analysis of estrogenic mycotoxins in cereals[J]. Fresenius' Journal of Analytical Chemistry,2001,369(6):469-476. ( 1) 1)
|
| [16] | SPRYNSKYY M,GADZALA-KOPCIUCH R,NOWAK K,et al.Removal of zearalenone toxin from synthetics gastric and body fluids using talc and diatomite:a batch kinetic study[J]. Colloids and Surfaces B:Biointerfaces,2012,94:7-14. ( 1) 1)
|
| [17] | STROKA J,HOLST C,ANKLAM E,et al.Immunoaffinity column cleanup with liquid chromatography using post-column bromination for determination of aflatoxin B1 in cattle feed:collaborative study[J]. Journal of AOAC International,2003,86(6):1179-1186. ( 1) 1)
|
| [18] | ARRANZ I,MISCHKE C,STROKA J,et al.Liquid chromatographic method for the quantification of zearalenone in baby food and animal feed:interlaboratory study[J]. Journal of AOAC International,2007,90(6):1598-1609. ( 1) 1)
|
| [19] | 刘媛婷.霉菌毒素吸附剂对黄曲霉毒素B1吸附特性及效果研究[D]. 硕士学位论文.雅安:四川农业大学,2011:38-43. ( 1) 1)
|
| [20] | MIAZZO R,ROSA C A R,CARVALHO E C D Q,et al.Efficacy of synthetic zeolite to reduce the toxicity of aflatoxin in broiler chicks[J]. Poultry Science,2000,79(1):1-6. ( 1) 1)
|
| [21] | DÖLL S,DÄNICKE S,VALENTA H,et al.In vitro studies on the evaluation of mycotoxin detoxifying agents for their efficacy on deoxynivalenol and zearalenone[J]. Archives of Animal Nutrition,2004,58(4):311-324. ( 1) 1)
|
| [22] | MAGNOLI A P,ALONSO V A,CAVAGLIERI L R,et al.Effect of monogastric and ruminant gastrointestinal conditions on in vitro aflatoxin B1 adsorption ability by a montmorillonite[J]. Food Additives & Contaminants:Part A,2013,30(4):743-749. ( 1) 1)
|
| [23] | MOSCHINI M,GALLO A,PIVA G,et al.The effects of rumen fluid on the in vitro aflatoxin binding capacity of different sequestering agents and in vivo release of the sequestered toxin[J]. Animal Feed Science and Technology,2008,147(4):292-309. ( 1) 1)
|




