黄曲霉毒素B1(AFB1)是一种强致癌物质,被联合国癌症委员会确定为一类致癌物[1]。温暖潮湿气候的粮食和饲料[2]极易污染AFB1,尤其是谷物、棉籽和花生在收割前后均易污染AFB1[3]。动物摄入AFB1后,在肝脏中通过微粒体细胞色素P-450转化为黄曲霉毒素M1(AFM1),AFM1也是一种强致癌物,通过血液循环进入到乳中,危害食品安全。因此非常有必要研究饲料中AFB1通过动物机体代谢转化到乳中AFM1的分泌规律及转化率,为有效控制饲料中AFB1污染对乳品质量安全的影响提供基础数据。
为了减少人类和动物污染黄曲霉毒素,许多国家对奶畜饲料中AFB1和乳中AFM1均设置了最大限量值,然而这些限量值在不同国家之间变化范围比较大。对于饲料,欧盟奶畜全价饲料中AFB1限量值是5 μg/kg[4],美国动物饲料和奶畜饲料原料中黄曲霉毒素总和的限量值是20 μg/kg[5],我国奶畜精饲料中AFB1限量值是10 μg/kg。对于乳的限量,欧盟对于液态乳和乳产品等设置的限量值是0.05 μg/kg,婴幼儿用乳中是0.025 μg/kg,美国食品药品监督管理局(FDA)和我国的限量值均是0.5 μg/kg。
对于饲料中AFB1与乳中AFM1的相关性,已有一些学者进行了相关研究[6, 7, 8, 9, 10],然而这些研究主要是给奶畜饲喂一段时间自然霉变的饲料,探讨乳中AFM1的变化。实践中可能也会发生只饲喂1次AFB1污染的饲料导致乳中AFM1超过限量值[8],然而对动物只饲喂1次AFB1污染的饲料导致乳中AFM1变化的研究较少。因此,本试验通过给奶山羊饲喂一次性单一剂量的AFB1,研究乳中AFM1的分泌规律及转化率,旨在对实践中偶然发生AFB1污染进行准确风险分析。
1 材料与方法 1.1 试验动物和饲养管理选择3只健康、体重在(35.00±2.65) kg的泌乳中期[泌乳天数(150±12) d]关中奶山羊,产奶量为(0.36±0.03) kg,胎次为2~3胎。试验羊单笼饲养,每天于08:00和16:00以先粗后精顺序分2次饲喂饲粮,饲粮的精粗比是50 ∶ 50,精饲料饲喂600 g/(d·只),苜蓿饲喂376 g/(d·只),青干草274 g/(d·只),自由饮水。试验之前,奶山羊每天挤奶2次,08:30和16:30。
1.2 基础饲粮基础饲粮满足NRC(1981)奶山羊(体重为35 kg)的推荐量,并参照我国奶山羊饲养标准[11]配制。基础饲粮组成及营养水平见表1。
| 表1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
根据Battacone等[8, 12]的试验方法,本试验每只奶山羊饲喂1 mg AFB1,试验所用AFB1为粉末(纯度为99.9%),用甲醇溶解后添加到300 g精饲料中,用于08:00的饲喂,添加后精饲料中AFB1的含量为3 333.3 μg/kg。
在饲喂AFB1后0、4、8、24、32、48、56、72、80、96、104及120 h记录每只羊的产奶量并采集乳样,冷冻保存。
1.4 测定指标 1.4.1 羊乳中AFM1含量羊乳中AFM1含量的检测方法参照GB 5413.37—2010,具体步骤如下。
1.4.1.1 试液提取称取20.00 g(精确至0.01 g)混匀的乳样,置于50 mL具塞离心管中,在水浴中加热到35~37 ℃。在6 000 r/min下离心10 min。收集全部上清液,供净化用。
1.4.1.2 净化① 免疫亲和柱的准备。将一次性的50 mL注射器筒与亲和柱上顶部相串联,再将亲和柱与固相萃取装置连接起来。
② 试样的纯化。将以上试液提取液移至50 mL注射器筒中,调节固相萃取装置的真空系统,控制试样以2~3 mL/min稳定的流速过柱。取下50 mL的注射器筒,装上10 mL注射器筒。注射器筒内加入水,以稳定的流速洗柱,然后,抽干亲和柱。脱开真空系统,在亲和柱下部放入10 mL刻度试管,上部装上另一个10 mL注射器筒,加入4 mL乙腈,洗脱AFM1,洗脱液收集在刻度试管中,洗脱时间不少于60 s。然后用氮气缓缓地在30 ℃下将洗脱液蒸发至近干(如果蒸发至干,会损失AFM1),用乙腈水溶液(10%)稀释至1 mL。 1.4.1.3 检测条件
采用高效液相色谱(HPLC)串联质谱检测,仪器设备型号为waters UPLC/Quattro Premier-XE。
① HPLC条件。色谱柱:ACQUITY UPLC BEH-C18,1.7 μm,2.1 mm(内径)×100 mm;流动相:A液,0.1%甲酸溶液,B液,乙腈梯度洗脱;流 动相流速:0.3 mL/min。柱温:35 ℃;进样量: 5 μL;保留时间:3.42 min。
| 表2 高效液相色谱洗脱条件 Table 2 The elution condition for HPLC |
② 质谱条件。毛细管电压:2.5 kv;离子源温度:120 ℃;脱溶剂气流:氮气,600 L/h;脱溶剂气温度:450 ℃;碰撞室压力:3.0×10-4 kPa;扫描方式:正离子模式(ESI+);检测方式: 多反应监测(MRM);定量离子:328.88>258.94,碰撞能量:25 eV;定性离子:328.88>272.95,碰撞能量:25 eV。
1.4.2 羊乳中AFM1的转化率AFM1各时间点转化率(%)=100×AFM1
各时间点含量×各时间点产奶量/AFB1添加量;
AFM1总转化率(%)=∑AFM1各时间点转化率。
试验数据基本处理采用Excel 2007,数据统计分析采用SAS 9.0进行方差分析,平均值的多重比较采用Duncan氏法进行。
2 结果与分析 2.1 饲喂AFB1对各试验羊乳中AFM1分泌规律的影响由图1可知,饲喂AFB1前,3只羊的乳中均未检出AFM1,但是在饲喂AFB1后4 h收集的羊乳中,3只羊均检出了AFM1。在1号和2号羊乳中,峰值出现在饲喂AFB1后的4 h,而在3号羊乳中,峰值出现在8 h。在峰值之后,所有羊乳中AFM1含量迅速下降,在120 h时,只有1号羊乳中未检出AFM1,2号和3号羊乳中仍有微量AFM1检出。虽然3只羊乳中AFM1分泌曲线相似,即呈先增加后下降趋势,但是单一曲线在上升过程中差异较大,2号和3号羊乳中AFM1上升幅度比1号羊大。
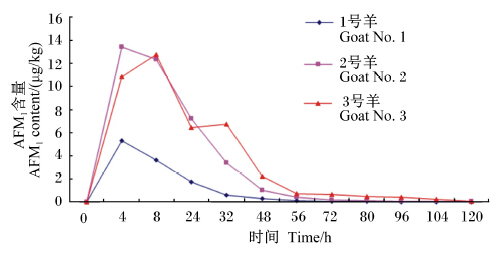 | 图1 饲喂AFB1后各试验羊乳中AFM1含量的分泌规律 Fig. 1 Excretion pattern of AFM1 content in milk of experimental goats after fed AFB1 |
2.2 饲喂AFB1对羊乳中AFM1平均含量的 分泌规律的影响
由图2可知,饲喂AFB1后,羊乳中AFM1的平均含量呈现先增加后下降的趋势,在4 h时达到峰值9.89 μg/kg,接近我国限量值0.5 μg/kg的20倍;在峰值之后,羊乳中AFM1平均含量减少比较快,在56 h时含量为0.39 μg/kg,低于我国限量值,到120 h为0.02 μg/kg,低于欧盟限量值0.05 μg/kg;在4和8 h时,AFM1平均含量显著高于以后其他各时间点(P<0.05),24 h时AFM1的 平均含量显著高于56 h及以后其他各时间点(P<0.05),32 h及以后各时间点之间AFM1平均含量差异不显著(P>0.05)。
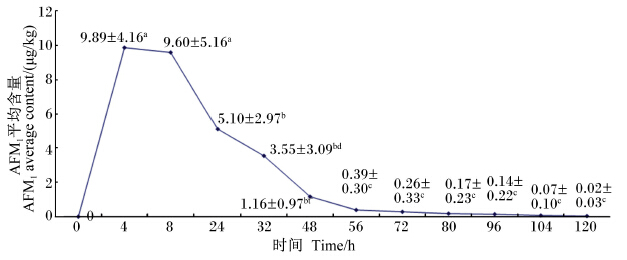 | 数据肩标不同小写字母表示差异显著(P<0.05)。 Values with different small letter superscripts mean significant difference (P<0.05).图2 饲喂AFB1后试验羊乳中AFM1平均含量的分泌规律 Fig. 2 Excretion pattern of AFM1 average content in milk of experimental goats fed AFB1 |
2.3 饲喂AFB1对羊乳中AFM1平均转化率的影响
由图3可知,随着取样时间的延长,AFB1转化为AFM1的平均转化率逐渐降低,到80 h时为0。其中AFB1转化为AFM1的总转化率为0.53%;饲喂AFB1后4 h时转化率最高为0.19%,8和24 h次之,这3个时间点平均转化率的和为0.43%。
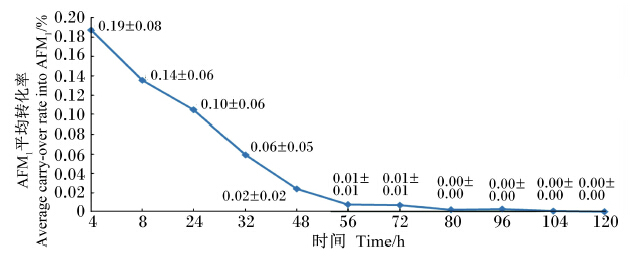 | 图3 饲料中AFB1转化为羊乳中AFM1的平均转化率的变化 Fig. 3 The change of average carry-over rate of AFB1 into AFM1 in milk of goats |
3 讨 论 3.1 饲喂AFB1后对试验羊乳中AFM1含量的分泌规律的影响
Battacone等[12]报道,给5只奶山羊饲喂单一剂量AFB1后,羊乳中AFM1在上升过程中变化比较大,但5只羊乳中AFM1分泌曲线却相似,这与本试验结果相似。Battacone等[12]给奶山羊饲喂0.8 mg AFB1,在饲喂后3 h时采集乳样检出了AFM1;Gallo等[13]给奶牛饲喂4.9 mg的AFB1,饲喂5 min后采血检出了AFM1;Cook等[14]给肉牛饲喂0.2~0.8 mg/kg BW的混合黄曲霉毒素(AFB1为75%),饲喂后30 min在血液中检出了AFM1,这些结果与本试验结果相似,表明AFB1在成年反刍动物的胃肠道吸收非常快,并且它的羟基化合物AFM1也很快分泌到乳中。
Battacone等[12]报道,给奶山羊饲喂单一剂量AFB1后,羊乳中AFM1的峰值在饲喂后3和6 h达到,为0.6~1.8 μg/kg,这一结果不同于本试验结果4和8 h(5.32~13.47 μg/kg),本试验AFM1峰值含量是Battacone等[12]试验结果的7.5~8.9倍。可能的原因有AFB1不同的喂量、奶山羊的品种、产奶量及体重等。本试验AFB1的喂量是1 mg,奶山羊为关中奶山羊,平均产奶量是0.36 kg,平均体重是35 kg,而Battacone等[12]饲喂的量是0.8 mg,奶山羊为萨能奶山羊,平均产奶量是3.35 kg,平均体重是59 kg,但不同饲粮也可能是导致2个试验峰值AFM1含量不同的原因,本试验饲喂的饲粮是精饲料、青干草与苜蓿,而Battacone等[12]饲喂的只是精饲料和干草,不含苜蓿,因此不同饲粮影响AFB1在瘤胃中的降解不同,导致羊乳中AFM1含量也不同。
3.2 饲喂AFB1对羊乳中AFM1平均含量 分泌规律的影响Battacone等[12]报道,给奶山羊饲喂AFB1后,羊乳中AFM1含量在3和6 h极显著高于其他时间点,与本试验结果AFM1平均含量在4 和8 h显著高于其他各时间点相似。
Battacone等[9]报道,给奶山羊连续7 d饲喂AFB1[128 μg/(d·只)],羊乳中AFM1的含量在2~7 d达到一个稳定值,停止饲喂AFB1后,羊乳中AFM1含量迅速下降,在停止饲喂4 d后,羊乳中检测不到AFM1;Battacone等[12]报道,给奶山羊饲喂1次AFB1(0.8 mg),84 h时检测不到羊乳中AFM1;本试验饲喂1次AFB1(1 mg),在饲喂后第5天早晨(120 h)所采集的羊乳中有微量AFM1被检出(0.02 μg/kg),不同于Battacone等[9,12]的试验结果,可能是AFB1饲喂量、饲粮及产奶量不同所致。
Battacone等[12]报道,在饲喂AFB1后36 h收集的羊乳中,AFM1含量低于欧盟限量值0.05 μg/kg;本试验结果表明,120 h羊乳中AFM1含量低于欧盟限量值。
3.3 饲喂AFB1对羊乳中AFM1平均转化率的影响本试验饲喂AFB1后4、8和24 h 3个时间点AFM1平均转化率之和为0.43%,占AFM1总转化率的81%,暗示了AFB1转化为AFM1主要在AFB1饲喂后的开始时间,即24 h内。Battacone等[8,12]报道AFB1转化为AFM1的总转化率为0.032%~0.170%,Helferich等[15]报道AFB1转化为AFM1的总转化率为0.18%~0.38%,Nageswara等[16]报道AFB1转化为AFM1的总转化率为0.40%,而本试验结果表明,AFB1转化为AFM1的总转化率为0.53%,均高于上述研究结果,可能是AFB1的饲喂量、不同的饲粮及奶山羊产奶量不同所致。
4 结 论① 饲喂AFB1前,羊乳中未检出AFM1,但是饲喂AFB1后4~8 h,羊乳中AFM1含量达到峰值,在峰值之后AFM1含量减少比较快。
② 各时间点AFB1转化为AFM1的最大平均转化率为0.19%,出现在4 h;饲喂AFB1后24 h内的AFM1平均转化率之和占AFM1总转化率的81%。
| [1] | IARC.Some naturally occurring substances:food items and constituents,heterocyclic aromatic amines and mycotoxins[M]. Lyon:World Health Organization,1993. ( 1) 1)
|
| [2] | COTTY P J,JAIME-GARCIA R.Influences of climate on aflatoxin producing fungi and aflatoxin contamination[J]. Food Microbiol,2007,119:109-115. ( 1) 1)
|
| [3] | RICHARD J L.Some major mycotoxins and their mycotoxicoses-an overview[J]. Food Microbiol,2007,119:3-10. ( 1) 1)
|
| [4] | Commission of The European Communities.European Commission Directive 2003/100/EC of 31 october 2003 amending annex Ⅰ to directive 2002/32/EC of the European Parliament and of the Council on undesirable substances in animal feed[J].European Journal of Communication,2003,285:33-37. ( 1) 1)
|
| [5] | U.S.FDA.CPG Sec.683.100 action levels for aflatoxins in animal feeds[EB/OL].[2015-03-20]http://www.fda.gov/ICECI/ComplianceManuals/CompliancePolicyGuidanceManual/ucm074703.htm. ( 1) 1)
|
| [6] | SMITH E E,PHILLIPS T D,ELLIS J A,et al.Dietary hydrated sodium calcium aluminosilicate reduction of aflatoxin M1 residue in dairy goat milk and effects on milk production and components[J]. Journal of Experimental Animal Science,1994,72:677-682. ( 1) 1)
|
| [7] | VELDMAN A,MEIJS J A C, BORGGREVE G J,et al.Carryover of aflatoxin from cows' food to milk[J]. Animal Production Science,1992,55:163-168. ( 1) 1)
|
| [8] | BATTACONE G,NUDDA A,CANNAS A,et al.Excretion of aflatoxin M1 in milk of dairy ewes treated with different doses of aflatoxin B1[J]. Journal of Dairy Science,2003,86:2667-2675. ( 3) 3)
|
| [9] | BATTACONE G, NUDDA A,PALOMBA M,et al.Transfer of aflatoxin B1 from feed to milk and from milk to curd and whey in dairy sheep fed artificially contaminated concentrates[J]. Journal of Dairy Science,2005,88:3063-3069. ( 2) 2)
|
| [10] | BATTACONE G,NUDDA A,PALOMBA M,et al.The transfer of aflatoxin M1 in milk of ewes fed diet naturally contaminated by aflatoxins and effect of inclusion of dried yeast culture in the diet[J]. Journal of Dairy Science,2009,92:4997-5004. ( 1) 1)
|
| [11] | 金公亮.奶山羊饲养标准[J]. 畜牧兽医杂志,1989,8(2):7-12. ( 1) 1)
|
| [12] | BATTACONE G,NUDDA A,RASSU S P G,et al.Excretion pattern of aflatoxin M1 in milk of goats fed a single dose of aflatoxin B1[J]. Journal of Dairy Science,2012,95:2656-2661. ( 10) 10)
|
| [13] | GALLO A, MOSCHINI M,MASOERO F.Aflatoxins absorption in the gastro-intestinal tract and in the vaginal mucosa in lactating dairy cows[J]. Animal.Science,2008,7:53-63. ( 1) 1)
|
| [14] | COOK W O,RICHARD J L,OSWEILER G D,et al.Clinical and pathological changes in acute bovine aflatoxicoses:rumen motility and tissue and fluid concentrations of aflatoxin B1 and M1[J]. American Journal of Veterinary Research,1986,47:1817-1825. ( 1) 1)
|
| [15] | HELFERICH W G,BALDWIN R L,HSIEH D P.[14C]-aflatoxin B1 metabolism in lactating goats and rats[J]. Animal.Science,1986,62:697-705. ( 1) 1)
|
| [16] | NAGESWARA RAO S B,CHOPRA R C.Influence of sodium bentonite and activated charcoal on aflatoxin M1 excretion in milk of goats[J]. Small Ruminant Research,2001,41:203-213. ( 1) 1)
|



