2. 南宁学院, 南宁 530200
2. Nanning University, Nanning 530200, China
单宁是是一种抗营养因子,味涩,并且具有抑菌作用,影响动物对营养物质的利用[1, 2, 3]。降解单宁的微生物能够分泌一种酶,此酶可以对单宁产生抗性并使单宁发生降解[4, 5, 6, 7]。
一些家畜和野生动物(如绵羊、山羊、鹿和麋鹿)的消化道中有单宁降解菌,有助于这些动物利用高单宁饲料。Skene等[8]于1995年首次从饲喂富含单宁牧草的山羊瘤胃中分离出了的厌氧菌反刍月形单胞菌(Selenomonas ruminantium),该菌不仅能够降解单宁,还可以利用其降解产物;Odenyo等[9]在一些非洲反刍动物的瘤胃液中也发现耐受单宁或降解单宁的微生物;Goel等[10]从没有采食含单宁饲粮的山羊粪便中分离到6株可以分解单宁-蛋白质结合物的革兰氏阳性球菌(gram-positive cocci),并通过分析证明它们属于不同的D型粪链球菌(Enterococcus faecalis),其中降解单宁能力最强的粪链球菌GF1在含单宁4%的培养基上也可以正常生长;Singh[11]从放养山羊瘤胃中分离出16株厌氧单宁降解菌,其中1株菌能够耐受3.5%的单宁酸,并且能将单宁降解为没食子酸和焦棓酸,经分子生物学法鉴定为路德维希肠杆菌(Enterobacter ludwigii)GRT-1。
本试验从采食富含单宁的植物的原生态山羊瘤胃中分离好氧及兼性厌氧的细菌,通过单宁浓度耐受培养基和单宁酶活力鉴定培养基筛选降解单宁的细菌,并通过16S rDNA基因序列测定分析对4株菌进行初步鉴定,再将菌株在单宁浓度为0.5%、1%、1.5%的单宁酶诱导培养基中培养,进行胞内酶活力测定,以期为单宁降解菌在实际生产中应用提供理论基础。
1 材料与方法 1.1 试验材料 1.1.1 试验试剂及主要来源没食子酸丙酯:购于上海生工生物工程有限公司。单宁酸(分子质量1 701.20 ku)、蛋白胨、牛肉浸膏、琼脂、Taq酶、异丙基硫代半乳糖苷(IPTG)、X-gal、DNA Marker DL2000、胰蛋白胨、酵母提取物、氨苄青霉素(Sigma分装)、氯化钠、磷酸氢二钾、乙二胺四乙酸、氢氧化钠、饱和酚、氯仿、异戊醇、蛋白酶K、溶菌酶、十二烷基硫酸钠、柠檬酸、Tris、冰乙酸、无水乙醇均为分析纯,购于上海生工生物工程有限公司。引物:上海生工生物工程有限公司合成。
1.1.2 样品采集采集广西省天然山林放牧养殖的隆林山羊瘤胃,在无菌环境下刮取瘤胃上皮和取瘤胃内容物,过滤将样品的固液相分离,立即用于菌株分离。
1.1.3 培养基单宁浓度耐受培养基:牛肉浸膏2.5 g,蛋白胨5 g,琼脂6 g,氯化钠2.5 g,磷酸氢二钾1 g,50 mL灭菌瘤胃液,超纯水定容到450 mL,pH 7.2,灭菌,分别添加10%、20%、30%、40%的灭菌单宁酸水溶液50 mL,混合。得到的培养基单宁浓度分别为1%、2%、3%、4%。另配制用蒸馏水代替单宁酸水溶液的不含单宁的普通培养基。
单宁酶鉴定培养基a:牛肉浸膏2.5 g,氯化钠2.5 g,磷酸氢二钾1 g,蛋白胨5 g,琼脂6 g,50 mL灭菌瘤胃液,超纯水定容到400 mL,pH 4.5,灭菌,加15%的灭菌单宁酸水溶液50 mL,加0.04%的溴酚蓝水溶液50 mL,混合。
单宁酶鉴定培养基b:琼脂6 g,50 mL灭菌瘤胃液,超纯水定容到400 mL,pH 4.5,灭菌,加15%的灭菌单宁酸水溶液50 mL,加0.04%的溴酚蓝水溶液50 mL,混合。
单宁酶诱导培养基(液体):牛肉浸膏2.5 g,蛋白胨5 g,氯化钠2.5 g,磷酸氢二钾1 g,50 mL灭菌瘤胃液,超纯水定容到450 mL,pH 7.2,灭菌,分别添加5%、10%、15%的灭菌单宁酸水溶液50 mL,混合。得到的培养基单宁浓度分别为0.5%、1%、1.5%。
1.2 试验方法 1.2.1 菌株筛选[11] 1.2.1.1 初筛设A、B、C、D 4组,每组3个重复。A、B组接种瘤胃液,C、D组接种瘤胃固相内容物;A、C组0.27×10-3×g 37 ℃摇床过夜培养;B、D组放于37 ℃培养箱中静置培养。然后将A、B、C、D 4组富集培养的细菌接种到24个不加单宁的普通培养基上,37 ℃静置培养。再将24个培养基上的细菌转接到含不同单宁浓度耐受培养基上进行培养,将菌落纯化后,保存。
1.2.1.2 复筛1)将筛选出的几株菌分别接种到含单宁酶鉴定培养基a和b上,当菌落周围颜色变为黄色,则证明有单宁酶产生,观察颜色的变化,从而确定出酶活力较强的几株菌。
2)将1)中筛出的几株菌分别接种到不同单宁酶鉴定培养基上培养,比较酶活力。
3)将筛选出活力较高的菌株,分别接种于10 mL单宁酶诱导培养基中,37 ℃ 0.27×10-3×g振荡培养16~24 h,-80 ℃保存,用于菌株鉴定和酶活力测定。
1.2.2 菌种鉴定 1.2.2.1 所筛菌株基因组DNA的提取、PCR扩增提取所筛选菌株的基因组DNA,选用细菌通用引物,上游27F:5′-AGAGTTTGATCMTGGCTGAG-3′;下游1492R:5′-TACGGCTACCTTGTTACGACTT-3′。对山羊瘤胃内单宁降解菌的基因组DNA进行PCR扩增,终体积为25 μL,PCR反应条件为95 ℃ 10 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,72 ℃ 10 min,共30个循环[12]。
1.2.2.2 PCR产物的电泳检测取2~3 μL产物与1 μL溴酚蓝上样缓冲液混合,上样到1%的琼脂糖凝胶孔中,在100 V 60 mA条件下,电泳60 min,放置于溴化乙锭(EB)中染色15~20 min,并在紫外分析仪下观测,然后放于凝胶成像系统中拍照,保存备用。
1.2.2.3 PCR产物的克隆及测序纯化与载体连接:采用SanPrep柱式PCR产物纯化试剂盒进行纯化。连接反应采用pGEM-T载体试剂盒,将准备好的反应体系放于4 ℃孵育过夜,得到最大数目的转化菌落。
连接产物的转化:1)轻微离心使连接产物汇集到管底,取2 μL连接产物加到置于冰上的1.5 mL离心中,向管中加入50 μL的DH5α感受态细胞,轻轻混匀,并在冰浴中放置30min;2)42 ℃水浴中热激45 s后快速转至冰浴中2 min,注意在此过程不要摇动离心管;3)向离心管中加入灭菌的500 μL LB液体培养基(不含抗生素),混合均匀后在37 ℃ 0.76×10-3 ×g条件下培养1 h,复苏细菌;4)分别取200 μL已转化的培养基涂到2个LB/氨苄/IPTG/X-Gal平板上,37 ℃正向放置1~2 h后,倒置过夜培养;5)将过夜培养的平板放于4 ℃ 2~3 h后,每个平板挑取5个白色菌落分别接种于10 mL含50 μg/mL氨苄青霉素的LB液体培养基中,37 ℃培养过夜。
阳性克隆的鉴定及测序:釆用一种简单的酚/氯仿/异戊醇抽提法,将重组质粒DNA抽提出来,鉴定出阳性重组子。鉴定出的阳性克隆直接进行菌液PCR,再一次鉴定阳性克隆,将菌液直接送于华大基因公司测序。
1.2.3 单宁酶活力测定采用没食子酸丙酯作为单宁酶的底物。没食子酸丙酯的浓度会随着酶促反应的进行而变小,从而引起在270 nm处的吸光值(OD)降低,根据没食子酸丙酯吸光值的变化,计算出单宁酶的活力。将筛选得到的菌株接种到单宁酶诱导培养基(单宁浓度0.5%、1%和1.5%)中,37 ℃,120 r/min震荡培养,待OD600 nm约为0.4~0.6时,收集菌体,加入36 μL的溶菌酶(50 mg/mL)和3 μL的Triton-100,37 ℃水浴15 min后,制得粗酶液,立即进行酶活力测定。酶活力的定义:40 ℃反应条件下,100 μL酶液每分钟使没食子酸丙酯溶液在270 nm处减少0.01个吸光度值定义为1个酶活力单位。
酶活力计算公式:
酶活力(U/mL)=[OD270 nm(测定管)-
OD270 nm(对照管)]×稀释倍数/0.01。
经过初筛和复筛,选出了4株菌,编号为No.1、No.2、No.3、No.4,结果表明,4株菌对单宁的最大耐受浓度均为4%,但No.2、No.3 2株菌的长势比No.1和No.4要好一些,通过单宁酶鉴定培养基看出菌株可以产生单宁酶,并且可以看出细菌在只有琼脂和溴酚蓝的单宁酶鉴定培养基b上与在含营养物质和溴酚蓝的单宁酶鉴定培养基a上相比生长缓慢,菌落周围变色缓慢,并且变色范围比较小,因此说明直接利用单宁作为营养物质的能力很低。部分菌株的单宁耐受情况见图1,部分菌株单宁酶初步鉴定结果如图2。
 | 图1 No.3菌株在不同单宁浓度耐受培养基上的生长状况 Fig. 1 The growth status of the No.3 strain on tolerance culture medium with different tannic concentration |
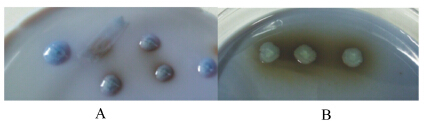 | 图2 No.2菌株在单宁酶鉴定培养基a(A)和b(B)上的生长情况 Fig. 2 The growth status of No.2 strain on tannase identification culture mediums a (A) and b (B) |
将测序所得序列提交至GenBank进行Blast序列同源性比对。选取若干同源性较高的16S rDNA序列经ClustalX1.84程序进行比对,采用Kimura4参数模型计算进化距离通过邻接法和最大简约法,运用MEGA4.0软件构建系统发育树,如图3所示。No.1菌株与登录号为EF192136的细菌亲缘关系最近,该菌属于肠杆菌目,肠杆菌科,普罗威登斯菌属,进一步比对得出No.1菌株属于产碱普罗威登斯菌(Providencia alcalifaciens);No.2菌株与4株细菌亲缘关系均比较近,基本都属于伯克氏菌目,但经分析判断No.2菌株与克斯特菌属亲缘关系更为接近,因此属于克斯特菌(Kerstersia);No.3菌株介于2大分支菌之间,但是更接近于下面1个分支菌,该菌也属于普罗威登斯菌属,通过比对得知No.3菌株为Providencia vermicola;No.4菌株与11株细菌亲缘关系均较近,均属于假单胞菌菌科,经进一步分析得知属于铜绿假单胞菌(Pseudomonas aeruginosa)。
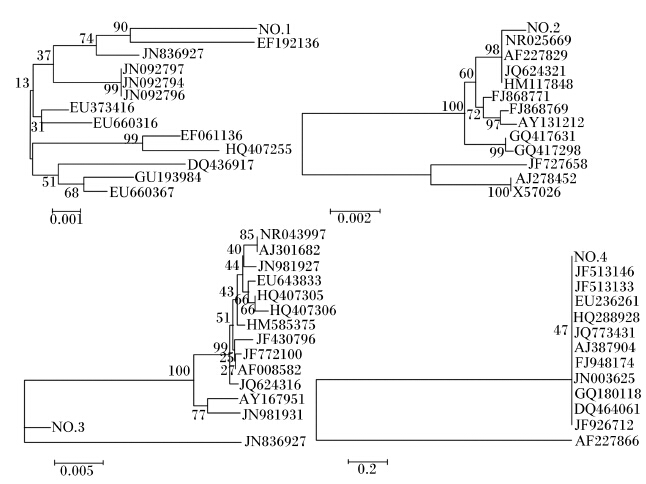 | 图3 4株细菌与其同源细菌的进化树 Fig. 3 Phylogenetic trees of the four strains and homologous bacteria |
2.3 4株筛选菌株的单宁酶活力
由表1可知,各单宁酶诱导培养基上均为No.2菌株的酶活力最高。各单宁浓度组酶活力比较得知,除了No.1菌株在0.5%组的单宁酶活力最大外,其他3株菌均在1%组具有最大酶活力,且这3株菌在1%组的酶活力均显著高于0.5%与1.5%组(P<0.05);通过0.5%组与1.5%组比较得知,除了No.4菌株在0.5%组低于1.5%组外,其他3株都与之相反。以上分析表明,单宁酶诱导培养基1%的单宁浓度对于菌株单宁酶的产生具有很好的诱导作用,而0.5%和1.5%浓度组诱导作用略差,原因可能是浓度太小对菌株的刺激作用太小,而浓度太大又会对菌株生长及单宁酶的产生起到抑制作用。
| 表1 单宁酶诱导培养基单宁浓度对4株细菌酶活力的影响 Table 1 Effects of tannin concentration of tannase inductive culture medium on enzyme activities of the four screened strains |
培养基的成分对于细菌生长所需的培养基,一般采用目前通用的细菌生长培养基即可,但是鉴于本试验中所筛菌株的特殊性,考虑到山羊瘤胃液中可能存在菌株生长所需的特殊物质,因此在配制培养基时,均加入了10%的灭菌山羊瘤胃液,通过比较显示,加入瘤胃液后,菌株的生长状况确实要好一些。
本试验所筛选的菌株能够在含单宁的培养基上生长,只能说明菌株能够抵抗单宁的抑菌作用,并不能说明可以产生单宁酶而降解单宁,因此对于单宁降解菌的筛选需要一定的方法。目前所建立的筛选鉴定方法都是针对青霉与曲霉等真菌的。1977年Bradoo等[13]在培养基中只加入1%的单宁和3%的琼脂,将菌株点种在平板培养基上培养48 h后,观察菌落周围的透明圈,把透明圈直径与菌落直径的比值作为筛选鉴定的标准。2001年,郭鲁宏[14]改进了筛选鉴定方法,在上述培养基的基础上添加终浓度为0.004%的溴酚蓝,利用菌落周围培养基颜色变化范围的大小与变色的程度直观地判断菌株是否可以产生单宁酶,以及产酶能力的大小。2008年,保玉心[15]也利用这种方法对其试验菌株做了筛选鉴定,效果比较明显,从而更好地证明了这种方法的可行性。因为本试试筛选的是细菌,因此针对细菌的生长需要,培养基也需要相应改变,本试验培养基需要在细菌生长培养基基础上加入1%的单宁和0.004%的溴酚蓝进行培养。
目前国内外对于单宁酶基因的报道都比较少,而现在可用于克隆表达且相对比较成功的一般是真菌的单宁酶基因,许彬[16]将米曲霉(Aspergillus oryzae)中单宁酶基因克隆于大肠杆菌和毕赤酵母中,并得到成功表达;黄小凤等[17]又将Aspergillus oryzae中单宁酶基因成功的克隆表达在了黑曲霉中。对于细菌的单宁酶基因克隆表达也有相关报道,Noguchi等[18]从路邓葡萄球菌(Staphylococcus lugdunensis)中克隆了能够编码613个氨基酸,并能够表达单宁酶活力的基因tanA,同时他们在Staphylococcus lugdunensis、植物乳杆菌(L. plantarum)、戊糖乳杆菌(L. pentosus)和解没食子酸链球菌(S. gallolyticus)等菌种中用tanA目标探针进行了Southen blot印记分析,发现探针只在邓葡萄球菌中有明确反应;Rodrígueza等[19]从植物乳酸菌ATCC 14917T中克隆出了单宁酶的编码基因tanLpl,并且在所有L. plantarum中进行了tanLpl基因的PCR扩增,得到了预期片段大小的目的DNA片段,在L. plantarum、类植物乳杆菌(L. paraplantarum)、L. pentosus和S. gallolyticus中进行了Southen blot印记分析,结果表明在前2种菌中都有明显反应。本试验对于单宁酶基因的扩增,所得的结果并不理想,因此后续试验还可以通过现有报道的产单宁酶菌株的单宁酶基因序列来设计合适的引物,扩增所得菌株的单宁酶基因序列,或者应用已知单宁酶基因片段做探针,对所筛菌的DNA进行Southern印迹杂交,从而找到所筛菌株的单宁酶基因,为以后将单宁酶基因克隆到合适的有益菌中,用于发酵香蕉叶来降低单宁含量或用于食品、化妆品等行业做准备。
4 结 论① 山羊瘤胃中存在能够降解单宁的菌株,经分子生物学法鉴定,分别为Providencia alcalifaciens、Kerstersia、Providencia Vermicola和Pseudomonas aeruginosa。
② 筛选出的4株菌单宁酶活力均较高,对单宁的最大耐受度均可达到4%。
| [1] | FRAZIER R A,DEAVILLE E R,GREEN R J,et al.Interactions of tea tannins and condensed tannins with proteins[J]. Journal of Pharmaceutical and Biomedical Analysis,2010,51(2):490-495. ( 1) 1)
|
| [2] | GETACHEW G,PITTROFF W,PUTNAM D H,et al.The influence of addition of gallic acid,tannic acid,or quebracho tannins to alfalfa hay on in vitro rumen fermentation and microbial protein synthesis[J]. Animal Feed Science and Technology,2008,140(3/4):444-461. ( 1) 1)
|
| [3] | LI M S,YAO K,HE Q,et al.Biodegradation of gallotannins and ellagitannins[J]. Journal of Basic Microbiology,2006,46(1):68-84. ( 1) 1)
|
| [4] | FIELD J A,LETTINGA G.Toxicity of tannic compounds to microorganisms[M]//HEMINGWAY R W,LAKES P E.Plant Polyphenols.New York:Plenum Press,1992:673-692.( 1) 1)
|
| [5] | GOLDSTEIN J L,SWAIN T.The inhibition of enzymes by tannins[J]. Phytochemistry,1965,4(1):185-192. ( 1) 1)
|
| [6] | CLOUTIER M M,GUERNSEY L.Tannin inhibits adenylate cyclase in airway epithelial cells[J]. The American Journal of Physiology,1995,268(5):815-855. ( 1) 1)
|
| [7] | OH H,HOFF J E.Effect of condensed grape tannins on the in vitro activity of digestive proteases and activation of their zymogens[J]. Food Science,1986,51(3):577-580. ( 1) 1)
|
| [8] | SKENE I K,BROOKER J D.Characterization of tannin acylhydrolase activity in the ruminal bacterium,Selenomonas ruminantium[J]. Anaerobe,1995,1(6):321-327. ( 1) 1)
|
| [9] | ODENYO A A,MCSWEENEY C A,PALMER B,et al.In vitro screening of rumen fluid samples from indigenous African ruminants provides evidence for rumen fluid with superior capacities to digest tannin-rich fodders[J]. Australian Journal of Agricultural Research,1999,50(7):1147-1157. ( 1) 1)
|
| [10] | GOEL G,PUNIYA A K,SINGH K.Phenotypic characterization of tannin-protein complex degrading bacteria from faeces of goat[J]. Small Ruminant Research,2007,69(1/2/3):217-220. ( 1) 1)
|
| [11] | SINGH B,BHAT T K,SHARMA O P,et al.Isolation of tannase-producing Enterobacter ludwigii GRT-1 from the rumen of migratory goats[J]. Small Ruminant Research,2011,102(2/3):172-176. ( 2) 2)
|
| [12] | 张武先,王金华,熊智,等.思茅松毛虫2龄幼虫肠道好氧细菌的筛选及毒力测定[J]. 安徽农业科学,2011,39(28):17288-17290. ( 1) 1)
|
| [13] | BRADOO S,GUPTA R,SAXENA R K.Screening of extracellular tannase-producing fung:development of a rapid and simple plate assay[J]. Journal of General and Applied Microbiology,1996,42(4):325-329. ( 1) 1)
|
| [14] | 郭鲁宏.单宁酶的制备及酶法制取没食子酸及其丙酯研究[D]. 博士学位论文.沈阳:中国科学院沈阳应用生态研究所,1999. ( 1) 1)
|
| [15] | 保玉心.固体发酵黑曲霉产单宁酶的研究[D]. 硕士学位论文.贵阳:贵州大学,2008. ( 1) 1)
|
| [16] | 许彬.米曲霉Aspergillus oryzae中单宁酶基因的克隆及其在大肠杆菌和毕赤酵母中的表达[D]. 硕士学位论文.南宁:广西大学,2003. ( 1) 1)
|
| [17] | 黄小凤,韦宇拓,韦传东,等.单宁酶基因在黑曲霉ST31中的克隆与表达[J]. 中国生物工程杂志,2005,25(9):74-77. ( 1) 1)
|
| [18] | NOGUCHI N,OHASHI T,SHIRATORI T,et al.Association of tannase-producing Staphylococcus lugdunensis with colon cancer and characterization of a novel tannase gene[J]. Journal of Gastroenterology,2007,42(5):346-351. ( 1) 1)
|
| [19] | RODRÍGUEZA H,DE LAS RIVASA B,GÓMEZ-CORDOVÉSB C,et al.Characterization of tannase activity in cell-free extracts of Lactobacillus plantarum CECT 748T[J]. International Journal of Food Microbiology,2008,121(1):92-98. ( 1) 1)
|




