哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是存在于哺乳动物中的一种进化保守的丝氨酸/苏氨酸蛋白激酶,它与其他一些蛋白质形成的复合体包括2种形式,分别是哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)和哺乳动物雷帕霉素靶蛋白复合体2(mammalian target of rapamycin complex 2,mTORC2)。mTOR信号通路能够调节细胞内重要的营养生物化学代谢途径与过程,当mTORC1被激活时将促进细胞的合成代谢,如蛋白质合成,且抑制分解代谢,如自噬。mTOR信号通路也参与机体内的病理学过程,如肿瘤的发生、神经退行性疾病、肥胖以及Ⅱ型糖尿病等。
1 mTOR信号通路对于哺乳动物而言,mTOR信号通路是调节细胞内蛋白质合成和蛋白质降解、调控细胞生长和增殖的重要信号通路之一。mTORC1由mTOR、具有底物识别功能的脚手架蛋白Raptor、负向调控蛋白PRAS40和DEPTOR、正向调节蛋白mLST8(又叫GβL)和调节mTORC1稳定性的Tti1和Tel2组成。而mTORC2则由mTOR、DEPTOR、mLST8、Tti1、Tel2,以及rictor、mSin1和protor1/2等蛋白质组成[1]。
mTORC1的上游信号通路可受糖、氨基酸、生长因子、氧化水平、能量水平等信号的调节。其中生长因子和能量水平调节mTORC1信号通路的分子机制已经研究的较为清楚,但对于氨基酸作为信号分子如何传递至mTORC1尚待进一步阐明[1]。mTORC1信号通路对来自于氨基酸的信号非常敏感,特别是细胞内的亮氨酸和异亮氨酸。
mTORC1下游信号通路包含2个关键的底物,即70 ku的核糖体蛋白S6激酶(ribosomal S6 kinase,S6K)和真核翻译起始因子4E(eIF4E)结合蛋白1(eukaryotic translational initiation factor 4E-binding protein 1,4E-BP1)。呈活化状态的mTORC1能够磷酸化激活S6K,磷酸化4E-BP1,从而解除对eIF4E的抑制,其通过启动和促进转录过程合成新的蛋白质,提高细胞增殖水平[1]。
2 氨基酸调节mTORC1信号通路的相关机制胰岛素等生长因子可以通过激活磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K),进一步激活蛋白激酶B(protein kinase B/Akt),活化的Akt将会抑制结节性硬化复合物(tuberous sclerosis complex,TSC)1/2的活性,从而使Rheb(脑内富集的Ras同源蛋白)携带三磷酸鸟苷(GTP)激活mTORC1,即:生长因子通过PI3K-Akt-TSC-Rheb通路激活mTORC1。然而,氨基酸激活mTORC1信号通路的机制不同于生长因子,并不经过PI3K-Akt-TSC-Rheb通路。研究发现,当细胞缺失TSC2时,氨基酸仍然能够调节mTORC1的活性,但是生长因子却不能对mTORC1的活性产生影响,表明氨基酸调节mTORC1并不依赖于TSC2[2]。
2.1 Rag GTPase在氨基酸调节mTORC1信号通路中的作用Rag GTPase来源于Ras相关小GTP结合蛋白(Ras-related small GTP-binding protein)家族,哺乳动物中有4种Rag蛋白,分别是RagA、RagB、RagC和RagD,其中RagA和RagB具有高度的相似性,RagC和RagD具有高度的相似性,通常RagA或RagB与RagC或RagD形成异二聚体[3]。
研究发现干扰Rag GTPase的表达时会抑制氨基酸对mTORC1的激活效应,并且当细胞中表达GTP结合状态的Rag GTPase时,尽管在无氨基酸刺激的情况下,mTORC1也会被激活[4]。当细胞中表达与GTP结合的Rag蛋白时,它会与mTORC1发生强烈的相互作用[5, 6]。氨基酸会促进RagA/B与GTP的结合,进而促进Rag异二聚体与Raptor的相互作用,从而将mTORC1募集至溶酶体表面激活[5, 6]。由此可见,Rag GTPase对于氨基酸激活mTORC1信号通路是必需的(图1)。
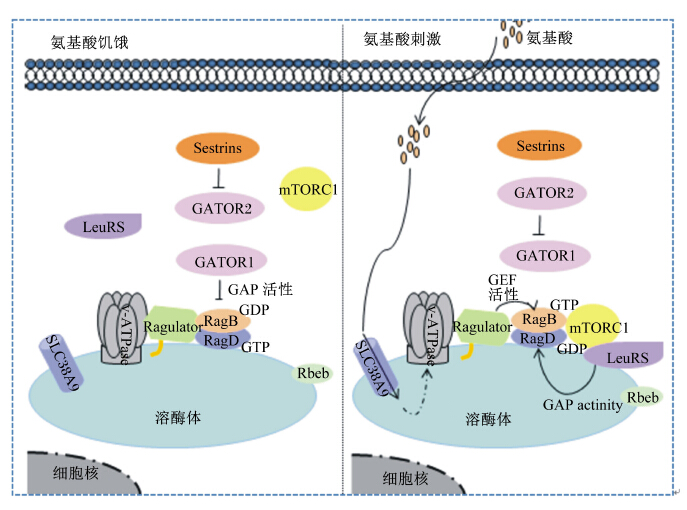 | 图 1 氨基酸调节mTORC1上游信号通路的机制 Fig. 1 The mechanism of amino acids sensing pathway upstream of mTORC1[7, 8, 9, 10, 11, 12] |
然而,研究发现谷氨酰胺激活mTORC1不依赖于Rag GTPase。在RagA和RagB基因敲除的稳定细胞系中,谷氨酰胺仍然促进mTORC1定位于溶酶体和激活mTORC1[13],表明不同氨基酸调节mTORC1信号通路的机制可能不同。
2.2 Ragulator在氨基酸调节mTORC1信号通路中的作用Ragulator最初被认为是一种参与氨基酸调节mTORC1信号通路的五聚体复合物,由MP1、p14、p18、HBXIP和C7orf59组成[6, 7]。免疫共沉淀试验发现Ragulator是Rag GTPase的互作蛋白,且Ragulator只有以五聚体复合物的形式存在时才能与Rag GTPase发生强烈相互作用[7]。当细胞中减少Ragulator的任一组分时,Rag GTPase不再定位于溶酶体表面,且氨基酸不能诱导mTOR定位于溶酶体和SK6的磷酸化[6, 7]。Ragulator对于氨基酸诱导mTORC1信号通路的激活是必需的,因此,Ragulator-Rag所介导的mTORC1在溶酶体表面的定位是氨基酸激活mTORC1信号通路中的关键步骤(图1)。
氨基酸能够调节Ragulator与Rag GTPase之间的相互作用,在氨基酸的刺激下,Ragulator与Rag GTPase之间的相互作用变弱[7]。因此,Ragulator对Rag GTPase可能存在其他作用方式。最初在酵母中研究发现Vam6是Gtr1p的一种鸟嘌呤核苷酸转换因子(guanine nucleotide exchange factor,GEF),Gtr1p是RagA和RagB在酵母中的同源物,Vam6对于氨基酸激活mTORC1信号通路是必需的[14];在哺乳动物细胞中研究发现Ragulator是Rag GTPase的一种GEF,并且Ragulator只有以五聚体复合物形式存在时才能发挥其GEF的作用,在氨基酸的刺激下,Ragulator的GEF活性被激活,使RagA或RagB所携带的GDP转换为GTP,RagC或RagD所携带的GTP转换为GDP[7]。当RagA或RagB携带GTP,而RagC或RagD携带GDP时,此异二聚体处于活化状态,活化的Rag异二聚体结合Raptor从而将mTORC1募集到溶酶体表面激活[5]。
2.3 v-ATPase在氨基酸调节mTORC1信号通路中的作用v-ATPase是一个多亚基复合体,包含V0和V1 2个结构域。研究发现,v-ATPase是mTORC1信号通路中的一个正向调节物,干扰v-ATPase将会抑制氨基酸诱导S6K的磷酸化以及mTOR定位于溶酶体,但并不能抑制RagB-GTP诱导的mTOR定位于溶酶体,表明v-ATPase在Rag GTPase的上游发挥作用[8]。此外v-ATPase通过与Ragulator和Rag GTPase相互作用参与调节mTORC1,并提出氨基酸的感应信号起始于溶酶体腔,即氨基酸必须先在溶酶体腔内蓄积才能起始感应信号[8]。v-ATPase对于氨基酸激活mTORC1信号通路是必需的,它在氨基酸与Rag GTPase之间发挥作用。但氨基酸是如何进入溶酶体腔内这一问题在当时并未得到解答,直到近期SLC38A9的发现才使这一问题得到初步解答。
SLC38A9是位于溶酶体膜上的一个精氨酸的转运感受体,与Ragulator和Rag GTPase相互作用,过表达SLC38A9基因使mTORC1信号通路对精氨酸饥饿不敏感,缺失SLC38A9基因则抑制精氨酸激活mTORC1,SLC38A9在Rag GTPase的上游发挥作用,很可能是细胞内感应精氨酸浓度变化的感受器[9, 15]。SLC38A9是mTORC1的正调节物,对于精氨酸激活mTORC1信号通路是必需的(图1)。
2.4 GATOR在氨基酸调节mTORC1信号通路中的作用GATOR是一个与Rag GTPase相互作用的八聚体,包括GATOR1和GATOR2 2个子复合体,GATOR1由DEPDC5、Nprl2和Nprl3组成,GATOR2由Mios、WDR24、WDR59、Seh1L和Sec13组成,GATOR复合体对于氨基酸调节mTORC1信号通路是必需的[10]。
GATOR1子复合体是RagA或RagB的GTPase激活蛋白,在氨基酸调节mTORC1信号通路中发挥抑制作用,GATOR1的缺失导致细胞内mTORC1对氨基酸饥饿不敏感;GATOR2在GATOR1的上游发挥作用,通过抑制GATOR1正向调节mTORC1[10]。因此,GATOR复合体是氨基酸调节mTORC1信号通路中的一个重要调节物(图1)。
2.5 Sestrins在氨基酸调节mTORC1信号通路中的作用p53是一种在应激情况下激活的能够抑制细胞增殖或诱导细胞凋亡的转录因子,因而被认为是一种重要的肿瘤抑制因子[16]。研究发现p53的靶基因为Sestrin1/PA26和Sestrin2/Hi95[17, 18]。进化保守的Sestrins家族在哺乳动物中由3个成员组成,其中Sestrin1和Sestrin2是应激诱导的且受p53的调节[17]。在细胞遭受DNA损伤和氧化应激时,Sestrin1和Sestrin2基因被诱导表达,通过抑制细胞生长和增殖而发挥细胞保护功能[19]。研究证实Sestrin1和Sestrin2通过激活腺苷酸活化蛋白激酶(AMPK)和TSC2的磷酸化负向调节mTOR,从而抑制细胞生长和增殖[20]。
近期研究发现Sestrins也参与了氨基酸调节mTORC1信号通路,但并不通过AMPK-TSC通路,而是通过GATOR复合体。免疫共沉淀试验发现Sestrins与GATOR2之间的相互作用受氨基酸的调节,氨基酸饥饿时会加强Sestrins与GATOR2的互相作用,氨基酸刺激时相互作用则减弱[11]。Sestrin2的缺失导致细胞内mTORC1对氨基酸饥饿不敏感,而过表达Sestrin2基因则抑制氨基酸激活mTORC1,Sestrins作为负调节物参与mTORC1感应氨基酸的上游信号通路,它在GATOR1以及Rag GTPase的上游发挥作用[11]。因此,Sestrins对于氨基酸诱导mTORC1在溶酶体表面的定位是必需的(图1)。
3 LeuRS在亮氨酸调节mTORC1信号通路中的作用氨基酰tRNA合成酶(aminoacyl-tRNA synthetases,ARSs)在细胞内的功能为催化氨基酸与其相应的tRNA相连接[21]。研究发现亮氨酰tRNA合成酶(leucyl-tRNA synthetase,LeuRS)参与了亮氨酸诱导mTORC1信号通路的激活,敲低LeuRS基因的表达将会抑制亮氨酸诱导S6K的磷酸化,以及mTOR和Raptor在溶酶体表面的定位[12]。敲低LeuRS基因表达并不能抑制RagB-GTP/RagD-GDP异二聚体诱导的mTORC1的激活,表明LeuRS在RagD的上游发挥作用[12]。LeuRS与RagD的相互作用依赖于亮氨酸,且LeuRS是RagD的GTPase激活蛋白,LeuRS作为细胞内亮氨酸浓度的感受器通过感应亮氨酸的浓度变化和促进RagD的GTP水解为GDP,从而使无活性的Rag异二聚体转变为活性形式,进而激活mTORC1[12]。因此,LeuRS作为正向调节物参与了氨基酸激活mTORC1信号通路(图1)。
4 运用无细胞体系(cell-free system)有助于研究氨基酸调节mTORC1信号通路的机制cell-free system是指模拟细胞内真实发生的生物学事件,利用来源于细胞的组份或结构(如S-100或细胞器等),构建可以进行正常生物学反应所需要的物质(如供能系统和酶反应体系等)组成的体系。该体系具有快速、灵敏、稳定、方便和批量研究等优点,深受生物化学等领域的研究人员欢迎和运用。
近年来,研究人员利用这一体系探讨了许多细胞生命活动中的营养学领域重要科学问题,如氨基酸对mTORC1信号通路以及自噬的调节机制。Zoncu等[10]通过分离溶酶体、提取含myc-Raptor的胞浆蛋白构建了cell-free system,通过向该体系中添加氨基酸,证明了氨基酸的感应信号起始于溶酶体腔。Yan等[22]通过分离自噬体、表达纯化Barkor-Flag蛋白、提取S-100(胞浆蛋白)构建了cell-free system,通过向该体系中添加L-亮氨基,证明了L-亮氨酸抑制自噬依赖于mTORC1。Moreau等[23]通过分离含有绿色荧光蛋白(GFP)标记的Atg16L的去核上清(postnuclear supernatants,PNS)以及含有红色荧光蛋白(mStrawberry)标记的Atg16L的PNS构建了cell-free system,证明了VAMP7介导了Atg16L囊泡的同型融合。因此,通过构建cell-free system将有助于研究氨基酸调节mTORC1信号通路的机制及其相关生物学事件。
5 小 结mTORC1信号通路是细胞内重要的调控蛋白质代谢通路之一。氨基酸不仅是合成蛋白质的底物,同时也作为一种信号分子参与调控 mTORC1信号通路。溶酶体是氨基酸激活mTORC1信号通路的一个关键细胞器,溶酶体表面的v-ATPase、Ragulator、Rag GTPase等复合体为mTORC1在溶酶体上的定位提供停泊位点。氨基酸必须首先在溶酶体腔内蓄积才能起始感应信号,且是一种依赖于溶酶体氨基酸转运感受体SLC38A9的作用方式,上述研究结果有助于深入理解氨基酸调节mTORC1信号通路的作用机制。
随着研究的深入,参与氨基酸调节mTORC1上游信号通路的调节蛋白质陆续被发现。Sesterins、GATOR2、GATOR1均被发现参与调节此信号通路,但GATOR复合体对mTORC1的调节并不依赖于Ragulator。mTORC1上游信号通路的v-ATPase-Ragulator-Rag GTPase分支与Sesterins-GATOR-Rag GTPase分支之间的关系尚未研究清楚,这2条分枝间可能存在着对话机制。氨基酸转运感受器及其在细胞内的定位一直吸引众多研究者的关注,胞浆内LeuRS被认为可能是亮氨酸浓度的感受器,而溶酶体氨基酸转运感受体SLC38A9则可能是精氨酸的感受器。因此,氨基酸调节mTORC1信号通路的未来研究重点将会是:1)鉴定和发现新的氨基酸转运感受体(指细胞质膜层面),并阐明其功能;2)结合串联亲和纯化技术和质谱技术鉴定和发现可以参与氨基酸调节mTORC1信号通路上游的新调节物(或蛋白质);3)在不同细胞器膜上鉴定和发现新的氨基酸转运感受体(指细胞器膜层面,如溶酶体膜或线粒体膜等),并阐明其作用机制。
| [1] | BHASKAR P T,HAY N.The two TORCs and Akt[J]. Developmental Cell,2007,12(4):487-502. ( 3) 3)
|
| [2] | SMITH E M,FINN S G,TEE A R,et al.The tuberous sclerosis protein TSC2 is not required for the regulation of the mammalian target of rapamycin by amino acids and certain cellular stresses[J]. The Journal of Biological Chemistry,2005,280(19):18717-18727. ( 1) 1)
|
| [3] | SCHVRMANN A,BRAUERS A,MABMANN S,et al.Cloning of a novel family of mammalian GTP-binding proteins (RagA,RagBs,RagB1) with remote similarity to the Ras-related GTPases[J]. The Journal of Biological Chemistry,1995,270(48):28982-28988. ( 1) 1)
|
| [4] | KIM E,GORAKSHA-HICKS P,LI L,et al.Regulation of TORC1 by Rag GTPases in nutrient response[J]. Nature Cell Biology,2008,10(8):935-945. ( 1) 1)
|
| [5] | SANCAK Y,PETERSON T R,SHAUL Y D,et al.The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1[J]. Science,2008,320(5882):1496-1501. ( 3) 3)
|
| [6] | SANCAK Y,BAR-PELED L,ZONCU R,et al.Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids[J]. Cell,2010,141(2):290-303. ( 4) 4)
|
| [7] | JEWELL J L,KIM Y C,RUSSELL R C,et al.Differential regulation of mTORC1 by leucine and glutamine[J]. Science,2015,347(6218):194-198. ( 6) 6)
|
| [8] | BAR-PELED L,SCHWEITZER L D,ZONCU R,et al.Ragulator is a GEF for the Rag GTPases that signal amino acid levels to mTORC1[J]. Cell,2012,150(6):1196-1208. ( 3) 3)
|
| [9] | BINDA M,PÉLI-GULLI M P,BONFILS G,et al.The Vam6 GEF controls TORC1 by activating the EGO complex[J]. Molecular Cell,2009,35(5):563-573. ( 2) 2)
|
| [10] | ZONCU R,BAR-PELED L,EFEYAN A,et al.mTORC1 senses lysosomal amino acids through an inside-out mechanism that requires the vacuolar H+-ATPase[J]. Science,2011,334(6056):678-683. ( 4) 4)
|
| [11] | WANG S Y,TSUN Z Y,WOLFSON R L,et al.Lysosomal amino acid transporter SLC38A9 signals arginine sufficiency to mTORC1[J]. Science,2015,347(6218):188-194. ( 3) 3)
|
| [12] | REBSAMEN M,POCHINI L,STASYK T,et al.SLC38A9 is a component of the lysosomal amino acid sensing machinery that controls mTORC1[J]. Nature,2015,519(7544):477-481. ( 4) 4)
|
| [13] | BAR-PELED L,CHANTRANUPONG L,CHERNIACK A D,et al.A Tumor suppressor complex with GAP activity for the Rag GTPases that signal amino acid sufficiency to mTORC1[J]. Science,2013,340(6136):1100-1106. ( 1) 1)
|
| [14] | LEVINE A J.p53,the cellular gatekeeper for growth and division[J]. Cell,1997,88(3):323-331. ( 1) 1)
|
| [15] | BUDANOV A V,SHOSHANI T,FAERMAN A,et al.Identification of a novel stress-responsive gene Hi95 involved in regulation of cell viability[J]. Oncogene,2002,21(39):6017-6031. ( 1) 1)
|
| [16] | PEETERS H,DEBEER P,BAIROCH A,et al.PA26 is a candidate gene for heterotaxia in humans:identification of a novel PA26-related gene family in human and mouse[J]. Human Genetics,2003,112(5/6):573-580. ( 1) 1)
|
| [17] | BUDANOV A V,SABLINA A A,FEINSTEIN E,et al.Regeneration of peroxiredoxins by p53-regulated Sestrins,homologs of bacterial AhpD[J]. Science,2004,304(5670):596-600. ( 2) 2)
|
| [18] | BUDANOV A V,KARIN M.p53 target genes Sestrin1 and Sestrin2 connect genotoxic stress and mTOR signaling[J]. Cell,2008,134(3):451-460. ( 1) 1)
|
| [19] | CHANTRANUPONG L,WOLFSON R L,OROZCO J M,et al.The sestrins interact with GATOR2 to negatively regulate the amino-acid-sensing pathway upstream of mTORC1[J]. Cell Reports,2014,9(1):1-8. ( 1) 1)
|
| [20] | PARK S G,EWALT K L,KIM S.Functional expansion of aminoacyl-tRNA synthetases and their interacting factors:new perspectives on housekeepers[J]. Trends in Biochemical Sciences,2005,30(10):569-574. ( 1) 1)
|
| [21] | HAN J M,JEONG S J,PARK M C,et al.Leucyl-tRNA synthetase is an intracellular leucine sensor for the mTORC1-signaling pathway[J]. Cell,2012,149(2):410-424. ( 1) 1)
|
| [22] | YAN X H,SUN Q M,JI J,et al.Reconstitution of leucine-mediated autophagy via the mTORC1-Barkor pathway in vitro[J]. Autophagy,2012,8(2):213-221. ( 1) 1)
|
| [23] | MOREAU K,RAVIKUMAR B,RENNA M,et al.Autophagosome precursor maturation requires homotypic fusion[J]. Cell,2011,146(2):303-317. ( 1) 1)
|




