2. 兰州大学草地农业科技学院, 兰州 730060;
3. 兰州大学生命科学学院, 兰州 730000;
4. 中国科学院兰州化学物理研究所, 兰州 730000;
5. 甘肃省喜羊羊农牧发展有限公司, 兰州 730300
2. College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730060, China;
3. School of Life Sciences, Lanzhou University, Lanzhou 730000, China;
4. Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China;
5. Gansu Province Pleasant Goat Agriculture and Animal Husbandry Development Limited Company, Lanzhou 730300, China
补偿生长是指动物经过一段时间的营养限制后,恢复营养供给,其在一段时期内表现出高生长速率的能力[1, 2]。小尾寒羊是一种原产于我国的具备良好经济价值的绵羊品种。它具备体成熟早、生长速度快、体格大、出栏率高、屠宰率高、繁殖率高以及适合舍饲等特点。因此,进行小尾寒羊的规模化饲养对西部偏远地区的社会经济发展具有重要意义。目前对小尾寒羊的研究大多集中在基于其优异繁殖性能的育种方面[3, 4, 5],关于在舍饲条件下羔羊育肥的研究较少。本试验旨在利用补偿生长的原理,结合本地区饲料资源短缺的实际情况,根据小尾寒羊生长性能、营养物质的消化代谢及瘤胃纤维素酶活性对不同限饲水平与营养补偿的响应,研究小尾寒羊的补偿生长能力。
1 材料与方法 1.1 试验动物选择40只体重为(19.77±1.34) kg、健康状况良好的3月龄小尾寒羊公羊作为试验动物。试验于2014年5月3日至2014年8月25日在甘肃省喜羊羊农牧发展有限公司养殖场进行。
1.2 试验饲粮本试验饲粮结合小尾寒羊营养需要特点,参照美国NRC(2007)肉羊营养需要中代谢能(ME)和粗蛋白质(CP)的推荐量。各种营养水平除ME外均按照饲料原料实际测得的数据计算[6],饲粮精粗比为60 ∶ 40。基础饲粮组成及营养水平见表1。
| 表1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验采用单因素完全随机设计,根据体重将40只羊随机分为Ⅰ(对照)、Ⅱ、Ⅲ、Ⅳ共4组,每组10只,其中3只做代谢试验,3只采集瘤胃液,其余4只为后备。正试期开始前4组体重分别为Ⅰ组(23.73±1.78) kg、Ⅱ组(23.65±1.68) kg、Ⅲ组(24.37±2.79) kg、Ⅳ组(24.76±1.06) kg,差异不显著(P>0.05)。预试期15 d,正试期90 d。正试期内限饲期30 d,Ⅰ组自由采食,试验组根据Ⅱ、Ⅲ、Ⅳ组羊的体重,按照NRC(2007)推荐的日增重为500、400、300 g/d的ME和CP需要量配制饲粮,每天分2次在07:00和19:00进行饲喂,自由饮水。在限饲期1、5、15、20 d晨饲前进行称重,并根据所得体重数据计算当天至下次称重前的饲喂量。30 d限饲期结束后即进入为期60 d的营养补偿期,营养补偿期4组绵羊均自由采食。试验羊按组单圈(5 m×8 m)饲养。预试期、限饲期和营养补偿期内各驱虫1次,每周打扫1次圈舍并对圈舍进行消毒。 1.4 消化代谢试验
整个试验期间,分别在限饲期结束前(24~30 d)和营养补偿期结束前(84~90 d)进行2次消化代谢试验。在每个组中选择与本组平均体重相近的绵羊3只,做好标记并转移至自制代谢笼,按照不同体重和限饲水平配制饲粮并单独饲喂,自由饮水。试验期总共为7 d,其中预试期3 d,正试期4 d,采用全收粪法和全收尿法进行消化代谢试验。 1.5 样品采集 1.5.1 饲料样及粪尿样的采集
消化代谢试验期间每天07:00和19:00收集粪样和尿样,记录每只羊每天的干物质采食量(DMI)、剩料量、排粪量和排尿量。每天的粪便收集称重混匀后按照重量的20%取样并放入-20 ℃冰柜冷冻保存,尿样收集前在自制集尿桶中加入10%硫酸30 mL,将其收集后测量总的体积并取50 mL,装入50 mL离心管放置在-20 ℃冰柜中冷冻保存。消化代谢试验结束后转至原圈饲养。 1.5.2 瘤胃液的采集
分别于正试期的1、15、30、45、60、90 d的晨饲前利用自制瘤胃软导管及蠕动泵进行瘤胃液的采集,每组3只。瘤胃软导管由圆柱形中空金属滤头(直径1.2 cm,长8 cm)、橡胶导管和1 000 mL真空抽滤瓶组成。采集后的瘤胃液迅速装入10 mL的离心管,放入液氮罐中,并尽快转移至-80 ℃的超低温冰箱中用于测定纤维素酶的活性。 1.6 测定指标及方法 1.6.1 饲料样及粪尿样的测定
样品带回实验室后将饲料样和粪样放入LABCONCO FreeZone 6 Plus型冷冻干燥机中冻干。饲料样和粪样中有机物(OM)利用干灰法测定,CP利用FIAstar5000 Analyzer型流动注射分析仪测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)利用纤维袋进行测定[7]。 1.6.2 瘤胃液纤维素酶活性的测定
将瘤胃液从-80 ℃的超低温冰箱转移至4 ℃冰箱解冻后,分别以Whatman No. 1滤纸和3,5-二硝基水杨酸作为反应的底物和显色剂,利用分光光度计在540 nm条件下测定生成的还原糖的量,计算酶活性。酶活性单位(U)定义为每分钟每毫升酶液作用于底物生成的葡萄糖的量[μmol/(min·mL)][8, 9, 10, 11, 12]。 1.7 数据统计分析
试验数据运用Microsoft Excel 2010进行整理,生长性能和消化代谢数据利用SPSS 13.0中的one-way ANONA进行分析,限饲期和营养补偿期间数据比较利用t检验进行。 2 结 果 2.1 限饲和营养补偿对小尾寒羊生长性能的影响
由表2可知,限饲期:Ⅰ、Ⅱ、Ⅲ、Ⅳ组初始体重差异不显著(P>0.05);Ⅰ组限饲结束体重显著高于Ⅲ、Ⅳ组(P<0.05),Ⅲ组显著高于Ⅳ组(P<0.05);Ⅰ组ADG显著高于其他各组(P<0.05),Ⅱ、Ⅲ组显著高于Ⅳ组(P<0.05)。营养补偿期:Ⅰ、Ⅱ、Ⅲ、Ⅳ组结束体重间差异不显著(P>0.05);Ⅲ、Ⅳ组ADG显著高于Ⅰ组(P<0.05)。由于按组分圈饲喂,故DMI、料肉比和体重补偿百分比未做方差分析,限饲期Ⅰ、Ⅱ、Ⅲ、Ⅳ组DMI分别为1.55、1.34、1.14、0.89 kg/d,料肉比分别为7.46、8.25、12.71、20.07。营养补偿期Ⅰ、Ⅱ、Ⅲ、Ⅳ组DMI分别为1.91、1.89、1.84、1.75 kg/d,料肉比分别为10.70、8.28、7.86、6.91。营养补偿期结束体重各试验组占Ⅰ组的比例均在99%以上,完全实现了预期目的。全期Ⅰ、Ⅱ、Ⅲ、Ⅳ组的DMI分别为1.80、1.72、1.62、1.49 kg/d,料肉比分别为9.57、8.27、8.59、8.53。
| 表2 限饲和营养补偿对小尾寒羊生长性能的影响 Table 2 Effects of dietary restriction and realimentation on growth performance of small tail Han sheep |
由表3可知,限饲期:随着限饲水平的提高,干物质(DM)、NDF、ADF的表观消化率显著降低(P<0.05);其中Ⅰ组DM的表观消化率显著高于Ⅳ组(P<0.05);Ⅰ组NDF的表观消化率显著高于Ⅱ、Ⅳ组(P<0.05),Ⅲ组NDF的表观消化率显著高于Ⅳ组(P<0.05);Ⅰ、Ⅱ、Ⅲ组ADF的表观消化率显著高于Ⅳ组(P<0.05);各组间OM、CP的表观消化率差异不显著(P>0.05)。
| 表3 限饲和营养补偿对小尾寒羊营养物质消化率的影响 Table 3 Effects of dietary restriction and realimentation on nutrient digestibility of small tail Han sheep |
经过60 d的营养补偿后,Ⅰ、Ⅱ、Ⅲ、Ⅳ组间DM、OM、CP、NDF、ADF的表观消化率均无显著差异(P>0.05)。 2.2.3 限饲和营养补偿对小尾寒羊营养物质消化率影响的比较
对限饲期和营养补偿期Ⅰ、Ⅱ、Ⅲ、Ⅳ组内的各种营养成分表观消化率进行t检验,结果表明:Ⅰ组内除NDF表观消化率在限饲期显著低于营养补偿期(P<0.05)外,其余各营养成分表观消化率均无显著差异(P>0.05)。Ⅱ组内除CP表观消化率在限饲期和营养补偿期无显著差异(P>0.05)外,其余各营养成分表观消化率在限饲期均显著低于营养补偿期(P<0.05),且NDF、ADF的表观消化率达到极显著水平(P<0.01)。Ⅲ、Ⅳ组内除CP表观消化率在限饲期和营养补偿期无显著差异外(P>0.05),其余各营养成分表观消化率在限饲期均极显著低于营养补偿期末(P<0.01)。 2.3 限饲和营养补偿对小尾寒羊氮代谢的影响 2.3.1 限饲对小尾寒羊氮代谢的影响
由表4可知,限饲期:Ⅰ、Ⅱ、Ⅲ、Ⅳ组间粪氮、尿氮无显著差异(P>0.05);Ⅰ、Ⅱ组食入氮显著高于Ⅲ、Ⅳ组(P<0.05);Ⅰ组氮沉积显著高于Ⅳ(P<0.05),Ⅱ组氮沉积显著高于Ⅲ、Ⅳ组(P<0.05);Ⅰ、Ⅱ、Ⅲ组氮沉积率显著高于Ⅳ组(P<0.05);Ⅰ、Ⅱ、Ⅲ、Ⅳ组随着限饲水平的升高,尿氮/食入氮呈现升高的趋势,但差异不显著(P>0.05)。
| 表4 限饲和营养补偿对小尾寒羊氮代谢的影响 Table 4 Effects of dietary restriction and realimentation on nitrogen metabolism of small tail Han sheep |
营养补偿末期:Ⅰ、Ⅱ、Ⅲ、Ⅳ组食入氮、粪氮、尿氮、氮沉积、氮沉积率、尿氮/食入氮均无显著差异(P>0.05)。 2.3.3 限饲和营养补偿对小尾寒羊氮代谢影响的比较
将限饲期和营养补偿期Ⅰ、Ⅱ、Ⅲ、Ⅳ组氮代谢数据全部换算成单位代谢体重(kg·BW0.75),进行t检验,结果表明:从限饲期到营养补偿期,所有组的尿氮均显著升高(P<0.05),Ⅱ、Ⅲ、Ⅳ组食入氮均显著升高(P<0.05),Ⅳ组粪氮显著升高(P<0.05),Ⅰ、Ⅱ组氮沉积量显著降低(P<0.05),Ⅰ、Ⅱ、Ⅲ、Ⅳ组氮沉积率显著降低(P<0.05),其余指标在限饲期末和营养补偿期末差异不显著(P>0.05)。 2.4 限饲和营养补偿对小尾寒羊瘤胃液纤维素酶活性的影响
由图1可知,Ⅰ组在整个试验期内瘤胃液纤维素酶的活性在持续升高。Ⅱ、Ⅲ、Ⅳ组瘤胃液纤维素酶的活性在限饲期均出现不同程度的下降。从30 d开始恢复自由采食后到营养补偿期结束时,Ⅱ、Ⅲ、Ⅳ组瘤胃液纤维素酶的活性均呈现持续升高趋势,在90 d均高于Ⅰ组,其中Ⅳ组最高。
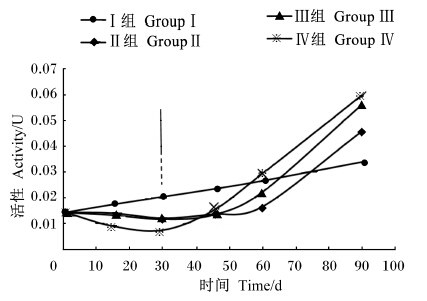 | 图1 限饲和营养补偿对小尾寒羊 瘤胃液纤维素酶活性的影响 Fig. 1 Effects of dietary restriction and realimentation on cellulase activity in rumianl fluid of Small Tail Han sheep |
维持正常新陈代谢的一个必要条件就是要保证动物从饲粮中获取充足的营养物质,同时动物的生产性能也与其饲喂营养水平直接相关[13]。Galvani等[14]对特克塞尔断奶羔羊的研究结果表明,分别饲喂1.00、0.70、0.55倍自由采食量的由青贮高粱和玉米以及豆粕组成的饲粮时,随着限饲水平的升高,羔羊的ADG显著下降。Neto等[15]对21月龄后备母牛分别以1.0、0.8、0.6倍自由采食量进行77 d限饲的研究结果表明,限饲结束时各组牛体重间差异显著,自由采食组体重显著高于0.8倍自由采食组,0.8倍自由采食组体重显著高于0.6倍自由采食组。限饲期间,自由采食组ADG显著高于0.6倍自由采食组。本试验表明限饲结束时,Ⅰ、Ⅱ、Ⅲ、Ⅳ组结束体重随限饲水平的升高而下降,ADG随限饲水平的升高而下降,影响显著,与上述研究结果一致。与本试验结果不同的是,Neto等[15]的研究同时表明限饲期自由采食组料肉比显著高于0.6倍自由采食组,而本试验结果表明限饲期随着限饲水平的升高,料肉比在逐渐升高,这种情况似与本试验中限饲水平较高时的营养物质消化率降低有关,特别是Ⅳ组限饲期料肉比为20.07,高于Ⅰ、Ⅱ、Ⅲ组,这说明按照NRC(2007)配制的日增重的300 g/d的饲粮仅稍高于小尾寒羊的维持需要。Neto等[15]在限饲77 d后进行的50 d自由采食的营养补偿试验结果表明,0.6倍自由采食组ADG显著高于1.0和0.8倍自由采食组,0.6倍自由采食组料肉比显著低于自由采食组。上述研究结果与本试验一致,本试验结果表明,营养补偿期Ⅰ组ADG低于Ⅱ、Ⅲ、Ⅳ组,且Ⅲ、Ⅳ组ADG显著高于Ⅰ组,营养补偿期Ⅰ、Ⅱ、Ⅲ、Ⅳ组料肉比依次降低。但是,本试验显示营养补偿期结束时Ⅰ、Ⅱ、Ⅲ、Ⅳ组间体重无差异,与Neto等[15]的研究不同,可能是因为营养补偿时间长短不一所致。 3.2 限饲和和补偿对小尾寒羊消化性能的影响
不同限饲水平对反刍动物消化性能有一定影响,但是目前关于不同饲粮水平对各种营养物质消化率影响的研究结果尚不一致。钟伟等[16]报道,当梅花鹿饲喂水平为2.5、2.0、1.5和1.0 kg/d时,其DM、OM、CP、NDF、ADF的表观消化率分别为73.61%~59.36%、72.87%~58.03%、75.96%~59.44%、66.66%~46.63%、59.56%~27.56%均显著降低。张瑛等[17]对20月龄藏系绵羊分别饲喂0.3、0.5、0.7、0.9倍自由采食量的燕麦干草的研究结果表明随着限饲水平的升高,DM、OM、CP、NDF、ADF的表观消化率均呈有下降的趋势,但差异不显著。霍小东等[13]和Teixeira等[18]对山羊的研究表明不同水平限饲条件下,DM、OM、CP、NDF、ADF的表观消化率间无显著差异。齐景伟[19]对妊娠期母羊不同水平限饲的研究结果显示,DM、OM、CP、NDF、ADF的表观消化率间无显著差异。但是许贵善等[20]对肉羊分别以1.0、0.7、0.4倍自由采食量的研究显示随着限饲水平的升高,营养物质的表观消化率呈现下降的趋势,Long等[21]关于牦牛的研究显示,分别饲喂自由采食量0.9、0.6、0.3倍的3组牦牛DM、OM、NDF的表观消化率范围分别为59.1%~66.1%、68.1%~59.9%、62.1%~54.3%,均呈现随着限饲水平的升高呈现上升的趋势。本试验结果表明,限饲期随着限饲水平的升高,DM、NDF、ADF的表观消化率均降低,影响显著,OM、CP的表观消化率有降低的趋势,但影响不显著,这一结果与钟伟等[16]以及张瑛等[17]在梅花鹿和藏羊上的研究相似。随着限饲水平的升高,动物采食氮水平降低,致使瘤胃内氨态氮(NH3-N)的浓度降低,瘤胃微生物合成缓慢,活力降低,酶的分泌受到影响,营养物质的消化也受到影响[13, 22],从而导致在强限饲水平下饲粮DM、NDF、ADF的表观消化率降低。
本试验结果表明,经过近60 d的营养补偿后,Ⅰ、Ⅱ、Ⅲ、Ⅳ组间DM、OM、CP、NDF、ADF的表观消化率均无显著差异且数值均在正常范围内,同时本试验中营养补偿期Ⅰ、Ⅱ、Ⅲ、Ⅳ组NDF、ADF的表观消化率分别为54.88%~58.66%和50.48%~55.53%,与许贵善等[20]和霍小东等[13]的研究结果接近,表明亚麻秸秆经过发酵处理后并未大幅提高碳水化合物的消化特性。限饲期和营养补偿期各组DM、OM、CP、NDF、ADF的表观消化率的对比表明,经过营养补偿后,Ⅰ组除NDF表观消化率在营养补偿期显著升高外,DM、OM、CP的表观消化率在2期间差异不显著。Ⅱ、Ⅲ、Ⅳ组除CP的表观消化率在营养补偿后升高不显著外,DM、OM、NDF、ADF的表观消化率经过营养补偿后均显著升高,Ⅲ、Ⅳ组的甚至达到了显著水平。这可能是由于营养补偿期随着DMI的增加,瘤胃液NH3-N浓度的升高,以及消化道和肝脏在限饲期间被动用蛋白的补偿性恢复,使其瘤胃内微生物活力和消化道功能增强的原因造成的。这一结果与刘海斌[22]、苗志国等[23]的研究结果一致。 3.3 限饲和营养补偿对小尾寒羊氮代谢的影响
氮代谢表征为食入氮与排出氮之间的动态关系,张瑛等[17]和Singh等[24]以及George等[25]关于藏羊和牛不同水平的限饲的研究表明,随着限饲水平的升高,食入氮和氮沉积均显著下降,本试验结果与之一致,这也印证了随着限饲水平的升高,瘤胃液NH3-N浓度降低,从而影响DM、OM、NDF、ADF表观消化率的观点,限饲水平的升高导致氮沉积量显著降低的原因可能是瘤胃液NH3-N浓度降低,以及进入小肠的非NH3-N与食入氮之间的比例降低[13]。同时限饲对粪氮和尿氮的影响不显著,这一结果与张瑛等[17]和许贵善等[20]的研究结果不一致。但各组的粪氮均小于尿氮,尿氮/食入氮随限饲水平的升高而升高,氮沉积率随限饲水平的升高而下降。这一结果与张瑛等[17]和许贵善等[20]以及霍小东等[13]的研究结果一致。
经过营养补偿后Ⅰ、Ⅱ、Ⅲ、Ⅳ组食入氮、粪氮、尿氮、氮沉积、氮沉积率、尿氮/食入氮范围分别为30.04~32.63 g/d、9.89~10.52 g/d、14.74~16.81 g/d、4.97~5.30 g/d、16.21%~16.55%、48.75%~52.04%、23. 57%~25.45%,组间均无显著差异。这一结果与Bezerra等[26]和Neto等[15]对21月龄后备母牛分别以1.0、0.8、0.6倍自由采食量限饲后进行的50 d营养补偿试验的研究结果一致。限饲期和营养补偿期的氮代谢分析结果表明,营养补偿期Ⅰ、Ⅱ、Ⅲ、Ⅳ组尿氮均显著升高,氮沉积率显著降低,此时各组羊平均体重已超过40 kg,氮沉积率的降低是其生长规律的必然体现,同时,此时Ⅰ、Ⅱ、Ⅲ、Ⅳ组尿氮分别为0.96、1.06、0.95、1.01 g/(kg BW0.75·d)较限饲期[0.65、0.59、0.64、0.66 g/(kg BW0.75·d)]均显著升高,这说明此时各组羊的氮利用效率较限饲期末有明显下降。 3.4 限饲和营养补偿对小尾寒羊瘤胃液纤维素酶活性的影响
2期瘤胃液纤维素酶活性测定结果表明,限饲期除Ⅰ组外,Ⅱ、Ⅲ、Ⅳ组纤维素酶活性随限饲水平的升高而呈下降趋势,这是由于纤维素酶是各种纤维素降解菌合成分泌的,此时由于饲喂水平受限,食入氮的降低,使得瘤胃液NH3-N浓度随之下降,而NH3-N是合成瘤胃微生物的氮源,NH3-N浓度的降低使瘤胃微生物蛋白合成减弱,纤维素酶作为一种瘤胃微生物合成分泌的蛋白酶,其合成和分泌也必然受到抑制[27],故而导致在整个限饲期内所有试验组纤维素酶活性均呈下降趋势。整个营养补偿期内,Ⅰ、Ⅱ、Ⅲ、Ⅳ组瘤胃液纤维素酶活性均呈升高趋势,且除Ⅰ组外,Ⅱ、Ⅲ、Ⅳ组纤维素酶活性升高均较明显。整个试验期内纤维酶活性的变化趋势与限饲期和营养补偿期的NDF、ADF的表观消化率的变化吻合,即限饲期随限饲水平的升高,NDF、ADF的表观消化率逐渐降低,营养补偿期随着限饲水平的升高,NDF、ADF的表观消化率均呈现升高趋势,且恢复到一定阶段后Ⅰ、Ⅱ、Ⅲ、Ⅳ组NDF、ADF的表观消化率将基本一致。 4 结 论
对小尾寒羊羔羊进行适度限饲并营养补偿后不会对其生长性能产生不利影响。本试验结果表明在较强限饲[按NRC(2007)300 g/d日增重]30 d后,自由采食60 d完全可以使其生长性能恢复到自由采食的水平。
| [1] | CHAOSAP C,PARR T,WISEMAN J.Effect of compensatory growth on performance,carcass composition and plasma IGF-1 in grower finisher pigs[J]. Animal (Cambridge,England),2011,5(5):749-756. ( 1) 1)
|
| [2] | ISHIDA A,KYOYA T,NAKASHIMA K,et al.Nitrogen balance during compensatory growth when changing the levels of dietary lysine from deficiency to sufficiency in growing pigs[J]. Animal Science Journal,2012,83(11):743-749. ( 1) 1)
|
| [3] | 楚惠民,王富国,宫本芝.小尾寒羊繁殖性能研究[J]. 中国草食动物科学,2014(S1):213-216. ( 1) 1)
|
| [4] | 毕晓丹,储明星,金海国,等.小尾寒羊高繁殖力候选基因ESR的研究[J]. 遗传学报,2005,32(10):1060-1065. ( 1) 1)
|
| [5] | 初汉平.杜泊羊和小尾寒羊杂一代羔羊与小尾寒羊羔羊生长性能、屠宰性能及肉品品质的比较[J]. 畜牧与兽医,2012,44(3):46-48. ( 1) 1)
|
| [6] | 熊本海,张宏福.国内外畜禽饲养标准与饲料成分表[M]. 北京:中国农业科技出版社,2010. ( 1) 1)
|
| [7] | 张丽英.饲料分析及饲料质量检测技术[M]. 3版.北京:中国农业大学出版社,2007. ( 1) 1)
|
| [8] | 汪水平,王文娟.瘤胃纤维降解相关酶活性的测定[J]. 中国饲料,2006(11):31-32. ( 1) 1)
|
| [9] | 郭旭东,刁其玉,徐俊,等.芦丁对奶牛瘤胃内固相和液相降解纤维素相关酶活性的影响[J]. 中国畜牧杂志,2012,48(7):55-58. ( 1) 1)
|
| [10] | 杨璐玲,吕永艳,张杰杰,等.啤酒糟对瘤胃发酵参数及纤维素酶活性的影响[J]. 动物营养学报,2013,25(10):2414-2421. ( 1) 1)
|
| [11] | 刘彩娟,孙满吉,孙金艳,等.饲粮中添加复合益生菌对奶牛瘤胃发酵及纤维素酶活的影响[J]. 动物营养学报,2011,23(5):821-827. ( 1) 1)
|
| [12] | 程抒劼,郑兰娟,林俊芳,等.纤维素酶活力测定研究进展[J]. 食品工业科技,2009(7):334-336,342. ( 1) 1)
|
| [13] | 霍小东,贾志海,张微,等.限饲对辽宁绒山羊生产性能及消化代谢的影响[J]. 中国畜牧杂志,2012,48(23):39-43. ( 6) 6)
|
| [14] | GALVANI D B,PIRES C C,KOZLOSKI G V,et al.Protein requirements of Texel crossbred lambs[J]. Small Ruminant Research,2009,81(1):55-62. ( 1) 1)
|
| [15] | NETO S G,BEZERRA L R,MEDEIROS A N,et al.Feed restriction and compensatory growth in Guzerá females[J]. Asian-Australasian Journal of Animal Sciences,2011,24(6):791-799. ( 5) 5)
|
| [16] | 钟伟,李光玉,罗国良,等.限饲对东北梅花鹿消化代谢及尿嘌呤衍生物排出量的影响[J]. 饲料工业,2009,30(21):44-47. ( 2) 2)
|
| [17] | 张瑛,周建伟,刘浩,等.藏羊瘤胃发酵参数对燕麦干草为饲粮限饲的响应及其氮维持需要量估测[J]. 动物营养学报,2014,26(2):371-379. ( 5) 5)
|
| [18] | TEIXEIRA I A M A,FILHO J M P,MURRAY P J,et al.Water balance in goats subjected to feed restriction[J]. Small Ruminant Research,2006,63(1/2):20-27. ( 1) 1)
|
| [19] | 齐景伟.营养限制和补偿生长对母羊和羔羊的生长轴激素及其受体基因表达水平的影响[D]. 博士学位论文.呼和浩特:内蒙古农业大学,2006. ( 1) 1)
|
| [20] | 许贵善,刁其玉,纪守坤,等.不同饲喂水平对肉用绵羊能量与蛋白质消化代谢的影响[J]. 中国畜牧杂志,2012,48(17):40-44. ( 4) 4)
|
| [21] | LONG R J,DONG S K,HU Z Z,et al.Digestibility,nutrient balance and urinary purine derivative excretion in dry yak cows fed oat hay at different levels of intake[J]. Livestock Production Science,2004,88(1/2):27-32. ( 1) 1)
|
| [22] | 刘海斌.蛋白水平对舍饲辽宁绒山羊生产性能及消化代谢的影响[D]. 硕士学位论文.长春:吉林农业大学,2008. ( 2) 2)
|
| [23] | 苗志国.苏尼特母羊补偿生长能力的研究[D]. 硕士学位论文.呼和浩特:内蒙古农业大学,2003. ( 1) 1)
|
| [24] | SINGH P,VERMA A K,SAHU D S,et al.Utilization of nutrients as influenced by different restriction levels of feed intake under sub-tropical conditions in crossbred calves[J]. Livestock Science,2008,117(2/3):308-314. ( 1) 1)
|
| [25] | GEORGE S K,DIPU M T,MEHRA U R,et al.Growth of crossbred bulls affected by level of feed intake[J]. Indian Journal Animal Nutrition,2005,22(2):81-84. ( 1) 1)
|
| [26] | BEZERRA L R,NETO S G,DE MEDEIROS A N,et al.Feed restriction followed by realimentation in prepubescent Zebu females[J]. Tropical Animal Health and Production,2013,45(5):1161-1169. ( 1) 1)
|
| [27] | 冯仰廉.反刍动物营养学[M]. 北京:科学技术出版社,2004. ( 1) 1)
|




