在家禽生产中,细菌、病毒和内毒素等抗原物质会造成免疫激发,使得体内营养物质的分配模式发生改变,从而影响家禽的生产性能。钙磷是机体重要的组成元素,其含量及代谢水平的正常进行对于维持动物骨代谢、神经传导、体液酸碱平衡等具有重要作用,是维持动物体正常生理功能的重要因素。脂多糖(lipopolysaeehafide,LPS)是革兰氏阴性细菌主要的致病成分,可诱发一系列的炎症反应造成机体的免疫应激,常被应用于动物体免疫应激模型的建立。当动物体遭受免疫应激反应时,其体内免疫系统将处于高度激活状态,进而影响动物体内营养物质的代谢水平。研究表明,LPS对动物体代谢的影响具有时间依赖性[1],高浓度的LPS单次注射会引起蛋鸡的病变[2],而低浓度的LPS长期处理也可以造成蛋鸡发热等免疫应激反应[3]。动物体的钙磷代谢平衡对动物的正常生长发育具有极其重要的作用,但当前针对免疫应激对蛋鸡钙磷代谢影响的研究报道却很少。为此,本试验以海兰褐蛋鸡为试验动物,对其进行长时间的LPS注射,旨在探究LPS应激对蛋鸡代谢性能,尤其是钙磷代谢的影响。
1 材料与方法 1.1 试验设计试验选用产蛋后期海兰褐蛋鸡20只,平均分为2组,进行单笼单饲管理并饲喂常规基础饲粮,基础饲粮参照NCR(1994)营养需要配制而成,其组成及营养水平见表1,其中钙含量实测值为4.44%,磷含量实测值为0.49%。试验组按照0.15 mg/kg体重腹腔注射LPS试剂(上海源叶生物科技有限公司),对照组注射等剂量生理盐水。连续10 d于饲喂后进行注射,自由采食和饮水。在试验过程中统计每只鸡每日采食量、产蛋重。试验以第1次注射以后的24 h为试验第1天,收集试验第1天到第3天、第8天到第10天所产鸡蛋及粪便,粪便采用全收粪法收集当天所排出的全部粪便。待第10天结束后采集样品。
| 表1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
每日记录鸡只体重、采食量和收集鸡蛋,收集试验初期3 d和末期3 d的粪便。记录蛋重和产 蛋率并计算产蛋量。
产蛋量=平均蛋重×产蛋率。
1.2.2 钙磷代谢试验过程中统计收集每只鸡在相应时间内所采食饲料量、排出粪便及所产鸡蛋进行钙磷含量测定。试验过程中收集注射前3 d和后3 d的鸡蛋、粪便样品及饲料样品,分别测定其钙、磷含量,将采食饲料中所含钙磷作为摄入钙磷,粪便当中所含钙磷作为粪钙、粪磷,蛋壳当中所含钙作为蛋壳钙,摄入钙磷减去粪便、蛋壳当中所含钙磷作为沉积钙磷。鸡蛋收集后将蛋黄、蛋清去除,将蛋壳烘干至恒重进行蛋壳钙磷含量测定。试验结束后取右侧骨骼样品置于酒精与苯2 ∶ 1的混合物中浸泡96 h进行脱脂处理,后经105℃烘干至恒重后为脱脂干重,将脱脂后的骨骼样品粉碎用于钙、磷含量测定。钙含量的测定采用高锰酸钾法(GB/T 6436—2002),磷含量的测定采用分光光度法(GB/T 6437—2002)。试验结束时采用翅静脉窦取血方式采集各组鸡血清样品,使用全自动生化分析仪(日立,7170A)进行血清钙、磷含量及碱性磷酸酶活性测定。
1.2.3 蛋品质每日测定鸡蛋品质,测定仪器为蛋壳厚度测定仪(ETG-1601A,日本ROBOTMATION公司)、蛋壳强度测定仪(EFG-0503,日本ROBOTMATION公司)。
1.2.4 骨骼指数测定试验结束后采集每只鸡左右两侧胫骨和股骨样品,左侧样品统一置于福尔马林溶液中进行浸泡固定,固定完全后置于10%硝酸溶液中浸泡(3 d换液1次),至针刺易入后制作骨切片。右侧样品进行称重,测量其胫骨长、胫骨中间部位胫围。
胫骨指数=(胫骨重/体重)×100;
胫骨饱满度=(胫围/胫长)×100;
股骨指数=(股骨重/体重)×100。
1.3 数据分析试验数据采用平均值±标准误表示,采用SAS(Version 8e,SAS Institute,1998)统计软件ANOVA法进行单因素方差分析,P<0.05为差异显著,采用Tukey法进行多重比较。
2 结果与分析 2.1 生产性能如图1所示,试验组平均日采食量在第1天较对照组发生显著降低(P<0.05),之后逐渐恢复到相似水平(P>0.05)。
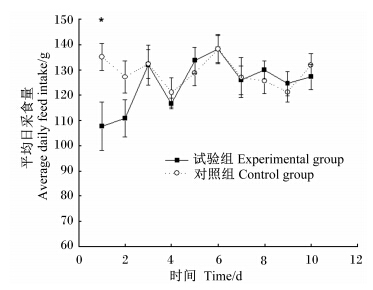 | *表示与对照组差异显著(P<0.05)。下图同。 * means significant difference compared with the control group (P<0.05). The same as below. 图1 LPS处理对蛋鸡平均日采食量的影响 Fig. 1 Effects of LPS treatment on average daily feed intake of laying hens (n=10) |
如图2所示,试验组与对照组相比,2组之间蛋壳厚度、蛋壳硬度变化趋势无显著差异(P>0.05)。
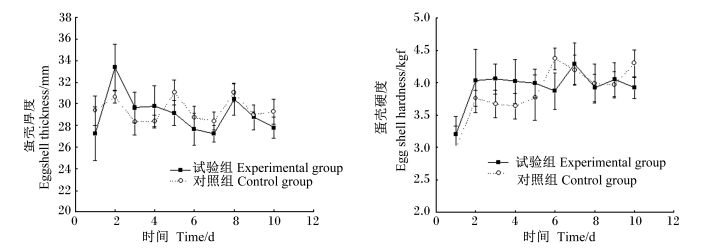 | *表示与对照组差异显著(P<0.05)。下图同。 * means significant difference compared with the control group (P<0.05). The same as below. 图2 LPS处理对蛋鸡蛋壳厚度和蛋壳硬度的影响 Fig. 2 Effects of LPS treatment on eggshell thickness and eggshell hardness of laying hens (n=10) |
由表2可见,LPS处理对胫骨指数、股骨指数均无显著影响(P>0.05),试验组蛋鸡胫骨饱满度较对照组有减小的趋势,但同样差异不显著(P>0.05)。对胫骨、股骨进行脱脂处理后称重分析,不同组间脱脂干重没有显著差异(P>0.05)。将脱脂后的骨骼粉碎后测定脱脂后骨骼当中钙、磷含量,结果显示其胫骨和股骨钙、磷含量均无显著变化(P>0.05)。
| 表2 LPS处理对蛋鸡骨骼质量的影响 Table 2 Effects of LPS treatment on bone qualities of laying hens (n=10) |
由图3可见,对骨切片进行观察,结果表明对照组蛋鸡胫骨中内外环骨板排列紧密,哈弗斯系统排列有序,皮质骨与髓质骨的接触部分没有明 显损伤,试验组蛋鸡胫骨皮质骨部分环骨板出现 部分破损,皮质骨与髓质骨的交界处骨小梁出现明显损伤,骨陷窝明显增加。对2个组间的股骨切片进行观察没有发现明显变化。
 | A:对照组胫骨切片 tibia section of control group;B:试验组胫骨切片 tibia section of experimental group;C:对照组股骨切片 femur section of control group;D:试验组股骨切片 femur section of experimental group。 图3 LPS处理对蛋鸡胫骨、股骨形态结构的影响 Fig. 3 Effects of LPS treatment on morphological structure of tibia and femur (200×) (n=10) |
如表3所示,试验组蛋鸡血清当中钙、磷含量较对照组显著降低(P<0.05),2组间碱性磷酸酶活性无显著差异(P>0.05)。
| 表3 LPS处理对蛋鸡血清指标的影响 Table 3 Effects of LPS treatment on serum parameters of laying hens (n=10) |
如表4所示,试验结果显示,LPS注射后前 3 d,2组之间钙磷代谢量均无显著差异(P>0.05),仅试验组沉积磷含量较对照组有下降趋势(P=0.058)。如表5所示,在试验最后3 d试验组较对照组仅蛋壳钙含量有下降趋势(P=0.088),其他钙磷代谢指标2组之间均无显著差异(P>0.05)。
| 表4 LPS处理对试验前3 d钙磷代谢的影响 Table 4 Effects of LPS treatment on Ca and P metabolism during the 3 days before experiment (n=10) |
| 表5 LPS处理对试验后3 d钙磷代谢的影响 Table 5 Effects of LPS treatment on Ca and P metabolism during the 3 days after experiment (n=10) |
通过注射LPS诱导应激反应建立动物体应激模型的方法具有广泛的应用。早期关于LPS应激对动物体影响作用的研究主要集中在哺乳动物上。近年来,关于LPS对禽类影响的报道逐渐增多。有研究发现,禽类动物受到LPS处理以后会发生生理和代谢水平的明显变化[4, 5, 6];另有研究发现,不同品系的鸡对由LPS应激引起的生理和遗传变化具有不同的耐受力[7]。
Takahash等[8]研究显示,通过腹腔注射LPS的方式建立免疫应激反应,结果会造成饲料利用率的下降,也有研究表明,LPS可造成火鸡采食量的下降,但不会导致料重比的显著变化[9]。在本研究中,试验组蛋鸡在注射LPS处理后,2 h内普遍发生趴卧、停止采食等现象。但2 h后陆续恢复到注射前状态,逐渐停止趴卧并恢复采食。对试验过程中每日采食量数据分析结果也表明,LPS组第1天的采食量发生显著降低,但第2天开始便逐渐恢复,之后一直与对照组保持相同水平。蛋壳厚度在注射第1天有所降低,但第2天便恢复至与对照组相似的水平并持续至试验结束,而蛋壳硬度在2组之间始终保持相同的变化趋势。结合蛋鸡采食量数据分析表明,注射开始时蛋鸡体内免疫水平较低,强烈的快速应激造成强烈的应激反应,导致蛋鸡采食量的明显下降和蛋品质的波动,随着注射的持续进行,蛋鸡体内的免疫应答可能已被激发并迅速产生适应,从而导致后期注射的LPS不再产生明显效应,其采食量、蛋品质等也陆续恢复至正常水平。
野生鸟类在发生免疫应激反应时,会将原本用于生长和代谢的营养物质用于抵抗免疫应激,这种现象在家禽中也是如此[10]。有研究表明,禽类具有较强的抵御LPS引起的应激反应的能力,使用大剂量的LPS处理,鸡也能在短时间内恢复健康[11]。本试验生产性能方面的数据基本证明了这一结论。
3.2 LPS处理对蛋鸡钙磷代谢的影响钙磷是动物体必需的矿物元素,饲粮中这2种元素的适宜水平对动物体的生长发育、饲料利用及骨骼健康至关重要,钙磷含量的缺乏或过高都会引发机体钙磷代谢障碍,进而导致动物体生产性能降低、蛋壳质量下降及骨质疏松症等疾病的发生[12]。试验发现,向腹腔中注射LPS会延迟骨折动物骨折愈合的进行,并可以降低新生骨的强度[13]。蛋鸡在产蛋过程中需要消耗大量的钙元素以满足蛋壳形成的需求,当血液中的钙含量不能满足蛋壳形成需求时,机体将动员骨骼中贮存的钙磷进入血液以维持血液当中钙磷含量的正常水平,继而保证蛋壳形成的正常进行。
对前3 d钙磷代谢水平的分析显示前3 d钙磷代谢水平并没有显著变化,说明注射前期虽然应激反应造成了蛋鸡采食量的下降以及蛋品质的短暂波动,但由于钙磷含量受激素等多种因素的共同调节,使得钙磷代谢水平短时间内不能发生显著变化。对试验后3 d的钙磷代谢数据进行分析,2组之间钙磷代谢水平同样差异不显著,但是试验组蛋鸡蛋壳钙含量较对照组有下降趋势,表明试验组蛋鸡到注射后期可能已经不能满足体内钙的正常代谢供应,从而导致了其蛋壳中钙含量发生变化。而前后3 d钙磷代谢数据的变化也说明LPS对蛋鸡的应激效应存在一定的时间依赖性,这与Xie等[6]的研究结论基本一致。
在本试验中,试验组蛋鸡血清中钙、磷含量较对照组均有降低且差异显著,说明LPS应激引起了蛋鸡体内血清中钙磷代谢的失衡。对骨切片观察的结果表明血清钙、磷含量的降低已经开始作用于骨骼,机体吸收骨骼中贮存的钙磷以维持血清钙磷的正常水平。碱性磷酸酶是成骨细胞的标志性酶,其活性高低在一定程度上可以反映成骨细胞的活性。本试验中血清碱性磷酸酶活性没有发生显著变化,说明血清当中钙、磷含量的降低没有引起成骨细胞的显著变化,而胫骨、股骨当中钙、磷含量检测数据也表明其骨骼脱脂重、骨骼钙磷含量均未发生明显改变。有文献指出,由LPS引起的多次免疫刺激会使肉鸡产生免疫耐受[14]。因此本试验可能是由于免疫耐受现象的存在而并未发生钙磷代谢失衡现象。
4 结 论① LPS处理初期可以改变蛋鸡采食量,蛋品质等性能也会因此发生波动,但随着注射时间的增加,LPS处理对蛋鸡生产性能的影响会逐步减弱。
② LPS处理降低血清钙、磷含量,但是对蛋壳品质和钙磷代谢无显著影响。
| [1] | SHINI S,KAISER P,SHINI A,et al.Biological response of chickens (Gallus gallus domesticus) induced by corticosterone and a bacterial endotoxin[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,149(2):324-333. ( 1) 1)
|
| [2] | GEHAD A E,LILLEHOJ H S,HENDRICKS G L,et al.Initiation of humoral immunity.Ⅰ.The role of cytokines and hormones in the initiation of humoral immunity using T-independent and T-dependent antigens[J]. Developmental & Comparative Immunology,2002,26(8):751-759. ( 1) 1)
|
| [3] | 成廷水,呙于明.脂多糖应激对添加不同锌源蛋鸡免疫反应和组织锌代谢的影响[J]. 畜牧兽医学报,2005,36(5),446-452. ( 1) 1)
|
| [4] | KOUTSOS E A,KLASING K C.The acute phase response in Japanese quail (Coturnix coturnix japonica)[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2001,128(2):255-263. ( 1) 1)
|
| [5] | WEBEL D M,JOHNSON R W,BAKER D H.Lipopolysaccharide-induced reductions in body weight gain and feed intake do not reduce the efficiency of arginine utilization for whole-body protein accretion in the chick[J]. Poultry Science,1998,77(12):1893-1898. ( 1) 1)
|
| [6] | XIE H,RATH N C,HUFF G R,et al.Effects of Salmonella typhimurium lipopolysaccharide on broiler chickens[J]. Poultry Science,2000,79(1):33-40. ( 2) 2)
|
| [7] | CHENG H W,FREIRE R,PAJOR E A.Endotoxin stress responses in chickens from different genetic lines.1.Sickness,behavioral,and physical responses[J]. Poultry Science,2004,83(5):705-715. ( 1) 1)
|
| [8] | TAKAHASHI K,MASHIKO T,AKIBA Y.Effect of dietary concentration of xylitol on growth in male broiler chicks during immunological stress[J]. Poultry Science,2000,79(5):743-747. ( 1) 1)
|
| [9] | PIQUER F J,SELL J L,SOTO-SALANOVA M F,et al.Effects of early immune stress and changes in dietary metabolizable energy on the development of newly hatched turkeys.1.Growth and nutrient utilization[J]. Poultry Science,1995,74(6):983-997. ( 1) 1)
|
| [10] | LOCHMILLER R L,DEERENBERG C.Trade-offs in evolutionary immunology:just what is the cost of immunity?[J]. Oilos,2000,88(1):87-98. ( 1) 1)
|
| [11] | ALDER H E,DAMASSA A J.Toxicity of endotoxins to chicks[J]. Avian Diseases,1978,23(1):174-178. ( 1) 1)
|
| [12] | WEBSTER A B.Welfare implications of avian osteoporosis[J]. Poultry Science,2004,83(2):184-192. ( 1) 1)
|
| [13] | REIKERÅS O,SHEGARFI H,WANG J E,et al.Lipopolysaccharide impairs fracture healing:an experimental study in rats[J]. Acta Orthopaedica,2005,76(6):749-753. ( 1) 1)
|
| [14] | 毛晓峰.黄芪多糖影响断奶仔猪免疫功能及其作用机理的研究[D]. 硕士学位论文.北京:中国农业大学,2004. ( 1) 1)
|




