2. 扬州大学动物科学与技术学院, 扬州 225009;
3. 扬州市扬大康源乳业有限公司, 扬州 225004
2. College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China;
3. Yangda Kang Yuan Dairy Co., Ltd., Yangzhou 225004, China
蛋氨酸是泌乳奶牛的第一或第二限制性氨基酸[1],影响奶牛蛋白质营养供给和泌乳性能。有研究表明,牛奶中乳蛋白的含量比产奶量对补充赖氨酸(Lys)和蛋氨酸(Met)的反应更敏感,尤其是在奶牛达到产奶高峰以后[2]。但由于奶牛瘤胃微生物对饲粮中氨基酸的降解,如原虫和细菌的脱氨基作用[3, 4],在奶牛饲粮中直接添加蛋氨酸很难调控到达小肠的限制性氨基酸水平。因此,如何使得蛋基酸能够到达小肠被吸收利用对饲粮蛋白质利用及乳蛋白含量的提高有着重要的意义。由于奶牛饲粮中直接添加蛋氨酸在进入瘤胃后,会被瘤胃微生物部分降解,而不能完全到达小肠满足宿主对蛋氨酸的需求[5, 6]。过瘤胃蛋氨酸则可以保护蛋氨酸在瘤胃内维持稳定的状态,并使其在小肠内释放并被吸收,从而满足宿主对蛋氨酸的营养需要。部分研究也证实,不同保护方法制备的过瘤胃蛋氨酸在试验状态下,不同程度地提高了试验奶牛的产奶量和奶品质[7, 8]。但对于过瘤胃蛋基酸的过瘤胃保护率、小肠释放率以及对饲粮粗蛋白质消化率影响的系统研究还不多见。本研究以喷雾冷却技术物理包被的过瘤胃蛋氨酸为研究对象,研究过瘤胃蛋氨酸在奶牛消化道不同部位的保护和释放性能,对瘤胃体外发酵性能以及泌乳奶牛氮素利用的影响,以期为奶牛生产中过瘤胃蛋氨酸的研发和应用提供一些参考。
1 材料与方法 1.1 试验材料的瘤胃保护率、小肠消化率过瘤胃蛋氨酸为上海美农生物科技股份有限公司产品,蛋氨酸有效含量是45%。
采用尼龙袋法测定瘤胃保护率。试验选用扬州市扬大康源乳业有限公司所属奶牛场的装有瘤胃瘘管的3头泌乳奶牛为试验动物。在早饲后1 h,通过瘤胃瘘管将尼龙袋放进瘤胃内。分别在0、2、4、8、12和24 h取出尼龙袋,测定瘤胃保护率。计算公式:
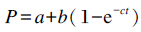 [9]
[9]
式中:P为瘤胃保护率,a、b和c分别为快速降解部分、慢速降解部分和慢速降解部分的降解速率常数。测得过瘤胃蛋氨酸的瘤胃保护率为80.63%。
采用体外法测定小肠消化率。取过瘤胃蛋氨酸瘤胃非降解产物(在瘤胃液中降解16 h),先加入胃蛋白酶溶液(pH=2)处理1 h,再用小肠混合溶液(pH=7.8)处理24 h,之后检测消化液中蛋氨酸的含量,推算产品中蛋氨酸的消化率[10]。测得小肠消化率为91.66%。
1.2 体外发酵试验 1.2.1 试验动物与饲养管理试验选用扬州市扬大康源乳业有限公司所属奶牛场的装有瘤胃瘘管的3头泌乳奶牛作为体外发酵试验瘤胃液供体。基础饲粮组成及营养水平见表1,采用全混合日粮(TMR)形式饲喂。
| 表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
晨饲前,通过瘤胃瘘管从3头瘘管奶牛瘤胃内采取瘤胃液各300 mL,过4层纱布后滤液混合均匀,与预先配制好的唾液盐溶液按1 ∶ 2的比例混合,于39 ℃水浴中进行瘤胃体外发酵试验。具体参考Menke等[11]的方法。
1.2.3 试验分组与样品采集试验分为蛋氨酸组(0.45 g蛋氨酸)、过瘤胃蛋氨酸组(1g过瘤胃蛋氨酸)和对照组,每组设置5个重复。蛋氨酸组与过瘤胃蛋氨酸组蛋氨酸含量一致。分别在发酵试验开始后的0、2、4、8、12、16和24 h取培养液样品。
1.2.4 测定指标pH:pHS-3C型pH计于采样后立即测定;氨态氮(NH3-N)含量:酚-次氯酸钠比色法[12]测定;细菌和原虫蛋白含量:TCA法测定。
1.3 动物试验 1.3.1 试验设计与试验饲粮于2013年12月—2014年1月在扬州市扬大康源乳业有限公司所属的奶牛场进行。选用30头日产奶量(30±3) kg、胎次为1~2胎之间、泌乳天数(60±3) d、健康状况良好的荷斯坦泌乳奶牛为试验动物。据胎次、产犊日期、产奶量相似的原则,采用随机区组试验分为3组:对照组(不加蛋基酸)、蛋氨酸组[添加DL-蛋氨酸13.50 g/(头·d),有效含量是99%,上海禾丰饲料有限公司]、过瘤胃蛋氨酸组[添加过瘤胃蛋氨酸30.00 g/(头·d),有效含量是45%,上海美农生物科技股份有限公司]。试验牛基础饲粮与体外试验瘤胃液供体牛相同(表1),由试验所在奶牛场提供。预试期7 d,正试期42 d。
1.3.2 样品采集 1.3.3.1 牛奶样品采集在第1、28、42天采奶样,每天分别在(08:00、14:30、22:30)3次取奶样,3次奶样按照4 ∶ 3 ∶ 3的比例混合,混合样用于乳脂率、乳蛋白率和乳尿素氮含量的检测。同时每天记录产奶量,计算日均产奶量。
1.3.3.2 血样采集在第1、28、42天,晨饲前尾静脉采血2.5 mL,放于促凝管中分离血清。用于检测血清尿素氮和总蛋白含量。
1.3.3.3 饲粮粗蛋白质消化率样品采集在第40、41、42天连续3 d收粪样,混合均匀3 d的样品,检测其中粗蛋白质和盐酸不溶灰分含量。同样收集与处理饲粮样。
1.3.4 样品检测与分析 1.3.4.1 乳品质分析在扬大康源乳业有限公司采用丹麦福斯120乳品检测仪(红外线)检测乳脂率、乳蛋白率。采用南京建成生物工程研究所尿素氮试剂盒(脲酶法),利用连续波长酶标仪检测尿素氮含量。
1.3.4.2 血样分析血清中的生化指标在扬州市疾病预防控制中心用全自动生化分析仪进行检测。
1.3.4.3 饲粮粗蛋白质消化率的检测盐酸不溶灰分法检测粗蛋白质消化率。凯氏定氮法测定饲粮和粪样中粗蛋白质含量。
饲粮粗蛋白质消化率(%)=[1-(饲粮盐酸不溶灰分含量/粪盐酸不溶灰分含量)×(粪粗蛋白质含量/饲粮粗蛋白质含量)]×100。
1.4 数据处理采用Excel初步整理后,采用SPSS 17.0软件中的ANOVE进行方差分析,Turkey’s法进行多重比较。
2 结 果 2.1 过瘤胃蛋氨酸对瘤胃体外发酵的影响由表2可见,蛋氨酸组和过瘤胃蛋氨酸组对培养液pH的影响不显著(P>0.05)。体外试验,随着时间的延长培养液pH降低。培养液NH3-N含量从0 h开始降低,4 h最低,然后上升至24 h结束;3组不同时间点的NH3-N含量差异不显著(P>0.05)。
| 表 2 过瘤胃蛋氨酸对瘤胃体外发酵培养液pH和NH3-N含量的影响 Table 2 Effects of rumen protected methionine on pH and NH3-N content in culture medium after in vitro ruminal fermentation |
由表3可见,各组培养液原虫蛋白含量均呈先降低后升高再降低再升高的变化趋势,在24 h,过瘤胃蛋氨酸组和蛋氨酸组的原虫蛋白含量皆显著高于对照组(P < 0.05),但过瘤胃蛋氨酸组和蛋氨酸组间的差异不显著(P>0.05)。各组的培养液细菌蛋白含量随培养时间延长,均呈现先降低后升高再降低再升高的变化趋势,但组间没有显著差异(P>0.05)。
| 表 3 过瘤胃蛋氨酸对瘤胃体外发酵培养液原虫蛋白和细菌蛋白含量的影响 Table 3 Effects of rumen protected methionine on protozoal protein and bacterial protein contents in culture medium after in vitro ruminal fermentation mg/mL |
由表4可见,过瘤胃蛋氨酸组的产奶量在数值上比对照组高1.22 kg,比蛋氨酸组高2.09 kg。从整个试验期看,过瘤胃蛋氨酸组和蛋氨酸组的乳脂率是不断升高的。试验的第1天,3组的乳脂率没有显著差异(P>0.05);试验的第28天,过瘤胃蛋氨酸组的乳脂率在数值上比对照组的提高4.07%,比蛋氨酸组的提高2.87%;试验的第42天,过瘤胃蛋氨酸组的乳脂率比对照组的提高6.65%(P < 0.05)、比蛋氨酸组的提高3.94%(P < 0.05)。蛋氨酸组和对照组的乳蛋白率在整个试验期变化不大,而过瘤胃蛋氨酸组的乳蛋白率不断提高。试验的第1天,3组的乳蛋白率均在3.04%左右;试验的第28天,过瘤胃蛋氨酸组的乳蛋白率在数值上高于其他2组;试验的第42天,过瘤胃蛋氨酸组的乳蛋白率显著高于对照组4.23%(P < 0.05),显著高于蛋氨酸组3.89%(P < 0.05)。
| 表 4 过瘤胃蛋氨酸对奶牛产奶量、乳脂率和乳蛋白率的影响 Table 4 Effects of rumen protected methionine on milk yield,and percentages of milk fat and milk protein of dairy cows |
由表5可见,过瘤胃蛋氨酸组的乳尿素氮含量比蛋氨酸组低24.27%(P < 0.05),比对照组低15.97%(P < 0.05),而蛋氨酸组和对照组间没有显著差异(P>0.05)。血清尿素氮含量在对照组持续在17.50 mg/dL左右变化;在蛋氨酸组有所降低;而在过瘤胃蛋氨酸组则由开始的17.43 mg/dL降低到了第42天时的14.98 mg/dL。试验的第1天,3组的血清尿素氮含量无显著差异(P>0.05);试验第28天,过瘤胃蛋氨酸组比对照组低14.80%(P < 0.05)、比蛋氨酸组低6.06%(P>0.05);试验第42天,过瘤胃蛋氨酸组比对照组低15.08%(P < 0.05)、比蛋氨酸组低7.81%(P < 0.05),而蛋氨酸组和对照组没有显著差异(P>0.05)。血清总蛋白含量在3组间没有显著差异(P>0.05)。
| 表 5 过瘤胃蛋氨酸对奶牛乳、血清尿素氮和血清总蛋白含量的影响 Table 5 Effects of rumen protected methionine on milk and serum urea nitrogen and serum total protein contents of dairy cows |
由表6可见,饲粮盐酸不溶灰分含量在0.93%左右,粗蛋白质含量在17.80%左右。过瘤胃蛋氨酸组的粪盐酸不溶灰分含量高于蛋氨酸组和对照组,差异不显著(P>0.05);该组的粪粗蛋白质含量显著低于蛋氨酸组和对照组(P < 0.05)。因而,过瘤胃蛋氨酸组的饲粮粗蛋白质消化率比对照组的显著提高8.50%(P < 0.05),比蛋氨酸组的显著提高9.38%(P < 0.05)。
| 表 6 过瘤胃蛋氨酸对奶牛饲粮粗蛋白质消化率的影响 Table 6 Effects of rumen protected methionine on the digestibility of dietary crude protein of dairy cows |
瘤胃发酵的正常是保证宿主动物健康和生产性能的前提。瘤胃内pH、NH3-N含量可以部分反映瘤胃内环境状况,是目前研究瘤胃发酵的主要发酵指标[13]。瘤胃液pH的一般变化范围为5.5~7.5,引起其波动的根本原因是饲粮组成和饲粮的营养含量[13]。本研究模拟瘤胃发酵内环境,发酵装置中有瘤胃液及人工唾液盐溶液,pH在5.93~7.00之间变化,属于微生物发酵正常范围。NH3-N含量是反映瘤胃内氮降解和微生物利用氨的动态指标。氨是瘤胃中主要微生物体系生长的氮源[14]。体外发酵试验与动物试验相比,消除了瘤胃壁对NH3-N的吸收、唾液尿素循环的影响,因此NH3-N含量变化主要是被微生物降解和利用的结果。本研究中,在培养后2~8 h期间,3组的NH3-N含量在较低范围波动,这可能是因为在培养开始阶段瘤胃微生物的快速增殖利用了NH3-N。培养8 h后,NH3-N含量开始逐步上升。这主要是由于降解产生的NH3-N不能及时被微生物利用,以及体外发酵装置不能移除多余的NH3-N而导致的蓄积,但组间的NH3-N含量差异不显著。影响微生物增殖的关键营养素是碳水化合物和蛋白质[15]。在本研究中,相对于对照组,2个蛋氨酸组对细菌蛋白含量都没有显著影响。这可能是由于氨是瘤胃细菌生长的主要氮源[14]。这与上述NH3-N含量在组间没有显著变化的结果有一定的一致性。但2个蛋氨酸组在一定程度上都提高了培养原虫蛋白的含量,这则可能是由于原虫以氨基酸为主要生长氮源,对氨的利用很少,蛋氨酸的添加在一定程度上促进了其增殖。这也与本研究所测定的过瘤胃蛋氨酸的瘤胃保护率为80.63%,在瘤胃有一定程度蛋氨酸的释放相一致。但原虫蛋白含量在2个蛋氨酸组间没有显著差异。以上体外试验结果说明过瘤胃蛋氨酸对瘤胃微生物体外发酵的pH、NH3-N含量以及原虫和细菌的生物量没有显著的影响。
3.2 过瘤胃蛋氨酸对奶牛泌乳性能和乳蛋白的影响蛋氨酸是奶牛的第一或第二限制氨基酸[1],通过氨基酸木桶原理可知,增加到达小肠的蛋氨酸的量可平衡氨基酸,提高饲粮粗蛋白质消化率和宿主的生产性能[16]。本研究中,过瘤胃蛋氨酸组的产奶量比对照组高1.22 kg;过瘤胃蛋氨酸组比蛋氨酸组高2.09 kg。与Guinard等[17]补充过瘤胃蛋氨酸后提高奶牛产奶量研究的结果一致。前人研究报道,给泌乳荷斯坦奶牛补饲过瘤胃蛋氨酸,乳蛋白含量有明显提高[18, 19]。本研究泌乳前中期奶牛的研究表明,过瘤胃蛋氨酸可以显著提高泌乳奶牛的乳蛋白率4.23%,同时也显著高于蛋氨酸组3.89%。与Misciattlli等[20]给乳前中期奶牛补饲12 g/(头·d)过瘤胃蛋氨酸提高乳蛋白率的结果相一致。以上表明,本研究中过瘤胃蛋氨酸可到达小肠以平衡氨基酸模式,进而满足乳蛋白合成的需求。另外,王纪亭等[21]报道,给泌乳荷斯坦奶牛补饲过瘤胃蛋氨酸55 g/(头·d),乳脂率提高12.06%。本研究也获得相近的结果,过瘤胃蛋氨酸组乳脂率比对照组的提高6.65%,比蛋氨酸组的提高3.94%。补喂过瘤胃蛋氨酸提高乳脂率,可能与蛋氨酸影响乳腺中短链和中链脂肪酸合成有关[22]。也有研究认为,蛋氨酸是合成胆碱的甲基供体,而胆碱是合成乳脂的限制性营养物质。具体的机理还需要进一步的研究予以阐明。
3.3 过瘤胃蛋氨酸对饲粮粗蛋白质饲粮消化率、乳尿素氮和血清尿素氮含量的影响到达小肠氨基酸的平衡性可在一定程度上影响饲粮粗蛋白质消化率。血清尿素氮的含量是反映机体氮代谢的重要指标,同时也能够反映饲粮含氮物质在瘤胃的降解情况[23]。血清尿素氮的主要来源是瘤胃中微生物对饲粮中的瘤胃可降解蛋白质(DIP)降解所产生的氨。这些氨主要被用来合成瘤胃微生物自身的氨基酸,如果DIP含量过高,瘤胃中被微生物利用多余的氨则被吸收进入血液,并在肝脏中转化为尿素,进而引起血清尿素氮含量的升高。王洪荣等[24]采用十二指肠梯度灌注氨基酸法+回撤法证明反刍动物氨基酸不平衡提高了血清尿素氮的含量。本研究中,过瘤胃蛋氨酸组的血清尿素氮含量比对照组降低了15.08%,比蛋氨酸组的降低了7.81%。另外,乳尿素氮和血清尿素氮含量存在高度的相关性[25],过高都表明饲粮蛋白质的浪费。在本研究中同时还发现,过瘤胃蛋氨酸组的乳尿素氮含量比对照组的降低了15.97%,比蛋氨酸组的降低了24.27%。与此同时,本研究中饲粮粗蛋白质消化率的结果也表明,过瘤胃蛋氨酸组比对照组提高了8.50%,比蛋氨酸组提高了9.38%。以上相关指标的结果一致表明了过瘤胃蛋氨酸更有利用氨基酸平衡,提高饲粮氮素的代谢利用状况。
4 结 论过瘤胃蛋氨酸对奶牛瘤胃体外发酵没有显著影响,但可在一定程度上提高奶牛乳蛋白率和乳脂率和饲粮粗蛋白质的消化率。
| [1] | MERCHEN N R,TITGEMEYER E C.Manipulation of amino acid supply to the growing ruminant[J]. Journal of Animal Science,1992,70(10):3238-3247. ( 2) 2)
|
| [2] | NRC.National research council,nutrient requirements of dairy cattle[S]. 7th ed.Washington,D.C.:National Academy of Sciences,2001. ( 1) 1)
|
| [3] | JOUANY J P,PAPON Y,LASSALAS B,et al.Effects of Isotricha,Eudiplodinium,Epidinium+Entodinium and a mixed population of rumen protozoa on the in vitro degradation of fish meal,soybean meal and casein[J]. Canadian Journal of Animal Science,1992,72(4):871-880. ( 1) 1)
|
| [4] | WALLACE R J,NEWBOLD C J,MCKAIN N.Inhibition by 1,10-phenanthroline of the breakdown of peptides by rumen bacteria and protozoa[J]. Journal of Applied Bacteriology,1996,80(4):425-430. ( 1) 1)
|
| [5] | CHALUPA W.Degradation of amino acids by the mixed rumen microbial population[J]. Journal of Animal Science,1976,43(4):829-834. ( 1) 1)
|
| [6] | ONODERA R.Methionine and lysine metabolism in the rumen and the possible effects of their metabolites on the nutrition and physiology of ruminants[J]. Amino Acids,1993,5(2):217-232. ( 1) 1)
|
| [7] | CHEN Z H,BRODERICK G A,LUCHINI N D,et al.Effect of feeding different sources of rumen-protected methionine on milk production and N-utilization in lactating dairy cows[J]. Journal of Dairy Science,2011,94(4):1978-1988. ( 1) 1)
|
| [8] | PATTON R A.Effect of rumen-protected methionine on feed intake,milk production,true milk protein concentration,and true milk protein yield,and the factors that influence these effects:a meta-analysis[J]. Journal of Dairy Science,2010,93(5):2105-2118. ( 1) 1)
|
| [9] | ØRSKOV E R,MCDONALD I.The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. The Journal of Agricultural Science,1979,92(2):499-503. ( 1) 1)
|
| [10] | 冯仰廉.反刍动物营养学[M]. 北京:科学出版社,2004:172-173. ( 1) 1)
|
| [11] | MENKEA K H,RAABA L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science (Cambridge),1979,93:217-222. ( 1) 1)
|
| [12] | 王继贵.临床生化检验[M].2版.长沙:湖南科学技术出版社:1996. ( 1) 1)
|
| [13] | REDDY P S,REDDY G V N,REDDY M R.Utilization of sunflower straw and subabul-meal in complete diets for crossbred bulls[J]. India Journal of Animal Sciences 1987,59(9):980-985. ( 2) 2)
|
| [14] | LENG R A,NOLAN J V.Nitrogen metabolism in the rumen[J]. Journal of Dairy Science,1984,67(5):1072-1089. ( 2) 2)
|
| [15] | STERN M D,VARGA G A,CLARK J H,et al.Evaluation of chemical and physical properties of feeds that affect protein metabolism in the rumen[J]. Journal of Dairy Science,1994,77(9):2762-2786. ( 1) 1)
|
| [16] | LEE C,HRISTOV A N,CASSIDY T W,et al.Rumen-protected lysine,methionine,and histidine increase milk protein yield in dairy cows fed a metabolizable protein-deficient diet[J]. Journal of Dairy Science,2012,95(10):6042-6056. ( 1) 1)
|
| [17] | GUINARD J,RULQUIN H.Effects of graded amounts of duodenal infusions of methionine on the mammary uptake of major milk precursors in dairy cows[J]. Journal of Dairy Science,1995,78(10):2196-2207. ( 1) 1)
|
| [18] | 邹阿玲,孙国军,李明强,等.过瘤胃蛋氨酸对泌乳早期奶牛生产性能的影响[J]. 中国奶牛,2005(2):27-29. ( 1) 1)
|
| [19] | 王永康,胡绪华,李海涛,等.补饲过瘤胃蛋氨酸提高奶牛生产性能的试验[J]. 乳业科学与技术,2005,27(1):33-35. ( 1) 1)
|
| [20] | MISCIATTELLI L,KRISTENSEN V F,VESTERGAARD M,et al.Milk production,nutrient utilization,and endocrine responses to increased postruminal lysine and methionine supply in dairy cows[J]. Journal of Dairy Science,2003,86(1):275-286. ( 1) 1)
|
| [21] | 王纪亭,万文菊,徐国青,等.保护性蛋氨酸对奶牛生产性能的影响[J]. 中国奶牛,2003(1):15-17. ( 1) 1)
|
| [22] | PISULEWSK P M,RULQUIN H,PEYRAUD J L,et al.Lactational and systemic responses of dairy cows to postruminal infusions of increasing amounts of methionine[J]. Journal of Dairy Science,1996,79(10):1781-1791. ( 1) 1)
|
| [23] | HUNTINGTON G B.Uptake and transport of nonprotein nitrogen by the ruminant gut[J]. Federation Proceedings,1986,45(8):2272-2276. ( 1) 1)
|
| [24] | 王洪荣,卢德勋.饲喂玉米型日粮的生长绵羊限制性氨基酸的研究[J]. 动物营养学报,1999,11(4):17-28. ( 1) 1)
|
| [25] | 翟少伟.中国荷斯坦牛血液与乳液中尿素氮浓度的关系研究[J]. 福建畜牧兽医,2008,30(增刊):53-55. ( 1) 1)
|




