随着海洋鱼类资源的下降,鱼粉价格高涨,植物性原料在水产动物饲料中的用量越来越高[1]。为了更好地利用植物性饲料,人们不仅研究了水产动物对其营养物质的利用效率[2],还探讨了蛋白酶抑制剂、植物凝集素、棉酚、黄曲霉毒素等抗营养因子的影响[3, 4, 5]。然而,关于非淀粉多糖(non-starch polysaccharides,NSPs)对水产动物潜在影响的报道还很少[1]。
NSPs是植物组织中由多种单糖和糖醛酸经糖苷键连接成的多聚体,包括纤维素(cellulose)、β-葡聚糖(β-glucans)、木聚糖(xylans)、木葡聚糖(xyloglucans)、果聚糖/菊粉(fructans/inulin)、甘露聚糖(mannans)、瓜尔胶(guar gum)、果胶(pectins)等[6]。其中果胶和木聚糖在水产动物常用植物性饲料中含量较高,豆粕和菜籽粕中果胶含量达11.5%,麦麸和次粉中木聚糖含量分别达21.9%和25.1%[7]。单胃动物由于缺乏非淀粉多糖酶,不能消化利用NSPs[1]。对畜禽的研究表明NSPs可以在动物肠道形成高黏性物质,延缓营养物质与消化液的混合速度[8],阻滞营养物质在动物体内的消化吸收,从而对动物的生长产生不利影响。NSPs的抗营养作用很大程度上与其黏性有关,不同动物肠道内食糜水分含量不同,食糜黏性随水分含量增加而降低[9]。水产生物长期生活在水环境中,肠道食糜水分含量一般高于陆生动物[10]。因此,NSPs对水产动物生长和消化生理的影响可能会比较小。如果高剂量的NSPs不影响水产动物的消化生理,那么在水产饲料配方设计时对NSPs的抗营养作用就可以不予考虑。
中华绒螯蟹(Eriocheir sinensis),又称河蟹,是我国重要的养殖经济蟹类。大量植物性饲料被用于其商品配合饲料中[11],而广泛存在于植物性饲料中的NSPs对河蟹消化生理的影响还未见报告。本研究以植物性饲料中含量较高的果胶和木聚糖这2种NSPs为研究对象,以酶解果胶和酶解木聚糖为对照,观察其对中华绒螯蟹生长、消化吸收和肠道形态的影响,探讨其潜在的影响机制,为中华绒螯蟹饲料配方设计提供依据,也为中华绒螯蟹饲料原料营养价值的评估提供借鉴。
1 材料与方法 1.1 试验果胶和木聚糖试验所用果胶购自深圳江源商贸有限公司。试验木聚糖以麦麸为材料,麦麸由鑫裕饲料(苏州)有限公司提供。果胶酶和木聚糖酶购自苏柯汉(潍坊)生物工程有限公司。将2种酶与相应的NSPs源按照1 ∶ 20的比例准确称取混匀后,加入5倍体积的双蒸水于45℃下振荡酶解3 h,制成酶解NSPs。将2种酶经过105℃ 30 min灭活后,按照上述方法添加到NSPs源中同法孵育,制成非酶解NSPs。
1.2 试验饲料为了避免植物性原料中NSPs的影响,本试验采用半精制饲料。试验所用鱼粉为白鱼粉,由北京桑普生物技术有限公司提供,粗蛋白质含量为67%。豆油为市售1级大豆油。其余原料均由鑫裕饲料(苏州)有限公司提供。根据果胶和木聚糖在中华绒螯蟹商品饲料中可能出现的上限设果胶和麦麸添加量分别为8%和30%,并根据试验NSPs源将饲料分别命名为果胶组、酶解果胶组、木聚糖组、酶解木聚糖组。饲料中添加0.1%的三氧化二钇(Y2O3)作指示剂测定营养物质表观消化率[12, 13],试验饲料组成及营养水平见表1。所有原料粉碎过60目筛,按配方称取原料充分混合均匀,加入质量分数20%的蒸馏水,用电动绞肉机挤压成直径为2 mm的条状物,然后手工切成5 mm左右的颗粒,室温下电风扇吹至水分含量12%左右,于-20℃冰箱中保存。
1.3 试验动物及饲养管理 1.3.1 生长试验试验用中华绒螯蟹购自苏州市阳澄湖国家现代农业发展有限公司。中华绒螯蟹购回后用3%食盐水浸泡5 min消毒,在18 m2的室内水泥池中驯化2周。驯化期间控制水深30~40 cm,24 h持续增氧,每天饱食投喂商品饲料2次(07:00、16:00),自然光周期,水温21.0~22.5℃,pH 7.8±0.4,溶解氧浓度为6.0~8.0 mg/L,氨氮浓度小于0.02 mg/L,亚硝酸盐浓度小于0.01 mg/L。每日换水1次,换水量不超过1/3。每5 d吸污1次。驯化2周后清点蟹数,调整每池蟹的数量为50只,称重后开始正式试验。中华绒螯蟹初始平均体重为(5.9±0.4) g,随机分为4组,每组投喂1种试验饲料,每组3个重复(池)。试验期间饲养管理及水质情况与驯化期间相似,实测水温21.0~29.5℃。正式试验从2013年4月10日至2013年6月6日,为期57 d。
1.3.2 消化率试验试验蟹来源同上,中华绒螯蟹初始平均体重为(42.0±5.1) g。中华绒螯蟹购回后同法消毒,在室内循环养殖系统中驯化2周,随机分养于60 cm×70 cm的水族箱中,每箱15只,每3箱为1组,饲喂1种试验饲料。试验期间控制水深30 cm左右,增氧和投饲方法同上,水温22.0~28.0℃,pH 7.9±0.3,溶解氧浓度为6.0~8.0 mg/L,氨氮浓度小于0.02 mg/L,亚硝酸盐浓度小于0.01 mg/L。2周后开始收集粪便,具体方法是:每天早上投饲2 h后用虹吸法排去残饵及粪便,再于3 h后用虹吸法收集粪便。粪便随水流收集于20 L的塑料桶中,沉淀后撇去上层水,用镊子选择新鲜、外表带有包膜、尽可能完整的粪便放入干净培养皿中,60℃烘干。采自同一水族箱的粪便烘干合并,-20℃保存待测。
| 表1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
饲料和粪便概略养分测定参考AOAC(2000)[14]中方法,即水分含量采用105℃烘干法测定,粗蛋白质含量采用凯氏定氮法测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用550℃灼烧法测定。钇(Y)元素含量采用美国Perkin Elmer Optima 8000电感耦合等离子体发射光谱仪测定。饲料中总木聚糖和可溶性木聚糖含量的测定采用地衣酚-盐酸法,总半乳糖醛酸含量的测定采用硫酸-咔唑法,还原糖含量的测定采用3,5-二硝基水杨酸试剂比色法。果胶的含量为总半乳糖醛酸和还原糖含量的差值。
1.4.2 生长性能分析生长试验结束后,禁食24 h,捕捞每池中华绒螯蟹,冰浴麻醉5 min后,计数并称重,计算增重率和特定生长率。
1.4.3 血淋巴的采集与血清指标分析用于生长试验的中华绒螯蟹称重后,每池随机取6只,分别用洁净的16号针头插入其步足基部软膜处收集血淋巴,于1.5 mL离心管中在4℃静置4 h,3 500 r/min离心20 min。小心吸出上层血清,液氮速冻后-80℃保存待测。血清总胆固醇(CHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、甘油三酯(TG)含量采用雅培全自动血液生化分析仪测定。
1.4.4 肝胰腺消化酶活性分析用于生长试验的中华绒螯蟹称重后,每池随机取6只,冰浴麻醉,迅速取出肝胰腺于Eppendorf管中,液氮速冻,-80℃保存。测定时,将组织解冻,取约0.25 g放入玻璃匀浆管中,加9倍体积缓冲液,在冰浴中5 000 r/min匀浆1 min,4℃ 3 500 r/min离心15 min,取上清,采用南京建成生物工程研究所生产的试剂盒测定胰蛋白酶(TP)、脂肪酶(LPS)、淀粉酶(AMS)活性及总蛋白含量。
1.4.5 肠道形态学分析用于生长试验的中华绒螯蟹称重后,每池随机取3只,解剖,分离出肠道,剔除表面脂肪组织,分别剪取中肠、肠球和后肠各1 cm左右的组织块,迅速固定于波恩氏液中。制样时将其取出,乙醇梯度脱水,并置于二甲苯中透明,最后包埋于低熔点石蜡中。使用YD-202型切片机横向切片,厚度为5 μm,而后展片于清洁的载玻片上,采用苏木精-伊红(HE)染色,中性树胶封片,在OLYMPUS DP72光学显微镜下观测围食膜厚度、皱襞宽度、皱襞高度等肠道形态学指标。
1.5 计算公式增重率(%)=[(末重-初重)/初重]×100;
特定生长率(%/d)=[(ln末重-ln初重)/试验天数]×100;
干物质表观消化率(%)=(1-饲料中Y2O3含量/粪便中Y2O3含量)×100;
某营养成分表观消化率(%)=[1-(饲料中Y2O3含量/粪便中Y2O3含量)×(粪便中该营养成分含量/饲料中该营养成分含量)]×100。
1.6 统计分析试验数据以平均值±标准差表示,采用SPSS 19.0软件进行同时进行单因素方差分析和双因素方差分析。单因素方差分析后进行Duncan氏法多重比较,双因素方差分析时以NSPs种类和水平(即酶解与否)为变量。显著水平为P<0.05。
2 结果与分析 2.1 饲料中果胶和木聚糖含量饲料中果胶和木聚糖含量如表1所示。果胶组的果胶含量为8.0%,酶解果胶组果胶含量为4.7%。木聚糖组含可溶性木聚糖1.7%,总木聚糖11.0%,酶解木聚糖组含可溶性木聚糖0.9%,总木聚糖9.5%。
2.2 果胶和木聚糖对中华绒螯蟹生长性能的影响经过57 d的饲养,中华绒螯蟹的体重均提高了3倍多,但各组间增重率和特定生长率差异不显著(P>0.05,表2)。
| 表2 果胶和木聚糖对中华绒螯蟹生长性能的影响 Table 2 Effects of pectin and xylan on growth performance of Chinese mitten crab (Eriocheir sinensis) |
果胶和木聚糖对中华绒螯蟹血清指标的影响见表3。单因素方差分析结果显示:果胶组中华绒螯蟹血清CHO、HDL和LDL含量均显著低于酶解果胶组、木聚糖组和酶解木聚糖组(P<0.05),后三者间差异不显著(P>0.05);血清TG含量各组间差异不显著(P>0.05)。双因素方差分析结果显示:NSPs种类对血清CHO和HDL含量的影响显著(P<0.05),NSPs水平对血清CHO和LDL含量的影响显著(P<0.05),且NSPs种类和水平间交互作用对血清CHO和LDL含量的影响显著(P<0.05)。
| 表3 果胶和木聚糖对中华绒螯蟹血清指标的影响 Table 3 Effects of pectin and xylan on serum indices of Chinese mitten crab (Eriocheir sinensis) |
果胶和木聚糖对中华绒螯蟹肝胰腺消化酶活性的影响见表4。单因素方差分析结果显示:果胶组肝胰腺胰蛋白酶活性显著低于酶解果胶组(P<0.05),木聚糖组和酶解木聚糖组的肝胰腺胰蛋白酶活性差异不显著(P>0.05),且两者均显著高于果胶组和酶解果胶组(P<0.05);肝胰腺脂肪酶活性各组间差异不显著(P>0.05);木聚糖组肝胰腺淀粉酶活性显著低于酶解木聚糖组(P<0.05),但果胶组与酶解果胶组间肝胰腺淀粉酶活性差异不显著(P>0.05)。双因素方差结果显示:NSPs种类和水平对肝胰腺胰蛋白酶活性的影响均显著(P<0.05),但交互作用不显著(P>0.05);NSPs水平对肝胰腺淀粉酶活性的影响显著(P<0.05),且NSPs 种类和水平间交互作用对肝胰腺淀粉酶活性的影响也显著(P<0.05)。
| 表4 果胶和木聚糖对中华绒螯蟹肝胰腺消化酶活性的影响 Table 4 Effects of xylan and pectin on hepatopancreas digestive enzyme activities of Chinese mitten crab (Eriocheir sinensis) |
各组中华绒螯蟹对试验饲料的表观消化率见表5。中华绒螯蟹对饲料中干物质、蛋白质和脂肪的表观消化率均呈现果胶组<酶解果胶组<木聚糖组<酶解木聚糖组的态势。单因素方差分析结果显示:果胶组干物质和脂肪的表观消化率显著低于酶解果胶组(P<0.05);木聚糖组蛋白质和脂肪的表观消化率显著低于酶解木聚糖组(P<0.05)。双因素方差分析结果显示:NSPs种类和水平均会对干物质、蛋白质和脂肪的表观消化率产生显著影响(P<0.05),但种类和水平间交互作用对上述指标的影响不显著(P>0.05)。
| 表5 果胶和木聚糖对中华绒螯蟹表观消化率的影响 Table 5 Effects of pectin and xylan on nutrient apparent digestibility of Chinese mitten crab (Eriocheir sinensis) |
中华绒螯蟹中肠、肠球及后肠均有明显的围 食膜覆盖在黏膜上(图1)。果胶和木聚糖组中华 绒螯蟹与其应的酶解组间在围食膜厚度、皱襞宽度、皱襞高度等指标上未见明显差异(数据未列出)。
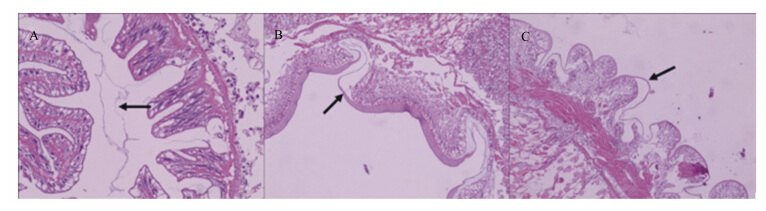 | 中肠(A)、肠球(B)、后肠(C)均有围食膜(箭头所指)覆盖在肠黏膜上。Peritrophic membrane (arrow) covered the mucosa of midgut (A), intestinal ball (B) and hindgut (C). 图1 中华绒螯蟹肠道显微结构 Fig. 1 Microstructure of Chinese mitten crab (Eriocheir sinensis) intestine |
本研究结果表明,各组中华绒螯蟹的特定生长率差异不显著,但对饲料营养物质的表观消化率差异较大,表现之一是果胶组和木聚糖组的各营养物质表观消化率均低于其相应的酶解组。在凡纳滨对虾(Litopenaeus vannamei)[15]等水产动物上也观察到NSPs酶解后可提高营养物质消化率,与本试验结果相支持。
NSPs对营养物质消化率的影响被认为与其黏性有关[1],而食糜黏性随水分含量增加而下降[9]。不同动物食糜水分含量不同,因此对NSPs的响应存在差异。例如,鸭食糜水分含量比鸡和猪高,因而NSPs对其消化率的影响较小[16]。水生生物长期生活在水环境中,肠道食糜水分含量一般高于陆生动物[10],因此我们曾推测中华绒螯蟹对营养物质的消化吸收可能不受NSPs的影响。但本试验结果与预期相反,2种NSPs对中华绒螯蟹的营养物质表观消化率的影响均显著。因为本试验中试验蟹比较小,未能获得足够的食糜直接检测其黏性,因而不能确定NSPs是否通过提高食糜黏性而发挥作用,但根据本试验结果可以肯定,NSPs降低中华绒螯蟹对营养物质的消化吸收,因而其饲料配方设计时应控制NSPs含量。
本试验中还观察到2个NSPs组与其对应酶解组间在肝胰腺胰蛋白酶和淀粉酶活性上存在显著差异。消化酶是由酶蛋白和辅因子(有机物和金属离子)以共价键的形式构成,辅因子又是活性部位的组成成分。NSPs通过与消化酶或消化酶辅因子结合影响内源酶活性。例如,NSPs对二价阳离子有较强的结合能力,而淀粉酶的活性依赖于Ca2+存在,NSPs可能竞争结合Ca2+从而抑制淀粉酶的活性[17]。NSPs对中华绒螯蟹消化酶活性的影响是否与其对辅因子的结合有关还有待进一步研究确认,但NSPs降低消化酶活性这一现象可能具有普遍性,因为许多研究都表明NSPs酶解后畜禽消化酶活性显著上升[18, 19, 20]。在水产动物研究方面,张璐等[21]也观察到NSPs酶解后显著提高鲈鱼(Lateolabrax japonicus)胃和肠道消化酶活性。本研究中2个NSPs组与其对应酶解组在消化酶活性上的变化规律与营养物质表观消化率测定结果一致,提示消化酶活性的降低是果胶和木聚糖组中华绒螯蟹养物质表观消化率下降的重要原因。
已有研究表明可溶性NSPs能与胆汁酸、胆固醇、脂肪结合[22],导致胆汁酸直接被排出体外[23],最终降低血液中的CHO和LDL含量[24, 25, 26]。本试验中也观察到果胶组血清CHO和LDL含量显著低于酶解果胶组,提示果胶影响了中华绒螯蟹对肠道内胆汁酸的重吸收,这可能也是果胶组脂肪表观消化率较低的另一个原因。
HDL的主要作用是通过胆固醇逆转运将肝外组织的CHO运送到肝脏,再由肠道排出体外[25],因此具有降低CHO含量的作用[26]。不少研究表明HDL不受NSPs的影响,甚至在NSPs存在时有所下降[27, 28, 29, 30]。本试验中也观察到果胶组血清HDL含量显著低于酶解果胶组,推测可能是由于果胶组血清CHO含量较低,HDL含量相应地下降从而维持血清中一定水平的CHO,确切原因还有待于进一步探究。
本研究结果表明,NSPs种类对部分饲料营养物质的表观消化率、消化酶活性及血清指标均有显著影响。这一点与Metzler-Zebeli等[31, 32]的研究报道相支持,他们在比较了不同黏性和可发酵性的NSPs对仔猪矿物质利用及肠道菌群的影响后指出,NSPs的生理效应与黏性无关而与其化学结构特征有关。目前关于不同NSPs生理效应的比较研究还很少,从本研究结果看,NSPs种类对营养物质表观消化率、血清CHO和HDL含量、肝胰脏蛋白酶活性的影响均显著,总体上表现为果胶的抗营养作用大于木聚糖。这一结果提示深入探究不同NSPs对消化功能的影响具有重要的意义。
肠道是与食糜直接接触的部位,研究发现动物肠道上绒毛高度、绒毛宽度、分泌等受饲料中NSPs的影响[33, 34]。本研究中未见果胶和木聚糖对中华绒螯蟹肠道形态产生影响,这可能与中华绒螯蟹肠道中覆盖着的围食膜有关。围食膜将食糜与肠道上皮相阻隔,保护肠道上皮与食糜成分的直接接触,因而中华绒螯蟹肠道形态没有发生显著变化。
虽然观察到果胶和木聚糖组营养物质消化率低于其对应酶解组,但各组中华绒螯蟹的特定生长率差异不显著,这可能是与投喂方式有关。本试验采用过量投饲方式,中华绒螯蟹可能通过提高采食量来弥补消化率下降的影响[35]。但根据消化率测定结果可以预见,等量投饲时NSPs会降低中华绒螯蟹的生长速度。
4 结 论果胶和木聚糖会降低中华绒螯蟹对营养物质的消化率,但不影响其肠道形态;果胶和木聚糖对中华绒螯蟹的抗营养作用强度不同,总体上表现为果胶的抗营养作用大于木聚糖。
| [1] | SINHA A K,KUMAR V,MAKKAR H P S,et al.Non-starch polysaccharides and their role in fish nutrition-a review[J]. Food Chemistry,2011,127(4):1409-1426. ( 4) 4)
|
| [2] | 姜雪姣,梁丹妮,刘文斌,等.团头鲂对8种非常规饲料原料中营养物质的表观消化率[J]. 水产学报,2011,35(6):932-939. ( 1) 1)
|
| [3] | 吉红.鱼用植物性蛋白饲料的抗营养因子[J]. 水利渔业,1999,19(4):22-24. ( 1) 1)
|
| [4] | 王桂芹,李清华.大豆蛋白中的主要抗营养因子对鱼类的影响[J]. 饲料工业,2007,28(12):44-47. ( 1) 1)
|
| [5] | 张璐.饲料蛋白源及抗营养因子对中华绒螯蟹生理生化影响的初步研究[D]. 硕士毕业论文.上海:华东师范大学,2007:28-35. ( 1) 1)
|
| [6] | KNUDSEN K E B,HEDEMANN M S,LRKE H N.The role of carbohydrates in intestinal health of pigs[J]. Animal Feed Science and Technology,2012,173(1/2):41-53. ( 1) 1)
|
| [7] | NRC.Nutrient requirements of fish and shrimp[S]. Washington,D.C.:National Academies Press,2011:138-140. ( 1) 1)
|
| [8] | CHOCT M, HUGHES R J,WANG J,et al.Increased small intestinal fermentation is partly responsible for the anti-nutritive activity of non-starch polysaccharides in chickens[J]. British Poultry Science,1996,37(3):609-621. ( 1) 1)
|
| [9] | 王杰.黏度法评定小麦非淀粉多糖的含量及低黏度小麦与酶制剂在仔猪日粮中应用[D]. 硕士毕业论文.呼和浩特:内蒙古农业大学,2003:17-19. ( 2) 2)
|
| [10] | REFSTIE S,SVIHUS B,SHEARER K D,et al.Nutrient digestibility in Atlantic salmon and broiler chickens related to viscosity and non-starch polysaccharide content in different soyabean products[J]. Animal Feed Science and Technology,1999,79(4):331-345. ( 2) 2)
|
| [11] | 谭德清,段中华,张道源,等.河蟹成蟹饲料配方及其制成河蟹成蟹配合饲料的方法.中国,ZL02139161.0[P]. 2003-03-19. ( 1) 1)
|
| [12] | REIS P A,VALENTE L M P,ALMEIDA C M R.A fast and simple methodology for determination of yttrium as an inert marker in digestibility studies[J]. Food Chemistry,2008,108(3):1094-1098. ( 1) 1)
|
| [13] | CARTER C G,LEWIS T E,NICHOLS P D.Comparison of cholestane and yttrium oxide as digestibility markers for lipid components in Atlantic salmon (Salmo salar L.) diets[J]. Aquaculture,2003,225(1/2/3/4):341-351. ( 1) 1)
|
| [14] | AOAC International.official methods of analysis of AOAC International[S]. 17th ed.Gaithersburg,MD:AOAC International,2000. ( 1) 1)
|
| [15] | 杨志刚,陈乃松,郑剑伟,等.酶解小麦对凡纳滨对虾生长性能的影响[J]. 粮食与饲料工业,2009(2):38-40. ( 1) 1)
|
| [16] | DANICKE S,VAHJEN W,SIMON O,et al.Effects of dietary fat type and xylanase supplementation to rye-based broiler diets on selected bacterial groups adhering to the intestinal epithelium on transit time of feed,and on nutrient digestibility[J]. Poultry Science,1999,78(9):1292-1299. ( 1) 1)
|
| [17] | STOREBAKKEN T,KVIEN I S,SHEARER K D,et al.Estimation of gastrointestinal evacuation rate in Atlantic salmon (Salmo salar) using inert markers and collection of faeces by sieving:evacuation of diets with fish meal,soybean meal or bacterial meal[J]. Aquaculture,1999,172(3/4):291-299. ( 1) 1)
|
| [18] | 杨桂芹,王佳丽.小麦饲粮中添加木聚糖酶对肉鹅消化器官指数和消化道酶活性的影响[J]. 沈阳农业大学学报,2006,36(3):324-327. ( 1) 1)
|
| [19] | 程志斌,张红兵,黄遵锡,等.几种商业非淀粉多糖酶制剂对肉鸡肠道及内容物消化酶的影响[J]. 家畜生态学报,2011,32(2):64-68. ( 1) 1)
|
| [20] | LI W F,FENG J,XU Z R,et al.Effects of non-starch polysaccharides enzymes on pancreatic and small intestinal digestive enzyme activities in piglet fed diets containing high amounts of barley[J]. World Journal of Gastroenterol,2004,10(6):856-859. ( 1) 1)
|
| [21] | 张璐,艾庆辉,麦康森,等.植酸酶和非淀粉多糖酶对鲈鱼生长和消化酶活性的影响[J]. 水生生物学报,2009,33(1):82-88. ( 1) 1)
|
| [22] | EBIHARA K,SCHNEEMAN B O.Interaction of bile acids,phospholipids,cholesterol and triglyceride with dietary fibers in the small intestine of rats[J]. The Journal of Nutrition,1989,119(8):1100-1106. ( 1) 1)
|
| [23] | IKEGAMI S,TSUCHIHASHI F,HARADA H,et al.Effect of viscous indigestible polysaccharides on pancreatic-biliary secretion and digestive organs in rats[J]. The Journal of Nutrition,1990,120(4):353-360. ( 1) 1)
|
| [24] | HOSSAIN M A,FOCKEN U,BECKER K.Galactomannan-rich endosperm of Sesbania (Sesbania aculeata) seeds responsible for retardation of growth and feed utilisation in common carp,Cyprinus carpio L.[J]. Aquaculture,2001,203(1/2):121-132. ( 1) 1)
|
| [25] | 郭志军,张颖秋,王芳建,等.内皮脂肪酶与高密度脂蛋白胆固醇代谢、胆固醇逆转运、动脉粥样硬化的关系研究进展[J]. 医学综述,2013,19(7):1169-1173. ( 2) 2)
|
| [26] | 陈国良,刘立伟,谢爽,等.高密度脂蛋白胆固醇代谢及其对冠心病影响的研究进展[J]. 心血管病学进展,2010,31(3):360-363. ( 2) 2)
|
| [27] | 胡娟.番茄皮膳食纤维对高脂膳食大鼠血脂的影响[D]. 硕士毕业论文.重庆:西南大学,2011:33-51. ( 1) 1)
|
| [28] | CHAU C F,CHEUNG P C K.Effects of the physico-chemical properties of three legume fibers on cholesterol absorption in hamsters[J]. Nutrition Research,1999,19(2):257-265. ( 1) 1)
|
| [29] | OHARA I,TABUCHI R,ONAI K,et al.Effects of modified rice bran on serum lipids and taste preference in streptozotocin-induced diabetic rats[J]. Nutrition Research,2000,20(1):59-68. ( 1) 1)
|
| [30] | GERMAN J B,XU R P,WALZEM R,et al.Effect of dietary fats and barley fiber on total cholesterol and lipoprotein cholesterol distribution in plasma of hamsters[J]. Nutrition Research,1996,16(7):1239-1249. ( 1) 1)
|
| [31] | METZLER-ZEBELI B U,HOODA S,ZIJLSTRA R T,et al.Dietary supplementation of viscous and fermentable non-starch polysaccharides (NSP) modulates microbial fermentation in pigs[J]. Livestock Science,2010,133(1/2/3):95-97. ( 1) 1)
|
| [32] | METZLER-ZEBELI B U,HOODA S,MOSENTHIN R,et al.Fermentation affects mineral flux in the gastrointestinal tract of pigs fed diets supplemented with different viscous and fermentable non-starch polysaccharides (NSP)[J]. Livestock Science,2010,134(1/2/3):82-84. ( 1) 1)
|
| [33] | 贺永惠,王清华,王艳荣,等.小麦非淀粉多糖与木聚酶对大鼠小肠形态结构的影响[J]. 河南科技学院学报,2010,38(2):56-59. ( 1) 1)
|
| [34] | HEDEMANN M S,ESKILDSEN M,LARKE H N,et al.Intestinal morphology and enzymatic activity in newly weaned pigs fed contrasting fiber concentrations and fiber properties[J]. Journal of Animal Science,2006,84(6):1375-1386. ( 1) 1)
|
| [35] | XIE S,ZHU X,CUI Y,et al.Utilization of several plant proteins by gibel carp (Carassius auratus gibelio)[J]. Journal of Applied Ichthyology,2001,17(2):70-76. ( 1) 1)
|




