2. 东北农业大学 食品安全与营养协同创新中心, 哈尔滨 150030;
3. 中国农业科学院与世界农用林业中心农用林业与 可持续畜牧业联合实验室, 北京 100193
2. Synergetic Innovation Center of Food Safety and Nutrition, Northeast Agriculture University, Harbin 150030, China;
3. CAAS-ICRAF Joint Laboratory on Agroforestry and Sustainable Animal Husbandry, Beijing 100193, China
在全球范围内,氮排泄问题已受到越来越多的关注,畜牧业是氮排放的主要来源,一方面氮排泄会对环境产生巨大的压力,影响畜牧业的可持续发展;另一方面能够影响饲养成本的投入[1, 2]。随着我国奶牛养殖业的蓬勃发展,氮排放问题亦是我们所面临的严峻挑战,粪便和尿液是反刍动物氮排泄的主要途径。减少蛋白质饲料用量和提高氮利用率是解决氮排放的重要手段。然而,减少蛋白质饲料的用量会影响奶牛的生产性能和乳品质,因此,提高氮利用率是解决奶牛生产氮排放问题的最有效手段[3]。已有研究表明,优化饲粮碳水化合物组成是提高奶牛氮利用率的重要营养学措施。Huhtanen等[4]研究表明,增加饲粮中淀粉类碳水化合物的含量,能够提高奶牛的氮利用率。与高蛋白质饲粮相比,在低蛋白质饲粮条件下,增加饲粮中淀粉含量,奶牛氮利用率提高更加显著[5]。Cantalapiedra-Hijar等[6]研究表明,饲粮中增加淀粉含量能够提高乳腺等外周组织对氨基酸的摄取效率,进而提高氮利用率。Arndt等[7]研究发现,当饲粮中淀粉含量从29.6%降低到24.0%,奶牛饲粮粗蛋白质转化为乳蛋白效率从30.7%降低至24.1%。然而,Hristov等[8]研究发现高纤维饲粮能够促进瘤胃氨氮和微生物蛋白(MCP)向乳蛋白的转化效率。因此,饲粮碳水化合物组成对奶牛氮利用率的影响结果不一。本试验旨在通过设计不同中性洗涤纤维与淀粉比例(NDF:starch)饲粮,研究奶牛在不同碳水化合物组成饲粮条件下的氮利用率,探究奶牛氮高效利用的最适饲粮碳水化合物组成,为奶牛实际生产氮高效利用提供科学依据。
1 材料与方法 1.1 试验动物和试验设计试验采用4×4拉丁方试验设计。本试验于北 京市顺义区中地种畜良种奶牛养殖场进行,试验选取8头泌乳阶段[泌乳天数(146.0±21.6) d]、产奶量[(35.1±0.5) kg/d]相近奶牛作为试验动物,其中4头安装永久瘤胃瘘管,每个处理2头,安装和未安装瘘管的奶牛各1头。为研究饲粮碳水化合物组成对奶牛氮利用率的影响, 分别设计4种不同饲粮碳水化合物组成饲粮,以NDF ∶ starch表示碳水化合物组成,共配制饲粮1(NDF ∶ starch= 0.86)、饲粮2(NDF ∶ starch=1.18)、饲粮3(NDF ∶ starch=1.63)和饲粮4(NDF ∶ starch=2.34)4种饲粮。通过改变饲粮中玉米、燕麦草和玉米青贮比例调节饲粮碳水化合物组成。每期试验21 d,其中适应期14 d,采样期7 d。试验饲粮组成及营养水平见表1。
| 表1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验奶牛采用全混合日粮方式饲喂,散栏式饲养,自由饮水,橡胶垫卧床。采用全自动饲喂系统(RIC systerm)饲养,此系统能够自动记录奶牛每天采食量以及采食行为,日挤奶3次(07:00、14:00和21:00),每天投料2次(08:00和16:00),保证每天奶牛剩料量小于饲喂量的5%。
1.3 样品采集与测定 1.3.1 饲料样采集与指标测定试验采样期第1、2和3天连续3 d采集饲粮和剩料,采样完毕混合3 d的样品,缩样至500 g,于-20 ℃保存待测。65 ℃烘干48 h,测定初水分,过1 mm筛,密封保存,参照AOAC(2000)[10]测定干物质和粗蛋白质含量,中性洗涤纤维和酸性洗涤纤维含量应用Ankom(200)纤维分析仪(Ankom Technology,美国)测定,淀粉含量测定参照Bertrand等[11]的方法。
1.3.2 奶样采集与指标测定试验采样期第1、2和3天连续3 d采集乳样,每天早、中、晚分别采集奶样50 mL,每天采集完按照4 ∶ 3 ∶ 3比例混合奶样,分为2份,一份用于乳成分测定,另一份缩样后于-20 ℃保存,用于测定乳中尿素氮(MUN)含量,具体参照Bhandari等[12]的方法。
1.3.3 血样采集与指标测定采样期第4天于尾动脉采集血样,每8 h采集1次血样,分别装于血清管和血浆管,3 000×g,离心15 min。然后将各时间点样品混合,-20 ℃保存,测定血液尿素氮(BUN)含量,具体参照Bhandari等[12]的方法。
1.3.4 尿液采集与指标测定试验采样期第4、5和6天连续3 d采集尿样,每天间隔6 h采集尿样,每次采集30 mL,然后加入10%的6 mol/L盐酸固氮,采样完成后混合尿样,缩样至100 mL,于-20 ℃保存,用于测定尿中尿素氮(UUN)含量,具体参照Bhandari等[12]的方法。
1.3.5 瘤胃微生物蛋白产量测定瘤胃微生物蛋白含量采用嘌呤衍生物(尿囊素和尿酸)法测定[13]。使用试剂盒(南京建成生物工程研究所)测定尿中肌酸酐含量(苦味酸法)。每天排尿量及尿中尿素氮、总氮和嘌呤衍生物排出量根据肌酸酐含量计算,肌酸酐排出量固定为29 mg/kg BW[14]。
瘤胃微生物蛋白产量根据尿中嘌呤衍生物含量估测,具体计算公式如下:
式中:X为十二指肠处微生物蛋白嘌呤衍生物吸收量(mmol/d);Y为尿中嘌呤衍生物排出量(mmol/d);0.385×W0.75为内源蛋白质的嘌呤衍生物排出量(mmol/d);Z为瘤胃微生物蛋白产量(g/d);0.85为十二指肠吸收的嘌呤衍生物排到尿中的比例;70为嘌呤衍生物中氮含量(mg/mmol);0.116为嘌呤衍生物氮与瘤胃微生物总氮之比;0.83为瘤胃微生物嘌呤在十二指肠的消化率。
1.3.6 瘤胃非降解蛋白质(RUP)十二指肠消化率测定瘤胃非降解蛋白质十二指肠消化率测定采用改进的三步体外(MTSP)法[15],具体如下:1)称取大约5 g饲料于5 cm×10 cm尼龙袋(孔径50 μm)中,晨饲后2 h全部投入瘤胃中,16 h后,取出尼龙袋,自来水清洗至澄清,然后将尼龙袋放在0.1%甲基纤维素溶液中,37 ℃振荡培养30 min,取出尼龙袋并洗净,于55 ℃烘箱内烘干48 h,至恒重,测定粗蛋白质含量。2)称取1 g残渣装入尼龙袋中,封口,将尼龙袋装入Daisy Ⅱ培养瓶中,每瓶最多可放入30个尼龙袋。培养瓶中加入预热的2 L培养液(1 g/L胃蛋白酶盐酸溶液,pH=1.9)。将培养瓶放在ANKOM Daisy Ⅱ体外模拟发酵培养箱39 ℃旋转培养1 h。3)培养完毕,取出尼龙袋并清洗干净,加入2 L预热的含有3 g/L胰蛋白酶(P-7545,Sigma,美国)和50 μg/L百里香酚的0.5 mol/L磷酸二氢钾溶液。并将培养瓶放在ANKOM Daisy Ⅱ体外模拟发酵培养箱39 ℃旋转培养24 h。4)培养24 h后,取出尼龙袋并清洗至水清,55 ℃烘箱内烘至恒重(48 h)。测定残渣中粗蛋白质含量。5)根据如下公式计算瘤胃非降解蛋白质十二指肠消化率:
可代谢蛋白质产量计算具体参照Zhu等[16]的方法,包括十二指肠消化微生物蛋白(IAMCP)(NRC,2001)和十二指肠消化瘤胃非降解蛋白质(IARDP)2部分,计算公式如下:
试验数据采用Excel软件处理后,运用SAS 9.1中Mixed模型进行统计,采用Tukey氏法进行多重比较,相关性分析采用SAS 9.1中Corr模型进行分析,相关性采用Pearson相关系数表示。P<0.05表示差异显著,0.05≤P<0.10表示具有差异显著的趋势。
2 结 果 2.1 采食和产奶由表2可知,饲粮NDF:starch对干物质采食量、粗蛋白质采食量、产奶量、乳蛋白含量和乳蛋白产量均有显著影响(P<0.05),且随比例增加均呈一次线性降低(P<0.05),其中产奶量、乳蛋白产量同时呈二次曲线变化(P<0.05)。
| 表2 不同中性洗涤纤维和淀粉比例饲粮对奶牛采食和产奶的影响
Table 2 Effects of different NDF ∶ starch diets on feed intake and milk production of dairy cows
|
由表3可知,与乳蛋白产量相关性由强到弱分别为:粗蛋白质采食量、可代谢蛋白质产量和微生物蛋白产量,乳蛋白产量与粗蛋白质采食量相关性为0.874。粗蛋白质采食量与微生物蛋白产量和可代谢蛋白质产量分别为0.588和0.814;微生物蛋白产量与可代谢蛋白质产量相关性为0.943。以上均为显著相关(P<0.05)。
2.2 氮利用率由表4可知,饲粮NDF:starch对饲粮粗蛋白质转化为乳蛋白效率有显著影响(P<0.05),随着饲粮NDF:starch的增加,呈先升高后降低的显著二次曲线变化(P<0.05);随着饲粮NDF:starch的增加,可代谢蛋白质转化为乳蛋白效率呈先升高后降低的二次曲线变化趋势(0.05≤P<0.10);微生物蛋白转化为乳蛋白效率在处理间无显著变化(P>0.05);饲粮NDF:starch对饲粮粗蛋白质转化为微生物蛋白的效率无显著影响(P>0.05),对饲粮粗蛋白质转化为可代谢蛋白质效率具有线性增 加的趋势(0.05≤P<0.10),对微生物蛋白转化为可代谢蛋白质效率无显著影响(P>0.05)。
| 表3 乳蛋白产量、粗蛋白质采食量、微生物蛋白产量与可代谢蛋白质产量的相关性(r) Table 3 Correlations (r) among milk protein yield,CP intake,MCP yield,and metabolizable protein yield |
| 表4 不同中性洗涤纤维和淀粉比例饲粮对奶牛氮利用率的影响 Table 4 Effects of different NDF ∶ starch diets on nitrogen utilization efficiency of dairy cows |
由图1可见,饲粮NDF ∶ starch对饲粮粗蛋白质转化为乳蛋白效率呈二次曲线变化,在本试验中,当饲粮NDF:starch为1.71时,效率最高,达到27.6%。
2.3 尿素氮含量由表5可知,饲粮NDF ∶ starch对血液尿素氮含量影响显著(P<0.05),随着饲粮NDF ∶ starch的增加,血液尿素含量呈显著的线性增加(P<0.05);尿中尿素氮的含量随饲粮NDF ∶ starch的增加呈现二次曲线变化趋势(0.05≤P<0.10),乳中尿素氮含量随着饲粮NDF ∶ starch的增加而呈显著的线性增加(P<0.05)。
3 讨 论在奶牛生产中,乳蛋白合成与干物质采食量、粗蛋白质采食量、微生物蛋白产量和可代谢蛋白质产量相关[17, 18]。本试验中,随着饲粮NDF ∶ starch的增加,干物质和粗蛋白质采食量显著降低,表明奶牛用于乳蛋白合成的底物逐渐减少,Hristov等[6]研究表明,奶牛采食量是影响乳蛋白合成的最主要营养指标,其主要是通过影响营养物质底物供给实现。可代谢蛋白质主要由微生物蛋白和瘤胃非降解蛋白质组成[18],因此,饲粮粗蛋白质采食量与可代谢蛋白质产量相关性强于其与微生物蛋白产量的相关性。微生物蛋白是可代谢蛋白质的最主要组成部分[17, 18],故微生物蛋白产量与可代谢蛋白质产量的相关性最强,达到0.943。
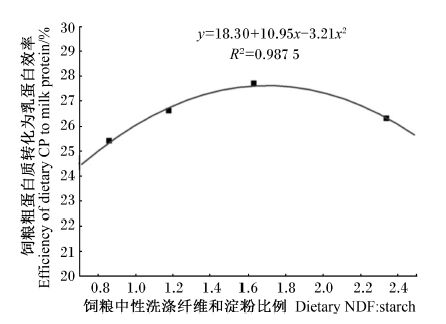 | 图1 不同中性洗涤纤维和淀粉比例饲粮对奶牛饲粮粗蛋白质转化为乳蛋白效率影响 Fig. 1 Effects of different NDF ∶ starch diets on dietary CP to milk protein efficiency of dairy cows |
饲粮粗蛋白质转化为乳蛋白效率是衡量奶牛饲粮氮转化效率的重要指标,其一方面能够影响奶牛养殖的效益,另一方面氮的低效利用能够增加环境压力[1, 5]。本试验结果表明,饲粮中的碳水化合物组成对饲粮粗蛋白质转化为乳蛋白效率存在显著影响,随着饲粮NDF ∶ starch的增加,呈现先 升高后降低的二次曲线变化。NDF ∶ starch过高或过低都能降低饲粮粗蛋白质转化为乳蛋白的效率。有研究表明,高淀粉饲粮能够增加饲粮氮利用率[4];与正常蛋白质含量(16.5%)饲粮相比,提高淀粉水平能够增加低蛋白质饲粮氮利用率;这些研究都表明,饲粮碳水化合物组成能够影响奶牛饲粮氮利用率[5]。然而,本试验中发现饲粮碳水化合物组成对饲粮粗蛋白质转化为乳蛋白效率并非呈现线性变化,而呈现明显的二次曲线变化。过低NDF ∶ starch的饲粮能够增加奶牛患亚急性瘤胃酸中毒的风险[19, 20],奶牛患亚急性瘤胃酸中毒能够影响机体的代谢水平和养分分配,使机体吸收的营养被分解用于抵抗应激,降低饲料转化效率[21],吸收的氨基酸并非用于乳蛋白的合成,进而造成低氮利用率,此假设可由可代谢蛋白质转化为乳蛋白效率的结果证实,其亦呈现二次曲线变化的趋势,同时,尿中尿素氮结果显示饲喂过低NDF ∶ starch饲粮能够增加尿中尿素氮含量。高NDF ∶ starch饲粮引起饲粮粗蛋白质转化效率降低可能主要是由于饲粮的淀粉含量低,研究表明低淀粉饲粮能够降低乳腺利用氨基酸合成乳蛋白的能力[6],此假设亦可由可代谢蛋白质转化为乳蛋白效率的结果证实,过高NDF ∶ starch饲粮引起其降低,同时,血液和乳中结果表明奶牛饲喂高NDF ∶ starch饲粮能够显著增加尿素氮的含量。Wang等[22]研究表明,随着饲粮可代谢蛋白质水平的提高,奶牛血液、尿液和乳中的尿素氮含量显著升高,说明可代谢蛋白质产量超过一定水平,机体氮利用率就会降低。因此,科学、合理的碳水化合物组成能够提高奶牛氮利用率。
| 表5 不同中性洗涤纤维和淀粉比例饲粮对奶牛尿素氮含量影响 Table 5 Effects of different NDF ∶ starch diets on urea nitrogen content of dairy cows |
微生物蛋白与可代谢蛋白质的合成效率是影响饲粮粗蛋白质转化为乳蛋白的营养学基础,其成为制约氮利用率的关键环节。饲粮碳水化合物能够为瘤胃微生物的合成提供能量,影响瘤胃微生物的合成效率。然而,已有研究表明,饲粮碳水化合物组成对瘤胃微生物的合成效率报道不一。Hristov等[8]报道随着饲粮中非结构性碳水化合物含量的增加,瘤胃微生物蛋白的合成效率增加,进而提高乳蛋白的合成效率。Cantalapiedra-Hijar等[5]研究表明,增加饲粮中淀粉类易发酵碳水化合物含量能够提高微生物蛋白合成效率。但在本试验中,饲粮碳水化合物对微生物蛋白产量无显著影响,可能与饲粮的采食量或流通速率等因素相关,随着饲粮NDF ∶ starch的增加,奶牛粗蛋白质采食量降低。本试验结果发现,随着饲粮NDF ∶ starch的增加,饲粮粗蛋白质转化为可代谢蛋白质效率呈增加趋势,表明饲粮碳水化合物组成可能通过瘤胃非降解蛋白质的含量或消化率影响可代谢蛋白质的合成效率。微生物蛋白是可代谢蛋白质的重要组成部分,能够提供畜体所需蛋白质的40%~60%[23],本试验结果发现饲粮碳水化合物的组成对微生物蛋白转化为可代谢蛋白质效率无显著影响,表明试验饲粮的蛋白质在瘤胃中的降解速度和利用速度保持一致。
4 结 论奶牛饲粮碳水化合物组成能够影响氮利用率,随着饲粮NDF ∶ starch的增加,奶牛饲粮粗蛋白质转化为乳蛋白效率呈二次曲线变化。在本饲粮条件下,奶牛饲粮NDF ∶ starch为1.71时能够获得最佳的氮利用率。
| [1] | 李德发.饲料高效利用与低碳氮排放畜牧业[J]. 中国家禽,2010,32(11):1-5. ( 2) 2)
|
| [2] | CASTILLO A R,KEBREAB E,BEEVER D E,et al.A review of efficiency of nitrogen utilisation in lactating dairy cows and its relationship with environmental pollution[J]. Journal of Animal and Feed Sciences,2000,9(1):1-32. ( 1) 1)
|
| [3] | KOHN R A,DOU Z,FERGURSON J,et al.A sensitivity analysis of nitrogen losses from dairy farms[J]. Journal of Environmental Management,1997,50(4):417-428. ( 1) 1)
|
| [4] | HUHTANEN P,HRISTOV A N.A meta-analysis of the effects of dietary protein concentration and degradability on milk protein yield and milk N efficiency in dairy cows[J]. Journal of Dairy Science,2009,92(7):3222-3232. ( 2) 2)
|
| [5] | CANTALAPIEDRA-HIJAR G,PEYRAUD J L,LEMOSQUET S,et al.Dietary carbohydrate composition modifies the milk N efficiency in late lactation cows fed low crude protein diets[J]. Animal,2014,8(2):275-285. ( 4) 4)
|
| [6] | CANTALAPIEDRA-HIJAR G,LEMOSQUET S,RODRIGUEZ-LOPEZ J M,et al.Diets rich in starch increase the posthepatic availability of amino acids in dairy cows fed diets at low and normal protein levels[J]. Journal of Dairy Science,2014,97(8):5151-5166. ( 3) 3)
|
| [7] | ARNDT C,POWELL J M,AGUERRE M J,et al.Performance,digestion,nitrogen balance,and emission of manure ammonia,enteric methane,and carbon dioxide in lactating cows fed diets with varying alfalfa silage-to-corn silage ratios[J]. Journal of Dairy Science,2015,98(1):418-430. ( 1) 1)
|
| [8] | HRISTOV A N,ROPP J K.Effect of dietary carbohydrate composition and availability on utilization of ruminal ammonia nitrogen for milk protein synthesis in dairy cows[J]. Journal of Dairy Science,2003,87(7):2416-2427. ( 2) 2)
|
| [9] | 中华人民共和国农业部.NY/T 34—2004奶牛饲养标准[S]. 北京:中华人民共和国农业部,2004. ( 2) 2)
|
| [10] | AOAC.Official methods of analysis of AOAC international[S]. 17th ed.Arlington,V.A.:AOAC,2000. ( 1) 1)
|
| [11] | BERTRAND A,CASTONGUAY Y,NADEAU P,et al.Oxygen deficiency affects carbohydrate reserves in overwintering forage crops[J]. Journal of Experimental Botany,2003,54(388):1721-1730. ( 1) 1)
|
| [12] | BHANDARI S K,OMINSKI K H,WITTENBERG K M,et al.Effects of chop length of alfalfa and corn silage on milk production and rumen fermentation of dairy cows[J]. Journal of Dairy Science,2007,90(5):2355-2366. ( 3) 3)
|
| [13] | CHEN X B,GOMES M J.Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives:an overview of technical details[M]//International feed resources unit.Aberdeen:Rowett Research Institute,1992. ( 1) 1)
|
| [14] | VALADARES R F D,BRODERICK G A,VALADARES FILHO S C,et al.Effect of replacing alfalfa silage with high moisture corn on ruminal protein synthesis estimated from excretion of total purine derivatives[J]. Journal of Dairy Science,1999,82(12):2686-2696. ( 1) 1)
|
| [15] | GARGALLO S,CALSAMIGLIA S,FERRET A.Technical note:a modified three-step in vitro procedure to determine intestinal digestion of proteins[J]. Journal of Animal Science,2006,84(8):2163-2167. ( 1) 1)
|
| [16] | ZHU W,FU Y,WANG B,et al.Effects of dietary forage sources on rumen microbial protein synthesis and milk performance in early lactating dairy cows[J]. Journal of Dairy Science,2013,96(3):1727-1734. ( 1) 1)
|
| [17] | 冯仰廉.反刍动物营养学[M]. 北京:科学出版社,2004. ( 2) 2)
|
| [18] | NRC.Nutrient requirements of dairy cattle[S]. 7th ed.Washington,D.C.:National Academy Press,2001. ( 3) 3)
|
| [19] | GOZHO G N,KRAUSE D O,PLAIZIER J C.Rumen lipopolysaccharide and inflammation during grain adaptation and subacute ruminal acidosis in steers[J]. Journal of Dairy Science,2006,89(11):4404-4413. ( 1) 1)
|
| [20] | KHAFIPOUR E,KRAUSE D O,PLAIZIER J C.A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J]. Journal of Dairy Science,2009,92(3):1060-1070. ( 1) 1)
|
| [21] | ZEBELI Q,AMETAJ B N.AMETAJ.Relationships between rumen lipopolysaccharide and mediators of inflammatory response with milk fat production and efficiency in dairy cows[J]. Journal of Dairy Science,2009,92(8):3800-3809. ( 1) 1)
|
| [22] | WANG C,LIU J X,YUAN Z P,et al.Effect of level of metabolizable protein on milk production and nitrogen utilization in lactating dairy cows[J]. Journal of Dairy Science,2007,90(6):2960-2965. ( 1) 1)
|
| [23] | WELCH J G,HOOPER A P.Ingestion of feed and water[M]//CHURCH D C.The ruminant animal:digestive physiology and nutrition.Prospect heights.Illinois:Waveland Press,1993:108-116. ( 1) 1)
|




