2. 河南农业大学, 现代试验技术与管理中心, 郑州 450002
2. Modern Experimental Techniques and Managing Centre, Henan Agricultural University, Zhengzhou 450002, China
褪黑素(melatonin,MT)是由脊椎动物脑部松果体合成分泌的一类吲哚类激素,对于皮肤色素具有凝集作用,在自然条件下,其分泌主要与光照有关,因此,随着光照的昼夜和季节性变化,MT的分泌表现为夜高昼低的日变化规律和秋冬高、春夏低的年变化规律[1, 2, 3, 4]。MT不仅存在于动物体内,还广泛地存在于植物体中[5, 6]。大量的研究表明MT具有抗氧化、抗衰老、改善动物神经疾病、调节动物睡眠等多方面的生物学活性和功能。在营养代谢和分配方面,MT也发挥着重要的作用,试验证明,MT可降低动物的采食量,影响能量代谢及动物的生长[7, 8]。但是MT对动物脂肪代谢与分配的影响研究得较少,尤其在调节机体脂肪分配方面的研究更少。本试验针对MT调节动物体脂肪分配进行研究,以了解MT对动物体内脂肪分配的影响。大量研究表明,MT在机体的代谢方面发挥着巨大的生理学效应,除了可以主导动物的生物节律性外,还具有抗氧化、抗肿瘤、提高机体的免疫机能、抵抗细胞凋亡等方面也有显著的效果[9, 10, 11, 12, 13, 14]。此外,MT还对胃肠道、肝脏等组织器官具有明显的保护作用[15]。研究证明,MT可通过降低肝脏细胞固醇调节原件结合蛋白-1c(SREBP-1c)的表达水平而缓解内毒素(lipopolysaccharide,LPS)所引起的非酒精性脂肪肝(non-alcoholic fatty liver diseases,NAFLD),进而起到保护肝脏的作用[16, 17, 18]。有关方面的研究表明,MT还可通过降低机体胆固醇的合成来减少血脂的含量,通过受体介导机制降低细胞内甘油三酯的合成和沉积[19],但这些大多是分子水平方面的研究,缺乏体内脂肪含量等方面的证据。王林枫等[20]以绒山羊为动物模型,采用氚水标记的方法研究证明,通过皮下埋植MT可以增加绒山羊体脂肪的含量,改变绒山羊的体成分组成,但其研究没有涉及内脏器官脂肪的含量与分配。本试验以大鼠为模型,以不同剂量的MT进行处理,研究大鼠体内各组织、器官脂肪的含量,明确不同剂量MT对动物体脂肪代谢和分配的影响。探索不同剂量MT与机体不同组织、器官脂肪含量的关系,阐明MT对体内脂肪的沉积和分配的影响,揭示MT在调节动物体内脂肪代谢与分配中的作用,为畜牧生产提供理论依据。
1 方法与材料 1.1 试验动物与试验分组选取6周龄、平均体重100 g左右的SD雄性大鼠50只,随机分为5组,每组10只。5组分别为正常饲粮(ND)、正常饲粮+褪黑素(ND+MT)、脂肪添加(FS)、脂肪添加+低剂量褪黑素(FS+LMT)和脂肪添加+高剂量褪黑素(FS+HMT)组。ND和ND+MT组的大鼠饲喂正常试验饲粮。FS、FS+LMT、FS+HMT组饲喂在正常饲粮添加10%猪油的饲粮。ND+MT、FS+LMT、FS+HMT组除饲喂特定饲粮外,分别灌服10、2、20 mg/kg BW的MT溶液。
1.2 饲养管理试验开始前对所有大鼠饲粮进行调整,预试10 d逐步过渡至试验所用鼠料。试验开始时,MT处理大鼠每天定时(16:00)灌服不同剂量的MT溶液,灌服剂量由相关文献中使用剂量10 mg/kg BW[23]为依据,分别设置2与20 mg/kg BW 2个极端剂量,以期获得差异性显著的试验结果。具体方法是:取一定量的MT溶解于少量酒精中,用蒸馏水配制成不同浓度的MT溶液,ND+MT、FS+LMT、FS+HMT组分别灌服10、2、20 mg/kg BW的MT溶液。ND及FS组灌服10 mL/kg BW 2%酒精。其他时间自由采食和饮水(蒸馏水),鼠房环境温度控制在24~26 ℃[21, 22]。整个试验过程为60 d。
1.3 样品采集与处理血液样品:饲养试验结束后用颈部脱臼法处死大鼠,剪断颈静脉,分别用5 mL肝素锂抗凝采血管和促凝采血管采集适量大鼠血液。采血后,抗凝管迅速离心(Eppendorf centrifuge 5810R),4 ℃,2 500 r/min,离心15 min;促凝管血液置于4 ℃冰箱中,待管中的血液完全凝固后再离心。离心后分别抽取血浆和血清,移入对应编号的EP管中,-40 ℃冰箱保存,待测。
组织样品:血液采集完毕后,迅速解剖大鼠,分离并摘取大网膜、肾周脂肪、附睾脂肪等组织样品,称重记录后迅速投入液氮中保存。肝脏称重后剪取部分样品保存于-20 ℃冰箱内,其余肝脏组织液氮内保存。
1.4 检测指标与方法 1.4.1 大鼠生长性能和不同器官/组织脂肪的含量每天灌服前称大鼠体重、供给饲料重和剩余饲料重,计算日均采食量、平均日增重。对摘取的大网膜、肾周脂肪、附睾脂肪等组织及肝脏进行称重并计算器官或组织指数,计算公式如下:
液氮保存的肝脏组织用于检测长链脂肪酸(long-chain fatty acids,LCFA)含量,检测方法采用高效液相色谱法,乙腈流动相,流速1 mL/min,柱温55 ℃,紫外检测波长242 nm,进样量20 μL[24]。
1.4.2 血液指标检测血浆检测葡萄糖(GLU)、甘油三酯(TG)、非酯化脂肪酸(NEFA)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)、总胆固醇(CHOL)含量及谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆碱酯酶(CHE)活性等生化指标;血清检测生长激素(GH)、胰岛素样生长因子Ⅰ(IGF-Ⅰ)、瘦素(leptin)、糖皮质激素(GC)、胰岛素(INS)、三碘甲腺原氨酸(T3)含量等激素指标。
1.4.3 组织样品冰冻切片检验取-20 ℃冰箱中冷冻的肝脏样品,修剪成合适的大小,置于预冷的冷冻切片机中进行切片,贴片后用油红O对脂肪进行染色,室温下放置7 min,去除多余染料后用1%盐酸水分化3 s,双蒸水冲洗5 s终止分化,苏木精对细胞核复染30 s,自来水返蓝1 min,室温下晾干后中性树胶封片,切片于普通光镜下观察并拍照[25]。
1.5 数据分析采集的原始数据用Graphpad prism 6.0统计软件进行分析,组间差异采用单因素方差分析(one-way ANOVA),当有显著差异时,再采用Turkey氏法进行多重比较,认为P<0.05表示差异有统计学意义。结果用平均值±标准差(mean±SD)表示。
2 结果与分析 2.1 大鼠生长性能和不同器官/组织脂肪的含量由表1可知,与ND组相比,ND+MT组日均采食量、终体重、平均日增重、肝脏重、肝脏指数、肝脏LCFA含量均显著下降(P<0.05),其中ND组终体重和平均日增重分别为(483.50±7.56) g、(4.80±0.13) g/d,ND+MT组则分别为(424.17±5.79) g、(3.84±0.07) g/d;与ND组相比,ND+MT组大网膜、附睾脂肪重及指数也显著下降(P<0.05)。与FS组相比,FS+LMT组的日均采食量、平均日增重、肝脏LCFA含量及大网膜、肾周脂肪、附睾脂肪和肝脏重与指数均显著降低(P<0.05),FS组与FS+LMT组的大网膜重分别为(4.15±0.17)、(2.31±0.29) g,附睾脂肪重分别为(8.35±0.74)、(3.61±0.61) g;FS+HMT组的大网膜、附睾脂肪重及肝脏LCFA含量比FS组显著降低(P<0.05);与FS组相比,ND组肾周脂肪重及指数显著升高(P<0.05),但附睾脂肪重与指数却显著下降(P<0.05)。与FS+HMT组相比,FS+LMT组平均日增重及各脂肪组织重均差异不显著(P>0.05)。
| 表1 大鼠生长性能和不同器官/组织脂肪的相关指标 Table 1 Growth performance,fat related indexes different organs or tissues in rat |
由图1可知,肝脏冰冻切片经油红O染色,200倍光镜下可以明显地看出ND组(图1-A和B)肝脏切片中红染的呈原点状的脂肪滴,而ND+MT组(图1-C和D)切片中能观察到的脂肪滴数量和大小均较ND组明显减少,呈小颗粒状散布于肝细胞浆内。400倍光镜下观察可看出ND+MT组的切片红染区域面积较ND组小且着色浅。上述结果表明MT处理后肝脏内脂肪的沉积明显减少。
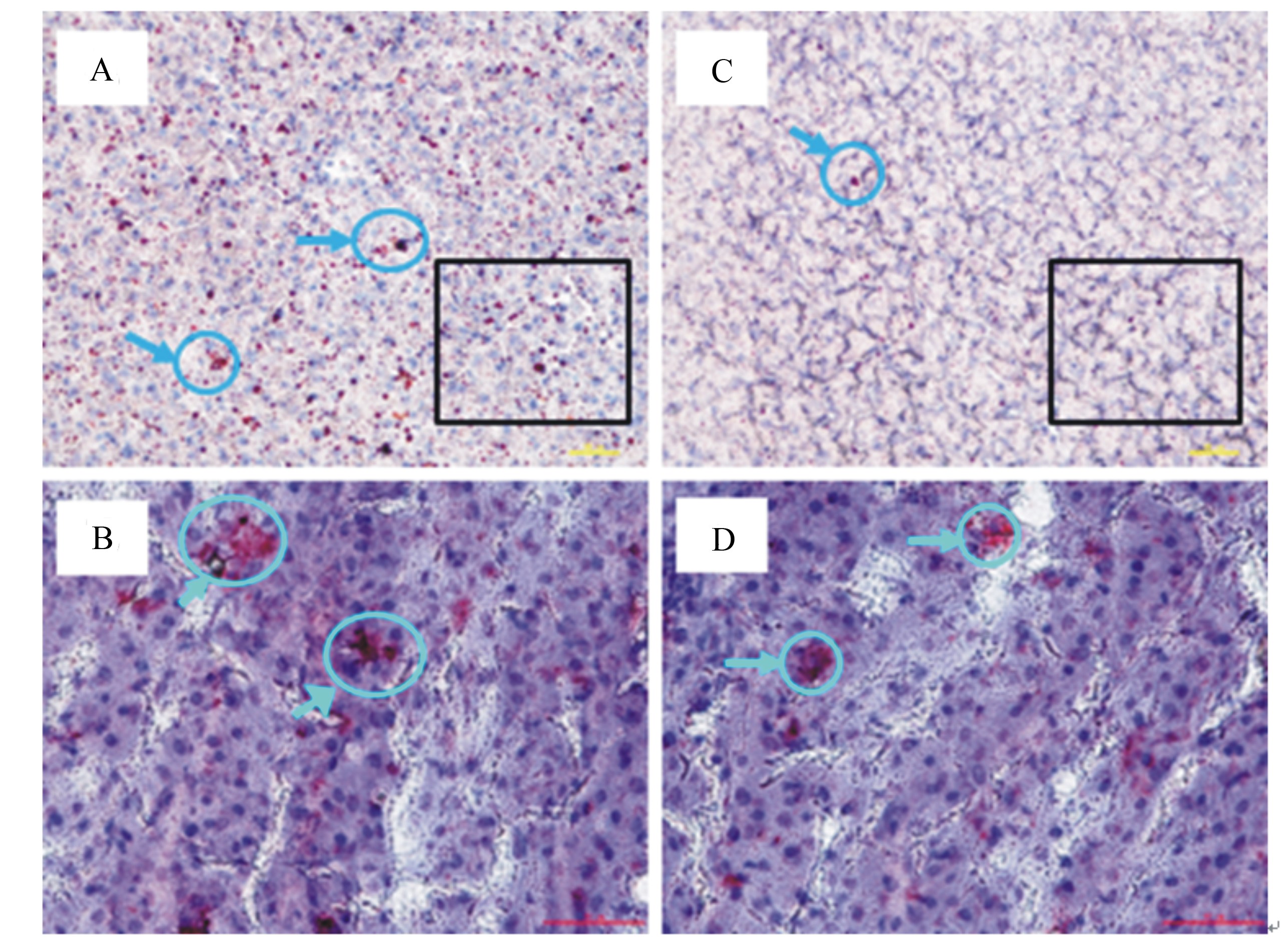 | A:ND组大鼠肝脏切片(200×)frozen liver section of rat in ND group (200×);B:A图中方框区域(400×)square area in figure A (400×);C:ND+MT组大鼠肝脏切片(200×)frozen liver section of rat in ND+MT group (200×);D:C图中方框区域(400×)square area in figure C (400×)。 图中箭头所指红色部分为脂肪。Red points in the figures are fat (arrow). 图1 ND组与ND+MT组大鼠肝脏冰冻切片 Fig. 1 Frozen sections of rat liver in ND and ND+MT groups |
由图2可知,200倍光镜观察FS(图2-A和B)、FS+LMT(图2-C和D)、FS+HMT组(图2-E和F)肝脏冰冻切片油红O染色的结果,FS组肝脏切片的红染脂肪滴最大且数量最多,其次是FS+HMT组,FS+LMT组的脂肪滴含量最少。400倍光镜下观察,FS组的红染区域最大且染色最深,FS+HMT组次之,FS+LMT组的染色区域面积最小且染色程度也最浅。从染色结果可知,在饲喂添加脂肪的饲粮时,低剂量MT对肝脏内脂肪的减少作用最明显。
2.3 大鼠血液相关生化指标由表2可知,与ND组相比,ND+MT组HDL、LDL、CHOL含量显著降低(P<0.05),ND+MT组的TG含量仅数值上降低(P>0.05),VLDL、NEFA含量仅数值上升高(P>0.05)。与ND组相比,FS组HDL、LDL、CHOL含量显著升高(P<0.05),TG、VLDL、NEFA含量仅数值上升高(P>0.05)。FS、FS+LMT、FS+HMT组的TG、NEFA含量数值上呈逐渐升高(P>0.05),这3组HDL、LDL含量表现为FS>FS+HMT>FS+LMT,而VLDL含量的则是FS+HMT>FS>FS+LMT。
ND+MT组与ND组的ALT、AST活性差异不显著(P>0.05),但ALT活性在饲喂有脂肪添加饲粮的试验组中其含量变化表现为FS+HMT>FS+LMT>FS,而FS+HMT、FS+LMT组的AST活性均显著高于FS组(P<0.05)。各组CHE活性差异均不显著(P>0.05)。
 |
A:FS组大鼠肝脏的冰冻切片(200×)frosen liver section of rat in FS group (200×);B:A图中方框区域(400×)square area in figure A (400×);C:FS+LMT组大鼠肝脏的冰冻切片(200×)frosen liver section of rat in FS+LMT group (200×);D:C图中方框区域(400×)square area in figure C (400×);E:FS+HMT组大鼠肝脏的冰冻切片(200×)frosen liver section of rat in FS+HMT group (200×);F:E图中方框区域(400×)square area in figure E (400×)。 图中箭头所指红色部分为脂肪。Red points in the figures are fat (arrow). 图2 FS、FS+LMT、FS+HMT组肝脏的冰冻切片 Fig. 2 Frozen sections of rat liver in FS,FS+LMT and FS+HMT groups |
| 表2 大鼠血液相关生化指标 Table 2 Related biochemical indexes in rat blood |
由表3可知,与ND组相比,ND+MT组INS、GC、T3含量仅数值上升高,GH、IGF-Ⅰ含量数值上降低,但均差异不显著(P>0.05)。FS、FS+LMT、FS+HMT组INS、T3、GC含量数值上呈逐渐升高,但差异均不显著(P>0.05);FS+HMT组各项激素指标均高于FS+LMT组,但差异不显著(P>0.05);FS+HMT组T3含量较FS组显著升高(P<0.05);FS+LMT组的Leptin含量在3个脂肪添加饲粮的试验组中最低。与ND组相比,FS组INS含量数值上有升高,GH含量在数值上下降,均差异不显著(P>0.05)。
| 表3 大鼠血液中相关激素含量 Table 3 Related hormones contents in rat blood ×10-3 |
ND+MT组大鼠的终体重与平均日增重均显著低于ND组,ND组和ND+MT组的终体重分别为(483.50±7.56)、(424.17±5.79) g,平均日增重则分别为(4.80±0.13)、(3.84±0.07) g/d。ND组与ND+MT组的日均采食量分别为(26.31±2.74)、(25.28±2.24) g/d,对比这2组大鼠的采食量可知,造成ND+MT组大鼠生长下降的原因与采食量的下降有关,采食量的下降使其增重受到了抑制,MT的这种作用在其他动物的试验上也得到了证明[7, 8]。Bubenik等[26]研究发现绝食30 h的猪再次摄食后体内MT含量显著升高并反馈性的抑制了猪的摄食活动。从激素指标看,本试验中,灌服MT后ND+MT组GH含量较ND组有降低,但是差异不显著。GH可作用于动物肝脏组织,与肝细胞上GH受体GHR结合而引起IGF-Ⅰ的分泌,IGF-Ⅰ作用于体组织靶细胞的受体,促进细胞的分裂和蛋白质的合成;在其他一些组织,GH可直接与细胞上的受体结合,发挥其促生长的生物学效应[27]。本试验中,ND+MT组GH与IGF-Ⅰ含量的降低是导致大鼠生长受阻的重要原因。在脂肪添加组,FS、FS+LMT、FS+HMT组GH的含量有升高趋势,但差异不显著。FS+LMT、FS+HMT大鼠的终体重及平均日增重均低于FS组,其中FS+LMT组降低显著,说明低剂量(2 mg/kg BW)MT的对大鼠增重的抑制作用大于高剂量(10 mg/kg BW)。据报道,生理剂量的MT主要是与相应的受体结合通过激活一系列的细胞通路而发挥对细胞的保护作用,高剂量的MT则是直接进入细胞内而发挥其抗氧化功能的[1]。张全江等[28]按照1 mg/kg BW的剂量连续51 d给小鼠灌服MT,结果表明MT可显著提高小鼠体内抗氧化物质的含量并减轻了小鼠的体重;魏涛等[29]分别用0.5、1.5 mg/kg BW的MT连续50 d给小鼠灌胃,均可以显著提高小鼠体内羟基自由基与过氧化脂质的清除效率。本试验中,从3组大鼠日均采食量来看,FS>FS+HMT>FS+LMT,且差异显著,这也证明了MT组大鼠体重的降低主要是采食量的下降引起的。Prunet-Marcassus等[30]用高脂饲粮饲喂大鼠,诱导大鼠肥胖,然后用30 mg/kg BW的MT进行3周的治疗,结果显示MT可显著减少大鼠的体重,降低大鼠的饲料消化率,降低大鼠TG的含量。
3.2 MT对大鼠脂肪分配的影响本试验中,从各组大鼠不同部位脂肪的含量可以看出,与ND相比,ND+MT组肝脏重、大网膜重、附睾脂肪重均显著下降,且各脂肪指数也呈现出下降趋势。由上述变化可以得出,MT可以显著地降低腹腔内主要器官和组织脂肪的沉积。从肝脏切片的油红O染色结果可以看出,ND+MT组大鼠肝脏内脂肪的含量明显减少。而本试验中,FS+LMT组大鼠的大网膜、肾周脂肪、附睾脂肪重及指数均比FS组有显著的降低;尽管FS+HMT组大鼠的大网膜、附睾脂肪重比FS组显著降低,而其组织指数降低并不显著,FS+HMT组肝脏脂肪含量的降低没有FS+LMT组显著。肝脏LCFA的含量也符合这个变化规律,说明MT对肝脏脂肪的代谢和沉积的影响与剂量有关,低剂量MT较高剂量能更明显地降低大鼠腹腔内脂肪的沉积。有试验通过饮水方式给大鼠饮用50 μg/mL的MT,每周5 d,连续12周,结果表明MT可显著降低大鼠内脏间的脂肪含量[31],这与本试验结果相似。Sanchez-Hidalgo等[19]用细胞培养的方法用MT处理ROS17/2.8细胞,发现MT可抑制细胞内甘油三酯的合成和累积,从细胞水平证明了MT可以减少脂肪含量。
3.3 MT对大鼠脂肪代谢的影响MT降低血脂的主要途径是通过降低胆固醇和TG的合成而实现的[32]。MT处理后,HDL、LDL及CHOL含量均呈下降趋势,使用MT可以降低正常饲粮饲养大鼠体内的胆固醇含量。GC和T3具有促进脂肪分解的作用,ND+MT组大鼠的GC与T3含量较ND组均呈现升高的趋势,表明其分解脂肪的能力增强。对比2组GH含量,ND+MT组较ND组有所降低。有试验表明,低剂量的GH可以引起机体的脂肪分解[33, 34],减少体内脂肪含量。Leptin是由白色脂肪细胞合成并分泌的具有调节动物采食量,能量代谢的激素,可以抑制动物的食欲并降低脂肪的沉积[35],灌服MT后Leptin含量呈现出升高的趋势,说明MT可以促进白色脂肪细胞对Leptin的分泌,进而抑制采食量并增加脂肪的沉积。王林枫等[36]对绒山羊埋植MT后发现,奶山羊的Leptin含量降低,与本研究的结果相反,可能是由于动物的种类、给药方式以及动物体内脂肪的含量不同引起的。INS可以加强机体的合成代谢,抑制脂肪的脂肪分解和糖原异生,本试验中,尽管ND+MT组INS含量较ND组有升高趋势,但其Leptin、GC、T3含量均有升高的趋势,Leptin、GC、T3有促进脂肪的分解的作用,在几种激素的综合作用下,脂肪的合成量少于氧化的分解量。虽然各种激素含量的变化并不显著,但由于日均采食量的显著差异,总体而言,MT降低了大鼠机体内脂肪的含量。
本试验中,由于脂肪的添加,FS、FS+LMT、FS+HMT这3组TG和NEFA含量数值上呈升高趋势,其肝脏组织中LCFA含量表现为FS+LMT <FS+HMT<FS,FS+LMT大鼠肝脏中脂肪酸的含量最低。3组血浆VLDL含量表现为FS+LMT<FS<FS+HMT,且差异显著。VLDL的作用是负责将肝脏内合成的TG运出肝脏,到外周组织利用,可在脂肪组织合成脂肪。本试验中,由于MT的作用,FS+LMT组TG合成减少,其VLDL含量最低,该变化与肝脏组织中LCFA含量一致,表明低剂量MT可显著降低大鼠肝脏内脂肪的合成。HDL、LDL和CHOL是VLDL脱去TG后的产物,其作用回到肝脏中作为载体重新合成VLDL,正常情况下,它们之间保持一定的比例关系。本试验中,HDL、LDL和CHOL含量的变化趋势为FS+LMT<FS+HMT<FS。表明在服用MT后,随着大鼠肝脏TG和VLDL含量的降低,其含量也随之下降。与脂肪代谢相关的激素中,T3促进脂肪的氧化分解,同时,MT可以通过影响甲状腺T3、甲状腺素(T4)的分泌来调节机体胆固醇含量[37]。在脂肪添加组中,FS、FS+LMT和FS+HMT组T3含量数值上呈升高,表明添加MT可促进脂肪酸氧化,并加速胆固醇的分解。3组之间,FS+LMT组大鼠的各个部位脂肪的含量皆为最低,因此该组的Leptin含量亦最低,同时也表明低剂量MT降低脂肪的效果最明显,从FS+LMT组肝脏切片油红O染色结果也可以得到印证。在促进脂肪合成方面,INS含量在FS、FS+LMT和FS+HMT组间虽有升高的趋势,但差异不显著,说明INS促进脂肪合成的作用不足以逆转采食量下降和脂肪分解增强所产生的后果,最终引起腹腔多器官脂肪含量降低。值得一提的是,FS+HMT组的大鼠AST、ALT活性较其他组显著升高,可能是由于肝脏脂肪分解增强对肝细胞造成了一定程度的影响,具体机制有待进一步研究。
4 结 论① 相同的饲粮条件下,MT可降低大鼠的日均采食量、平均日增重及体重,影响大鼠的生长。
② MT可降低肝脏、大网膜、肾周脂肪、附睾脂肪重,改变体内脂肪的代谢和分配。
| [1] | LUCHETTI F,CANONICO B,BETTI M,et al.Melatonin signaling and cell protection function[J]. The FASEB Journal,2010,24(10):3603-3624. ( 2) 2)
|
| [2] | TOSINI G,BABA K,HWANG C K,et al.Melatonin:an underappreciated player in retinal physiology and pathophysiology[J]. Experimental Eye Research,2012,103:82-89. ( 1) 1)
|
| [3] | 何炜,李晓晔,石鑫,等.褪黑素的生理活性研究进展[J]. 医药导报,2006,25(6):556-558. ( 1) 1)
|
| [4] | 刘淑英,龄南.褪黑素生理作用的研究进展[J]. 动物医学进展,2005,26(7):11-14. ( 1) 1)
|
| [5] | ARNAO M B,HERNÁNDEZ-RUIZ J.The physiological function of melatonin in plants[J]. Plant Signaling & Behavior,2006,1(3):89-95. ( 1) 1)
|
| [6] | 张娜,张海军,杨荣超,等.褪黑素在植物中的功能研究进展[J]. 中国农学通报,2012,28(9):16-20. ( 1) 1)
|
| [7] | PINILLOS M L,DE PEDRO N,ALONSO-GÓMEZ A L,et al.Food intake inhibition by melatonin in goldfish (Carassius auratus)[J]. Physiology & Behavior,2001,72(5):629-634. ( 2) 2)
|
| [8] | BERMUDEZ F F,FORBES J M,INJIDI M H.Involvement of melatonin and thyroid hormones in the control of sleep,food intake and energy metabolism in the domestic fowl.[J]. The Journal of Physiology,1983,337(1):19-27. ( 2) 2)
|
| [9] | ESPINO J,PARIENTE J A,RODRÍGUEZ A B.Oxidative stress and immunosenescence:therapeutic effects of melatonin[J]. Oxidative Medicine and Cellular Longevity,2012,2012:670294. ( 1) 1)
|
| [10] | CHETSAWANG B,PUTTHAPRASART C,PHANSUWAN-PUJITO P,et al.Melatonin protects against hydrogen peroxide-induced cell death signaling in SH-SY5Y cultured cells:involvement of nuclear factor kappa B,Bax and Bcl-2[J]. Journal of Pineal Research,2006,41(2):116-123. ( 1) 1)
|
| [11] | PROKSCH S,STROBEL S L,VACH K,et al.Melatonin as a candidate therapeutic drug for protecting bone cells from chlorhexidine-induced damage[J]. Journal of Periodontology,2014,85(12):e379-e389. ( 1) 1)
|
| [12] | BRUCK R,AEED H,AVNI Y,et al.Melatonin inhibits nuclear factor kappa B activation and oxidative stress and protects against thioacetamide induced liver damage in rats[J]. Journal of Hepatology,2004,40(1):86-93. ( 1) 1)
|
| [13] | BRZOZOWSKA I,STRZALKA M,DROZDOWICZ D,et al.Mechanisms of esophageal protection,gastroprotection and ulcer healing by melatonin.Implications for the therapeutic use of melatonin in gastroesophageal reflux disease (GERD) and peptic ulcer disease[J]. Current Pharmaceutical Dessign,2014,20(30):4807-4815. ( 1) 1)
|
| [14] | ESPOSITO E,CUZZOCREA S.Antiinflammatory activity of melatonin in central nervous system[J]. Current Neuropharmacology,2010,8(3):228-242. ( 1) 1)
|
| [15] | SOMMANSSON A,SAUDI W S W,NYLANDER O,et al.Melatonin inhibits alcohol-induced increases in duodenal mucosal permeability in rats in vivo[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology,2013,305(1):G95-G105. ( 1) 1)
|
| [16] | MATHES A M,KUBULUS D,WEILER J,et al.Melatonin receptors mediate improvements of liver function but not of hepatic perfusion and integrity after hemorrhagic shock in rats[J]. Critical Care Medicine,2008,36(1):24-29. ( 1) 1)
|
| [17] | CHEN X,ZHANG C,ZHAO M,et al.Melatonin alleviates lipopolysaccharide-induced hepatic SREBP-1c activation and lipid accumulation in mice[J]. Journal of Pineal Research,2011,51(4):416-425. ( 1) 1)
|
| [18] | WANG H,LI L,ZHAO M,et al.Melatonin alleviates lipopolysaccharide-induced placental cellular stress response in mice[J]. Journal of Pineal Research,2011,50(4):418-426. ( 1) 1)
|
| [19] | SANCHEZ-HIDALGO M,LU Z,TAN D X,et al.Melatonin inhibits fatty acid-induced triglyceride accumulation in ROS17/2.8 cells:implications for osteoblast differentiation and osteoporosis[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology,2007,292(6):R2208-R2215. ( 2) 2)
|
| [20] | 王林枫,卢德勋,孙海洲,等.褪黑激素对非生绒期内蒙古白绒山羊体成分的影响[J]. 中国畜牧兽医,2004,31(11):3-5. ( 1) 1)
|
| [21] | LIU Y,MEYER C,XU C F,et al.Animal models of chronic liver diseases[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology,2013,304(5):G449-G468. ( 1) 1)
|
| [22] | 张众,张翼鸿,李强,等.不同脂肪含量饮食对小鼠脂肪细胞肥胖相关基因表达的影响[J]. 中华内分泌代谢杂志,2009,25(2):193-196. ( 1) 1)
|
| [23] | 杨凌辉.褪黑素及光照周期的改变对大鼠脂肪组织代谢的影响[D]. 博士学位论文.上海:第二军医大学,2005. ( 1) 1)
|
| [24] | 黄作君,徐刚,黎月玲,等.高效液相色谱法测定大鼠血浆中游离脂肪酸浓度[J]. 广东药学院学报,2004,20(6):656-658. ( 1) 1)
|
| [25] | 田玉旺,李琳,李丽,等.介绍一种改良的油红O脂肪染色法[J]. 中国组织化学与细胞化学杂志,2007,16(6):736. ( 1) 1)
|
| [26] | BUBENIK G A,PANG S F,HACKER R R,et al.Melatonin concentrations in serum and tissues of porcine gastrointestinal tract and their relationship to the intake and passage of food[J]. Journal of Pineal Research,1996,21(4):251-256. ( 1) 1)
|
| [27] | 赵咏梅,毛萌.GH-IGF-1轴的作用机制[J]. 四川医学,2005,26(7):808-810. ( 1) 1)
|
| [28] | 张全江,李秋霞,熊正英,等.连续51天服用褪黑激素对小鼠肾脏、心肌与脑部分生化指标及体重变化的影响[J]. 食品科学,2003,24(4):142-145. ( 1) 1)
|
| [29] | 魏涛,张蕊,金宗濂.褪黑激素抗氧化作用的研究[J]. 食品工业科技,2002,23(2):30-32. ( 1) 1)
|
| [30] | PRUNET-MARCASSUS B,DESBAZEILLE M,BROS A,et al.Melatonin reduces body weight gain in Sprague Dawley rats with diet-induced obesity[J]. Endocrinology,2003,144(12):5347-5352. ( 1) 1)
|
| [31] | CIORTEA R,COSTIN N,BRAICU I,et al.Effect of Melatonin on intra-abdominal fat in correlation with endometrial proliferation in ovariectomized rats[J]. Anticancer Research,2011,31(8):2637-2643. ( 1) 1)
|
| [32] | 方楠.褪黑素通过改善血脂、抑制TLR4信号通路和血炎症因子水平影响兔动脉粥样硬化斑块[D]. 硕士学位论文.合肥:安徽医科大学,2013. ( 1) 1)
|
| [33] | 单安山,徐奇友.动物脂肪代谢与调控[J]. 东北农业大学学报,2004,35(2):216-221. ( 1) 1)
|
| [34] | HARRIS D M,DUNSHEA F R,BAUMAN D E,et al.Effect of in vivo somatotropin treatment of growing pigs on adipose tissue lipogenesis[J]. Journal of Animal Science,1993,71(12):3293-3300. ( 1) 1)
|
| [35] | DARDENO T A,CHOU S H,MOON H S,et al.Leptin in human physiology and therapeutics[J]. Frontier in Neuroendocrinology,2010,31(3):377-393. ( 1) 1)
|
| [36] | 王林枫,卢德勋,孙海洲,等.光照和埋植褪黑激素对非生绒期内蒙古白绒山羊体成分的影响及应用[J]. 中国畜牧杂志,2005,41(9):7-10. ( 1) 1)
|
| [37] | VAUGHAN M K,POWANDA M C,BRAINARD G C,et al.Effects of blinding or afternoon melatonin injections on plasma cholesterol,triglycerides,glucose,TSH and thyroid hormone levels in male and female Syrian hamsters[J]. Progress in Clinical and Biological Research,1981,92:177-186. ( 1) 1)
|



