功能性奶牛乳腺上皮细胞在奶牛泌乳调控和奶牛乳房炎发病机制研究中,已经成为一种重要的细胞模型[1]。Schmid等[2]首次建立了奶牛乳腺上皮细胞系,但是此细胞系只是用于细胞骨架蛋白的研究并无对奶牛乳腺上皮细胞的泌乳营养的研究。Huynh等[3]利用对温度敏感的突变体SV40 T抗原基因转染原代的牛乳腺细胞建立了奶牛乳腺上皮细胞系,该细胞系保留了上皮细胞的典型特征,而且在激素的诱导下能够分泌乳蛋白。Zavizion等[4]建立了温度敏感的奶牛乳腺上皮细胞系,虽然能够合成乳蛋白,但是表达的乳蛋白极低甚至不表达。由于转染的外源基因是随机插入奶牛乳腺上皮细胞染色体上,可能会导致细胞具有不同的核型,影响细胞的正常形态及功能[5, 6, 7, 8]。本试验旨在对成功培养的奶牛乳腺上皮细胞系进行功能验证,为奶牛乳腺上皮细胞的泌乳调控和奶牛乳房炎的发病机制研究提供功能性的细胞素材。
1 材料与方法 1.1 试剂DMEM/F12完全培养基:10%胎牛血清、5 mL胰岛素-转铁蛋白-硒-乙醇胺溶液、15 mmol/L羟乙基哌嗪乙磺酸(Hepes)(Gibco公司),100 U/mL青霉素、100 μg/mL链霉素、4 mmol/L L-谷氨酰胺溶液、2.8 μmol/L氢化可的松、1 μg/mL催乳素(Sigma公司),15 ng/mL表皮生长因子(EGF)(Peprotech公司)。
杜氏磷酸盐缓冲液(DPBS)、0.25%胰蛋白酶-乙二胺四乙酸(trypsin-EDTA)购自Gibco公司,细胞角蛋白18单克隆抗体、羊抗鼠荧光二抗购自Santa cruz公司。
1.2 奶牛乳腺上皮细胞原代培养对健康无乳房炎荷斯坦奶牛进行活体采样,把乳腺组织块放入含有300 U/mL的青霉素和300 μg/mL链霉素的DMEM/F12培养基中,立即带回实验室。参照Gibson等[5]进行组织块培养奶牛乳腺上皮细胞。将活体采样的乳腺组织带回实验室,用酒精消毒并撕下封口膜,把组织放入培养皿中,用DPBS(添加200~300 U/mL的青霉素和200~300 μg/mL链霉素)清洗乳腺组织数次,去除结缔组织和脂肪组织,将组织移至新培养皿中,用DPBS再进行清洗乳腺组织,直至上清液清亮。再用无血清的DMEM/F12培养基反复清洗组织,直至培养基上清液清亮无杂物,并转移到100 mL小烧杯中,并用小剪刀将组织剪成<1 mm3的碎片,静置1~2 min自行沉淀,弃去上清液,继续剪碎,加无血清DMEM/F12培养基悬浮组织块,再转移至15 mL的离心管中清洗,130×g离心5 min,弃上清。如上反复清洗组织块,直至上清液澄清。加入含10%胎牛血清的DMEM/F12完全培养基悬浮组织块,用扩口移液管将组织块转入25 cm2培养瓶中,放入CO2培养箱中培养。加入培养基量非常重要,刚开始加入一点点湿润组织即可,切记不能让组织块漂起来。
1.3 奶牛乳腺上皮细胞的纯化和克隆将培养瓶放在倒置显微镜下观察,用记号笔只圈出1个上皮细胞集落,然后用一次性细胞刮刀将其他区域的细胞全部刮掉,并用DPBS清洗培养皿吸去杂细胞。继续培养10 d之后,用胰酶分离消化细胞,完全培养基终止消化,吹打并悬浮细胞,计数,使细胞密度为10个/mL,取100 μL细胞悬液加入96孔板中,培养1周。如果没有集落再培养1周,若仍然没有集落形成,换液再培养1周,这时再没有形成集落,就不会形成集落了。
1.4 奶牛乳腺上皮细胞的生长曲线的测定取第5代奶牛乳腺上皮细胞,按照3×103个/孔的密度接种到96孔板,每隔24 h取8孔,每孔加入20 μL的噻唑蓝(MTT)溶液放入培养箱继续培养4 h。 吸出MTT溶液再用DPBS清洗细胞2~3遍并吸弃,每孔加入150 μL的二甲基亚砜(DMSO),慢摇10 min。吸出8孔的液体并转入96孔板中,490 nm测吸光度(OD)值,连续测10 d。
1.5 奶牛乳腺上皮细胞角蛋白18的鉴定将奶牛乳腺上皮细胞按1×104个/cm2接种于8孔腔室玻片(chamber slide),待细胞密度至60%时,用预冷的DPBS清洗细胞2次。用-20 ℃的丙酮、甲醛混合液(V ∶ V=1 ∶ 1)固定30 min,用DPBS清洗细胞2次,每次5 min。3%鸡血清室温封闭30 min,弃血清。加鼠源细胞角蛋白18一抗,对照组加磷酸盐缓冲液(PBS),放置4 ℃冰箱过夜。DPBS洗3次,加绿色荧光羊抗鼠二抗,避光孵育1 h。DPBS清洗3次,二脒基苯基吲哚(DAPI)室温染色7 min。DPBS洗3次,蒸馏水洗1次,封固剂封片,避光。
1.6 奶牛乳腺上皮细胞核型分析取10和20代的奶牛乳腺上皮细胞,加秋水仙素至终浓度为0.1~0.4 μg/mL,在37 ℃培养箱中继续培养3~4 h,大部分处于细胞分裂中期。胰蛋白酶消化分离细胞,转入15 mL离心管,250×g 4 ℃离心3 min收集细胞。吸去上清液加入预热至37 ℃ 0.075 mol/L氯化钾溶液7 mL,吹打均匀,37 ℃培养箱中温育17 min。悬液中加入新鲜固定液1 mL,打匀。将悬液250×g离心10 min去上清,加入新鲜固定液7 mL打匀,室温静置30 min。重复以上步骤。离心后去掉上清液,视细胞量加入固定液0.5~1.0 mL,吹打均匀。取出预冷的载玻片并将载玻片倾斜45°,在上方用吸管迅速滴上2~3滴细胞悬液。用嘴轻轻吹散,使细胞分散均匀,室温干燥。吉姆萨(Giemsa)工作液染色15 min,自来水冲洗,空气干燥。先用低倍镜寻找良好的分裂相,再使用高倍镜观察。
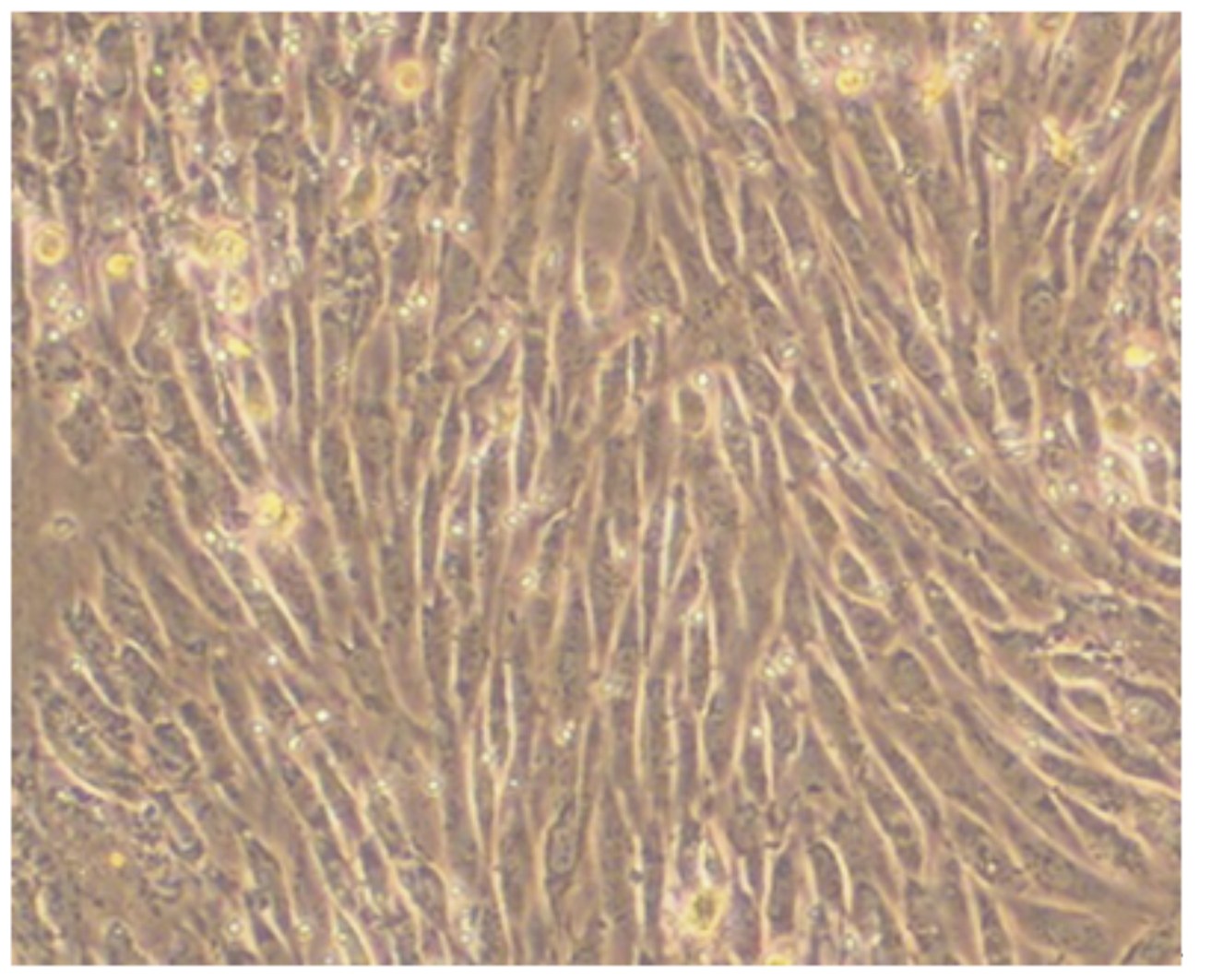
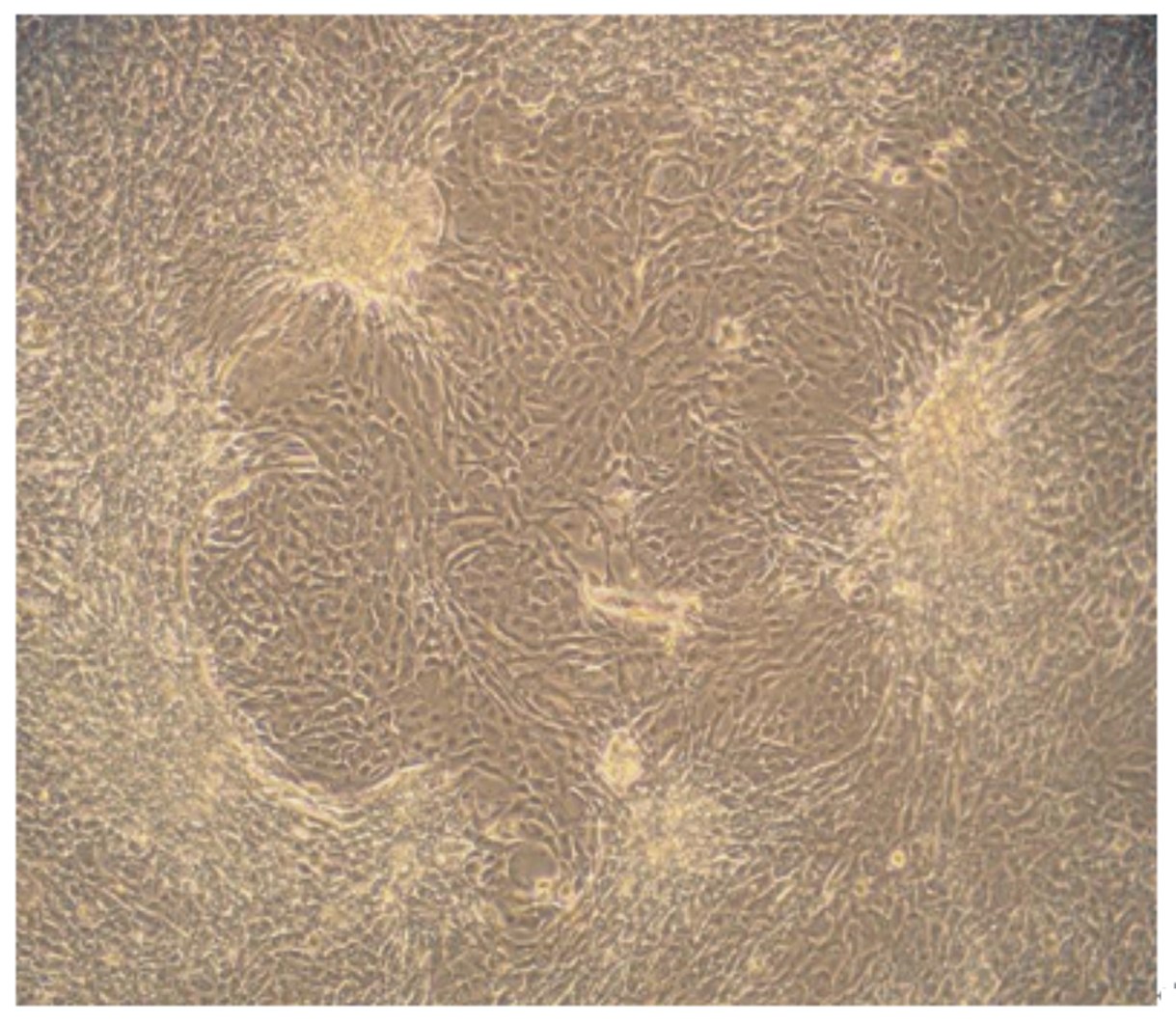
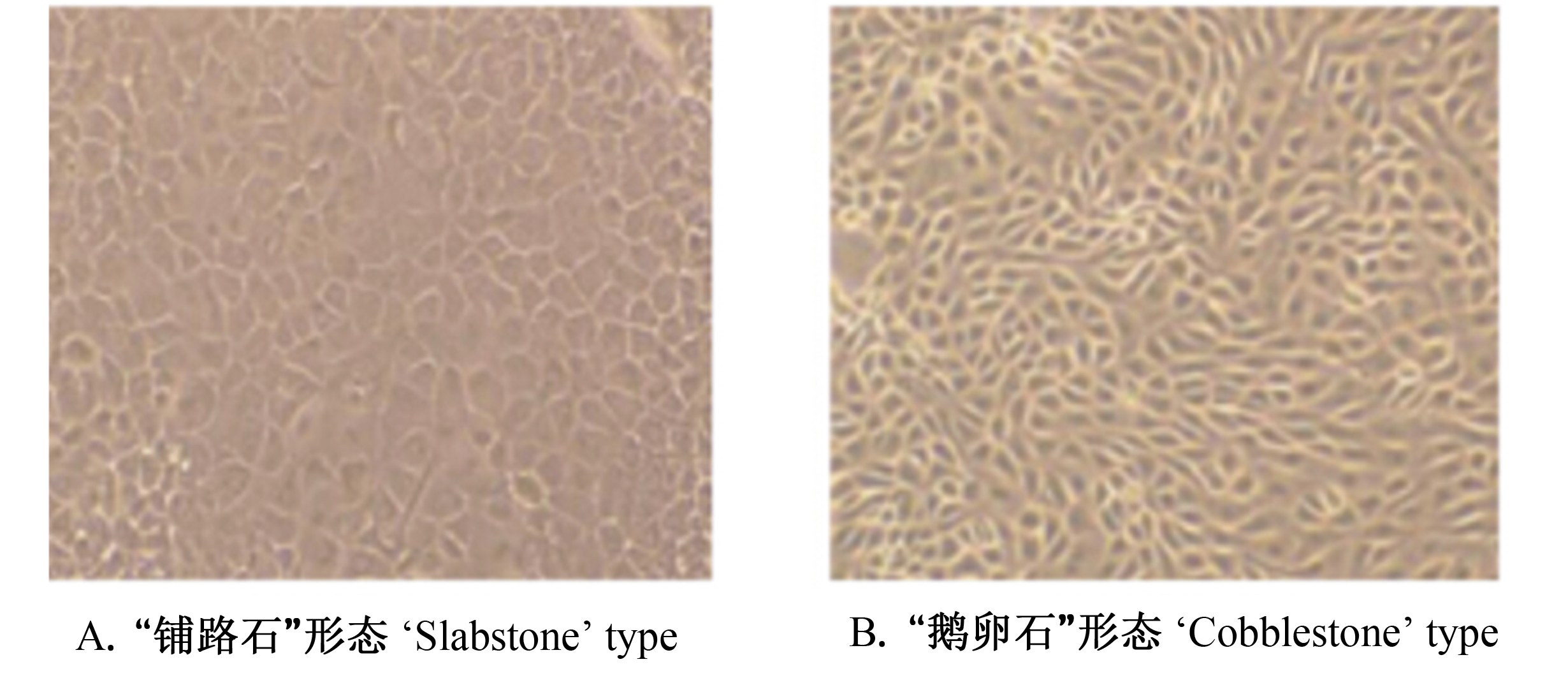
2 结 果 2.1 奶牛乳腺上皮细胞的纯化和克隆由图1可知,培养18 h内组织块即可贴壁,并分裂出少量的成纤维细胞。图2显示培养6 d成纤维细胞迅速增殖并处于对数生长期,同时辐射出少量的乳腺上皮细胞。由图3可知,培养8~9 d乳腺上皮细胞增殖明显且活力较强。从图4来看,利用96孔板有限稀释法克隆细胞,已成功获得克隆的乳腺上皮细胞株。乳腺上皮细胞形态呈现不规则形状,细胞与细胞之间紧密相连,呈单层“铺石路”和“鹅卵石”生长。
2.2 奶牛乳腺上皮细胞生长曲线的测定培养1~3 d奶牛乳腺上皮细胞生长缓慢,培养至3~7 d奶牛乳腺上皮细胞处于对数生长期,增殖较快。培养7~10 d细胞增殖缓慢达到平台期。细胞生长曲线为“S”形,符合正常细胞生长的一般规律。
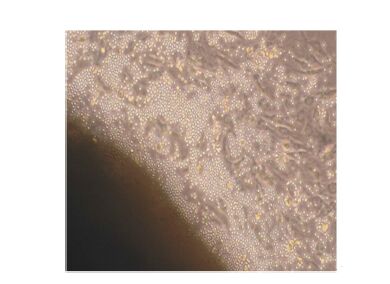 | 图1 组织块种植大约18 h后发生贴壁, 并有少量成纤维细胞分裂 Fig. 1 The tissue mass started the adherence and a few fibroblast cells divided after 18 h of inoculation (10×) |
 | 图2 培养6 d成纤维细胞迅速增殖并处于对数生长期 Fig. 2 At 6 days of cultivation,fibroblast cells had rapid proliferation and were in logarithmic growth phase (4×) |
 | 图3 培养8~9 d乳腺上皮细胞增殖明显 Fig. 3 At 8 to 9 days of cultivation,bovine mammary epithelial cells proliferated obviously (4×) |
由图6显示,通过荧光拍照视野下的所有细胞都发出绿色荧光,这说明每个细胞表面都有细胞角蛋白18抗原,表明克隆的细胞为上皮型细胞。
2.4 奶牛乳腺上皮细胞核型分析选择培养至10和20代的奶牛乳腺上皮细胞进行染色体核型分析。由图7可知,培养至10和20代的奶牛乳腺上皮细胞染色体数仍然是60条,具有哺乳动物细胞的二倍体核型。以上数据暗示培养至20代的奶牛乳腺上皮细胞仍然保持着生物学功能,细胞并未转化。
3 讨 论 3.1 组织块法培养原代奶牛乳腺上皮细胞利用组织块培养原代细胞是最简单方便的方法。此方法未经任何酶的处理,因此能够获得活性很高且增殖旺盛的细胞,这为建立永生化细胞系奠定基础。国外培养原代细胞主要是通过酶消化法和组织块法来获得原代细胞[9, 10, 11]。然而,此方法需要经过高浓度酶消化组织块,会使奶牛乳腺上皮细胞膜表面的一些受体蛋白遭到破坏。膜蛋白是细胞信号转导的重要中间蛋白,一旦被破坏,那么细胞的信号转导受阻,细胞无法正常发挥生物学功能。国外研究者还通过乳汁分离法来获得乳腺上皮细胞。一部分的上皮细胞或细胞团脱落到乳汁中,通过密度梯度离心乳汁可以得到乳腺上皮细胞[12]。鉴于此,本试验采取组织块细胞培养法,并成功获得奶牛乳腺上皮细胞株。组织块细胞培养首先确保组织不能被污染。本试验在培养基中加入3倍常规浓度的青霉素和链霉素是防止细菌污染的最好的方法。隐形乳房炎的奶牛,采集的乳腺组织中会带有真菌,因此在培养基中加入4 μg/mL两性霉素是防止真菌污染的最有效途径。组织块接种到培养瓶的数量也是非常重要,过少导致细胞难以汇合,过多会导致培养基营养成分降低。本试验每隔1 cm大约接种1个组织块,取得良好的效果。培养基的用量是组织块能否成功培养出乳腺上皮细胞的重要因素,刚开始用培养基湿润组织块即可。24 h之后再加1 mL DMEM/F12完全培养基,48 h后可再加1 mL DMEM/F12完全培养基。原代培养过程中,要每天观察细胞的培养状况,如有污染应立即丢弃。添加抗生素可以有效防止各种微生物的污染。有研究表明,抗生素会抑制上皮细胞的增殖[13]。从培养箱拿出培养瓶的时候,要小心操作,禁止晃动培养瓶,只要轻微的晃动,组织块就可能会漂起来。培养6 d奶牛乳腺上皮细胞就会从乳腺组织周围分裂出来,然而,动物的小肠上皮细胞24 h就会从组织块周围辐射出。这可能是小肠上皮细胞还处于胚胎时期,并未分化成熟,增殖旺盛。然而,奶牛乳腺上皮细胞已具有分泌乳蛋白的功能,处于细胞的分化末期。本试验研究表明,运用组织块培养奶牛乳腺上皮细胞是获得原代奶牛乳腺上皮细胞的最佳方法。
 | 图4 利用96孔板有限稀释法获得的单克隆奶牛乳腺上皮细胞系
Fig. 4 Monoclonal bovine mammary epithelial cell lines obtained using limiting dilution method (10×) |
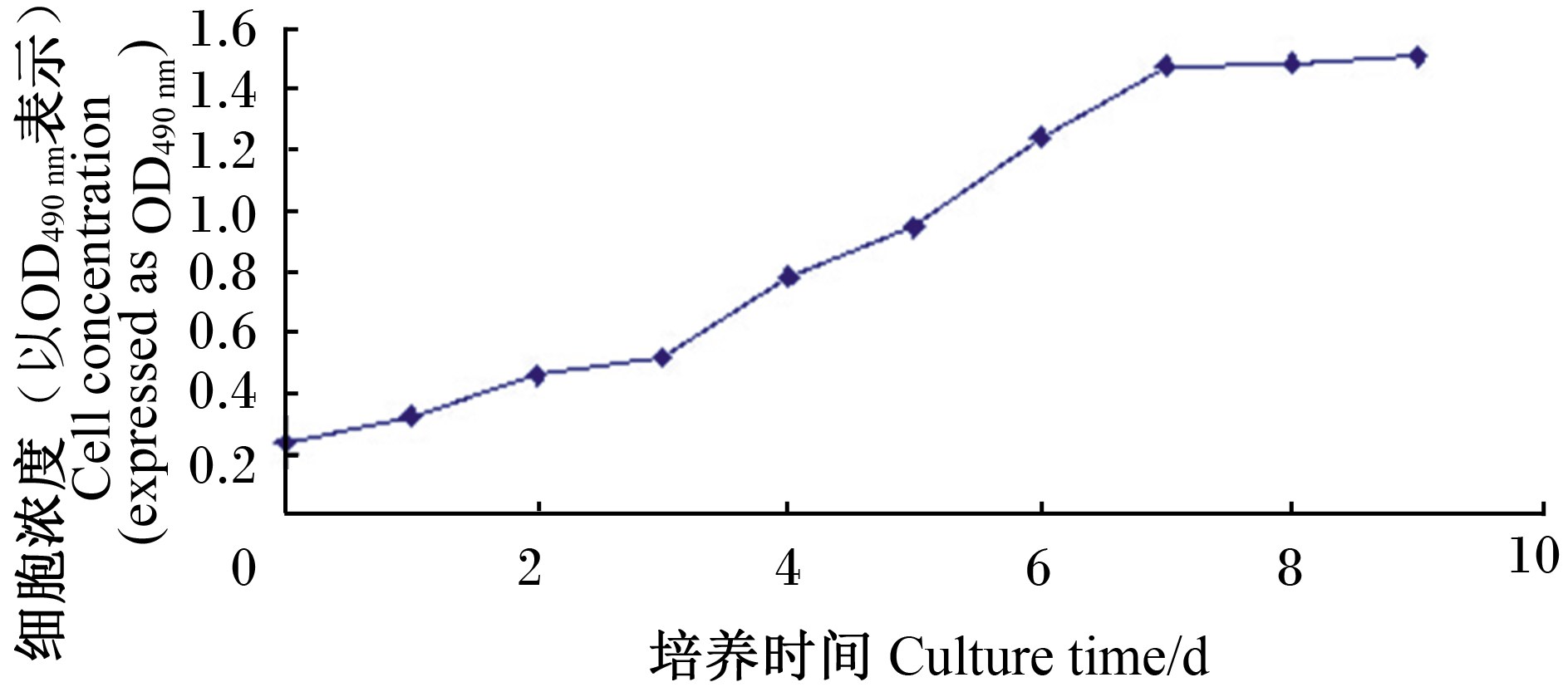 | 图5 奶牛乳腺上皮细胞生长曲线
Fig. 5 Growth curve of bovine mammary epithelial cells |
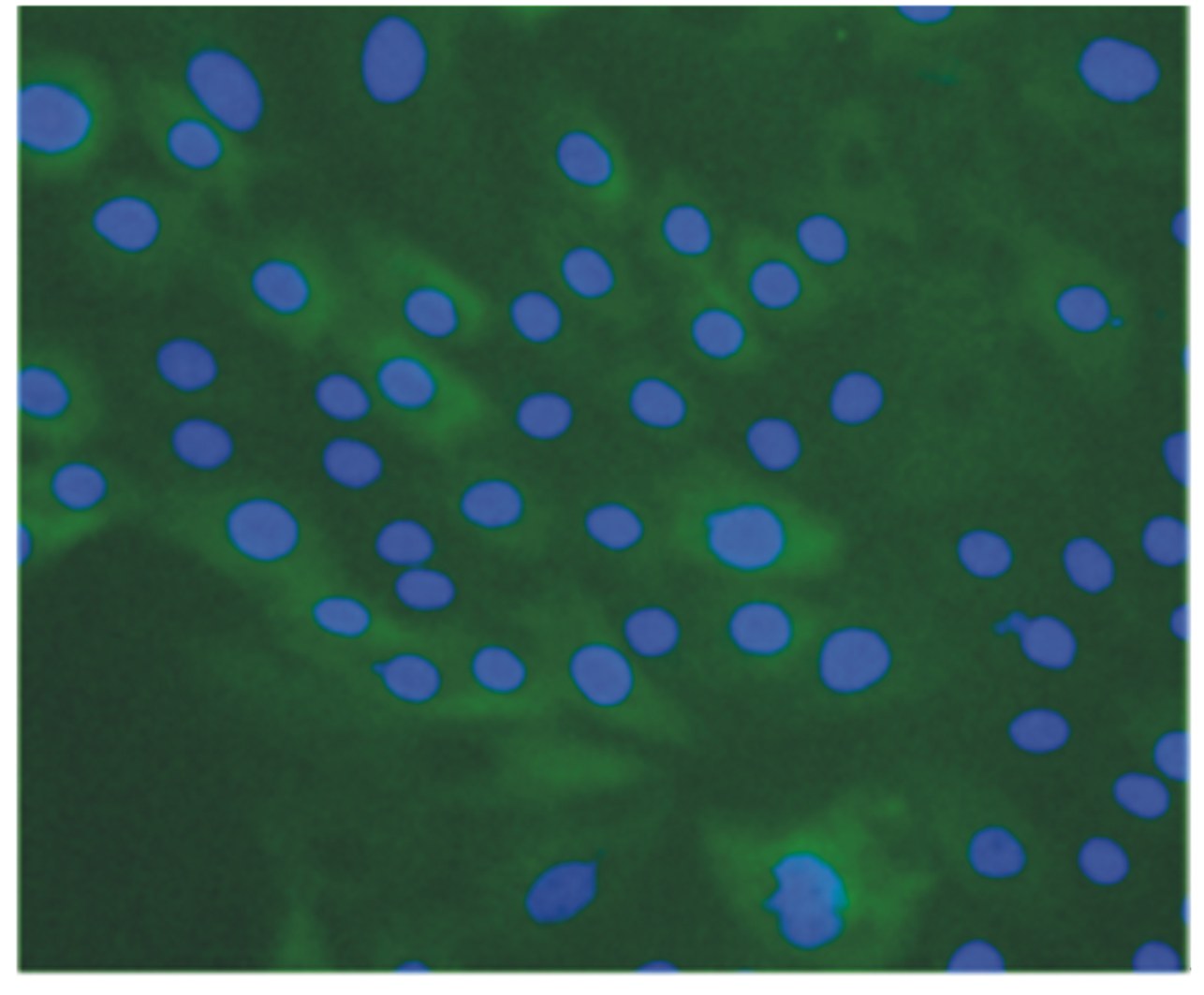 | 图6 奶牛乳腺上皮细胞角蛋白18免疫荧光鉴定 Fig. 6 Identification of bovine mammary epithelial cells by cytokeratin 18 immunofluorescence |
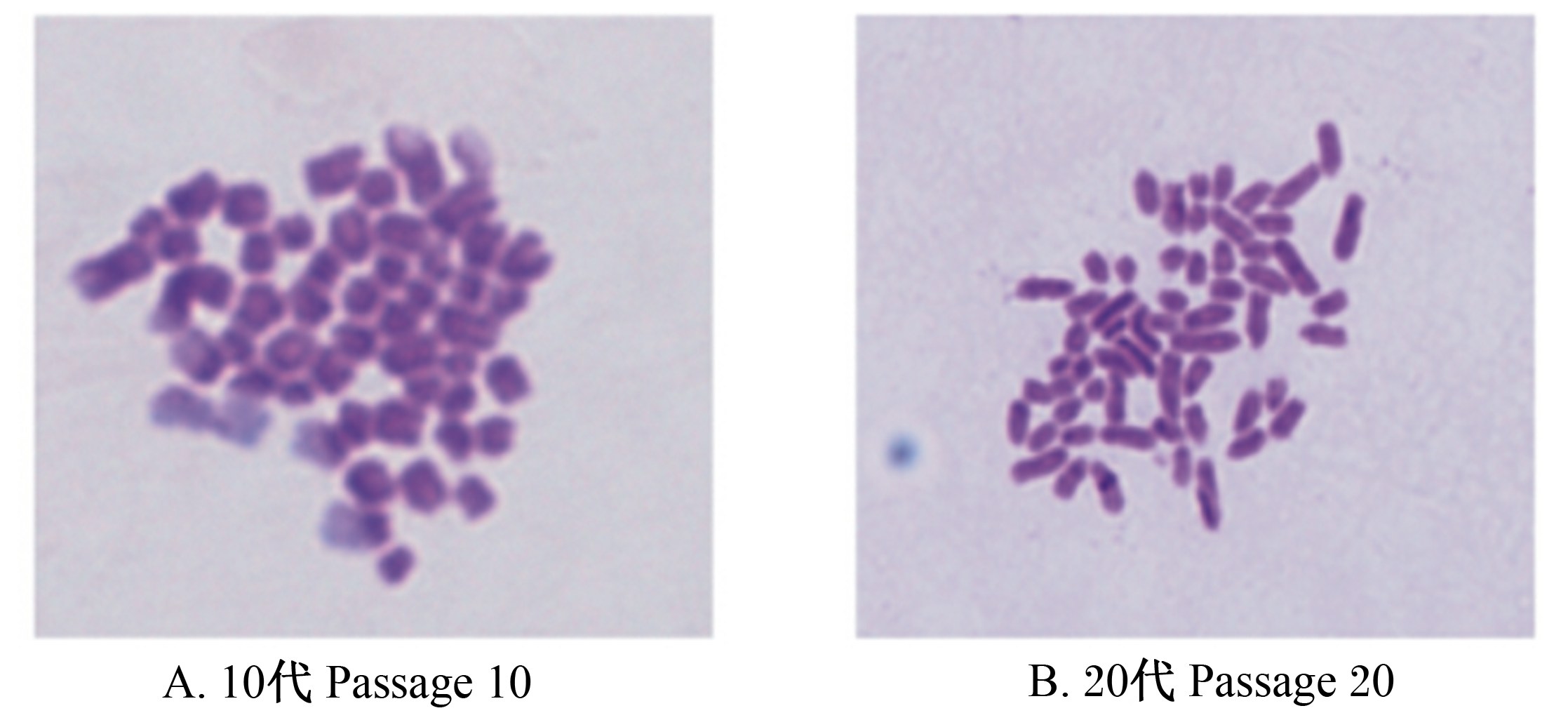 | 图7 奶牛乳腺上皮细胞核型分析
Fig. 7 Karyotype analysis of bovine mammary epithelial cells |
3.2 奶牛乳腺上皮细胞分离纯化与克隆
组织块细胞培养法最大的缺点是上皮细胞与成纤维细胞夹杂生长。本试验采用刮除法、相差消化和相差贴壁法来纯化奶牛乳腺上皮细胞。首先在显微镜下用油笔圈出几个上皮细胞集落,然后将上皮细胞集落外的杂细胞刮掉,再用DPBS清洗以去除杂细胞。继续培养,直至培养瓶内大部分是上皮细胞。采用0.25%胰酶消化细胞4 min,这时大部分成纤维细胞皱缩发亮,用力敲打培养瓶,大量的成纤维细胞从瓶底脱落,然而上皮细胞不会脱落或很少脱落,DMEM/F12完全培养基终止消化。如果仍然有杂细胞生长,可采用相差贴壁法进一步纯化细胞。由于成纤维细胞的贴壁速率比上皮细胞贴壁快。因此,放入培养箱中30 min,成纤维细胞基本贴壁,上皮细胞没有贴壁,将培养基移入另一培养瓶中,此时培养瓶基本上是奶牛乳腺上皮细胞,但仍然有很少的成纤维细胞。通过有限稀释法能够获得单克隆奶牛乳腺上皮细胞系。国外克隆细胞采用克隆环方法,然而本试验未获得成功,有待进一步探讨。
3.3 奶牛乳腺上皮细胞的生长曲线的测定细胞生长曲线是评定奶牛乳腺上皮细胞增殖的生物学特性。非转化细胞和转化细胞在增殖方面差异较大。按照1×104个/cm2接种细胞,转化细胞在2 d之内细胞密度为80%,然而,非转化细胞需要3 d细胞密度才达到70%。由图5可知,培养1~3 d奶牛乳腺上皮细胞生长速度较慢,培养3~7 d奶牛乳腺上皮细胞处于对数生长期,增殖较快;培养7~10 d细胞增殖缓慢达到平台期,细胞无法增殖。从时间上看,原代奶牛乳腺上皮细胞增殖10 d才能完成细胞的增殖过程。然而,一些肠上皮细胞和癌细胞的增殖速率远远大于原代细胞。随着培养时间延长,原代细胞就会进入衰老期和死亡期。一旦进入衰老期,细胞的形态发生改变,细胞体积变大,有些细胞出现增殖抑制。越过细胞衰老期之后,细胞就会进入死亡期,这时大量的原代细胞凋亡,大部分细胞开始从瓶底脱落。原代的奶牛乳腺上皮细胞能够传至20代,然而动物的肠上皮细胞一般传至11代,细胞就不会继续生长。为了克服细胞增殖抑制难题,可通过转入病毒基因使目的细胞永生化。有研究表明,一些病毒基因或人端粒酶逆转录酶(hTERT)基因会使原代细胞永生化并具有无限增殖的性能[14, 15, 16, 17, 18, 19]。然而,传代数的增加,这样的细胞会成为转化细胞。因此,选取细胞进行相关研究,我们必须选取细胞传代次数越少的细胞进行研究,这样得出的结果才是可靠的。本试验通过组织块培养奶牛乳腺上皮细胞并未转入致癌基因,然而也能够传至20代,基本上符合试验的需求。细胞生长曲线符合奶牛乳腺上皮细胞的生长特性。以上数据暗示培养的奶牛乳腺上皮细胞具有良好的细胞生物学功能,为奶牛乳腺上皮细胞泌乳营养奠定基础。
3.4 奶牛乳腺上皮细胞角蛋白18的鉴定国外鉴定乳腺上皮细胞过程中,除了运用细胞角蛋白进行鉴定之外,Kumura等[20]和Barash等[21]利用荧光定量β-酪蛋白mRNA的表达量来鉴定乳腺上皮细胞。酪蛋白是乳腺上皮细胞内表达的特有蛋白质。同时,β-酪蛋白占总酪蛋白50%,因此β-酪蛋白也可作为鉴定是否为乳腺上皮细胞的重要指标之一。本试验采用免疫荧光来鉴定上皮细胞表面特异性抗原。由于细胞角蛋白是上皮细胞表面特有的蛋白,因此常用来鉴定是否为上皮细胞型。利用上皮细胞表面特异性细胞角蛋白来鉴定上皮细胞型,在鉴定过程中,一抗稀释的比例和孵育时间非常重要,否则会导致背景过高。核经过DAPI染色之后,核发出蓝色荧光,细胞角蛋白18发出绿色荧光,以上数据暗示我们所培养的细胞为上皮型。细胞在一定传代次数范围内具有一定的活力,并且仍是上皮细胞型。但是随着乳腺上皮细胞传代次数增加至20代之后,细胞开始出现衰老迹象。
3.5 奶牛乳腺上皮细胞核型分析细胞在传代的过程中必然有一些重要的遗传信息丢失,从而导致细胞无法正常模拟体内细胞一样的正常功能。因此,在传代的过程中鉴定奶牛乳腺上皮细胞的染色体核型是至关重要。Zhang等[7]通过SV40 T永生化原代鼻咽上皮细胞并研究永生化细胞分子遗传特征,发现NP69-LMP1亚细胞系传至50代之后染色体紊乱,暗示细胞传代增加,细胞生物学功能将丧失。国内外研究中,奶牛乳腺上皮细胞在传代过程中同时鉴定细胞的染色体核型报道鲜见,这样就很容易造成试验结果不理想。细胞染色体变为单倍体、二倍体或多倍体,这些改变对细胞的遗传功能不利的。有研究表明,转录区染色体的丢失将阻碍细胞分子信号转导通路,将下调抑癌基因的表达或高表达一些癌基因[22, 23, 24],这些改变将影响乳腺上皮细胞的泌乳营养调控和基因表达。功能基因的表达是基于启动子基础上实现的,一旦启动子丢失或甲基化这会下调基因表达或阻碍基因表达。然而,有些核转录因子位于染色体上,如果细胞在传代法过程中,染色体丢失或重排,最终引起细胞功能基因不能够正常表达。丢失含有核转录因子染色体细胞根本不能够模拟奶牛体内乳腺上皮细胞的泌乳模型。本试验研究表明,我们所培养的奶牛乳腺上皮细胞在10和20代染色体数仍然是60条,是典型的二倍体核型,具有稳定的细胞生物学功能。
4 结 论本试验利用组织块细胞培养法成功培养了奶牛乳腺上皮细胞,且细胞活力较强,并能够继续传至20代,原代奶牛乳腺上皮细胞成功培养可为细胞的永生化、酪蛋白调控机制、奶牛的分子营养研究和奶牛乳房炎的治疗提供理想的试验模型。
| [1] | ROSE B T,ASO H,YONEKURA S,et al.In vitro differentiation of a cloned bovine mammary epithelial cell[J]. Journal of Dairy Research,2002,69(3):345-355. ( 1) 1)
|
| [2] | SCHMID E,SCHILLER D L,GRUND C,et al.Tissue type-specific expression of intermediate filament proteins in a cultured epithelial cell line from bovine mammary gland[J]. The Journal of Cell Biology,1983,96(1):37-50. ( 1) 1)
|
| [3] | HUYNH H T,ROBITAILLE G,TURNER J D.Establishment of bovine mammary epithelial cells(MAC-T):an in vitro model for bovine lactation[J]. Experimental Cell Research,1991,197(2):191-199. ( 1) 1)
|
| [4] | ZAVIZION B,VAN DUFFELEN M,SCHAEFFER W,et al.Establishment and characterization of a bovine mammary epithelial cell line with unique properties[J]. In Vitro Cellular and Developmental Biology:Animal,1996,32(3):138-148. ( 1) 1)
|
| [5] | GIBSON C A,VEGA J R,BAUMRUCKER C R,et al.Establishment and characterization of bovine mammary epithelial cell lines[J]. In Vitro Cellular and Developmental Biology:Animal,1991,27(7):585-594. ( 2) 2)
|
| [6] | HUYNH H T,POLLAK M.HH2A,an immortalized bovine mammary epithelial cell line,expresses the gene encoding mammary derived growth inhibitor (MDGI)[J]. In Vitro Cellular and Developmental Biology:Animal,1995,31(1):25-29. ( 1) 1)
|
| [7] | ZHANG H,TSAO S W,JIN C,et al.Sequential cytogenetic and molecular cytogenetic characterization of an SV40T-immortalized nasopharyngeal cell line transformed by Epstein-Barr virus latent membrane protein-1 gene[J]. Cancer Genetics and Cytogenetics,2004,150(2):144-152. ( 2) 2)
|
| [8] | HU H,WANG J Q,BU D P,et al.In Vitro culture and characterization of a mammary epithelial cell line from Chinese Holstein dairy cow[J]. PLoS One,2009,4(11):e7636. ( 1) 1)
|
| [9] | WANG M Z,XU B L,WANG H R,et al.Effects of arginine concentration on the in vitro expression of casein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J]. PLoS One,2014,9(5):e95985. ( 1) 1)
|
| [10] | 李文清,王加启,南雪梅,等.奶牛乳腺上皮细胞的不同培养方法比较及激素和细胞因子对β-酪蛋白mRNA表达的诱导[J]. 动物营养学报,2014,26(9):2607-2614. ( 1) 1)
|
| [11] | KAEFFER B.Mammalian intestinal epithelial cells in primary culture:a mini-review[J]. In Vitro Cellular and Developmental Biology:Animal,2002,38(3):123-134. ( 1) 1)
|
| [12] | BUEHRING G C.Culture of mammary epithelial cells from bovine milk[J]. Journal of Dairy Science,1990,73(4):956-963. ( 1) 1)
|
| [13] | SCHIERACK P,NORDHOFF M,POLLMANN M,et al.Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J]. Histochemistry and Cell Biology,2006,125(3):293-305. ( 1) 1)
|
| [14] | BALDUCCI L,BLASI A,SALDARELLI M,et al.Immortalization of human adipose-derived stromal cells:production of cell lines with high growth rate,mesenchymal marker expression and capability to secrete high levels of angiogenic factors[J]. Stem Cell Research and Therapy,2014,5(3):63. ( 1) 1)
|
| [15] | ZHAO Y G,LI Y,WANG L,et al.microRNA response elements-regulated TRAIL expression shows specific survival-suppressing activity on bladder cancer[J]. Journal of Experimental and Clinical Cancer Research,2013,32(1):10. ( 1) 1)
|
| [16] | TSAO S W,WANG X H,LIU Y,et al.Establishment of two immortalized nasopharyngeal epithelial cell lines using SV40 large T and HPV16E6/E7 viral oncogenes[J]. Biochimica et Biophysica Acta (BBA):Molecular Cell Research,2002,1590(1/2/33):150-158. ( 1) 1)
|
| [17] | KIM R H,KANG M K,SHIN K H,et al.Bmi-1 cooperates with human papillomavirus type 16 E6 to immortalize normal human oral keratinocytes[J]. Experimental Cell Research,2007,313(3):462-472. ( 1) 1)
|
| [18] | KARANTZA-WADSWORTH V,WHITE E.A mouse mammary epithelial cell model to identify molecular mechanisms regulating breast cancer progression[J]. Methods in Enzymology,2008,446:61-76. ( 1) 1)
|
| [19] | WONG S Y,SEOL A D,SO P L,et al.Primary cilia can both mediate and suppress Hedgehog pathway-dependent tumorigenesis[J]. Nature Medicine,2009,15(9):1055-1061. ( 1) 1)
|
| [20] | KUMURA H,TANAKA A,ABO Y,et al.Primary culture of porcine mammary epithelial cells as a model system for evaluation of milk protein expression[J]. Bioscience,Biotechnology,and Biochemistry,2001,65(9):2098-2101. ( 1) 1)
|
| [21] | BARASH I,FAERMAN A,RICHENSTEIN M,et al.In vivo and in vitro expression of human serum albumin genomic sequences in mammary epithelial cells with β-lactoglobulin and whey acidic protein promoters[J]. Molecular Reproduction and Development,1999,52(3):241-252. ( 1) 1)
|
| [22] | HUANG D P,LO K W,CHOI P H K,et al.Loss of heterozygosity on the short arm of chromosome 3 in nasopharyngeal carcinoma[J]. Cancer Genetics and Cytogenetics,1991,54(1):91-99. ( 1) 1)
|
| [23] | DENG L W,JING N,TAN G L,et al.A common region of allelic loss on chromosome region 3p25.3-26.3 in nasopharyngeal carcinoma[J]. Genes Chromosomes and Cancer,1998,23(1):21-25. ( 1) 1)
|
| [24] | CHAN A S C,TO K F,LO K W,et al.High frequency of chromosome 3p deletion in histologically normal nasopharyngeal epithelia from southern Chinese[J]. Cancer Research,2000,60(19):5365-5370. ( 1) 1)
|




