蛋白质是生命过程的重要物质,是组成机体结构物质、体内代谢活性物质的主要成分,是组织更新、修补的原料。哺乳动物必须每天摄取一定量的蛋白质来满足机体需求。饲粮中蛋白质水平的变化能够影响动物的食欲,从而影响到动物的生产性能。动物的食欲调节系统包括外周和中枢神经系统,下丘脑是食欲调节的中枢,其最主要的食欲调控位点是弓形核(ARC)[1,2],这里包含2类相互联系的调控神经元:促进采食的神经肽Y(NPY)、刺鼠基因相关蛋白(AgRP)和抑制采食的阿片促黑色素原(POMC)、可卡因-苯丙胺调节转录物(CART)[3]。NPY/AgRP和POMC/CART这2类神经元是食欲调控的1级神经元[4]。NPY、AgRP、POMC和CART基因在各物种之间的进化上是保守的,在哺乳动物和家禽中,NPY、AgRP都具有刺激食欲、促使动物摄食的作用,而POMC、CART具有使动物产生厌食感、停止摄食的作用。此外,AgRP与POMC竞争其受体形成了黑皮质素系统,形成一个食欲调节网络。外周食欲调节系统包括胃肠道、脂肪、胰腺等,其中胆囊收缩素(CCK)是外周激素调节摄食的重要生理因子[5,6]。当肠道上皮细胞感受到食物刺激时,通过释放CCK来调节胃肠道平滑肌的收缩或蠕动、胃的排空以及对胃酸分泌。此外,CCK的释放能够刺激外周神经,产生“饱感”信号,这些信号通过迷走神经传入中枢神经系统[7];CCK也可以直接通过血脑屏障,与下丘脑中受体结合,调节1级神经元表达[8]。Fan等[9]发现,在小鼠的下丘脑中发现大量的CCK受体的存在,并且CCK可通过下丘脑中POMC神经元调节食欲。最终,下丘脑对外周信号进行综合,最后决定是否终止摄食。
在小鼠上的研究发现,饲粮中蛋白质水平的变化是影响肠道内CCK释放的主要因素[10]。此外,饲粮中蛋白质水平的变化对哺乳动物食欲的影响具有不一致的研究结果。Kinzig等[11]研究发现,高蛋白质饲粮能够通过刺激下丘脑中NPY的释放引起小鼠的食欲。但Morrison等[12]研究发现,高蛋白质饲粮更容易满足机体需求,主要是通过抑制下丘脑中AgRP基因的表达来抑制小鼠食欲。不同蛋白质水平饲粮对家兔食欲肽基因表达的影响目前尚未有研究。此外,目前商业上生长肉兔颗粒料中蛋白质水平在16%左右,而獭兔饲粮蛋白质水平为17.5%时具有最高的饲料转化效率[13]。因此,本试验拟研究饲粮蛋白质水平对家兔食欲肽基因表达的影响,以探讨饲粮蛋白质水平从缺乏到满足需要对家兔食欲肽基因表达的影响规律。
1 材料与方法 1.1 试验设计选择体重相近的30日龄断奶伊拉肉兔30只,随机分为3组,分别饲喂蛋白质水平为12.8%、16.0%和19.2%的试验饲粮,每组10个重复,每个重复1只兔。试验饲粮组成及营养水平见表1,各组试验兔每天定量饲喂相应饲粮。试验兔单笼饲养,采用常规饲养管理和免疫程序,自然采光、通风,自由饮水,3~5 d消毒兔舍1次。预试期7 d,正试期35 d。
1.2 样品采集试验期间每天统计采食量,每周称1次体重,饲料转化效率由试验期间的采食量与体增重计算得出。试验结束后,每组随机抽取8只试验兔,心脏采血(肝素抗凝),3 000 r/min离心10 min,分离血浆,-20 ℃冷冻保存待测;然后将其颈椎错位致死,屠宰,采集十二指肠、空肠、回肠及ARC样品,放入液氮速冻后,置于-80 ℃冰箱中保存。
| 表1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
下丘脑中总RNA用异硫氰二胍盐法提取,利用琼脂糖凝胶电泳和生物分光光度计分别检测总RNA的质量和浓度。按照TaKaRa RNA PCR反转录试剂盒操作说明进行反转录。反应体系为:500 ng RNA、5 mmol/L MgCl2、1 μL RT buffer、1 mmol/L dNTP、2.5 U AMV、0.7 nmol/L oligo d(T)和10 U Ribonuclease inhibitor,加焦碳酸二乙酯(DEPC)水至10 μL。42 ℃反应40 min,99 ℃灭活反应5 min,5 ℃反应5 min。
cDNA合成以后进行荧光定量PCR。荧光定量PCR引物(表2)是根据TaKaRa反转录试剂盒说明书的要求设计,由上海生工生物技术有限公司合成,通过对混合样品进行标准曲线测定确定引物的质量及最佳的稀释浓度。荧光定量PCR反应体系为20 μL:10 μL SYBR Premix Ex TaqTM(2×)、0.4 μL PCR Forward Primer (10 μmol/L)、0.4 μL PCR Reverse Primer (10 μmol/L)、0.4 μL ROX Reference Dye Ⅱ(50×)、2 μL cDNA模板和6.8 μL dH2O。PCR循环参数为:95.0 ℃预变性10 s;95.0 ℃变性5 s;60 ℃延伸和退火34 s,共40个循环。
| 表2 相关基因的引物序列 Table 2 Primer sequences of related genes |
参照Livak等[14]的方法用2-ΔΔCt法定量目标基因的mRNA相对表达量,以甘油醛-3-磷酸脱氢酶(GAPDH)作为参照基因进行校正。
1.4 数据统计分析试验数据统计采用SAS 8.0统计软件ANOVA法进行单因素方差分析,如果处理效应差异显著,采用Duncan氏法进行多重比较,数据用平均值±标准误表示,P<0.05为差异显著。
2 结 果如图1所示,随着饲粮中蛋白质水平的增加,家兔的平均日增重逐渐增加(图1 A),而料重比 逐渐降低(图1 B),其中19.2%蛋白质饲粮组的平均日增重显著高于12.8%和16.0%蛋白质饲粮组(P<0.05),而料重比3组间均有显著差异(P<0.05)。
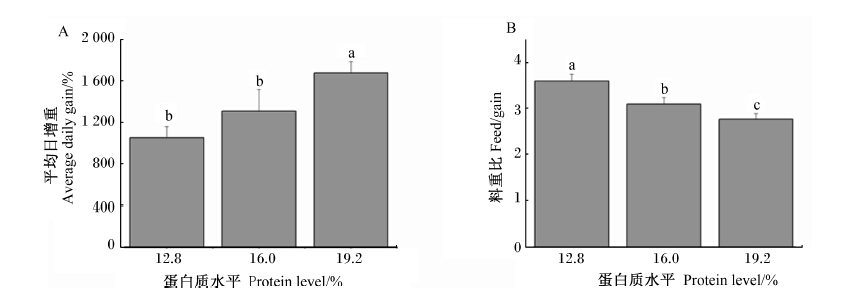 | 数据柱形标注不同小写字母表示差异显著(P<0.05)。图2 和图3 同。 Value columns with different small letters mean significant difference (P<0.05). The same as Fig.2 and Fig.3.图1 饲粮蛋白质水平对家兔生产性能的影响 Fig. 1 Effects of dietary protein level on performance of rabbits |
通过比较16.0%蛋白质饲粮组ARC和不同肠道组织中CCK基因的相对表达量(图2),可看出十二指肠CCK基因的相对表达量显著高于空肠、回肠和ARC(P<0.05)。
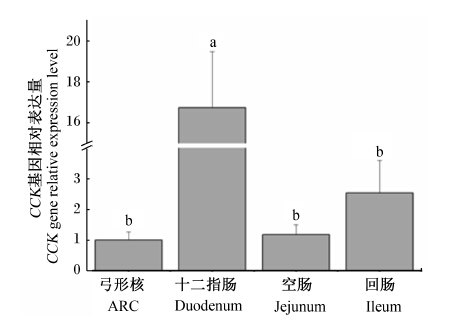 | 图2 家兔CCK基因在不同组织中的表达 Fig. 2 CCK gene expression in different tissues of rabbits |
从图3中可看出,与16.0%蛋白质饲粮组相比,12.8%蛋白质饲粮组十二指肠、回肠和ARC中CCK及ARC中POMC、CART、NPY和AgRP基因的相对表达量都没有显著变化(P>0.05)。与16.0%和12.8%蛋白质饲粮组相比,19.2%蛋白质饲粮组十二指肠中CCK基因的相对表达量显著增加(P<0.05,图3-A),而其回肠、ARC中CCK基因的相对表达量无显著变化(P>0.05,图3-B和图3-C);19.2%蛋白质饲粮组显著增加ARC中POMC和CART基因的相对表达量(P<0.05,图3-F和图3-G),而其ARC中NPY和AgRP基因的相对表达量无显著变化(P>0.05,图3-D和图3-E)。
 | 图3 饲粮蛋白质水平对家兔食欲肽基因表达的影响 Fig. 3 Effects of dietary protein level on appetitive peptide gene expression of rabbits |
CCK作为胃肠激素和脑肠肽,广泛分布于消化系统、中枢及外周神经系统等组织和器官中。在本试验中发现,家兔的CCK基因主要表达部位是十二指肠,其次是回肠,ARC和空肠中几乎没有CCK基因的表达。在家兔上得到的结果与在小鼠上得到的结果稍有差异,小鼠CCK基因表达的主要部位也为十二指肠,其次是空肠和下丘脑,最后是回肠[15]。这些结果说明CCK的表达具有种属和组织特异性。CCK作为饱感信号起到抑制食欲的作用,是外周摄食调节的主要生理因子[6]。外周[16]和脑室[17]注射CCK都显著降低了肉仔鸡的采食量。哺乳动物CCK的释放受到饲粮中蛋白质和脂肪水平的影响,Wang等[10]指出,引起CCK释放的因素按刺激的强弱排列为蛋白质分解产物、脂酸钠、盐酸、脂肪。在本试验中,蛋白质水平为19.2%的组显著增加了十二指肠中CCK基因的相对表达量。这一结果说明饲粮蛋白质水平为19.2%的组家兔的低采食量与十二指肠中CCK基因的高表达有关。此外,在哺乳动物中,CCK还能 够抑制肠道的排空[18]。CCK还可以通过中枢神 经系统抑制胃的排空,如向下丘脑内注入CCK28可降低胃内压,减慢胃排空。因此,本试验结果也暗示出饲粮蛋白质水平为19.2%的组家兔的低食欲可能是由CCK抑制了肠道排空速率所导致的。
NPY在动物的摄食活动中发挥着十分重要的食欲促进作用。研究发现,饥饿、禁食、泌乳等能量需求增加的行为,可增强下丘脑中NPY信号,并随进食活动的持续逐渐降低,这表明NPY参与摄食的启动与维持[19]。此外,中枢注射NPY可使啮齿类动物产生特征性的夜间阵发性进食行为[20]。研究发现,饲喂高蛋白质饲粮显著增加了小鼠下丘脑中NPY基因的表达[11]。在本试验中,饲粮蛋白质水平并没有显著影响到家兔ARC中NPY基因的表达。这些结果说明饲粮对ARC中NPY基因表达的影响具有种属特异性,家兔ARC中NPY神经元并不是饲粮蛋白质水平影响家兔食欲的靶点。
AgRP是中枢黑皮质素系统的拮抗剂,它与黑皮质素系统的激动剂α促黑素细胞激素(α-MSH)竞争性与黑皮质素受体4(MC4R)结合,抑制其厌食的作用[21]。中枢注射AgRP可以引起摄食增加作用,这种摄食增加的作用比中枢注射NPY所引起的摄食增加作用持续的时间长[22]。对于NPY基因敲除的小鼠,AgRP增加食欲的信号仍然有效,这可能的解释是AgRP与NPY作用通路是并行的[23]。小鼠ARC中AgRP基因的表达不仅受到饲粮中能量水平的影响[24],还受到蛋白质水平的影响,与饲喂20%蛋白质饲粮的小鼠相比,饲喂10%蛋白质饲粮的小鼠下丘脑中AgRP基因的表达显著增加[12]。本试验中,饲粮蛋白质水平的改变并没有显著影响到家兔ARC中AgRP基因的表达。这一结果暗示,家兔ARC中AgRP神经元可能没有参与蛋白质水平调控家兔食欲的过程。
POMC在下丘脑内合成和加工后成α-MSH,其可通过脑内G蛋白偶联受体黑皮质素受体3(MC3R)与MC4R作用发挥其分解代谢的生物效应。研究发现,当POMC基因的表达激发时,其产物α-MSH通过其受体激活交感神经系统,从而减少摄食;当能量匮乏时,AgRP基因的表达增加,与α-MSH竞争结合MC4R,降低其厌食作用[25]。冯军等[13]研究发现,饲粮蛋白质水平对饲料转化效率的影响主要与采食量有关,饲粮蛋白质水平与采食量呈负相关,这可能与下丘脑中POMC含量的变化有关,饲粮蛋白质水平为19.2%的组家兔的ARC中POMC基因的相对表达量显著增加。相同的结果也出现在大鼠的试验中[11]。这些结果说明ARC中POMC神经元能够感受到饲粮中蛋白质水平的变化。此外,在大鼠上的研究发现,外周CCK可以促进下丘脑中POMC基因的表达,从而降低采食量[9]。在本试验中,饲粮蛋白质水平为19.2%的组家兔十二指肠中CCK和ARC中POMC基因的表达具有相同的趋势,这一结果暗示CCK/POMC信号通路可能参与蛋白质水平影响家兔食欲过程,此推论还需进一步去验证。
CART具有抑制摄食、激活交感神经系统、防止体重增加的作用。禁食时,CART基因在ARC中表达受到抑制,而高脂饮食促进了CART基因的表达[26]。饲粮中蛋白质水平的变化对ARC中CART基因表达的影响还没有相关报道,在本试验中,19.2%蛋白质饲粮显著增加了ARC中CART基因的表达,这说明饲粮中蛋白质可能通过影响ARC中CART基因的表达调节家兔食欲。此外,与其他能量调节神经肽一样,CART的作用也是相互协调的。在ARC中,CART神经元上表达POMC,说明CART与黑皮质素系统关系密切[27]。饲喂19.2%蛋白质饲粮家兔ARC中CART与POMC基因的表达共同升高可能与此有关。此外,饲喂19.2%蛋白质饲粮家兔ARC中CART基因表达的变化还可能与外周CCK有关,Pete等[28]研究发现外周注射CCK后能够激活下丘脑中CART基因的表达。
4 结 论饲喂低蛋白质水平(12.8%~16.0%)饲粮家兔食欲增加与肠道和中枢神经系统中脑肠肽有关。与低蛋白质水平饲粮比较,高蛋白质水平(19.2%)饲粮显著提高了十二指肠中CCK和ARC中CART和POMC基因的相对表达量,表明这些基因形成食欲网络共同参与饲粮蛋白质调控家兔食欲的过程。此外,回肠和ARC中CCK、下丘脑中NPY和AgRP基因对饲粮中蛋白质水平变化不敏感。
| [1] | HARRIS G C,ASTON-JONES G.Arousal and reward:a dichotomy in orexin function[J]. Trends in Neurosciences,2006,29(10):571-577. ( 1) 1)
|
| [2] | WYNNE K,STANLEY S,MCGOWAN B,et al.Appetite control[J]. The Journal of Eedocrinology,2005,184(2):291-318. ( 1) 1)
|
| [3] | YU Y H,DENG C,HUANG X F.Obese reversal by a chronic energy restricted diet leaves an increased ARC NPY/AgRP,but no alteration in POMC/CART,mRNA expression in diet-induced obese mice[J]. Behavioural Brain Research,2009,205(1):50-56. ( 1) 1)
|
| [4] | SONG Z G,EVERAERT N,WANG Y F,et al.The endocrine control of energy homeostasis in chickens[J]. General and Comparative Endocrinology,2013,190:112-117. ( 1) 1)
|
| [5] | PORTE D,Jr,BASKIN D G,SCHWARTZ M W.Leptin and insulin action in the central nervous system[J]. Nutrition Reviews,2002,60(10 Pt 2):S20-S29. ( 1) 1)
|
| [6] | PEREIRA R T,COSTA L S,OLIVEIRA I R C,et al.Relative distribution of gastrin-,CCK-8-,NPY- and CGRP-immunoreactive cells in the digestive tract of dorado (Salminus brasiliensis)[J]. Tissue and Cell,2015,47(2):123-131. ( 2) 2)
|
| [7] | FUJITANI M,MIZUSHIGE T,BHATTARAI K,et al.The daidzein- and estradiol-induced anorectic action in CCK or leptin receptor deficiency rats[J]. Bioscience Biotechnology and Biochemistry,2015,13:1-8. ( 1) 1)
|
| [8] | WANG L,BARACHINA M D,MARTÍNEZ V,et al.Synergistic interaction between CCK and leptin to regulate food intake[J]. Regulatory Peptides,2015,92(1/2/3):79-85. ( 1) 1)
|
| [9] | FAN W,ELLACOTT K L J,HALATCHEV I G,et al.Cholecystokinin-mediated suppression of feeding involves the brainstem melanocortin system[J]. Nature Neuroscience,2004,7(4):335-336. ( 2) 2)
|
| [10] | WANG C C,GROSSMAN M I.Physiological determination of release of secretin and pancreozymin from intestine of dogs with transplanted pancreas[J]. The American Journal of Physiology,1951,164(2):527-545. ( 2) 2)
|
| [11] | KINZIG K P,HARGRAVE S L,HYUN J,et al.Energy balance and hypothalamic effects of a high-protein/low-carbohydrate diet[J]. Physiology & Behavior,2007,92(3):454-460. ( 3) 3)
|
| [12] | MORRISON C D,XI X C,WHITE C L,et al.Amino acids inhibit Agrp gene expression via an mTOR-dependent mechanism[J]. American Journal of Physiology:Endocrinology and Metabolism,2007,293(1):E165-E171. ( 2) 2)
|
| [13] | 冯军.日粮蛋白质水平对生长獭兔生长性能、氮代谢以及小肠蛋白酶活的影响[D]. 硕士学位论文.泰安:山东农业大学,2012. ( 2) 2)
|
| [14] | LIVAK K J,SEHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408. ( 1) 1)
|
| [15] | 汪锦林,朱文玉.胆囊收缩素研究的进展[J]. 北京医学院学报,1982,14(2):159-162. ( 1) 1)
|
| [16] | GLATZLE J,DARCEL N,RECHS A J,et al.Apolipoprotein A-Ⅳ stimulates duodenal vagal afferent activity to inhibit gastric motility via a CCK1 pathway[J]. American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2004,287(2):R354-R359. ( 1) 1)
|
| [17] | OLLI K,SALLI K,ALHONIEMI E,et al.Postprandial effects of polydextrose on satiety hormone responses and subjective feelings of appetite in obese participants[J]. The Journal of Nutrition,2015,14:2. ( 1) 1)
|
| [18] | KHOO J,RAYNER C K,FEINLE-BISSET C,et al.Gastrointestinal hormonal dysfunction in gastroparesis and functional dyspepsia[J]. Neurogastroenterology & Motility,2010,22(12):1270-1278. ( 1) 1)
|
| [19] | CHU S C,CHEN P N,HO Y J,et al.Both neuropeptide Y knockdown and Y1 receptor inhibition modulate CART-mediated appetite control[J]. Hormones and Behavior,2015,67:38-47. ( 1) 1)
|
| [20] | ROJAS J M,STAFFORD J M,SAADAT S,et al.Central nervous system neuropeptide Y signaling via the Y1 receptor partially dissociates feeding behavior from lipoprotein metabolism in lean rats[J]. American Journal of Physiology:Endocrinology and Metabolism,2012,303(12):E1479-E1488. ( 1) 1)
|
| [21] | CHAI B X,NEUBIG R R,MILLHAUSER G L,et al.Inverse agonist activity of agouti and agouti-related protein[J]. Peptides,2003,24(4):603-609. ( 1) 1)
|
| [22] | LEVIN E,YOM-TOV Y,HEFETZ A,et al.Changes in diet,body mass and fatty acid composition during pre-hibernation in a subtropical bat in relation to NPY and AgRP expression[J]. Journal of Comparative Physiology B:Biochemical Systemic and Environmental Physiology,2013,183(1):157-166. ( 1) 1)
|
| [23] | PATEL H R,QI Y,HAWKINS E J,et al.Neuropeptide Y deficiency attenuates responses to fasting and high-fat diet in obesity-prone mice[J]. Diabetes,2006,55(11):3091-3098. ( 1) 1)
|
| [24] | BARNES M J,ARGYROPOULOS G,BRAY G A.Preference for a high fat diet,but not hyperphagia following activation of muopioid receptors is blocked in AgRP knockout mice[J]. Brain Research,2010,1317:100-107. ( 1) 1)
|
| [25] | KLOVINS J,HAITINA T,FRIDMANIS D,et al.The melanocortin system in Fugu:determination of POMC/AGRP/MCR gene repertoire and synteny,as well as pharmacology and anatomical distribution of the MCRs[J]. Molecular Biology and Evolution,2004,21(3):563-579. ( 1) 1)
|
| [26] | SAVONTAUS E,CONWELL I M,WARDLAW S L.Effects of adrenalectomy on AGRP,POMC,NPY and CART gene expression in the basal hypothalamus of fed and fasted rats[J]. Brain Research,2002,958(1):130-138. ( 1) 1)
|
| [27] | ZHENG H Y,CORKERN M,STOYANOVA I,et al.Peptides that regulate food intake:appetite-inducing accumbens manipulation activates hypothalamic orexin neurons and inhibits POMC neurons[J]. American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2003,284(6):R1436-R1444. ( 1) 1)
|
| [28] | PETER L,STENGEL A,NOETZEL S,et al.Peripherally injected CCK-8S activates CART positive neurons of the paraventricular nucleus in rats[J]. Peptides,2010,31(6):1118-1123. ( 1) 1)
|




