准确测定畜禽采食实际含蛋白质饲粮时内源氨基酸损失量(endogenous amino acid losses,EAAL)是建立真可消化氨基酸(AA)营养体系的核心和技术难点。姚军虎[1]和Xu等[2]提出并初步建立了一次注射小剂量同位素标记亮氨酸(Leu)法(简称一次注射法)用于检测家禽采食实际含蛋白质饲粮时的EAAL,并证明了该法的可行性。但在实践中应用该方法时,仍需要优化其检测参数,以简化操作流程、减少动物应激、降低成本。本课题组前期研究利用3H-Leu作为示踪物,证明了单一时间点采血的可行性[2, 3]。然而,3H-Leu具有放射性并具有衰变现象,不仅危害人体健康、试验受时间限制,而且低剂量引入后检测灵敏度低[4]。鉴于此,本研究采用众多研究者[5, 6, 7, 8, 9]均采用的稳定性同位素15N标记Leu。与采用3H-Leu相比,除安全、无时间限制外,用质谱技术测定“稳定同位素丰度”比放射性示踪实验中的“比放射性”方便、准确[4]。但是,目前国内对单体化合物稳定同位素丰度检测的相关报道比较少。此外,15N-Leu适宜的引入方式和剂量也没有进行相关研究。所以,本试验包含2部分:试验一,研究气相色谱-质谱联用仪(GC-MS)分离测定15N-Leu丰度的适宜参数,优化GC-MS条件和适宜的丰度测定范围,为快速、准确测定样品15N丰度奠定基础;试验二,研究15N-Leu引入方式及剂量对内源AA主要分泌源中Leu的15N丰度(APEL)的影响,对15N-Leu引入方式和剂量进行优化。本试验旨在优化一次注射15N-Leu示踪法检测鸡EAAL的适宜参数,以期建立更加经济、简便、可靠的的操作流程,为一次注射法在实践中应用奠定理论依据。
1 材料与方法 1.1 气相色谱-质谱分离测定15N-亮氨酸的适宜参数 1.1.1 仪器与试剂TRACE DSQ型GC-MS(美国Thermo Finnigan公司);2 mL进样瓶(美国Agilent公司);氮吹仪(杭州良宇仪器有限公司);冻干机(美国SP Scientific公司);Milli Q纯水机。
Leu(≥99.0%;Sigma-Aldrich,美国);15N-Leu(15N丰度≥99.0%;Cambridge Isotope Laboratories,美国);MTBSTFA衍生化试剂:N-叔丁基二甲基甲硅烷基-N-甲基三氟乙酰胺(≥95%;MTBSTFA)+1%叔丁基二甲基氯硅烷(1%;TBDMSCl)(Sigma-Aldrich,美国);乙腈(国产优级纯)。
1.1.2 标准溶液样品用Milli Q水配制15N-Leu和Leu浓度均为1 mmol/L的标准母液,并将两者以不同体积配制成不同APEL的标准工作液:0、0.05%、0.1%、0.2%、0.4%、0.8%、1.6%和3.2%,其中APEL为0的样品作为本底样品。
1.1.3 氨基酸的衍生化过程取各系列工作液100 μL放入2 mL自动进样瓶中,置于氮吹仪中于50 ℃下吹至完全干燥,室温冷却,然后分别加入100 μL MTBSTFA衍生化试剂和100 μL乙腈混匀,在100 ℃下干浴加热2 h,反应完成后冷却至室温,待GC-MS分析。
1.1.4 GC-MS分析条件色谱柱:DB-5MS(30 m×0.25 mm×0.25 μm,美国Agilent公司)。
气相质谱(GC)条件:进样量1 μL;载气为高纯氦气,流速1 mL/min;进样口温度250 ℃;分流比50 ∶ 1;GC升温程序:起始温度90 ℃,保持1 min,然后以10 ℃/min升至180 ℃,保持2 min,再以20 ℃/min升至280 ℃,保持5 min。
色谱(MS)条件:电离源为EI源,电离能量70 eV;离子源温度和接口温度均为250 ℃。1)首先Leu衍生物在全离子扫描(full ion monitoring,FIM)模式下运行,离子扫描范围45~500质荷比(m/z),然后根据检索谱库寻找Leu峰;2)运行模式调整为选择离子扫描(selected ion monitoring,SIM)模式,检测m/z为200、201、274、275、302和303的碎片离子峰,找到最大离子峰(m);3)在SIM模式下只检测m和m+1,计算其碎片离子峰面积。各样品在GC-MS上连续测定5次。
1.2 15N-Leu引入方式及剂量对内源氨基酸主要分泌源15N丰度的影响 1.2.1 试验动物取48只体况良好、体重相近[(1.90±0.18) kg]、16周龄的艾维茵公鸡随机等分为12组,每组4重复,每重复1只鸡。试鸡均分为2部分,其中6组试鸡的处理因素为15N-Leu的引入方式(肌肉注射和静脉注射)和剂量(10、20和30 mg/kg);另外6组试鸡将注射溶液换为等量的生理盐水,其他不变,用于采集本底样品。
1.2.2 试验饲粮与饲养管理参照NRC(1994)[10]鸡营养需要配制基础饲粮(表1)。试验期间试鸡单笼饲养,试鸡自由采食和饮水,舍温控制在16~20 ℃,相对湿度为55%~65%。
1.2.3 试验流程试鸡采食试验饲粮7 d后开始正试期。正试期第1天08:00试鸡饲喂饲粮后,于翅静脉或翅基部三角肌肌肉注射15N-Leu溶液或等量生理盐水,各组注射量按试验设计给予,严格计时。试鸡于注射24 h后翅静脉采集血液5 mL,注入预先经肝素钠润洗的离心管内,经3 000 r/min离心10 min,吸取上清置于-20 ℃保存备用。采集血样后,立即放血屠宰试鸡,快速采取肝脏、胰腺、肠黏膜和黏液放于冻存管中,液氮冷冻,-80 ℃保存。
1.2.4 化学分析 1.2.4.1 血浆样品的前处理1)解冻:4 ℃下解冻血浆样品;2)去蛋白质:在4 mL离心管中加入1.5 mL血浆样品、1.5 mL 10%(m/V)三氯乙酸,3 000 r/min离心15 min;3)去三氯乙酸:取上清1 mL放于2 mL离心管中,加入1 mL无水乙醚,漩涡振荡2 min,3 000 r/min离心10 min,弃掉上层乙醚,然后再用无水乙醚洗涤2次;4)浓缩、调整溶剂:溶液置于氮吹仪在50 ℃下吹干,加入2 mL 0.1 mol/L HCl溶液溶解;5)AA纯化:溶液过阳离子固相萃取小柱(SPE;Bond Elut Plexa PCX,60 mg/3 mL,美国Agilent公司),溶液全部过柱后,用1 mL 2%甲酸溶液清洗柱子3次,再用1 mL甲醇 ∶ 乙腈(1 ∶ 1,V/V)溶液清洗3次;然后用新配制的4 mol/L的氨水溶液2×0.5 mL洗脱柱子2次,再用1 mL Milli Q水再冲洗1次,全部2 mL洗脱液保留在进样瓶中;6)浓缩干燥:进样瓶中洗脱物在50 ℃下氮气吹干,冷却至室温,待GC-MS上机分析。
| 表1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) |
1)制备冻干样:从-80 ℃冰箱中取出组织样品,立即研碎,放入10 mL的离心管中,用组织匀浆机将其匀浆,然后冷冻干燥;2)水解:精确称取冻干样0.2 g,放入10 mL带螺旋盖的玻璃水解管中,加入10 mL 6 mol/mL HCl溶液,另加入0.2 g预先溶解在6 mol/mL HCl中的苯酚,作为抗氧化剂以防止AA氧化;然后氮气吹去液面上的空气,迅速拧紧管盖,于110 ℃烘箱中放置24 h,使蛋白质完全水解;3)浓缩、调整溶剂:水解样冷却至室温后,4 ℃下3 000 r/min离心20 min,上清液经0.22 μm的滤膜过滤,取3 mL滤液置于4 mL离心管中,于氮吹仪在50 ℃下吹干,然后加入2 mL 0.1 mol/L HCl溶液溶解;4)其余操作同血浆样品。
1.2.4.3 样品中15N-Leu的GC-MS分析进样瓶中的AA样品按“1.1.3”中的衍生化过程进行处理,然后根据“1.1.4”中确定的GC-MS分析条件进行15N丰度测定。
1.3 计算与数据统计分析 1.3.1 15N丰度计算15N丰度采用15N的百分原子超(atom percent excess,APE)表示,其值按照Wolfe等[11]提出的如下公式进行计算:
APE(%)=[R/(R+1)]×100;
R=[(M+1)/M]sam-[(M+1)/M]nat。
其中,M+1和M分别表示m/z在m+1和m处的特征碎片离子峰面积;sam和nat分别表示含有15N-Leu样品和不含15N-Leu的本底样品。
1.3.2 GC-MS测定15N丰度的准确度与精准度“1.1”中APEL测定的准确度(RE)和精准度(RSD)采用如下公式进行计算:
RE(%)=[(Xi-XT)/XT]×100;
RSD(%)=[(∑ n |Xi-X|)/(nX)]×100。
其中,Xi为实测值,XT为理论值, 为实测值的平均值,n为重复数。
1.3.3 同位素稀释曲线以“1.1”中理论APEL作为横坐标,以实测APEL作为纵坐标,进行线性拟合。
1.3.4 统计分析“1.2”中数据采用SPSS 21.0软件中的一般线性模型(GLM)进行方差分析,Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准。
2 结 果 2.1 GC-MS图谱分析Leu标样经MTBSTFA衍生后,其羧基和氨基上的2个氢都被基团叔丁基二甲基硅(TBDMS)取代,得到Leu衍生物Leu-(TBDMS)2,进GC-MS分析得到的色谱图、质谱图以及衍生物结构式如图1所示。图1中色谱图出现一条单峰,出峰时间为12.44 min,该峰对应的质谱图如(b)所示,结果表明m/z为200、274、302为其特征离子峰,最大离子峰为200。经质谱谱库检索对应的化合物结构如图(c)所示,结果显示该峰为Leu峰。
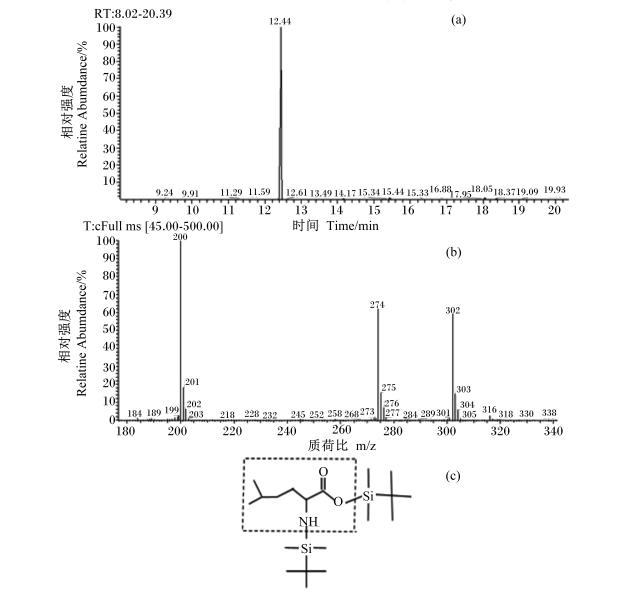 | 图1 亮氨酸衍生物Leu-(TBDMS)2碎片离子的色谱图(a)和质谱图(b)以及衍生物的结构(c) Fig. 1 Chromatogram (a),mass spectra (b) and structural formula (c) of TBDMS-derivatized leucine |
血浆样品按“1.2.4.1”操作处理后,将AA衍生物进入GC-MS分析后得到15种AA的总离子流图,如图2所示。由图2可知,Leu-(TBDMS)2的碎片离子分离峰较好,其他组织样品具有类似的分离峰,可用来作进一步分析计算。
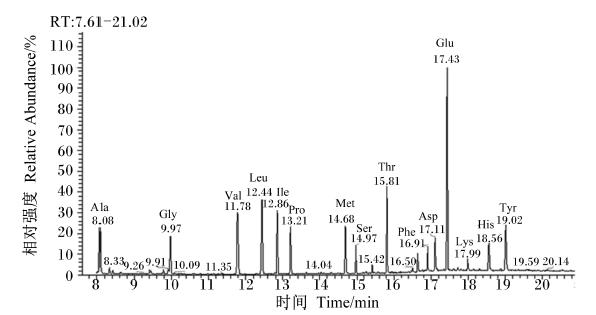 | Ala:丙氨酸;Gly:甘氨酸;Val:缬氨酸;Leu:亮氨酸;Ile:异亮氨酸;Pro:脯氨酸;Met:蛋氨酸;Ser:丝氨酸;Thr:苏氨酸;Phe:苯丙氨酸;Asp:天冬氨酸;Glu:谷氨酸;Lys:赖氨酸;His:组氨酸;Tyr:酪氨酸。 图2 血浆中游离氨基酸衍生物的GC-MS总离子流图 Fig. 2 The GC-MS ion chromatogram of free amino acids in plasma |
样品的APEL实测均值及其测定精准度和准确度如表2所示。当样品APEL<0.1%时,测定精准度(>10.0%)和准确度(>10.0%)较差;当样品APEL为0.1%~3.2%时,测定精准度和准确度分别为4.3%~9.7%和-5.9%~4.1%,所得到的同位素稀释曲线线良好(图3),R2为0.989;完全可以满足定量分析要求。
| 表2 GC-MS测定含不同15N丰度的亮氨酸标准样品的精准度和准确度 Table 2 Precision and accuracy of different 15N-enrichment of standard leucine sample determined by GC-MS |
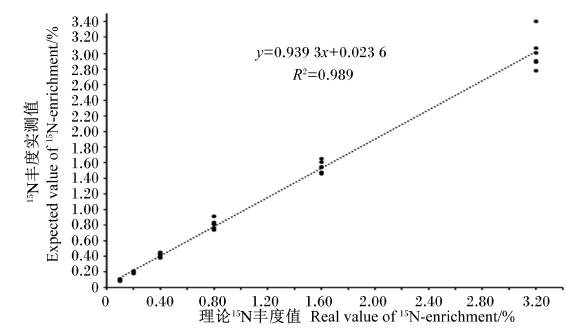 | 图3 含有不同15N丰度亮氨酸标样的同位素稀释曲线 Fig. 3 Standard curve of mixtures of natural and 15N-labeled leucine |
15N-Leu引入方式和剂量对内源AA主要分泌源中APEL的影响见表3。当静脉注射15N-Leu剂量为10 mg/kg BW时,血浆的APEL因其数值变异较大而没有被列入统计分析,并且静脉注射的部分试鸡在注射部位出现不同程度的淤血和外渗现象。
由表3可知,15N-Leu引入方式和引入剂量对内源AA主要分泌源的APEL不存在交互作用(P>0.05)。15N-Leu引入剂量显著影响内源AA主要分泌源的APEL(P<0.05)。在同一引入方式下,血浆、胰腺、肝脏和肠黏膜的APEL均随15N-Leu引入剂量的增大而显著增加(P<0.05)。静脉注射和肌肉注射对肝脏的APEL无显著影响(P>0.05);而2种引入方式显著影响胰腺和肠黏膜的APEL。图4和图5分别比较了不同引入剂量和方式时各内源AA主要分泌源间的APEL。
| 表3 引入方式和引入剂量对鸡内源氨基酸主要分泌源15N丰度的影响 Table 3 Effects of methods and doses of administration on 15N-enrichment in main secretory source of endogenous amino acids |
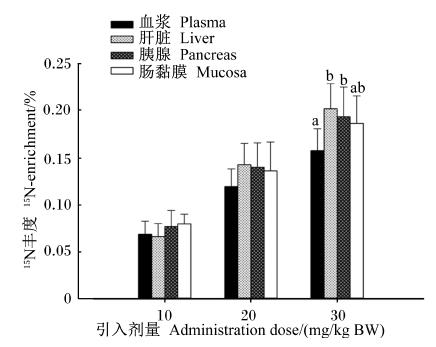 | 数据柱形标注不同小写字母表示差异显著(P<0.05)。 Value columns with different small letters mean significant difference (P<0.05). 图4 不同引入剂量时内源氨基酸主要分泌源15N丰度的比较 Fig. 4 Comparison of 15N-enrichment in main secretory source of endogenous amino acids among doses of administration |
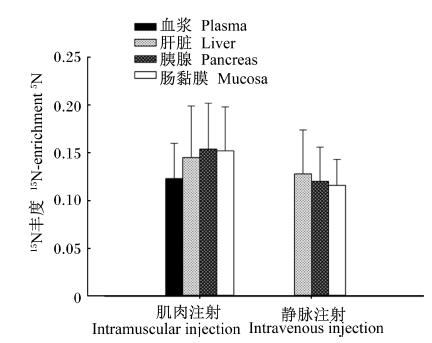 | 图5 不同引入方式时内源氨基酸主要分泌源15N丰度的比较 Fig. 5 Comparison of 15N-enrichment in main secretory source of endogenous amino acids between different administration methods |
由图4可知,在引入剂量为10和20 mg/kg BW时,各主要分泌源间APEL无显著差异(P>0.05);而在引入剂量为30 mg/kg BW时,血浆APEL显著低于肝脏和胰腺的APEL,肠黏膜的APEL处于中间。除静脉注射时血浆的APEL因数值变异较大没有列入比较外,2种引入方式下,各主要分泌源间APEL均无显著差异(P>0.05)(图5),Leu的15N丰度值显示为肝脏>胰腺>肠黏膜。
目前测定单体AA氮稳定同位素丰度的方法主要包括GC-MS分析[11, 12, 13]和气相色谱-燃烧-同位素比值质谱仪(GC-C-IRMS)分析[11, 14, 15, 16, 17]。虽然GC-MS的灵敏度和精准度不及GC-C-IRMS[16],但后者设备昂贵,国内很少,单个样品的分析成本是GC-MS的2~3倍,不宜用于大批量样品的测定。在采用GC-MS进行氮稳定同位素丰度测定之前,必需要确定适宜的检测参数,包括AA衍生化与GC-MS分析条件、准确度和精准度以及适宜的丰度范围[11]。
AA是两性电解质,需要在分析前将其衍生化以提高其挥发性。研究表明[12, 18, 19, 20],硅烷化试剂MTBSTFA能够将AA上的羟基和氨基硅烷化,一步加热反应即可完成,反应条件相对温和,操作简便易行,衍生化后样品可以直接进样分析。本试验结果表明,样品中Leu经MTBSTFA在100 ℃下加热2 h后,按“1.1.4”的GC-MS分析条件可得到较好的分离峰,能够用来作进一步的同位素丰度计算分析。此外,本试验采用TRACE DSQ型GC-MS,对其测定Leu标样的准确度和精准度的分析表明,当样品的APEL在0.1%~3.2%的范围内,同位素的稀释曲线良好,测定的精准度和准确度完全可以满足定量分析的要求;但当样品的APEL<0.1%时,测定精准度和准确度相对较差,样品测定数值变异较大(表3),不适宜采用GC-MS进行分析。所以,本研究后续的试验要确定适宜的15N-Leu引入剂量以确保样品的APEL>0.1%。 3.2 采血时间和15N-Leu引入方式及剂量的确定
与传统的15N稀释技术(连续灌注法)[9, 21, 22]相比,一次注射法利用多时间点采血来反映血浆和肠道内源AA的动态变化规律,这是一次注射法的优势之一[1]。但在实际应用中,多时间点采血不仅操作不便、增加成本,而且还会给动物造成较大应激,影响测定结果的准确性。鉴于此,本研究小组前期研究利用3H-Leu作为示踪物,采用多时间点采血,然后经微积分处理后证明了单一时间点采血的可行性。研究结果表明,在单次瞬时引入3H-Leu后的第24 h为最佳的采血时间点[2, 3]。考虑到3H-Leu具有放射性,不仅危害人体健康,而且低剂量引入后检测灵敏度低[4],本研究采用众多研究者[5, 6, 7, 8, 9]均采用的稳定性同位素15N进行标记Leu,3H与15N在这里均起到标记Leu的作用,二者对Leu在动物体内代谢无本质差别[4],所以15N-Leu作为示踪物与3H-Leu作为示踪物应具有相同的采血时间点。
除采血时间点外,确定最佳的15N-Leu引入方式和剂量是简化操作程序,降低成本,在实践中应用该法的另2个关键控制点。本试验结果表明,N-Leu引入方式和引入剂量对内源AA主要分泌源的APEL不存在交互作用。在肌肉注射和静脉注射2种引入方式下,各内源AA主要分泌源的APEL均没有显著差异(图5),表明各内源AA主要分泌源之间的15N-Leu分布较为均匀,15N在内源AA分泌源的富集规律相似。肌肉注射时各主要分泌源的APEL高于静脉注射时各主要分泌源的APEL。一方面,静脉注射易造成试鸡注射部位局部淤血、标记物外渗等,实际注射到体内的15N-Leu剂量减少;另一方面,静脉注射时示踪物直接进入血液循环,代谢速率高于肌肉注射,因而各内源AA分泌源的15N-Leu被机体更新的速度也快于肌肉注射。传统的15N稀释技术均采用静脉灌注法[9, 21, 22]向代谢区引入示踪物,试验动物大多是猪;然而对于鸡来说,由于其静脉血管较细薄,除给试鸡造成较大应激之外,而且静脉注射操作难度大。本试验选取翅基部三角肌部位进行肌肉注射引入15N-Leu,该部位血管丰富,吸收迅速,利于示踪物快速被吸收进入血液。与静脉注射相比,肌肉注射简单易行,在实践中更易操作,并且对试鸡的应激较小,测定结果更准确。
引入剂量的确定要综合考虑检测灵敏度、示踪物对机体代谢的影响、成本等因素。考虑到15N-Leu价格较为昂贵,以及注射高剂量Leu会影响机体AA代谢[23, 24],因而,在不影响检测准确度的基础上,尽量以小剂量注射为宜。本试验结果表明,当15N-Leu引入剂量为10 mg/kg BW时,内源AA主要分泌源的APEL测定值均在0.05%~0.10%范围内,结合“2.2”结果,显示该测值的准确度和精确度较差;当15N-Leu引入剂量为20和30 mg/kg BW时,内源AA主要分泌源的APEL均在0.10%~0.30%范围内,测值的准确度和精确度较好,可以满足本实验的研究需要。此外,本试验结果显示,在引入剂量为10和20 mg/kg BW时,各内源AA主要分泌源之间的15N-Leu分布较为均匀;而在引入剂量为30 mg/kg BW时,血浆的APEL显著低于肝脏和胰腺的APEL(图4),表明15N-Leu引入剂量为30 mg/kg BW时对内源AA主要分泌源的Leu代谢产生影响。综上所述,选取引入剂量为20 mg/kg BW较为适宜。
4 结 论一次注射15N-Leu示踪法检测鸡内源氨基酸损失量适宜参数如下:
① 本试验中采用TRACE DSQ型GC-MS,需要样品中Leu的适宜15N丰度为APEL>0.1%。
② 15N-Leu引入剂量为20 mg/kg BW可达到GC-MS分析要求,同时选取肌肉注射并于注射后第24 h采血可减少动物应激,操作及实施相对容易,成本较低。
| [1] | 姚军虎.一次注射[3H]亮氨酸测定肉鸡内源氨基酸排泄量的研究[D]. 博士学位论文.雅安:四川农业大学,1998. ( 2) 2)
|
| [2] | XU M,YAO J H,WANG K N,et al.3H-leucine single-injection method for determining endogenous amino acid losses of broilers[J]. Nutrition,2011,27(7/8):829-832. ( 3) 3)
|
| [3] | 孟德连,姚军虎,吕金印,等.一次注射法适宜采血时间的确定[J]. 核农学报,2003,17(4):308-312. ( 2) 2)
|
| [4] | 王世真.核医学与核生物学基础及应用[M]. 北京:科学出版杜,1990:261-292. ( 4) 4)
|
| [5] | DE LANGE C F M,SAUER W C,SOUFFRANT W B,et al.15N-Leucine and 15N-isoleucine isotope dilution techniques versus the 15N-isotope dilution technique for determining the Recovery of endogenous protein and amino acids in digesta collected from the distal ileum in pigs[J]. Journal of Animal Science,1992,70(6):1848-1856. ( 2) 2)
|
| [6] | SCHULZE H,BUTTS C A,MOUGHAN P J,et al.The 15N-isotope dilution method for determining ileal endogenous nitrogen excretion in the young (10 kg liveweight) pig[J]. Journal of the Science of Food and Agriculture,1995,69(1):41-50. ( 2) 2)
|
| [7] | LETERME P,THEWIS A,FRANCOIS E,et al.The use of 15N-labeled dietary proteins for determining true ileal amino acid digestibilities is limited by their rapid recycling in the endogenous secretions of pigs[J]. Journal of Nutrion,1996,126(9):2188-2198. ( 2) 2)
|
| [8] | GABERT V M,CANIBE N,JØRGENSEN H,et al.Use of 15N-amino acid isotope dilution techniques to determine endogenous amino acids in ileal digesta in growing pigs[J]. Acta Agriculturae Scandinavica Section A-Animal Science,1997,47(3):168-177. ( 2) 2)
|
| [9] | HESS V,THIBAULT J N,SÈVE B.The 15N amino acid dilution method allows the determination of the real digestibility and of the ileal endogenous losses of the respective amino acid in pigs[J]. Journal of Nutrion,1998,128(11):1969-1977. ( 4) 4)
|
| [10] | NRC.Nutrient requirements of poultry[S]. Washington,D.C.:National Academy Press,1994. ( 1) 1)
|
| [11] | WOLFE R R,Chinkes D L.Isotope tracers in metabolic research:principles and practice of kinetic analysis[M]. 2nd ed.New Jrtsey:John Wiley & Sons,2005:93-120. ( 3) 3)
|
| [12] | DAUNER M,SAUER U.GC-MS analysis of amino acids rapidly provides rich information for isotopomer balancing[J]. Biotechnology Progress,2000,16(4):642-649. ( 2) 2)
|
| [13] | 王建,王泽建,黄明志,等.13CMFA过程中GC-MS分析菌体蛋白氨基酸的13C标记丰度[J]. 中国生物工程杂志,2009,29(7):87-93. ( 1) 1)
|
| [14] | METGES C C,PETZKE K-J,HENNING U.Gas chromatography/combustion/isotope ratio mass spectrometric comparison of N-acetyl- and N-pivaloyl amino acid esters to measure 15N isotopic abundances in physiological samples:a pilot study on amino acid synthesis in the upper gastro-intestinal tract of minipigs[J]. Journal of Mass Spectrometry,1996,31(4):367-376. ( 1) 1)
|
| [15] | MEIER-AUGENSTEIN W.Use of gas chromatography-combustion-isotope ratio mass spectrometry in nutrition and metabolic research[J]. Current Opinion in Clinical Nutrition & Metabolic Care,1999,2(6):465-470. ( 1) 1)
|
| [16] | 徐春英,李玉中,梅旭荣,等.小麦籽粒氨基酸碳氮稳定同位素的测定与分析[J]. 中国农业科学,2009,42(2):446-453. ( 1) 1)
|
| [17] | 蔡德陵,刘金钟,刘海珍.气相色谱-燃烧-同位素比值质谱法测定单体氨基酸的碳稳定同位素组成[J]. 质谱学报,2004,25(增刊):175-176. ( 1) 1)
|
| [18] | 张佳.应用气相色谱—质谱测定茶叶中主要游离氨基酸及15N丰度的研究[D]. 硕士学位论文.北京:中国农业科学院,2010. ( 1) 1)
|
| [19] | WILKERLING K,VALENTA H,KERSTEN S,et al.Determination of very low stable isotope enrichments of [2H5]-phenylalanine in chicken liver using liquid chromatography-tandem mass spectrometry (LC-MS/MS)[J]. Journal of Chromatography B,2012,911:147-153. ( 1) 1)
|
| [20] | SOBOLEVSKY T G,REVELSKY A I,MILLER B,et al.Comparison of silylation and esterification/acylation procedures in GC-MS analysis of amino acids[J]. Journal of Separation Science,2003,26(17):1474-1478. ( 1) 1)
|
| [21] | LIEN K A,SAUER W C,DUGAN M E R.Evaluation of the 15N-isotope dilution technique for determining the recovery of endogenous protein in ileal digesta of pigs:effect of the pattern of blood sampling,precursor pools,and isotope dilution technique[J]. Journal of Animal Science,1997,75(1):159-169. ( 2) 2)
|
| [22] | LIEN K A,SAUER W C,MOSENTHIN R,et al.Evaluation of the 15N-isotope dilution technique for determining the recovery of endogenous protein in ileal digestion of pigs:effect of dilution in the precursor pool for endogenous nitrogen secretion[J]. Journal of Animal Science,1997,75(1):148-158. ( 2) 2)
|
| [23] | LI F N,YIN Y L,TAN B,et al.Leucine nutrition in animals and humans:mTOR signaling and beyond[J]. Amino Acids,2011,41(5):1185-1193. ( 1) 1)
|
| [24] | GARLICK P J.The role of leucine in the regulation of protein metabolism[J]. The Journal of Nutrition,2005,135(6):1553S-1556S. ( 1) 1)
|




