维生素C是脊椎动物所必需的维生素,它对机体生长、繁殖、胶原形成、铁元素代谢、伤口愈合以及免疫应答有着重要的作用。大多数的鱼类由于缺乏维生素C合成的关键酶——L-古洛糖酸内酯氧化酶,必须通过食物获取来满足需求[1]。饲料中维生素C缺乏会导致鱼类出现一些典型的维生素C缺乏症状,如:游动异常、表皮发黑,骨质畸形、眼睛和鳃异常、鳞片脱落、骨胶原减少等[2]。高密度养殖环境下,鱼类应激反应严重,免疫水平和抗病力降低的情况时有发生。维生素C是生物体内有关酶的激活剂,也是具有广泛生理和免疫作用的调节因子,可以防止鱼类贫血症和出血症,缓解应激反应,促进鱼类快速生长,增强机体抵抗病原侵袭并提高特异性体液免疫功能[3, 4, 5]。
黄颡鱼(Pelteobagrus fulvidraco Rich)隶属于鲶形目(Silurformes),鲿科(Bagride),黄颡鱼属(Pelteobagrus),对生态环境适应性强,是我国淡水中分布较广的经济鱼类。由于黄颡鱼的肉质鲜甜美味,在国内具有广阔的发展前景,在东南亚国家拥有巨大的市场潜力,因而受到许多学者重视。目前,虽然有一些学者已经研究出黄颡鱼对维生素C的需要量[6, 7],但维生素C对黄颡鱼健康(血液指标)、抗氧化指标以及非特异性免疫指标等的影响尚存空白。因此,本试验通过研究维生素C对黄颡鱼生长性能、血液指标、抗氧化指标以及非特异性免疫指标的影响,以确定黄颡鱼幼鱼对维生素C的适宜需要量,为黄颡鱼高效配合饲料的配制提供理论依据。
1 材料与方法 1.1 试验饲料制备以红鱼粉、豆粕、小麦蛋白粉和磷虾粉为蛋白质源,鱼油和豆油为脂肪源,配制基础饲料(表1)。在每千克基础饲料中分别添加0、20.0、40.0、80.0、160.0和320.0 mg维生素C(以维生素C磷酸酯形式添加,帝斯曼公司提供),配制出6种等氮等脂的试验饲料,饲料中维生素C水平用高效液相色谱法[8]分析,结果分别为1.9、18.9、36.8、78.4、156.5和316.0 mg/kg饲料。在配制饲料前,所有原料粉碎后过80目筛网,按表1的配方准确称量各种饲料原料再加适量水混匀,用双螺杆挤条机[华南理工大学,F-26(Ⅱ)型]加工成型,压制成2种颗粒大小不同的饲料(直径分别为2和3 mm),自然条件下风干至饲料水分为9%~10%,风干后放置于冰箱中备用。
| 表1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
饲养试验在宁波大学海洋学院水产养殖试验基地进行,试验所用的黄颡鱼鱼苗购自嘉兴黄颡鱼育苗场,为当年人工孵化的同一批次鱼苗。试验开始前,鱼苗暂养于300 L玻璃钢桶中,以基础饲料饱食投喂,使之逐渐适应试验饲料和养殖环境。暂养结束后,试验用鱼饥饿24 h,之后称重并挑选出健康、规格较为均一的鱼苗[初始体重为(2.00±0.02) g] 随机放养于18个室内300 L玻璃钢桶内。每桶放养黄颡鱼幼鱼20尾。每种饲料随机投喂3个桶,每天投喂饲料2次(07:00、17:00)。试验1~6周投喂直径为2 mm的饲料,7~12周投喂直径为3 mm的饲料。 每天投喂前1 h吸污,投喂后1 h收集未吃饲料,烘干、称重。试验各组每2周称重1次,用以调整每天的投喂量。投喂量初期为6%体重,以后每2周调整1次,投喂量逐渐降低为5%、4%,之后保持稳定。试验用水经沉淀、过滤并持续充气。水温为27.0~30.0 ℃,溶解氧含量在6.5 mg/L以上,氨氮含量在0.05 mg/L以下,养殖试验持续12周。 1.3 样品采集
试验结束时,停止投喂24 h后,把试验鱼从桶中捞出,用丁香酚(1 ∶ 10 000,上海化学试剂公司提供)麻醉,计数并称重,用于计算生长指标。然后从每个桶中随机取3尾测量体长,称体重,并解剖取肝脏、内脏团,称重,以计算其形态学指标。每个桶另取8尾鱼,从尾部静脉抽取血样,其中3尾鱼血样注入抗凝管中,用于血液学参数检测;另外5尾鱼血样注入1.5 mL离心管中,在4 ℃冰箱静置过夜,3 500 r/min离心10 min制得血清,用于血清生化、抗氧化及免疫指标的测定。
1.4 攻毒试验攻毒试验所用嗜水气单胞菌(Aeromonas hydrophilalala)来自浙江省宁波大学海洋生物研究室。将冷冻保存的嗜水气单胞菌接种到固体琼脂培养基上,37 ℃培养12 h后,于无菌操作台上勾取菌种到灭菌的液体琼脂培养基上;37 ℃培养12 h后离心(1 000×g,10 min),沉淀溶解到0.85%生理盐水中。试验开始前,将菌液浓度调节到1×106、1×107、1×108和1×109 CFU/mL 4个梯度进行预试验。预试验结果表明,注射量为0.2 mL时1×107 CFU/mL的注射浓度较为合适。为期12周的生长试验结束后,每桶随机挑选10尾鱼,用一次性注射器腹腔注射0.2 mL浓度为1×107 CFU/mL的嗜水气单胞菌。随后按生长试验投喂程序继续投喂试验饲料,每日2次观察和记录死亡情况。攻毒试验持续2周。
1.5 指标测定 1.5.1 生长性能、饲料利用和形态学指标计算公式增重率(weight gain rate,WGR,%)=100×(终末均重-初始均重)/初始均重;
特定生长率(specific growth rate,SGR,%/d)=100×(ln终末均重-ln初始均重)/试验天数;
存活率(survival rate,SR,%)=100×终末存活尾数/初始投放尾数;
蛋白质效率(protein efficiency ratio,PER)=(终末鱼体重-初始鱼体重)/(饲料摄食量×饲料粗蛋白质含量);
饲料效率(feed efficiency,FE)=(终末鱼体重+死亡鱼体重-初始鱼体重)/摄食量;
肝体比(hepatosomatic index,HSI,%)=100×肝脏重/体重;
脏体比(viscerosomatic index,VSI,%)=100×内脏重/体重;
肥满度(condition factor,CF,g/cm3)=体重/体长3。
1.5.2 常规营养成分分析饲料常规营养成分的测定参照AOAC(1995)[9]的方法,即水分含量采用105 ℃常压干燥法测定,粗蛋白质含量采用凯氏定氮法测定,粗灰分含量采用550 ℃高温炉灼烧法测定,粗脂肪含量采用索氏抽提法测定。
1.5.3 血液学参数及血清生化指标测定血液中白细胞数量(white blood cell count,WBC)、红细胞数量(red blood cell count,RBC)、血红蛋白(hemoglobin)含量和红细胞压积(hematocrit)采用血液常规分析仪(Sysmex KX-21N,日本)进行检测;血清中总蛋白(total protein,TP)、葡萄糖(glucose,GLU)、甘油三酯(triglyceride,TG)、胆固醇(cholesterol,CHOL)含量均采用全自动生化分析仪(HITACHI 7600-110,日本)进行检测。
1.5.4 血清抗氧化及免疫指标测定血清中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、溶菌酶(LZM)活性及丙二醛(MDA)含量采用南京建成生物工程研究所提供的试剂盒测定,试剂配制、样品前处理及操作办法严格按照操作说明书执行。血清中总免疫球蛋白(Ig)和总补体(CH50)含量采用上海酶联生物科技有限公司提供的酶联免疫吸附试验(ELISA)试剂盒测定,试剂配制、样品前处理及操作办法严格按照操作说明书执行。
1.5.5 头肾巨噬细胞吞噬百分率和呼吸爆发测定按照Secombes等[10]方法获得头肾细胞悬液后,将100 μL酵母悬液(1×108个/mL)加入到100 μL头肾细胞悬液中(23.5 ℃,40 min)。在显微镜下对巨噬细胞吞噬的酵母细胞数量进行统计[11],以测定吞噬百分率。呼吸爆发的测定按照Secombes等[10]的方法,具体如下:将100 μL 1 mg/mL四唑氮蓝(NBT)[(含100 mL 1 μg/mL聚甲基丙烯酸酯(PMA)]加入到100 μL头肾细胞悬液中(25 ℃,45 min),通过无水甲醇终止反应;70%甲醇漂洗2次,空气干燥;加入120 μL 2 mol/L KOH和140 μL二甲基亚砜(DMSO),以KOH/DMSO为空白,在630 nm处比色。
1.6 统计分析方法采用“SPSS version 18.0”软件对数据进行统计学分析,先对数据作单因素方差分析(one-way ANOVA);统计间若有显著差异,再用Duncan氏法进行多重比较,P<0.05表示差异显著。试验数据以平均值±标准差表示。
2 结 果 2.1 饲料中维生素C水平对黄颡鱼幼鱼生长性能、饲料利用和形态学指标的影响由表2可知,当饲料中维生素C水平由 1.9 mg/kg上升到156.5 mg/kg时,黄颡鱼幼鱼的增重率和特定生长率显著升高(P<0.05),但是当饲料中维生素C水平由156.5 mg/kg上升到316.0 mg/kg时,黄颡鱼幼鱼的增重率和特定生长率变化不显著(P>0.05),在数值上甚至有所降低。饲料中维生素C水平对黄颡鱼幼鱼的存活率、饲料系数、蛋白质效率、肝体比和脏体比的影响均不显著(P>0.05)。以特定生长率为评价指标,根据折线模型得出黄颡鱼幼鱼饲料中维生素C适宜水平为114.5 mg/kg(图1)。
| 表2 饲喂不同维生素C水平饲料的黄颡鱼幼鱼的生长性能、饲料利用和形态学指标 Table 2 Growth performance,feed utilization and morphological indexes of juvenile yellow catfish fed diets with different vitamin C levels (n=3) |
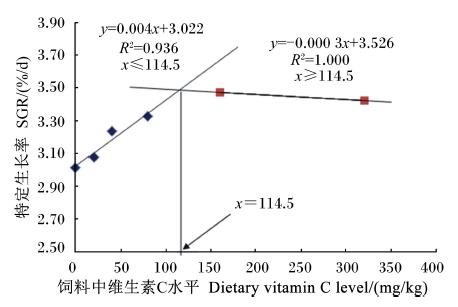 | 图1 饲料中维生素C水平与黄颡鱼幼鱼特定生长率的关系 Fig. 1 Relationship between dietary vitamin C level and SGR of juvenile yellow catfish |
由表3可知,饲料中维生素C水平可显著影响黄颡鱼幼鱼血液中血红蛋白含量和血清中葡萄糖及甘油三酯含量(P<0.05)。当维生素C水平由1.9 mg/kg上升到78.4 mg/kg时,黄颡鱼幼鱼的血液中血红蛋白含量显著上升(P<0.05),但当饲料中维生素C水平高于78.4 mg/kg后,血液中血红蛋白含量则显著下降(P<0.05)。饲料中维生素C水平为1.9 mg/kg时,黄颡鱼幼鱼血清中甘油三酯含量显著高于其他各组(P<0.05)。当饲料中维生素C水平分别为1.9和18.9 mg/kg时,黄颡鱼幼鱼血清中葡萄糖含量差异不显著(P>0.05),但均显著高于其他各组(P<0.05)。饲料中维生素C水平对黄颡鱼幼鱼的血液中红细胞数量、白细胞数量、红细胞压积及血清中总蛋白、胆固醇含量均无显著影响(P>0.05)。
| 表3 饲喂不同维生素C水平饲料的黄颡鱼幼鱼的血液学参数和血清生化指标
Table 3 Haematological characteristics and serum biochemical indices of juvenile yellow catfish fed diets with different vitamin C levels (n=3)
|
由表4可知,饲料中维生素C水平可显著影响黄颡鱼幼鱼血清中超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性和丙二醛的含量(P<0.05)。当维生素C水平由1.9 mg/kg上升到156.5 mg/kg时,黄颡鱼幼鱼血清中超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性显著提高(P<0.05),而丙二醛含量显著下降(P<0.05);但当饲料中维生素C水平由156.5 mg/kg上升到316.0 mg/kg时,血清中超氧化物歧化酶、过氧化氢酶活性和丙二醛含量变化不显著(P>0.05),但谷胱甘肽过氧化物酶活性出现显著下降(P<0.05)。
| 表4 饲喂不同维生素C水平饲料的黄颡鱼幼鱼的血清抗氧化指标
Table 4 Serum antioxidant indices of juvenile yellow catfish fed diets with different vitamin C levels (n=3)
|
由表5可知,饲料中维生素C水平可显著影响黄颡鱼幼鱼血清中溶菌酶活性及头肾巨噬细胞吞噬百分率和呼吸爆发(P<0.05),对血清总补体、总免疫球蛋白含量无显著影响(P>0.05)。当饲料中维生素C水平由1.9 mg/kg上升到156.5 mg/kg时,血清溶菌酶活性显著提高(P<0.05),但随着维生素C水平的继续升高,溶菌酶活性变化不显著(P>0.05)。随着饲料中维生素C水平的升高,头肾巨噬细胞吞噬百分率和呼吸爆发先呈上升趋势,在维生素C水平为156.5 mg/kg时达到最大值,然后随饲料中维生素C水平继续升高而下降。以血清中溶菌酶活性为评价指标,根据折线模型得出黄颡鱼幼鱼饲料中维生素C适宜水平为142.43 mg/kg(图2)。
| 表5 饲喂不同维生素C水平饲料的黄颡鱼幼鱼的免疫应答
Table 5 Immune response of juvenile yellow catfish fed diets with different vitamin C levels (n=3)
|
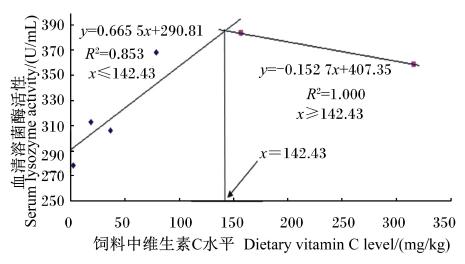 | 图2 饲料中维生素C水平与黄颡鱼幼鱼血清中溶菌酶活性的关系 Fig. 2 Relationship between dietary vitamin C level and serum lysozyme activity of juvenile yellow catfish |
由图3可知,感染嗜水气单胞菌14 d后,当饲 料中维生素C水平为1.9 mg/kg时,黄颡鱼幼鱼累计存活率显著低于维生素C水平为18.9和36.8 mg/kg时(P<0.05)。
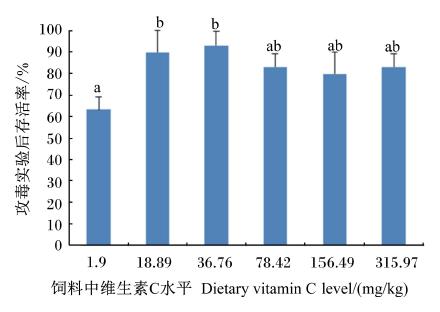 | 数据柱标注不同字母表示差异显著(P<0.05)。 Data columns with different letter superscripts mean significant difference (P<0.05). 图3 攻毒后饲喂不同维生素C水平饲料的黄颡鱼幼鱼的累计存活率 Fig. 3 Cumulative survival rate of juvenile yellow catfish fed diets with different vitamin C levels post-challenge |
维生素C对鱼类的生长、健康是必不可少的。对水生动物而言,未没有发现体内过高的维生素C水平具有细胞毒性;但是,当维生素C供应量不足时,鱼类会出现骨骼及软骨组织畸变、毛细血管脆弱、创伤修复迟缓、免疫能力下降、生长速率降低以及死亡率增加等一系列维生素C缺乏症[10]。本试验中,在不添加维生素C组中观察到黄颡鱼幼鱼普遍表现出维生素C缺乏症,如生长缓慢、反应迟钝等,但骨骼结构畸形等症状并没有被发现。大西洋鲑(Salmo salar)[12]、斑点叉尾 (Ictalurus punctatus)[13]、黑带石斑鱼(Epinephelus malabaricus)[14]等鱼类的维生素C缺乏症与本试验中观察到的现象基本相同。本试验结果表明,饲料中维生素C水平影响黄颡鱼幼鱼的生长性能,各添加维生素C组黄颡鱼幼鱼的增重率和特定生长率均高于不添加维生素C组,因此表明了维生素C确实提高了黄颡鱼幼鱼的生长性能,这同在牙鲆(Paralichthys olivaceus)[15]、军曹鱼(Rachycentron canadum)[16]上得出的结果相同。王吉桥等[7]研究发现,黄颡鱼对维生素C的需求量为600~800 mg/kg,如此高需要量的原因可能是饲料蛋白质含量对黄颡鱼生长的影响掩盖了维生素C的贡献。然而,金头鲷(Sparus aurata)[17]和大黄鱼(Pseudosciaena crocea)[18]的研究结果则显示饲料中添加维生素C对鱼的生长性能影响不显著,这可能与养殖对象的种类、生长阶段、生理状况、养殖环境以及饲料中维生素E等营养因子相互作用的影响有关。以特定生长率为评价指标,采用折线模型可以得到黄颡鱼幼鱼对饲料中维生素C的需求量为114.5 mg/kg。
已有的研究表明,血液中白细胞数量、血红蛋白含量及血清中总蛋白、甘油三酯与胆固醇含量与生物体的健康状况与免疫系统息息相关[19]。红细胞中的维生素C可以直接还原高铁血红蛋白成为血红蛋白以恢复运输氧的能力。本试验表明,当饲料维生素C水平为78.4~156.5 mg/kg时,黄颡鱼幼鱼血液中血红蛋白含量显著高于维生素C水平分别为1.9(最低水平组)和316.0 mg/kg(最高水平组)时,表明饲料中适宜水平的维生素C能保护血液中血红蛋白免受氧化,过低或过高的维生素C水平都会影响机体血液中血红蛋白的氧化情况。Hamre等[20]报道饲料中添加适量的维生素C可以提高大西洋鲑血液中红细胞数量以保护其免受氧化,这与本试验的研究结果一致。血清脂类(包括甘油三酯、磷脂、胆固醇及少量的游离脂肪酸)是体内脂类转运的主要形式,在各种异常代谢及病理过程中可及时反映出机体脂类代谢的相应变化[21]。本试验中,不添加维生素C组黄颡鱼幼鱼血清中葡萄糖和甘油三酯含量要高于各添加维生素C组,表明维生素C对血清脂类转运有积极作用,然而高含量的葡萄糖和甘油三酯容易导致肝胰腺疾病,出现脂肪肝的风险较高[22],相同的研究结果在金头鲷[17]和虹鳟(Oncorhynchus mykiss)[23]中也有报道。
细胞正常的需氧代谢过程会连续不断地产生许多活性氧(ROS)。活性氧对大部分细胞都有毒性,自由基可攻击细胞膜脂质中的不饱和脂肪酸(PUFA)引发脂质过氧化反应,脂质过氧化物的形成使膜受体、膜蛋白酶和离子通道的脂质微环境改变,从而改变它们的功能[24]。抗氧化酶系统中几种重要的抗氧化酶包括总超氧化物歧化酶(T-SOD)、过氧化氢酶和谷胱甘肽过氧化物酶,抗氧化酶可以消除过量的活性氧,减少脂质过氧化损伤[24, 25]。油脂氧化酸败的终产物之一丙二醛作为一种重要的检测指标,在目前可直接用来评价机体氧化损伤程度。本试验中,随着饲料中维生素C水平的升高,黄颡鱼幼鱼血清中超氧化物歧化酶和过氧化氢酶活性不断上升,在维生素C水平最高(316.0 mg/kg)时达到顶峰。而血清中谷胱甘肽过氧化物酶活性随着维生素C水平的升高先上升后降低,在维生素C水平为156.5 mg/kg时获得最高值。血清中丙二醛含量亦伴随着维生素C水平的升高而下降。饲料中维生素C水平显著影响了黄颡鱼幼鱼血清中过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶活性和丙二醛含量,可能是因为维生素C作为体内非酶类抗氧化系统成分之一,在细胞中有效清除自由基,防止脂质过氧化以及降低抗氧化酶的消耗,从而减少了机体的氧化损伤程度,这说明饲料中维生素C的添加起到了提高机体抗氧化能力的作用。据Zhou等[16]报道,随着饲料中维生素C水平的升高,军曹鱼血清中总超氧化物歧化酶活性显著增加。胡毅等[26]报道,给青鱼(Mylopharyngodon piceus)幼鱼喂食添加维生素C的饲料能显著提高青鱼幼鱼血清中过氧化氢酶和谷胱甘肽过氧化物酶活性。何蓝波[27]发现在每千克饲料中添加800 mg维生素C能显著降低黄鳝(Monopterus albus)血清中丙二醛含量。以上学者在不同动物上的研究结果与本试验结果基本一致。
与哺乳动物相比,先天免疫系统对于鱼类来说更为重要,它被看作为鱼类免疫反应和防御病原体的第1道防线。溶菌酶活性是鱼类的先天免疫的一个重要的指标,溶菌酶在活的生物体内无处不在,能够破坏细菌的胞壁结构并最终导致细胞崩解[28]。文华等[29]报道,草鱼(Ctenopharyngodon idellus)血清中溶菌酶活性随饲料维生素C水平的升高而显著增加,在维生素C水平为609.2 mg/kg时达最大。Ai等[18]给大黄鱼投喂添加不同水平维生素C的饲料,发现添加维生素C组大黄鱼的血清溶菌酶活性显著高于不添加维生素C组。本试验中,当饲料中维生素水平由1.9 mg/kg上升到78.4 mg/kg时,黄颡鱼幼鱼血清中溶菌酶活性显著增加,随着维生素C水平的进一步升高,血清中溶菌酶活性无显著变化。此结果与秦启伟等[3]对青石斑鱼(Epinephelus awoara)、宋学宏等[4]对异育银鲫(Carasszus auratus gitelio)、Zhou等[16]对军曹鱼的研究结论基本一致。
鱼类吞噬细胞除作为辅助细胞具有特异性免疫功能外,也是组成非特异性防御系统的关键成分。同时,它广泛参与免疫应答、免疫效应和免疫调节,有吞噬杀伤和递呈抗原的作用[30]。呼吸爆发的提高被认为是由于维生素和超氧化物歧化酶清除在氧化过程中产生的自由基,对细胞直接保护的结果[31]。本试验中,添加维生素C可显著提高黄颡鱼幼鱼头肾巨噬细胞的吞噬百分率和呼吸爆发,这可推断出维生素C可以保护头肾巨噬细胞免受氧化损伤。宋学宏等[4]报道了异育银鲫头肾细胞吞噬能力随着饲料中维生素C水平的升高而显著增加,这与本试验的结果是一致的,表明维生素C能够影响水生动物的非特异性免疫系统,提高机体免疫力,增强溶菌酶活性和杀菌活性等。然而,Ren等[32]对大菱鲆(Scophthatmus maximus)的研究表明,维生素C对动物血细胞吞噬活性并无显著影响。不同学者对维生素C对鱼类白细胞吞噬活性影响的观察结果存在差异,可能是由于试验鱼的种类、代谢率以及试验方法和取样时间不同所致。
动物的存活率是反映疾病抵抗力高低的综合指标,尤其是攻毒后的存活率可以综合反映水生动物的免疫能力。本试验中,饲料中适宜水平的维生素C能显著提高黄颡鱼抵抗嗜水气单胞菌的能力,从而获得较高的攻毒存活率。黄颡鱼幼鱼的存活率与其非特异性免疫指标如血清溶菌酶活性、巨噬细胞吞噬指数和呼吸爆发呈正相关。同时,大量的试验研究证明,饲料中添加维生素C能显著提高鱼体的抗病能力。Ai等[18]研究表明,用哈维氏弧菌(Vibrio harveyi)攻毒大黄鱼时,饲料中缺乏维生素C的组鱼死亡率显著高于添加维生素C的组,而且添加高剂量(489.0 mg/kg)维生素C组的存活率显著高于添加低剂量(23.8 mg/kg)维生素C组。Zhou等[16]发现维生素C能通过增强免疫力来提高军曹鱼抵御哈维氏弧菌的能力,从而提高了军曹鱼的攻毒存活率。
4 结 论① 饲料中适宜水平的维生素C可以提高黄颡鱼幼鱼的增重率以及特定生长率,增强血清超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性,降低血清丙二醛含量,并显著提高血清中溶菌酶活性,头肾巨噬细胞吞噬百分率、呼吸爆发以及抗病能力。
② 以特定生长率和血清中溶菌酶活性为评价指标,通过折线模型得出黄颡鱼幼鱼对饲料中维生素C的需要量分别为114.5和142.3 mg/kg。
| [1] | FRACALOSSI D M,ALLEN M E,YUYAMA L K,et al.Ascorbic acid biosynthesis in Amazonian fishes[J]. Aquaculture,2001,192(2/3/4):321-332. ( 1) 1)
|
| [2] | NRC.Nutrient requirements of fish and shrimp[S]. Washington,D.C.:National Academies Press,2011,207-209. ( 1) 1)
|
| [3] | 秦启伟,吴灶和,周永灿,等.饵料维生素C对青石斑鱼的非特异性免疫调节作用[J]. 热带海洋,2000,19(1):58-63. ( 2) 2)
|
| [4] | 宋学宏,蔡春芳,潘新法,等.用生长和非特异性免疫力评定异育银鲫维生素C需要量[J]. 水产学报,2002,26(4):351-356. ( 3) 3)
|
| [5] | 王安利,母学全,凌利英.中国对虾配合饵料中维生素C添加量的研究[J]. 海洋与湖沼,1996,27(4):368-372. ( 1) 1)
|
| [6] | 王文辉,王吉桥,程鑫,等.不同剂型维生素C对黄颡鱼生长和几种免疫指标的影响[J]. 中国水产科学,2006,13(6):951-958. ( 1) 1)
|
| [7] | 王吉桥,王文辉,李文宽,等.饲料蛋白质和维生素C含量对黄颡鱼生长和免疫力的影响[J]. 水产学报,2005,29(4):512-518. ( 2) 2)
|
| [8] | SHIAU S Y,HSU T S.Vitamin C requirement of grass shrimp,Penaeus monodon,as determined with L-ascorbyl-2-monophosphate[J]. Aquaculture 1994,122(4):347-357. ( 1) 1)
|
| [9] | AOAC.Official methods of analysis of AOAC[M]. 15th ed.Arilington,VA:Association of official Analytical Chemists,1995:684. ( 1) 1)
|
| [10] | SECOMBES C J.Isolation of salmonid macrophages and analysis of their killing activities[M]//STOLEN J S,FLETCHER T C,ANDERSON D P,et al.Techniques in fish immunology.Fair Haven,NJ:SOS Publications,1990:137-152. ( 3) 3)
|
| [11] | PULSFORD A L,CRAMPE M,LANGSTON A,et al.Modulatory effects of disease,stress,copper,TBT and vitamin E on the immune system of flatfish[J]. Fish and Shellfish Immunology,1995,5(8):631-643. ( 1) 1)
|
| [12] | HALVER J E,HARDY R W.L-ascorbyl-2-sulfate alleviates Atlantic salmon scurvy[J]. Experimental Biology and Medicine,1994,206(4):421-424. ( 1) 1)
|
| [13] | LIM C,LOVELL R T.Pathology of the vitamin C deficiency syndrome in channel catfish (Ictalurus punctatus)[J]. The Journal of Nutrtion,1978,108(7):1137-1146. ( 1) 1)
|
| [14] | LIN M F,SHIAU S Y.Dietary L-ascorbic acid affects growth,nonspecific immune responses and disease resistance in juvenile grouper,Epinephelus malabaricus[J]. Aquaculture,2005,244(1/2/3/4):215-221. ( 1) 1)
|
| [15] | WANG X J,KIM K W,BAI S C,et al.Effects of different dietary levels of L-ascorbyl-2-polyphosphate on growth and tissue vitamin C concentrations in juvenile olive flounder,Paralichthys olivaceus (Temminck et Schlegel)[J]. Aquaculture Research,2002,33(4):261-267. ( 1) 1)
|
| [16] | ZHOU Q C,WANG L G,WANG H L,et al.Effect of dietary vitamin C on the growth performance and innate immunity of juvenile cobia (Rachycentron canadum)[J]. Fish and Shellfish Immunology,2012,32(6):969-975. ( 4) 4)
|
| [17] | HENRIQUE M M F,GOMES E F,GOUILLOU-COUSTANS M F,et al.Influence of supplementation of practical diets with vitamin C on growth and response to hypoxic stress of seabream,Sparus aurata[J]. Aquaculture,1998,161(1/2/3/4):415-426. ( 2) 2)
|
| [18] | AI Q H,MAI K S,TAN B P,et al.Effects of dietary vitamin C on survival,growth and immunity of large yellow croaker,Pseudosciaena crocea[J]. Aquaculture,2006,261(1):327-336. ( 3) 3)
|
| [19] | ZHOU Q C,MAI K S,TAN B P,et al.Partial replacement of fishmeal by soybean meal in diets for juvenile cobia (Rachycentron canadum)[J]. Aquaculture Nutrition,2005,11(3):175-182. ( 1) 1)
|
| [20] | HAMRE K,WAAGBØ R,BERGE R K,et al.Vitamins C and E interact in juvenile Atlantic salmon (Salmo salar,L.)[J]. Free Radical Biology and Medicine,1997,22(1/2):137-149. ( 1) 1)
|
| [21] | 刘玮,戴年华,任本根,等.不同脂肪源饲料对团头鲂稚鱼生长的影响[J]. 水产学报,1997,21(增刊):44-48. ( 1) 1)
|
| [22] | HIJAMS B S,GREFHORST A,OOSTERVEER M H,et al.Zonation of glucose and fatty acid metabolism in the liver:mechanism and metabolic consequences[J]. Biochimie,2014,96:121-129. ( 1) 1)
|
| [23] | JOHN T M,GORGE J C,HILTON J W,et al.Influence of dietary ascorbic acid on plasma lipid levels in the rainbow trout[J]. International Journal for Vitamin and Nutrition Research,1979,49(4):400-405. ( 1) 1)
|
| [24] | FREEMAN B A,CRAPO J D.Biology of disease:free radicals and tissue injury[J]. Laboratory Investigation,1982,47(5):412-426. ( 2) 2)
|
| [25] | SIES H.Oxidative stress:oxidants and antioxidants[J]. Experimental Physiology,1997,82(2):291-295. ( 1) 1)
|
| [26] | 胡毅,黄云,文华,等.维生素C对青鱼幼鱼生长、免疫及抗氨氮胁迫能力的影响[J]. 水产学报,2013,37(4):565-573. ( 1) 1)
|
| [27] | 何蓝波.维生素C对黄鳝生产性能、营养成分、抗氧化能力和免疫功能的影响[D]. 硕士学位论文.雅安:四川农业大学,2010:27-32. ( 1) 1)
|
| [28] | SAURABH S,SAHOO P K.Lysozyme:an important defence molecule of fish innate immune system[J]. Aquaculture Research,2008,39(3):223-239. ( 1) 1)
|
| [29] | 文华,严安生,雍文岳,等.饲料维生素C水平对草鱼的免疫功能和抵抗病菌感染的影响[J]. 饲料工业,2005,26(18):56-59. ( 1) 1)
|
| [30] | ADOLPH S,SCHOENIGER A,HERBERT F H,et al.Unsaturated fatty acids as modulators of macrophage respiratory burst in the immune response against Rhodococcus equi and Pseudomonas aeruginosa[J]. Free Radical Biology and Medicine,2012,52(11/12):2246-2253. ( 1) 1)
|
| [31] | 王立改.维生素E和C对军曹鱼(Rachycentron canadum)生长性能和非特异性免疫的影响[D]. 硕士学位论文.湛江:广东海洋大学,2011:26-32. ( 1) 1)
|
| [32] | REN T J,KOSHIO K,ISHIKAWA M,et al.Influence of dietary vitamin C and bovine lactoferrin on blood chemistry and non-specific immune responses of Japanese eel,Anguilla japonica[J]. Aquaculture,2007,267(1/2/3/4):31-37. ( 1) 1)
|




