2. 中国科学院亚热带农业生态研究所, 中国科学院亚热带农业生态过程重点实验室, 湖南省农业生态过程重点实验室, 长沙 410125
2. Key Laboratory of Agro-Ecological Processes in Subtropical Region, Hunan Key Laboratory of Agro-Ecological Processes, Institute of Subtropical Agriculture, The Chinese Academy of Sciences, Changsha 410125, China
瘤胃作为反刍动物特有的消化器官,是反刍动物对饲料消化代谢和营养吸收的第1场所,在反刍过程中发挥着极其重要的作用。瘤胃壁由黏膜、黏膜下层、肌层、浆膜4层构成。基层很发达,内层为环形肌,外层为纵形肌,都为平滑肌。瘤胃平滑肌细胞作为瘤胃的主要组织成分,主要维持平滑肌组织的结构完整性和运动,在运动功能方面,平滑肌主要的功能是进行收缩和舒张能力的调节。
目前国内外有关胃平滑肌的研究主要是在离体上进行[1],为了更直接地从细胞和分子水平研究胃平滑肌细胞增殖的因素,以及模拟体内各种生理、病理条件下胃平滑肌功能的改变,需要对瘤平滑肌细胞进行培养和深入研究。
近年来,国内外学者们已经成功在体外培养了多种动物的胃平滑肌细胞,并将胃平滑肌组织或者细胞应用于相关领域的病因、病理学等的研究。例如:Jalilzadeh-Amin等[2]通过对绵羊瘤胃和皱胃纵向平滑肌组织进行体外试验,试验表明了欧薄荷香油能作为一种胃动力促进剂和松弛剂来防止和减轻胃肠道的功能障碍; 许远靖[3]研究β-羟丁酸对皱胃平滑肌细胞氧化应激及收缩相关蛋白质表达的影响,揭示β-羟丁酸造成皱胃平滑肌氧化应激损伤的分子机制,为防治皱胃变位提供理论依据。但是关于山羊瘤胃平滑肌细胞的体外培养尚不多见。因此,本试验以期建立一种有效、快速的获得瘤胃平滑肌细胞的体外培养方法,为研究反刍动物瘤胃相关功能提供一定的技术支持。
1 材料与方法 1.1 样品和试剂试验动物为4只42日龄湘东黑山羊,体重为(5.9±0.8) kg。颈静脉放血致死,取出内脏组织,分离瘤胃,去掉内容物后用无菌生理盐水反复冲洗干净,然后进行样本采集。
Ⅱ型胶原酶、胎牛血清、DMEM/F12、胰蛋白酶、青链霉素均购自Gibco公司;二辛可宁酸法(BCA)蛋白质浓度测定试剂盒、免疫染色固定液、4′,6-二脒基-2-苯基吲哚(DAPI)染色液、抗荧光猝灭剂、α肌动蛋白(α-actin)平滑肌特异性抗体、十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)蛋白质上样缓冲液(5×)、SDS-PAGE凝胶配制试剂盒、蛋白质印迹(Western blot)电泳缓冲液、Western blot转膜液、Western blot洗涤液、Western blot一抗稀释液、Western blot二抗稀释液、BeyoECL plus(超敏ECL化学发光试剂盒)均购自碧云天生物技术研究所;庆大霉素和两性霉素B购自BBI公司;细胞计数试剂盒(CCK-8)购自日本同仁化学研究所;荧光标记驴抗鼠二抗[Dylight 488 Affinipure donkey anti-mouse IgG(H+L)]购自Earthox公司;Tritonx-100、牛血清白蛋白(BSA)均购自Amresco公司。
1.2 瘤胃平滑肌细胞原代培养取出瘤胃组织,去除内容物,用无菌生理盐水反复冲洗干净,钝性剥离瘤胃平滑肌。用含500 μg/mL青链霉素、5 μg/mL两性霉素B和庆大霉素的洗涤液冲洗瘤胃平滑肌,并放入含500 μg/mL青链霉素、5 μg/mL两性霉素B和庆大霉素的DMEM/F12中带回细胞培养室。用磷酸盐缓冲液(PBS)清洗瘤胃平滑肌组织2~3次,剪去结缔、脂肪及可见导管组织。将瘤胃平滑肌组织块尽量剪碎(约1 mm3,肉眼观察呈糊状),再用PBS和DMEM/F12各洗涤1次。弃去上清液,往沉淀中加入5倍组织体积的0.2%Ⅱ型胶原酶消化液,37 ℃空气浴振荡消化1.5 h。消化完成后1 000 r/min条件下离心5 min,倒掉上清,加入适量DMEM/F12完全培养液[含5%胎牛血清、1%双抗、0.1 mg/mL庆大霉素、2.5 μg/mL两性霉素B、5 ng/mL小鼠表皮生长因子(mEGF)、1 μg/mL胰岛素(insulin)、1 μg/mL原运铁蛋白(apo-transferrin)、3.4 nmol/L亚硒酸钠]重悬细胞。然后过滤,收集的滤液1 000 r/min条件下离心5 min后,倒掉上清液,往沉淀中加入PBS重悬细胞,继续1 000 r/min条件下离心5 min。接种细胞后置于CO2培养箱(37 ℃、5% CO2)培养,细胞浓度调整为1×107 个/mL。
1.3 细胞传代培养当细胞长满培养皿的85%时,吸去培养基,用PBS洗涤细胞。在培养皿中加入1 mL消化液(0.25%胰蛋白酶 ∶ 0.02%EDTA为1 ∶ 1),放入37 ℃培养箱中消化细胞。显微镜下观察细胞开始变圆时,迅速用含血清的培养基终止消化。将贴壁的细胞吹打成悬液,1 000 r/min条件下离心5 min,弃去上清液,加入适量的培养基重悬细胞,以1 ∶ 3的比例进行传代。在培养箱(37 ℃、5% CO2)中培养30 min后,吸出上清液至另一培养皿中继续培养,此步骤重复1次。
1.4 细胞形态学观察采用徕卡DMI 3000B型倒置显微镜观察原代和传代培养所获细胞的形态及生长状况。
1.5 细胞免疫荧光鉴定小心倾去细胞培养液,用PBS清洗细胞2次。吸干液体后加入免疫染色固定液(4%多聚甲醛),室温固定细胞10 min。去除固定液,PBS洗涤细胞2次。然后用0.1% Tritonx-100透化细胞7~10 min,透化完成后PBS清洗细胞。用5% BSA封闭,室温孵育1~2 h后,去除封闭液,加入一抗(抗体稀释倍数1 ∶ 400),于4 ℃冰箱中孵育过夜。此一抗是具平滑肌特异性的,并适合山羊样品检测。次日,PBS洗3次。避光室温孵育二抗[Dylight 488 Affinipure donkey anti-mouse IgG(H+L)]1 h后,再PBS洗3次。然后加入DAPI染色液500 μL,室温染色1~3 min后,PBS洗3次。最后加入500 μL抗荧光猝灭剂,荧光显微镜观察拍照。
1.6 细胞生长曲线的绘制取对数生长期细胞按1/2依次用培养基等比稀释成6个细胞浓度梯度,每组6个重复孔。培养4 h使细胞贴壁后,加CCK-8试剂培养4 h后测定450 nm吸光度值(OD450 nm),以细胞数量为横坐标,OD450 nm为纵坐标,制作标准曲线。同时取对数生长期细胞以5×103 个/孔的密度接种于96孔板细胞培养板中,共分7组,每组6个重复孔。分别于接种后1、2、3、4、5、6、7 d给各组细胞中添加10 μL CCK-8试剂,37 ℃培养4 h后酶标仪测定OD450 nm。通过标准曲线换算得到细胞数。以培养时间为横坐标,细胞数为纵坐标,绘制细胞生长曲线。
1.7 各代次细胞的生长活性检测取第1~11代处于对数生长期的细胞,以5×103 个/孔的密度接种于96孔板细胞培养板中,每代次取4个平行。培养24 h后,加CCK-8试剂培养4 h后测定OD450 nm,以培养代次为横坐标,吸光值为纵坐标,绘制曲线图。
1.8 Western blotting技术检测各代次细胞α-actin表达当细胞长满至培养皿85%以上时,用PBS洗涤。加入400 μL蛋白质裂解液,冰上静置30 min,每隔10 min漩涡振荡30 s。然后于4 ℃高速离心机中12 000×g条件下离心5 min,收集上清。吸取1 μL上清液,用BCA法检测蛋白质浓度,在样品中加入上样缓冲液(5×),并稀释成同一浓度。
先后配制10%分离胶和5%浓缩胶,采用恒压浓缩胶80 V、分离胶120 V电泳直至溴酚染料前沿下至凝胶末端处,即停止电泳。然后采用200 mA电转1.5 h。电转完成后用5% BSA于振荡器上封闭2 h。加入一抗,于4 ℃冰箱中孵育过夜。次日,再加入二抗在振荡器上孵育1 h。最后在膜上滴加显影液,显影。
1.9 统计分析Western blotting得到的条带采用Gel-Pro analyzer4分析灰度值,再将灰度值用SAS 8.2软件进行统计分析,P < 0.05为差异显著,P>0.05为无显著差异。
2 结 果 2.1 山羊瘤胃平滑肌细胞形态通过倒置光学显微镜对瘤胃平滑肌细胞形态进行了观察,结果表明,原代培养1 d后,瘤胃平滑肌细胞开始贴壁(图1-A)。原代培养4 d的瘤胃平滑肌细胞呈典型平滑肌细胞所具有的长梭形或带状三角形(图1-B)。细胞生长至8 d时,可见细胞呈95%左右融合。细胞排列成漩涡状或栅栏状,有的相互平行,并且重叠生长,表现为典型的“波峰”和“浪谷”状(图1-C)。传代细胞与原代细胞相比,第5代细胞的形态无明显变化(图1-D)。
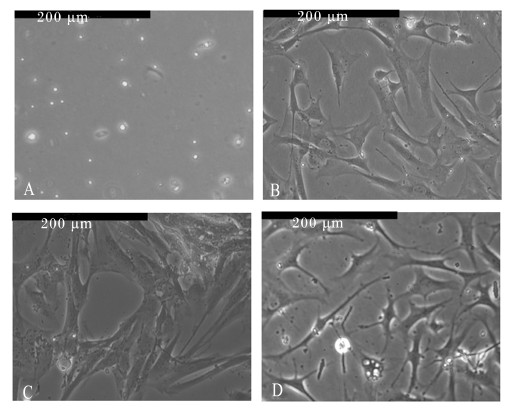 |
A.原代培养1 d的瘤胃平滑肌细胞;B.原代培养4 d的瘤胃平滑肌细胞;C.原代培养8 d的瘤胃平滑肌细胞;D.第5代 瘤胃平滑肌细胞。 A.primary ruminal smooth muscle cells after cultured for 1 d;B.primary ruminal smooth muscle cells after cultured for 4 d; C.primary ruminal smooth muscle cells after cultured for 8 d;D.P5 ruminal smooth muscle cells. 图1 山羊瘤胃平滑肌细胞形态 Fig. 1 Morphology of cultured ruminal smooth muscle cells of goats (100×) |
利用α肌动蛋白(α-actin)抗体对第5代瘤胃平滑肌细胞进行免疫荧光鉴定,在倒置荧光显微镜下观察拍照。结果显示,DIPI染色细胞核呈蓝色(图2-A),细胞质呈阳性表达(图2-B),阴性对照细胞无荧光(图2-D),说明分离培养的细胞为平滑肌细胞,阳性瘤胃平滑肌细胞达约98%(图2-C),证明培养的瘤胃平滑肌细胞纯度很高。
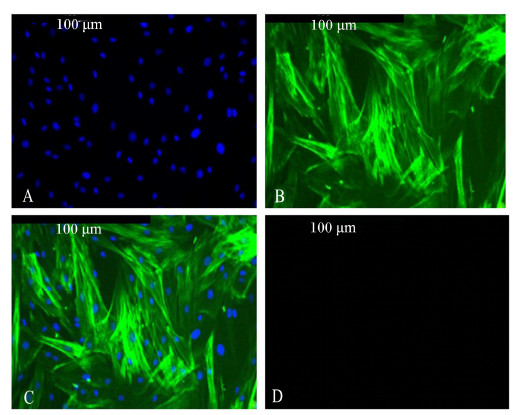 |
A.DAPI细胞核染色;B.α-actin呈阳性细胞质表达;C.A与B叠加;D.阴性对照。 A.DAPI nuclear staining;B.α-actin positive expression cytoplasm;C.the merging of A and B;D.negative control. 图2 山羊瘤胃平滑肌细胞表面标记免疫荧光检测 Fig. 2 Immunofluorescence identification of ruminal smooth muscle cells surface markers (200×) |
细胞生长曲线测定结果如图3所示。第5代瘤胃平滑肌细胞的生长曲线均呈典型的“S”型。细胞增殖过程经历了潜伏期、对数生长期和平台期。1~2 d为细胞潜伏期,细胞生长比较缓慢;培养2 d后,细胞增殖进入对数生长期,5 d后进入平台期,细胞生长缓慢,细胞数量不再增加。
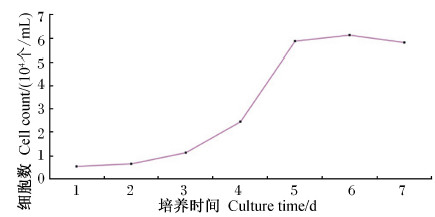 | 图3 山羊瘤胃平滑肌细胞生长曲线 Fig. 3 Growth curve of ruminal smooth |
各代次间细胞的生长活性测定如图4所示,从第1代开始,随着代次的增加细胞的生长活性变化不大。在第5代时,细胞的生长活性是最强的。
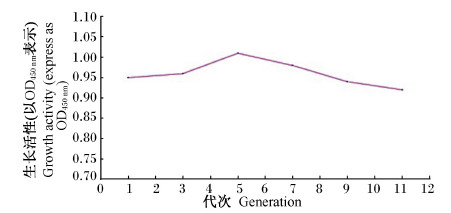 | 图4 各代次山羊瘤胃平滑肌细胞生长活性曲线 Fig. 4 Growth activity curve of generations of ruminal smooth muscle cells of goats |
如图5所示,从左至右各条带分别为第1、3、5、7、9、11代山羊瘤胃平滑肌细胞的检测条带,可知α-actin在各代次山羊瘤胃平滑肌细胞中表达稳定,没有显著差异(P>0.05)。
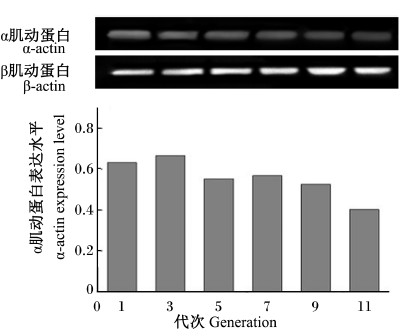 | 图5 各代次山羊瘤胃平滑肌细胞α肌动蛋白表达结果 Fig. 5 Expression of α-actin in generations of ruminal smooth muscle cells of goats |
细胞培养主要分为原代培养和传代培养2大类[4]。而常用的细胞原代培养培养方法有酶消化培养法和组织块贴壁法[5]。采用酶消化法培养原代平滑肌细胞的优点是在较短时间内即可获得细胞,通常培养1周左右就能传代,且原代细胞的产量较高,细胞形态分化良好,其缺点则是需要大量组织进行消化。组织块培养法则便于操作,需要的组织量小,但不足之处是组织贴块后容易脱落,成功率不高,且一般需要较长时间才能长满瓶底。丘钦英等[6]用组织块法培养了大鼠脑基底动脉平滑肌细胞,组织块贴块后5 d有细胞萌出,培养2周后细胞才融合传代。因此,传统消化法培养效率高于组织块培养法[7]。
平滑肌细胞外基质中有胶原存在,使用性质温和的Ⅱ型胶原酶既可以将细胞间的胶原连接去除,使细胞彼此分离,同时对细胞活力损伤较小。臧元伟等[8]使用0.2%的Ⅱ型胶原酶消化成功获得大鼠输精管平滑肌细胞。同样,本试验采用5×平滑肌组织体积的0.2%的Ⅱ型胶原酶对瘤胃平滑肌组织进行消化,有效分离出山羊瘤胃平滑肌细胞。
具有完整形态的平滑肌细胞能表达相关蛋白质以发挥其生理功能,如肌球蛋白重链SM1、α-actin等,通常将细胞内是否有α-actin的表达作为鉴定平滑肌细胞的标准[9]。本试验采用平滑肌特异性的α-actin作为一抗,采用免疫荧光染色对所培养的细胞进行鉴定,发现采用胶原酶消化法能获得的瘤胃平滑肌细胞经α-actin免疫细胞荧光染色后,胞质着色,呈阳性反应,高倍镜下可见胞质内绿色与细胞长轴平行的纤维细丝,说明培养的细胞为平滑肌细胞,且细胞的纯度较高,满足后续试验的要求。这与Suh等[10]在分离、培养平滑肌细胞时,通过检测α-actin的表达鉴定胎盘动脉平滑肌细胞是一致的。同时,陈威中等[11]在建立人脐动脉内皮细胞-平滑肌细胞共培养模型时,也是用α-actin免疫细胞荧光染色鉴定平滑肌细胞。本试验采用Western blotting检测平滑肌特异性表达的α-actin在各代次山羊瘤胃平滑肌细胞间的表达,通过SAS分析软件统计出α-actin在细胞内的表达不受传代的影响,各代次之间的表达没有显著差异。
动物细胞培养过程中容易受到微生物污染。反刍动物瘤胃中栖息的微生物包括细菌(超过200种,活菌数高达1×1011 CFU/mL)、原虫(超过25个属,其数量为1×104~1×106 CFU/mL)、真菌(5个属,真菌孢子为1×103~1×105 CFU/mL)、古菌和噬菌体(其数量可达1×107~1×109 CFU/mL)[12, 13]。为了防止细菌和真菌的污染,本试验在取样用的组织洗涤液和原代细胞培养液中加入了5×的青链霉素、2×的庆大霉素和两性霉素B。庆大霉素对支原体具有杀菌或抑菌作用,而两性霉素对酵母或霉菌具有杀菌或抑菌作用。
由于原代细胞在培养过程中不可避免的会参杂有成纤维细胞,利用成纤维细胞贴壁时间短于瘤胃平滑肌细胞这一特点[14],在细胞消化后,运用差速贴壁法将细胞培养先30 min,去除部分成纤维细胞,吸出上清液至另一培养皿中继续培养,再次静置、贴壁。此步骤重复1次,提高瘤胃平滑肌细胞纯度。利用此方法多次传代后可使细胞达到较高的纯度。随着传代次数的增加,瘤胃平滑肌细胞可排挤成纤维细胞的生长而优势增殖。在第5代左右平滑肌细胞的纯度可达约98%,并在第5代时细胞的生长活性达到最高。
4 结论本研究中,利用酶消化培养法培养了山羊原代瘤胃平滑肌细胞,并利用免疫荧光对山羊瘤胃平滑肌细胞进行了鉴定,较快获得理想的细胞分离效果以及细胞增殖活性。为山羊瘤胃平滑肌的功能研究提供了理想的细胞模型。
| [1] | SO I,KIM K W.Nonselective cation channels activated by the stimulation of muscarinic receptors in mammalian gastric smooth muscle[J]. Journal of Smooth Muscle Research,2003,39(6):231-247. ( 1) 1)
|
| [2] | JALILZADEH-AMIN G,MAHAM M,BALIR-NAGHADEH B,et al.Effects of Mentha longifolia essential oil on ruminal and abomasal longitudinal smooth muscle in sheep[J]. Journal of Essential Oil Research,2012,24(1):61-69. ( 1) 1)
|
| [3] | 许远靖.β-羟丁酸对皱胃平滑肌细胞氧化应激及收缩相关蛋白表达的影响[D]. 硕士学位论文.长春:吉林大学,2013. ( 1) 1)
|
| [4] | SWEENEY D,HOLLINS F,GOMEZ E,et al.No evidence for altered intracellular calcium-handling in airway smooth muscle cells from human subjects with asthma[J]. BMC Pulmonary Medicine,2015,15:12,doi:10.1186/s12890-015-0009-z. ( 1) 1)
|
| [5] | XU S W,FU J J,CHEN J W,et al.Development of an optimized protocol for primary culture of smooth muscle cells from rat thoracic aortas[J]. Cytotechnology,2009,61(1/2):65-72. ( 1) 1)
|
| [6] | 丘钦英,周家国,刘玉洁,等.大鼠脑基底动脉平滑肌细胞培养及功能鉴定[J]. 中国药理学通报,2007,23(11):1531-1533. ( 1) 1)
|
| [7] | 李影.猪脂肪细胞生物学特性及胰岛素和胆固醇在其生脂过程中的调控作用[D]. 博士学位论文.杨凌:西北农林科技大学,2006. ( 1) 1)
|
| [8] | 臧元伟,高路,吴栋,等.组织块消化法原代培养大鼠输精管平滑肌细胞及鉴定[J]. 山东大学学报:医学版,2012,50(8):51-56. ( 1) 1)
|
| [9] | CAIRRÃO E,SANTOS-SILVA A J,ALVAREZ E,et al.Isolation and culture of human umbilical artery smooth muscle cells expressing functional calcium channels[J]. In Vitro Cellular & Developmental Biology Animal,2009,45(3/4):175-184. ( 1) 1)
|
| [10] | SUH J H,YOON J S,KIM H W,et al.Adventitial fibroblast abormality in thoracic aortic aneurysms and aortic dissections[J]. The Korean Journal of Thoracic and Cardiovascular Surgery,2011,44(6):406-412. ( 1) 1)
|
| [11] | 陈威中,吴满平.人脐动脉内皮细胞——平滑肌细胞共培养模型的建立及鉴定[J]. 复旦学报:医学版,2009,36(6):768-775. ( 1) 1)
|
| [12] | JANSSEN P H,KIRS M.Structure of the archaeal community of the rumen[J]. Applied and Environmental Microbiology,2008,74(12):3619-3625. ( 1) 1)
|
| [13] | DEHORITY B A,TIRABASSO P A.Effect of feeding frequency on bacterial and fungal concentrations,pH,and other parameters in the rumen[J]. Journal of Animal Science,2001,79(11):2908-2912. ( 1) 1)
|
| [14] | 辛毅,许秀芳,黄益民,等.乳小鼠心肌成纤维细胞和心肌细胞的分离培养及荧光鉴定[J]. 新乡医学院学报,2011,28(5):541-547. ( 1) 1)
|




