2. 天津海友佳音生物科技股份有限公司, 天津 300356;
3. 天津农学院水产科学系, 天津市水产生态及养殖重点实验室, 天津 300384
2. Tianjin Ocean Pal Carol Biotech Co., Ltd., Tianjin 300356, China;
3. Tianjin Key Laboratory of Aqua-Ecology and Aquaculture, Department of Fishery Science, Tianjin 300384, China
维生素C(抗坏血酸)是一种有效的自由基清除剂,通过逐级供给电子而转变成脱氢抗坏血酸,以清除组织中过多的自由基,具有保护过氧化物酶活性及对组织的自由基损伤起到一定的防御作用[1, 2]。
由于红细胞中不含线粒体,红细胞只能通过磷酸戊糖途径生成还原型辅酶Ⅱ(NADPH),维持红细胞内的还原能力,防止过氧化氢(H2O2)等对红细胞造成损伤[3]。红细胞中的葡萄糖-6-磷酸脱氢酶(glucose-6-phos-phate dehydrogenises,G-6-PD)是红细胞糖代谢中的一种关键酶,其作用是保护还原型谷胱甘肽和NADPH,而NADPH能防止因氧化应激而引起的细胞损伤。G-6-PD活性降低会影响红细胞膜的代谢与功能,严重的可致红细胞破坏溶解而贫血[4],进而降低红细胞的抗氧化能力。
目前,有关维生素C对红细胞抗氧化能力的研究只在哺乳动物(人和鼠)[5, 6, 7]中有相关报道,在水产动物上仅见有维生素C对鱼类红细胞数量、血细胞比容的报道(如湄公河巨型鲶鱼[8]、尼罗河罗非鱼[9])。本研究用不同维生素C含量的饲料饲喂半滑舌鳎后,感染迟缓爱德华氏菌,旨在探讨维生素C对半滑舌鳎红细胞氧化和抗氧化状态的影响,为揭示半滑舌鳎红细胞的氧化损伤机制提供依据。
1 材料与方法 1.1 试验动物及饲料试验用半滑舌鳎[平均体重(99.12±1.58) g]取自天津立达海水资源开发有限公司。在基础饲料中分别添加0(对照)、300、600、900、1 500、2 400 mg/kg L-抗坏血酸-2-磷酸酯(L-ascorbayl-2-phosphate,作为维生素C添加剂,购于天津市新概念生物技术有限公司,有效物质含量35%),制成6种试验饲料,维生素C含量实测值分别为0.2(对照)、104.8、209.6、313.8、521.6、837.3 mg/kg饲料。将健康的半滑舌鳎随机分成6组,每组3个重复,每个重复20尾,分别喂食上述6种试验饲料84 d。基础饲料组成及营养水平见表1。
| 表1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
从患病鱼病灶处分离出细菌进行划线培养,培养24 h后观察,从平板上将形态不同的菌落挑出,在已制好的平板培养基上进行划线分离纯化,用微生物鉴定仪(法国梅里埃,型号VTK2)鉴定出迟缓爱德华氏菌,然后放入甘油保存在-80 ℃冰箱里待用。
1.3 攻毒试验及样品采集将分离出的迟缓爱德华氏菌用生理盐水将浓度调至1.68×108 个/mL。每个重复取试验鱼8尾,经腹腔注射0.2 mL菌悬液,连续观察14 d。然后取攻毒试验组及对照组半滑舌鳎,每个重复3尾,尾静脉采血,用肝素钠抗凝(50 U/mL血液),一部分用于测定红细胞G-6-PD活性和血红蛋白(Hb)含量,一部分用于红细胞膜的提取。攻毒期间试验鱼不投喂。
1.4 红细胞膜提取红细胞膜的提取参照朱国霞等[10]和封家旺[11]的方法。具体方法如下:用pH 7.4等渗磷酸盐缓冲液(含0.86%的NaCl)分离红细胞,室温下2 000 r/min离心10 min,留取下层红细胞,生理盐水洗涤红细胞3次,每次室温下1 000 r/min离心10 min。将所得红细胞用0.1 mL生理盐水悬起,加40倍体积含0.5 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl-fluoride,PMSF)的低渗缓冲液(5 nmol/L Tris-HCl,pH 7.4),于4 ℃溶胞30 min,室温下2 000 r/min离心5 min,弃上清,向残留黏稠物中加入0.5 mL含0.5 mmol/L PMSF的低渗缓冲液,手动冰浴匀浆1 min(下同),4 ℃ 12 000 r/min离心15 min,沉淀用含0.5 mmol/L PMSF的低渗缓冲液洗涤3次,以完全除去胞浆蛋白。最后离心所得沉淀即为红细胞膜,用含0.5 mmol/L PMSF的低渗缓冲液悬起,用考马斯亮蓝G-250法[12]测定膜蛋白含量,分装,于-70 ℃冰箱中保存备用。
1.5 指标测定方法 1.5.1 血浆维生素C和红细胞Hb含量的测定血浆维生素C含量采用维生素C测定试剂盒(南京建成生物工程研究所生产)检测,红细胞Hb含量采用氰化高铁血红蛋白(MetHb)法测定。
1.5.2 红细胞抗氧化指标及G-6-DP活性测定红细胞超氧化物歧化酶(SOD)活性采用黄嘌呤氧化酶法测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)比色法测定,过氧化氢酶(CAT)活性采用钼酸铵法测定,G-6-PD活性采用MetHb还原法测定,结果以Hb还原百分率(%)表示;红细胞膜一氧化氮(NO)含量采用硝酸还原酶法测定。以上指标均采用南京建成生物工程研究所提供的试剂盒进行检测。
1.6 数据处理与分析应用SPSS 18.0软件分析数据,结果以平均值±标准差表示,组间差异显著性采用单因素方差分析(one-way ANOVA)进行统计分析,差异显著的用Duncan氏法进行多重比较,显著性水平设为P < 0.05。用折线(broken-line)法和二次曲线回归方程法对饲料中维生素C含量与试验鱼氧化及抗氧化指标做拟合方程。
2 结果与分析 2.1 养殖结束后各组试验鱼生长指标由表2可知,连续饲喂84 d后,209.6 mg/kg组试验鱼的终末体重、特定生长率显著高于其他组(P < 0.05),其他各组之间特定生长率没有显著差异(P>0.05)。增重率也是以209.6 mg/kg组最高,显著高于除837.3 mg/kg组外的其他各组(P < 0.05)。
| 表2 饲喂84 d后饲料维生素C含量对半滑舌鳎生长指标的影响 Table 2 Effects of dietary vitamin C content on growth parameters of tongue sole after feeding 84 days |
对照组试验鱼明显表现出厌食、竖鳞,鳞片用手触摸后易脱落,并伴有腹水、肝胰脏糜烂等维生素C缺乏症状(图1箭头所示部位),死亡率达到41.67%。在104.8 mg/kg C组试验鱼仅表现出厌食、竖鳞,死亡率仅为8.33%,其余各组未表现出腹水和肝胰脏糜烂等缺乏症状。
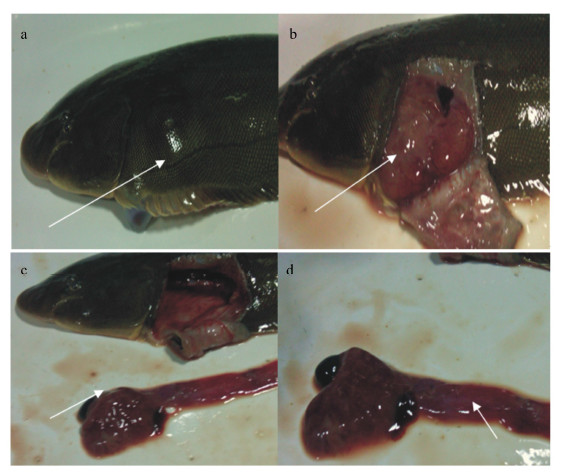 |
a:腹水病,腹部隆起;b:严重腹水;c:肝胰脏溃烂;d:肠道充血。 a:ascites disease,abdominal bluge;b:severe ascites;c:ulcers in the hepatopancreas;d:intestinal hyperemia. 图1 患病半滑舌鳎症状解剖图(箭头所示病灶) Fig. 1 The prevalence of tongue sole symptoms of anatomy (lesion as indicated by the arrow) |
由表3可知,随着饲料中维生素C含量的升高,血浆维生素C含量呈上升趋势,837.3 mg/kg组显著高于其他各组(P < 0.05)。红细胞Hb含量和G-6-PD活性也随着饲料中维生素C含量的升高呈上升趋势,其中837.3 mg/kg组Hb含量显著高于对照组和104.8 mg/kg组(P < 0.05),521.6和837.3 mg/kg组G-6-PD活性显著高于其他各组(P < 0.05)。
| 表3 血浆维生素C含量及红细胞Hb含量和G-6-PD活性 Table 3 Viatmin C content in plasma,and Hb content and G-6-PD activity in RBC |
由表4可知,随着饲料中维生素C含量的升高,红细胞SOD和CAT活性先升高后下降,在209.6 mg/kg组活性均达到最高,且其SOD活性显著高于对照组和521.6、837.3 mg/kg组(P < 0.05),CAT活性则显著高于对照组和104.8、837.3 mg/kg组(P < 0.05)。对照组红细胞MDA含量显著高于各添加组(P < 0.05)。红细胞膜NO含量随着饲料中维生素C含量的升高则呈下降趋势,对照组显著高于各添加组(P < 0.05)。
| 表4 红细胞抗氧化能力及红细胞膜NO含量 Table 4 RBC antioxidant capacity and RBC membrane NO content |
采用折线模型(图2)分析饲料中维生素C含量与红细胞CAT、SOD活性和MDA含量的关系,分别求得方程y=0.058 7x+27.652(R2=0.911 8)和y=-0.046 3x+54.641(R2=0.900 4),y=0.036 9x+40.026(R2=0.912 0)和y=-0.013x+57.06(R2=1.000 0),y=-0.000 002x2+0.002 3x+1.833 2(R2=0.998 6)和y=-0.096 6x+12.269(R2=1.000 0),由方程得出饲料维生素C含量分别为257.04、341.36和105.75 mg/kg时,红细胞CAT和SOD活性较高,MDA含量较低。
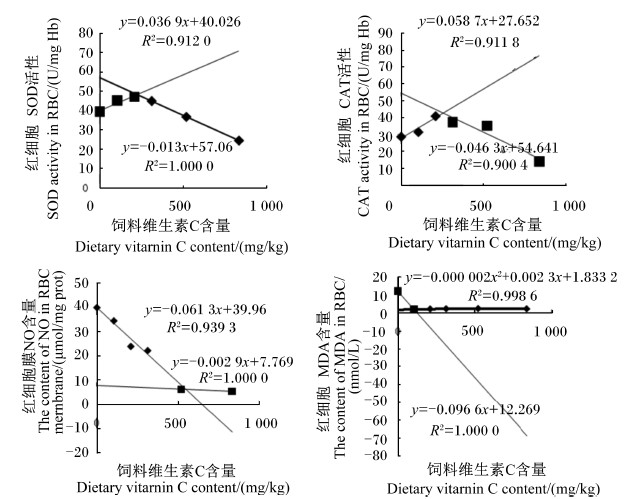 | 图2 饲料维生素C含量与半滑舌鳎红细胞CAT、SOD活性和MDA含量及红细胞膜NO含量的折线模型 Fig. 2 Broken-line models between dietary vitamin C content and RBC SOD, CAT activities and MDA content and RBC membrane NO content |
采用折线模型(图2)分析饲料中维生素C含量与红细胞膜NO含量的关系,求得方程y=-0.002 9x+7.767(R2=1.000 0)和y=-0.061 3x+39.96(R2=0.939 3),由方程得出饲料维生素C含量为551.25 mg/kg时,红细胞膜NO含量趋于稳定,对细胞膜损害程度较低。
3 讨论 3.1 饲料维生素C含量对半滑舌鳎血浆维生素C含量及红细胞Hb含量和G-6-PD活性的影响当红细胞内G-6-PD活性正常时,通过戊糖代谢旁路形成的NADPH可作为血液中MetHb还原酶的辅酶,将无功能的MetHb还原为亚铁血红蛋白。红细胞内G-6-PD缺乏时,NADPH生成减少,MetHb不能被还原,MetHb沉积成为变性珠蛋白小体,贴附于细胞膜使细胞膜受损,降低红细胞对氧化物质损伤的自我保护能力[4, 13]。陈晓军[4]的研究证实,G-6-PD活性降低会影响红细胞膜的代谢与功能,严重的可致红细胞破坏溶解而贫血。
本试验结果表明,对照组半滑舌鳎红细胞G-6-PD活性显著低于209.6~837.3 mg/kg组,说明维生素C缺乏导致的G-6-PD活性降低,能影响半滑舌鳎红细胞膜的正常代谢和功能的发挥。在研究中还发现,对照组血浆维生素C含量及红细胞Hb含量也显著低于各添加组,这可能是由于维生素C不足或缺乏导致红细胞膜发生脂质过氧化作用,造成膜损伤,致使细胞脆性增加导致溶血,发生血液运输氧能力下降,阻碍Hb的合成代谢。
3.2 饲料维生素C含量对半滑舌鳎红细胞抗氧化能力及红细胞膜NO含量的影响机体的自由基清除体系是机体通过酶促和非酶促系统清除过量的自由基来保护机体保护细胞免受损伤。酶促系统中的酶主要有谷胱甘肽过氧化物酶(GSH-Px)、SOD和CAT等。非酶促系统主要是一些小分子化合物,如抗氧化剂(维生素C、维生素E)和胡萝卜素等[13]。MDA作为机体内氧自由基代谢中产生的脂质过氧化物,其含量高低可以间接反映机体内氧自由基代谢状况,从而反映出细胞损伤的程度[14]。
本试验中,在饲料维生素C含量在0.2~209.6 mg/kg时,209.6 mg/kg组红细胞SOD和CAT活性显著高于对照组,说明维生素C在一定添加范围内能明显提高红细胞SOD和CAT活性,推测其原因可能是维生素C除了自身具有抗氧化作用外,它还具有使机体提高SOD和CAT活性的诱导作用。而后随着饲料维生素C含量的继续升高,红细胞SOD和CAT活性降低并趋于稳定,这可能是由于维生素C本身就是抗氧化剂,高剂量的维生素C对红细胞具有一定保护作用,因而使SOD和CAT活性下降并维持在一定水平,也可能是由于添加过量的维生素C抑制了红细胞SOD和CAT活性。相较于对照组,饲料添加维生素C后,红细胞MDA含量显著减少,进一步说明了维生素C是生物体内自由基消除剂,维生素C的抗氧化作用主要表现在清除自由基引发的脂质过氧化作用。
NO是迄今发现的体内第1个气体性信息分子,作为一种生物信使分子和细胞毒效应因子,具有双重的作用,小剂量能发挥有益的生理作用,还可以通过调节由感染引起的炎症,从而进行免疫抑制[15];而大剂量常有致病或使病情恶化的作用。研究表明,NO在体内生成不足或过量与临床多种疾病的发生、发展有着密切关系,过量NO还可引起细胞损伤[16]。本研究结果表明,对照组红细胞膜NO含量显著高于各添加组,随着维生素C含量的升高,红细胞膜NO含量呈下降趋势。这表明维生素C能阻断生物膜NO反应链,降低NO含量,保护机体免受自由基造成的过氧化损伤。
4 结论综合分析,维生素C能有效降低感染迟缓爱德华氏菌半滑舌鳎的红细胞氧化损伤程度;经过折线模型分析,推荐饲料中维生素C含量为257.04~341.36 mg/kg。
| [1] | 莫简.医用自由基生物学导论[M]. 北京:人民卫生出版社,1989.( 1) 1)
|
| [2] | 海春旭.自由基医学[M].
西安:第四军医大学出版社,2006.
( 1) 1)
|
| [3] | FARHUD D D,YAZDANPANAH L.Glucose-6-phosphate dehydrogenase (G6PD) deficiency[J]. Iranian Journal of Public Health,2008,37(4):1-18. ( 1) 1)
|
| [4] | 陈晓军.红细胞G6PD速率法检测及对贫血患者的诊断意义[J]. 中国实验诊断学,2006,10(7):773. ( 2) 2)
|
| [5] | 詹彤,陶靖,唐荣才,等.维生素C对人全血红细胞的抗氧化保护作用[J]. 中国实验血液学杂志,2005,13(6):1106-1108. ( 1) 1)
|
| [6] | 孙永叶,马爱国,张秀珍,等.维生素C缺乏对豚鼠抗氧化能力及红细胞膜流动性的影响[J]. 卫生研究,2005,34(3):329-330. ( 1) 1)
|
| [7] | 薛美兰,马爱国,张秀珍.大剂量维生素C对大鼠抗氧化能力及淋巴细胞增殖功能影响的研究[J]. 营养学报,2008,30(5):525-527. ( 1) 1)
|
| [8] | PIMPIMOL T,PHOONSAMRAN K,CHITMANAT C.Effect of dietary vitamin c supplementation on the blood parameters of Mekong giant catfish (Pangasianodon gigas)[J]. International Journal of Agriculture and Biology,2012,14(2):256-260. ( 1) 1)
|
| [9] | IBRAHEM M D,FATHI M,MESALHY S,et al.Effect of dietary supplementation of inulin and vitamin C on the growth,hematology,innate immunity,and resistance of Nile tilapia (Oreochromis niloticus)[J]. Fish & Shellfish Immunology,2010,29(2):241-246. ( 1) 1)
|
| [10] | 朱国霞,黄亚冬,孙朦朦,等.维生素E对半滑舌鳎抗迟缓爱德华氏菌感染的影响[J]. 饲料研究,2013(9):1-4. ( 1) 1)
|
| [11] | 封家旺.维生素E缺乏对雏鸡红细胞膜的影响[D]. 硕士学位论文.哈尔滨:东北农业大学,2008. ( 1) 1)
|
| [12] | BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantifies of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254. ( 1) 1)
|
| [13] | 封家旺,李艳飞,张金龙,等.维生素E缺乏对雏鸡红细胞抗氧化性能及G-6-PD活性的影响[J]. 中国家禽,2007,29(14):43-44,57. ( 2) 2)
|
| [14] | 严建伟,阮积慧.生物体系中自由基检测方法评述[J]. 杭州大学学报:自然科学版,1998,25(3):75-80. ( 1) 1)
|
| [15] | EISENSTEIN T K,HUANG D,MEISSLER J J,et al.Macrophage nitric oxide mediates immunosuppression in infectious inflammation [J]. Immunobiology,1994,191(4/5):493-502. ( 1) 1)
|
| [16] | FARUQI R,DE LA MOTTE C,DICORLETO P E.Alpha-tocopherol inhibits agonist-induced monocytic cell adhesion to cultured human endothelial cells[J]. Journal of Clinical Investigation,1994,94:592-600. ( 1) 1)
|




