2. 中国科学院大学, 北京 100049;
3. 湖南农业大学生物科学技术学院, 长沙 410128
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Biology and Technology, Hunan Agricultural University, Changsha 410128, China
氨基酸是机体重要功能物质合成的必需前体物,在维持机体正常的生长、发育和繁殖方面发挥重要作用。机体每天都需要补充大量的氨基酸作为底物参与细胞蛋白质的合成以及为细胞生长提供能量。氨基酸主要通过需钠耗能的主动转运方式在小肠吸收。肠黏膜细胞膜上转运氨基酸的载体利用细胞内外的钠离子(Na+)浓度梯度将氨基酸和Na+转入细胞内,而Na+则利用钠泵主动排到胞外。哺乳动物细胞中广泛存在氨基酸转运系统,依据转运是否依赖Na+可分为Na+依赖转运载体和非Na+依赖转运载体[1]。其中Na+依赖性中性氨基酸转运载体(sodium dependent neutral amino acid transporter,SNAT)2作为体内主要的氮转运载体,成为近年来发现的氨基酸转运感受体(transceptor)的典型代表。本文围绕SNAT2的分子特性、生物学特性、表达调控及其介导的氨基酸感应信号的研究进展进行综述。
1 分子特性SNAT2以前被称为ATA2、SAT2或SA1,是溶质载体家族38(solute carrier family 38,SLC38)的第2个成员,该家族中的SNAT1和SNAT3最先被克隆,随后SNAT2的基因序列及SNAT2分子结构也被探明[2]。SNAT2蛋白由506个氨基酸组成,理论分子质量约为56 ku。采用ClustalW对SLC38家族各成员蛋白序列进行多序列比对后,再用MEGA6对其做同源性分析,结果表明:SNAT2与SNAT4的氨基酸序列相似度最高,达到58%;与SNAT6氨基酸序列的相似度最低,为45%(图1)[2]。各个成员之间的氨基酸相似性分析结果可以看出,SLC38家族成员间蛋白结构及功能的相似性,对于进一步认识家族各成员的结构、功能、分布与表达都有重要的参考价值。
 | 图1 SLC38家族各成员蛋白序列发育树分析 Fig. 1 Phylogenetic tree of amino acid sequences of SLC38 family[2] |
由于SNAT2的晶体结构目前还没有报道,目前的研究多是基于和已知晶体结构的同源性高的蛋白质比较分析。Yao等[2]运用亲水性分析预测了SNAT2具有11个跨膜区(transmembrane domain,TMD),且由于其氨基酸序列N端缺少膜插入信号肽从而推测N端位于细胞内侧,C端在细胞外侧,预测的TMD5与TMD6之间存在2个糖基化位点(图2)[2]。也有研究构建的拓扑模型显示SNAT2有12个跨膜区且C末端位于胞内[3, 4],Hyde等[5]通过免疫荧光技术发现SNAT2的C末端抗原表位在在胞外区域是很容易被找到的,有力地支持了11跨膜区模型。有研究预测,SNAT2在膜螺旋区1和8的中央具有1个保守的Na+结合位点,其中苏氨酸-384(Thr-384)被认为是Na+结合位点的一部分,Thr-384位点的突变不仅可以抑制阴离子流动(该过程需要Na+结合到SNAT2上),也可以显著降低SNAT2对Na+的亲和力[6]。此外,研究表明,TMD1上的保守氨基酸——天冬酰胺-82(Asn-82)直接或间接的涉及到SNAT2对Na+的协调转运,推测TMD1对于SLC38家族的转运体的功能都是至关重要的[7]。
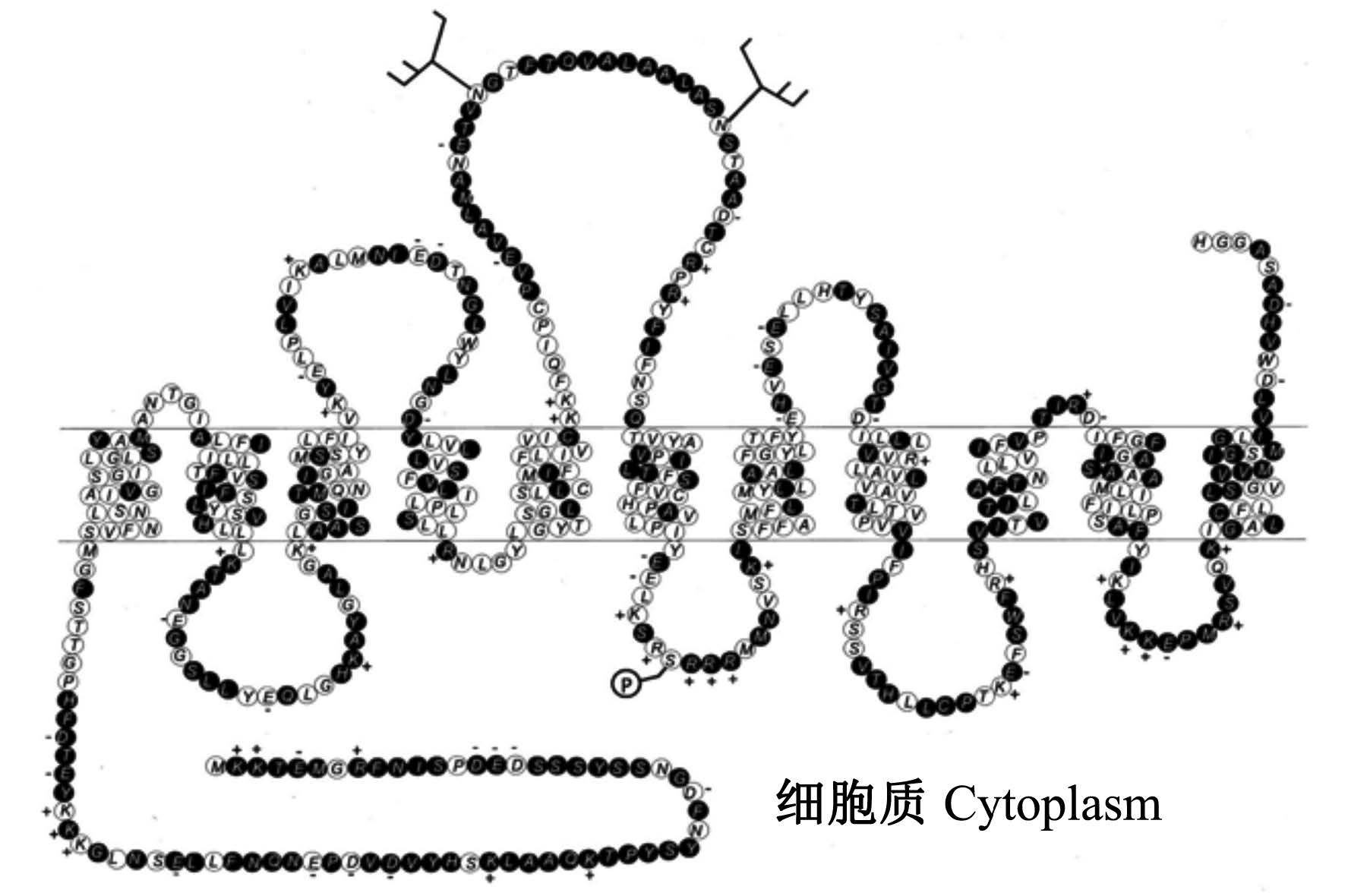 | 图2 SNAT2的拓扑结构预测 Fig. 2 Prediction of topology structure of SNAT2[2] |
转运系统A是哺乳动物细胞中受胰岛素调控的重要氨基酸转运载体,且分布广泛,SNAT基本分布于吸收性上皮细胞的基底外侧膜上,其中SNAT2对底物表现出广泛的亲和性,除了偏好转运谷氨酰胺之外,还转运蛋氨酸、脯氨酸、丝氨酸、天冬氨酸、甘氨酸和组氨酸[8]。N-(甲基氨基)-异丁酸(methylamino-isobutyric acid,MeAIB)是A类氨基酸转运载体的特异性底物,运用MeAIB的竞争性抑制试验检测SNAT2对各种不同底物的转运亲和力,发现SNAT2对丙氨酸、脯氨酸、蛋氨酸和丝氨酸亲和力较高,而基本上不转运带电氨基酸(谷氨酸、赖氨酸)以及分子质量较大的氨基酸(亮氨酸、缬氨酸和苯丙氨酸等)[9]。胰腺α和β细胞中SNAT之间会发生互相转运底物的情况,比如当血浆中谷氨酰胺的浓度很低的时候,SNAT3会释放谷氨酰胺供应给SNAT2作为底物,以此刺激胰高血糖素的分泌[10]。
有研究表明,SNAT2可介导某些阴离子的跨膜流动,当SNAT2转运某些底物如丙氨酸、谷氨酰胺或MeAIB时,其阴离子电流通道可以被不同程度的抑制,尤其是转运MeAIB时表现出最大的抑制效应[11]。SNAT2蛋白跨膜区域1的 Asn-82和跨膜区域8的Thr-384与Na+的结合有关,C端可以通过电压依赖性过程调节氨基酸的转运[7, 12]。SNAT2蛋白的组氨酸-304 (His-304)如果突变为丙氨酸时,SNAT2介导的阴离子电流的能力会增强,此时若转运底物为丙氨酸,其能力则受到强烈的抑制;且SNAT2对硫酸氢根离子的渗透性比氯离子高。因此,认为SNAT2更偏向转运疏水性阴离子,Na+可以增加电流幅度,但Na+与SNAT2的结合并不是阴离子电流产生的必要条件[11]。
研究表明,SNAT2可调节细胞内参与合成代谢的氨基酸浓度,调控核苷酸/核酸代谢和细胞生长的氨基酸信号。SNAT2作为重要的氨基酸转运载体可以通过调节胞内氨基酸含量间接调节哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的表达以此来影响胞内总体mRNA水平,进而影响整个细胞的生长情况[13]。抑制SNAT2影响哺乳动物类雷帕霉素靶蛋白到核糖体蛋白S6激酶(ribosomal S6 kinase,RSK)、核糖体蛋白S6(ribosomal protein S6,rpS6)和真核翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1,4E-BP1)的信号通路,进而导致蛋白质合成过程受到抑制。已经有研究证实,支链氨基酸能通过SNAT2诱导激活mTOR,表现为磷酸化S6K1蛋白表达量升高[13]。SNAT2也可通过磷脂酰肌醇3激酶(phosphatidylinositol-3 kinase,PIK3)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)等mTOR通路的重要调控因子,发挥更重要的调控作用[14]。此外,链脲佐菌素诱导的糖尿病或胰高血糖素处理都会使SNAT2表达显著上调,表明SNAT2可能在供应氨基酸进入糖异生途径方面发挥了一定的作用[15]。
3 SNAT2的调控 3.1 底物首先,底物浓度的改变会影响SNAT2的mRNA水平。氨基酸饥饿可以提高SNAT2的mRNA水平已经在许多组织中被证实。Hyde等[5]证实,在肌管细胞L6和脂肪细胞3T3-L1中SNAT2蛋白含量的升高是由氨基酸饥饿诱导。在BeWo细胞中发现,必需氨基酸缺失时,SNAT1的mRNA水平在1 h内有明显下降,SNAT2的mRNA水平在1 h内没有变化而需要3 h或者更长时间上升;当增加氨基酸供应时,SNAT2的mRNA水平也有显著提高[16]。氨基酸饥饿处理引起的SNAT2表达上调可能是因为加强了SNAT2蛋白的从头合成途径,进而使得质膜上转运载体的密度升高[17]。Tanaka等[17]发现,将人滋养层细胞置于无氨基酸的培养基中培养,转运系统A的活性增加,其刺激作用可以被放线菌素D(RNA合成抑制剂)和放线菌酮(蛋白合成抑制剂)显著的减弱。转运系统A底物,包括合成的氨基酸类似物MeAIB,都可以抑制氨基酸饥饿条件下SNAT2表达的增高。同样,细胞质内转运系统A底物的过量累积也会抑制胞外氨基酸的进一步内流,SNAT2就受这种反馈抑制的调节,不仅控制了氨基酸充足时胞内氨基酸浓度的过度升高,也可以调节转运载体感应胞内外氨基酸浓度介导的信号通路[18]。而在果蝇中发现,系统A底物对SNAT2表达的抑制作用可能并不是通过SNAT2本身起作用的,而是通过质子依赖性氨基酸转运载体(proton-assisted amino acid transporter,PAT),PAT属于SLC36家族成员,与SNAT2共有一些底物,如丙氨酸和脯氨酸[19]。
增加必需氨基酸的含量也可以提高SNAT2的mRNA及蛋白表达水平,且是以一种依赖mTOR通路的途径,这可能是对于增加的胞内氨基酸转运压力的一种适应性机制[20]。氨基酸被转运进入或运出质膜可能是分别依赖mTORC1或通用控制蛋白2激酶(general control nonderepressible 2,GCN2)氨基酸感应通路的[20]。其中GCN2途径的激活不仅是为了控制胞内游离氨基酸的进一步损失,而且可以作为恢复正常氨基酸水平的调节途径[18]。氨基酸饥饿和氨基酸添加诱导SNAT2的表达都是由转录激活因子4(activating transcription factor 4,ATF4)介导的,但2种条件下ATF4的激活途径是不同的。氨基酸饥饿条件下,不带电的tRNAs累积,GCN2被激活,eIF2α被磷酸化,导致翻译起始和蛋白合成的下调[18]。但是,这并不会减少支持转运载体基因表达的蛋白质的合成,因为SNAT2 mRNA的5'-非翻译区(URT)含有1个内部核糖体进入序列(IRES),在氨基酸饥饿环境中总蛋白质合成受抑制的情况下,SNAT2的mRNA也会通过帽端依赖机制非常有效地表达[21]。在添加氨基酸的条件下,GCN2增加了ATF4的表达,ATF4作为转录因子上调氨基酸转运体基因的转录。也就是说,氨基酸充足会刺激胰岛素-mTOR信号(表现为同化作用),氨基酸缺乏会激活GCN2信号(表现为异化作用),二者共同利用ATF4为靶点来调节氨基酸转运载体的表达,转运载体的上调为满足胞内能量需要提供快捷途径。但是,目前并不清楚胰岛素是通过胰岛素受体直接作用于mTORC1而激活ATF4还是通过SNAT2等转运载体形成氨基酸内流间接参与到mTOR通路中[18]。
底物种类也会影响SNAT2的表达,底物对SNAT2的抑制作用与底物和SNAT2转运Km系数正相关[3]。亮氨酸处理肌管细胞可以增加SNAT2的mRNA水平,这个过程是依赖mTOR信号通路的,可能是以依赖mTORC1的ATF4信号途径识别并转运胞外的支链氨基酸进入胞内而导致了SNAT2表达的增加[13]。Grewal等[22]研究表明,添加一定浓度的谷氨酰胺可以抑制SNAT2的表达,同时也可以抑制神经元细胞内SNAT2启动子中氨基酸反应元件与ATF4和CCAAT/增强子结合蛋白的结合。并不是只有转运系统A的底物抑制SNAT2。牛磺酸、γ-氨基丁酸、β-丙氨酸被证实比转运系统A底物更加强烈的抑制SNAT2,但SNAT2对于它们的响应速度较慢[22]。
3.2 激素SNAT2的活性受到胰岛素和胰高血糖素的调节。研究表明,鼠骨骼肌L6细胞在胰岛素刺激下,转运载体汇集的信号转导过程有PIK3的参与[23],而添加胰高血糖素导致SNAT2活性的升高可能是由环磷酸腺苷(cyclic adenosine monophosphate,cAMP)介导的[15]。运用Northern blot技术检测发现,添加雌性激素(17β-雌二醇)能使具有阳性受体的肿瘤细胞或乳腺癌细胞中SNAT2的mRNA水平提高,但添加雌激素受体拮抗剂ICI182780可以抵消这种效应[24]。分析SNAT2启动子区域发现,在转录起始位点上游的1 471和1 486碱基之间存在1个假定的雌激素反应元件(estrogen response element,ERE)[25]。泌乳期间17β-雌二醇通过SNAT2启动子内的ERE结合到一个含特异的聚(二磷酸腺苷-核糖)合酶1、狼疮Ku抗原蛋白、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的复合体上,起到激活SNAT2的作用。Jones等[26]在人胎盘细胞系细胞BeWo中发现,较低浓度(20~50 nmol/L)的皮质醇对SNAT2的mRNA和SNAT2蛋白水平无影响,但可以调控SNAT2蛋白从胞内重新定位到质膜上;当浓度增加为1 000 nmol/L时,mRNA和蛋白水平都增加。
3.3 细胞环境高渗透压可引起SNAT2 mRNA水平的提高已在多种组织中证实。高渗透压刺激下,转运系统A活动的增加主要依赖新的SNAT2合成[21],依靠激活的T细胞5的核转录因子(nuclear factor of activated T cells 5,NFAT5),NFAT5与高渗透压激活的上游调控基因的渗透压反应元件相结合发挥作用。渗透压应激可以激活分裂酶原蛋白激酶(mitogen actvated protein kinases,MAPK)下的级联反应,其中ERK作为一个促进有丝分裂信号的传感器在渗透压应激下的鼠嗜铬瘤细胞PC12中被大量激活。ERK还参与到SNAT2应对氨基酸缺乏的适应性信号传导途径,通过使结节性硬化复合物2(tuberous sclerosis complex2,TSC2)转录后失活参与到mTOR信号通路中[27]。
SNAT2对酸环境非常敏感。当胞外pH高于7.5时SNAT2的活性会显著增加,当胞外pH低于7.5时SNAT2活性会显著降低。SNAT2与Na+共转运比例为1 ∶ 1,即使SNAT2对pH高度敏感的,H+不大可能是一个可移动的与SNAT2偶联的离子[4]。SNAT2对酸环境的敏感性可能与组氨酸残基有关,转运载体在细胞质区域具有一个对pH敏感的结构域,可能是由组氨酸残基负责胞内pH诱导转运载体功能的改变,组氨酸修饰剂焦碳酸二乙酯(DEPC)可以显著降低SNAT2对pH环境的敏感度[28]。因此,SNAT2可能是治疗尿毒症、急性酸中毒等疾病的理想药物靶点。
不同因素对SNAT2表达的调控作用的强弱无法判定,因组织或细胞的种属和部位不同而影响不同。鼠骨骼肌细胞L6在添加胰岛素、高渗透压和氨基酸缺乏3种培养条件下比较发现,3种处理都使SNAT2的表达上调,其上调作用从强到弱依次为高渗透压、氨基酸缺乏和添加胰岛素[29]。总之,SNAT2的表达长期的上调是该基因转录增加的结果,而短期迅速的上调则是SNAT2蛋白从细胞内重新定位分布到质膜导致的,这样的调节方式与胰岛素诱导葡萄糖转运载体(glucose transporter 4,GLUT4)的机制十分相似[15, 23]。
4 SNAT2与氨基酸感应信号氨基酸转运载体的底物结合位点可以被很好的定位,以此来充当膜内外侧氨基酸浓度的直接感受器,这为感应氨基酸的受体结合行为转化为下游胞内级联信号提供了一种可能的机制。SNAT2底物结合位点的占用可以激发了一个抑制性信号,以此来减弱氨基酸总体缺乏而发挥适应性调节作用[3]。SNAT2载体的结合位点占据是如何被感知的,感知后的信号如何调控下游的转录过程仍然是未知的。膜内底物结合位点的定位分为信号和非信号2种构象,氨基酸底物在胞内的结合把转运载体锁在向内的构象即非信号构象,这种性质与转运系统A的反式抑制相似[30],细胞质内的氨基酸可以抑制转运载体对胞外的氨基酸的吸收[3]。超表达SNAT2发现,反式抑制能通过细胞质内氨基酸的结合把SNAT2锁定为向内的构型,以此阻止空载的转运体回到质膜的外表面来完成转运循环。SNAT2的反式抑制会允许质膜2侧底物的浓度对氨基酸吸收速率的反馈性动力学调节[31]。在饱和的MeAIB环境中,肌细胞对胰岛素诱导的PI3K途径和蛋白激酶(protein kinase,PKB/Akt)磷酸化过程有激活性作用,相反,用RNA干扰沉默SNAT2表达,对PI3K的脂类激酶活动有抑制性作用[32]。目前并不清楚SNAT2如何调节PI3K/PKB信号途径,但很可能会协同增强胰岛素对mTOR通路的作用。Hundal等[18]认为SNAT2可能直接调控mTOR信号通路,在人乳腺癌细胞MCF7培养基中添加MeAIB,尽管可以通过抑制转运系统A的跨膜转运使得胞内氨基酸含量减少,同时也诱导S6K1的磷酸化。但MeAIB处理对mTOR信号通路产生的积极作用,可能是由于对营养物质敏感的胞内激酶家族的激活,而不是通过SNAT2本身[33, 34]。此外,SNAT2会与其他转运系统如系统L发生偶联作用,例如,如果谷氨酰胺的浓度较高,细胞会加大系统L底物的吸收来增强调节mTOR信号通路的能力[18]。
5 小 结SNAT2作为体内主要的氮转运载体,对底物具有广泛的亲和性,受底物、激素和细胞环境等因素调控。SNAT2通过转运过程调节细胞内氨基酸的浓度,从而调控细胞内氨基酸感应信号,发挥着氨基酸转运载体和受体的双重功能。以后研究需进一步了解SNAT2的蛋白晶体结构,研究其偶联作用的动力学特征和胞内氨基酸感应的分子机制,以全面揭示SNAT2介导的转运机制和感应信号通路。
| [1] | ZENG L,TAN B,XIAO H,et al.Amino acid sensing signaling induced by amino acid transporters[J]. Scientia Sinica Vitae,2012,42(9):699-708. ( 1) 1)
|
| [2] | YAO D,MACKENZIE B,MING H,et al.A novel system A isoform mediating Na+/neutral amino acid cotransport[J]. The Journal of Biological Chemistry,2000,275(30):22790-22797. ( 6) 6)
|
| [3] | HYDE R,CWIKLINSKI E L,MACAULAY K,et al.Distinct sensor pathways in the hierarchical control of SNAT2, a putative amino acid transceptor, by amino acid availability[J]. The Journal of Biological Chemistry,2007,282(27):19788-19798. ( 4) 4)
|
| [4] | SUGAWARA M,NAKANISHI T,FEI Y J,et al.Cloning of an amino acid transporter with functional characteristics and tissue expression pattern identical to that of system A[J]. The Journal of Biological Chemistry,2000,275(22):16473-16477. ( 2) 2)
|
| [5] | ZHANG Z,ALBERS T,FIUMERA H L,et al.A conserved Na(+) binding site of the sodium-coupled neutral amino acid transporter 2(SNAT2)[J]. The Journal of Biological Chemistry,2009,284(37):25314-25323. ( 2) 2)
|
| [6] | ZHANG Z,GAMEIRO A,GREWER C.Highly conserved asparagine 82 controls the interaction of Na+ with the sodium-coupled neutral amino acid transporter SNAT2[J]. The Journal of Biological Chemistry,2008,283(18):12284-12292. ( 1) 1)
|
| [7] | SCHIOTH H B,ROSHANBIN S,HAGGLUND M G,et al.Evolutionary origin of amino acid transporter families SLC32, SLC36 and SLC38 and physiological, pathological and therapeutic aspects[J]. Molecular Aspects of Medicine,2013,34(2-3):571-585. ( 2) 2)
|
| [8] | 明洪,龙莉,曾惠芳,等.两种A类氨基酸转运蛋白部分功能差异的研究[J]. 细胞生物学杂志,2003,25(02):104-108. ( 1) 1)
|
| [9] | JENSTAD M,CHAUDHRY F A.The Amino Acid Transporters of the glutamate/GABA-glutamine cycle and their impact on insulin and glucagon secretion[J]. Frontiers in Endocrinology,2013,4:199. ( 1) 1)
|
| [10] | ZHANG Z,GREWER C.The sodium-coupled neutral amino acid transporter SNAT2 mediates an anion leak conductance that is differentially inhibited by transported substrates[J]. Biophysical Journal,2007,92(7):2621-2632. ( 1) 1)
|
| [11] | ZHANG Z,ZANDER C B,GREWER C.The C-terminal domain of the neutral amino acid transporter SNAT2 regulates transport activity through voltage-dependent processes[J]. The Biochemical Journal,2011,434(2):287-296. ( 2) 2)
|
| [12] | LUO J Q,CHEN D W,YU B.Upregulation of amino acid transporter expression induced by L-leucine availability in L6 myotubes is associated with ATF4 signaling through mTORC1-dependent mechanism[J]. Nutrition,2013,29(1):284-290. ( 1) 1)
|
| [13] | VAN DORT M E,GALBAN S,WANG H,et al.Dual inhibition of allosteric mitogen-activated protein kinase (MEK) and phosphatidylinositol 3-kinase (PI3K) oncogenic targets with a bifunctional inhibitor[J]. Bioorganic & Medicinal Chemistry,2015,23(7):1386-1394. ( 3) 3)
|
| [14] | VAROQUI H,ERICKSON J D.Selective up-regulation of system a transporter mRNA in diabetic liver[J]. Biochemical and Biophysical Research Communications,2002,290(3):903-908. ( 1) 1)
|
| [15] | HYDE R,CHRISTIE G R,LITHERLAND G J,et al.Subcellular localization and adaptive up-regulation of the System A (SAT2) amino acid transporter in skeletal-muscle cells and adipocytes[J]. The Biochemical Journal,2001,355(Pt 3):563-568. ( 3) 3)
|
| [16] | JONES H N,ASHWORTH C J,PAGE K R,et al.Expression and adaptive regulation of amino acid transport system A in a placental cell line under amino acid restriction[J]. Reproduction,2006,131(5):951-960. ( 1) 1)
|
| [17] | TANAKA K,YAMAMOTO A,FUJITA T.Functional expression and adaptive regulation of Na+-dependent neutral amino acid transporter SNAT2/ATA2 in normal human astrocytes under amino acid starved condition[J]. Neuroscience Letters,2005,378(2):70-75. ( 1) 1)
|
| [18] | HUNDAL H S,TAYLOR P M.Amino acid transceptors:gate keepers of nutrient exchange and regulators of nutrient signaling[J]. American Journal of Physiology Endocrinology and Metabolism,2009,296(4):E603-613. ( 6) 6)
|
| [19] | BOLL M,DANIEL H,GASNIER B.The SLC36 family:proton-coupled transporters for the absorption of selected amino acids from extracellular and intracellular proteolysis[J]. Pflugers Archiv:European Journal of Physiology,2004,447(5):776-779. ( 1) 1)
|
| [20] | DRUMMOND M J,GLYNN E L,FRY C S,et al.An increase in essential amino acid availability upregulates amino acid transporter expression in human skeletal muscle[J]. American Journal of Physiology Endocrinology and Metabolism,2010,298(5):E1011-1018. ( 2) 2)
|
| [21] | GACCIOLI F,HUANG C C,WANG C,et al.Amino acid starvation induces the SNAT2 neutral amino acid transporter by a mechanism that involves eukaryotic initiation factor 2alpha phosphorylation and cap-independent translation[J]. The Journal of Biological Chemistry,2006,281(26):17929-17940. ( 2) 2)
|
| [22] | GREWAL S,DEFAMIE N,ZHANG X,et al.SNAT2 amino acid transporter is regulated by amino acids of the SLC6 gamma-aminobutyric acid transporter subfamily in neocortical neurons and may play no role in delivering glutamine for glutamatergic transmission[J]. The Journal of Biological Chemistry,2009,284(17):11224-11236. ( 2) 2)
|
| [23] | HYDE R,PEYROLLIER K,HUNDAL H S.Insulin promotes the cell surface recruitment of the SAT2/ATA2 system A amino acid transporter from an endosomal compartment in skeletal muscle cells[J]. The Journal of Biological Chemistry,2002,277(16):13628-13634. ( 2) 2)
|
| [24] | BHAT H K,VADGAMA J V.Role of estrogen receptor in the regulation of estrogen induced amino acid transport of System A in breast cancer and other receptor positive tumor cells[J]. International Journal of Molecular Medicine,2002,9(3):271-279. ( 1) 1)
|
| [25] | VELAZQUEZ-VILLEGAS L A,ORTIZ V,STROM A,et al.Transcriptional regulation of the sodium-coupled neutral amino acid transporter (SNAT2) by 17β-estradiol[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(31):11443-11448. ( 1) 1)
|
| [26] | JONES H N,ASHWORTH C J,PAGE K R,et al.Cortisol stimulates system A amino acid transport and SNAT2 expression in a human placental cell line (BeWo)[J]. American Journal of Physiology Endocrinology and Metabolism,2006,291(3):E596-603. ( 1) 1)
|
| [27] | MA L,CHEN Z,ERDJUMENT-BROMAGE H,et al.Phosphorylation and functional inactivation of TSC2 by Erk implications for tuberous sclerosis and cancer pathogenesis[J]. Cell,2005,121(2):179-193. ( 1) 1)
|
| [28] | BAIRD F E,PINILLA-TENAS J J,OGILVIE W L,et al.Evidence for allosteric regulation of pH-sensitive System A (SNAT2) and System N (SNAT5) amino acid transporter activity involving a conserved histidine residue[J]. The Biochemical Journal,2006,397(2):369-375. ( 1) 1)
|
| [29] | KASHIWAGI H,YAMAZAKI K,TAKEKUMA Y,et al.Regulatory mechanisms of SNAT2, an amino acid transporter, in L6 rat skeletal muscle cells by insulin, osmotic shock and amino acid deprivation[J]. Amino Acids,2009,36(2):219-230. ( 1) 1)
|
| [30] | WU B,OTTOW K,POULSEN P,et al.Competitive intra- and extracellular nutrient sensing by the transporter homologue Ssy1p[J]. The Journal of Cell Biology,2006,173(3):327-331. ( 1) 1)
|
| [31] | SU T Z,CAMPBELL G W,OXENDER D L.Glutamine transport in cerebellar granule cells in culture[J]. Brain Research,1997,757(1):69-78. ( 1) 1)
|
| [32] | EVANS K,NASIM Z,BROWN J,et al.Inhibition of SNAT2 by metabolic acidosis enhances proteolysis in skeletal muscle[J]. Journal of the American Society of Nephrology,2008,19(11):2119-2129. ( 1) 1)
|
| [33] | FINDLAY G M,YAN L,PROCTER J,et al.A MAP4 kinase related to Ste20 is a nutrient-sensitive regulator of mTOR signalling[J]. The Biochemical Journal,2007,403(1):13-20. ( 1) 1)
|
| [34] | GULATI P,GASPERS L D,DANN S G,et al.Amino acids activate mTOR complex 1 via Ca2+/CaM signaling to hVps34[J]. Cell Metabolism,2008,7(5):456-465. ( 1) 1)
|




